八下化学式和化合价计算
化学式与化合价的计算方法

化学式与化合价的计算方法在化学中,化学式和化合价是非常重要的概念。
化学式代表了化合物中不同元素的种类和数量,而化合价则表示了元素在化合物中的价态或价值。
计算化学式和化合价的方法有多种,下面将介绍其中的几种常用方法。
一、化学式的计算方法1. 价电子法根据元素的原子序数可以确定其外层电子的数量,进而推算出元素的化合价。
例如氯原子的原子序数为17,它的外层电子数量为7,因此氯的化合价为-1。
通过这种方法,可以推算出化合物的化学式。
例如氯和钠的化合物,由于钠原子的化合价为+1,氯原子的化合价为-1,因此它们的化学式为NaCl。
2. 交叉相乘法通过化合物中不同元素化合价的交叉相乘可以得到下标,从而推算出化合物的化学式。
例如氧元素的化合价为-2,锂元素的化合价为+1,它们的化学式为Li2O,其中2和-2就是通过交叉相乘法计算得到的下标。
二、化合价的计算方法1. 电子填充法根据元素的原子序数可以确定其外层电子的数量,通过将外层电子按能级填充的方式,可以推算出元素的化合价。
例如氯原子的原子序数为17,其外层电子数量为7,通过填充方式可得到氯的化合价为-1。
2. 氧化数法化合价与氧化数有一定的对应关系。
氧化数是指元素在化合物中的氧化态或氧化程度。
通过氧化数的计算,可以推算出元素的化合价。
例如氧化钠(Na2O)中,由于氧原子的化合价为-2,钠原子的氧化数为+1,因此钠的化合价为+1。
除了上述方法,还可以根据元素的位置在周期表中的位置以及化合物的电中性来推算化合价。
综上所述,化学式和化合价的计算方法有多种,可以根据不同的情况选择合适的方法。
掌握这些计算方法,能够更好地理解和分析化学的基本概念,为后续的化学学习打下良好基础。
化学式与化合价

化学式与化合价化学式是一种用符号和数字来表示化学物质组成的式子,它反映了物质组成、结构和性质的重要信息。
而化合价则是指一种元素的一个原子与其他元素的原子形成化合物时所具有的价态。
化学式与化合价在化学学习中扮演着重要的角色,对于理解化学反应、合成与分解物质以及掌握元素的性质等方面都具有重要的意义。
一、化学式化学式是用符号和数字来表示化学物质组成的式子,它具有以下特点:1、客观性:化学式能够客观地反映物质的组成和结构,不受主观意识的影响。
2、简洁性:通过化学式,可以简洁明了地表示出物质的组成和结构,方便记忆和使用。
3、通用性:化学式是国际通用的表示方式,不受地域和语言的限制。
化学式的书写规则包括:1、单质采用元素符号来表示,如氧气(O₂)、氢气(H₂)等。
2、化合物采用元素符号和数字的组合来表示,其中数字表示原子个数,如水(H₂O)、二氧化碳(CO₂)等。
3、书写化学式时,一般按照先读后写的顺序进行,如硫酸钠(Na₂SO ₄)。
二、化合价化合价是指一种元素的一个原子与其他元素的原子形成化合物时所具有的价态。
化合价的确定对于理解化学反应中元素的性质和化学键的形成具有重要意义。
化合价的确定方法包括:1、实验测定:通过化学实验测定物质的性质和反应条件,从而确定元素的化合价。
2、理论推导:根据化学键理论和元素周期律等理论知识,推导出元素的化合价。
化合价的规则包括:1、常见元素的化合价:如氢为+1价,氧为-2价,金属元素一般显正价等。
2、化合价的代数和为零:在化合物中,正负化合价的代数和为零。
3、化合价的标示方法:在元素符号的正上方标示化合价,如NaOH中,钠显+1价,氢氧根显-1价。
三、化学式与化合价的应用化学式与化合价在化学学习中具有广泛的应用,例如:1、化学式的书写:通过化学式可以方便地表示出物质的组成和结构,有助于理解物质的性质和用途。
2、化合价的计算:通过化合价可以计算出物质中各元素的原子个数比,有助于理解化学反应中元素的性质和变化规律。
初中化学化学式和化合价

初中化学化学式和化合价在初中化学的学习中,化学式和化合价是非常重要的概念。
它们就像是化学世界的语言密码,帮助我们理解和描述各种物质的组成和性质。
首先,让我们来聊聊化学式。
化学式是用元素符号来表示物质组成的式子。
比如说,水的化学式是 H₂O,氧气的化学式是 O₂,二氧化碳的化学式是 CO₂。
通过这些化学式,我们能够清楚地知道这些物质是由哪些元素组成的,以及它们的原子个数比。
那么,化学式是怎么得来的呢?这就需要我们了解元素的化合价。
化合价是元素在形成化合物时表现出来的一种性质。
它反映了原子之间相互化合的数目。
化合价有正价和负价之分。
一般来说,金属元素在化合物中通常显正价,非金属元素在化合物中既可以显正价也可以显负价。
比如,在氯化钠(NaCl)中,钠元素显+1 价,氯元素显-1 价。
常见元素的化合价是需要我们记忆的。
像氢元素通常显+1 价,氧元素通常显-2 价,钾元素显+1 价,钙元素显+2 价等等。
但也有一些元素的化合价不是固定不变的,比如铁元素,它有+2 价和+3 价。
掌握了化合价,我们就可以根据化合物中各元素化合价的代数和为零这一原则,来书写化学式。
例如,要写出氧化铝的化学式,我们先确定铝元素显+3 价,氧元素显-2 价。
因为化合价的代数和要为零,所以铝原子和氧原子的个数比应该是 2∶3,氧化铝的化学式就是Al₂O₃。
再来说说化学式的意义。
以水的化学式 H₂O 为例,它有以下几种意义:宏观上,表示水这种物质,还表示水是由氢元素和氧元素组成的;微观上,表示一个水分子,还表示一个水分子是由两个氢原子和一个氧原子构成的。
在化学计算中,化学式也起着重要的作用。
我们可以通过化学式来计算物质的相对分子质量。
比如,二氧化碳(CO₂)的相对分子质量就是 44,计算方法是 12 + 16×2 = 44。
化合价的规律也有不少。
在化合物里,正负化合价的代数和为零。
在单质中,元素的化合价为零。
一些原子团也有固定的化合价,比如硫酸根(SO₄)显-2 价,硝酸根(NO₃)显-1 价。
化合价的计算与规律

给了化合式之后,若知道一个元素的化合价,可将其化合价与其分子中该元素的原子数相乘。
因化合价的电性为零,将零减去上一个化合价与该元素原子数的积再除以分子中另一元素的原子数,即得到另一元素化合价。
给了两元素的化合价,求出化合价的绝对值之最小公倍数。
再用最小公倍数除以化合价绝对值即求出分子中原子数。
化合价的表示方法:正负化合价用+1,+2,+3,-1,-2……0等要标在元素符号的正上方。
确定化合物中元素的化合价,需注意∶(1)化合价有正价和负价;(2)氧元素通常显-2价。
(3)氢元素通常显+1价。
(4)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
(5)一些元素在同种物质中可显不同的化合价。
(6)在化合物里正负化合价的代数和为0.(7)元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为0.初中化学确定元素化合价的方法一定数目的一种元素的原子跟一定数目的其他元素的原子化合的性质,叫元素的化合价。
它是元素的一个重要性质,确定元素的化合价是初中生应掌握的一种基本技能,现就其在初中范围内作一归纳,以期对同学们的学习有所帮助。
一、根据与其他元素组成的化合物化学式确定【例1】试确定化合物K2MnO4中Mn元素的化合价。
解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
二、根据元素的原子电子层结构特征确定【例2】元素X的原子最外层上有1个电子,元素Y的原子外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[ ]A.XY B.X2Y C.XY2 D.X3Y解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。
因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
化合价与化学式及有关的计算

化合价与化学式以及有关的计算(化学用语)班级 姓名 座号(11福州) 1.三氧化二铋(Bi 2O 3)俗称铋黄,是制作防火纸的材料之一。
三氧化二铋中铋元素的化合价是 ( )A.+6B. +3C. +2D. -2(11福州) 2. 下列化学用语与含义不相符的是 ( )A.AlCl 3—氯化铝B. 钙离子—Ca 2+C. 2个氧元素—2OD. 2个水分子—2H 2O(11莆田)3.下列化学符号中,表示2个氢分子的是 ( )A H 2B 2HC 2H 2D 2H +(09娄底)4.掌握化学用语是学好化学的关键。
下列化学用语与所表述的意义相符合的是A.H 2O ——1个水分子B.Na +1——1个钠离子C.3Fe 3+ ——3个铁原子D.2H ——2个氢元素 (10龙岩)5.冲洗照片时,需将底片浸泡在大苏打(Na 2S 2O 3)溶液中,使影像固定下来,这一过程叫“定影”。
大苏打中硫元素的化合价为 ( )A .0B .+2C .+4D .+6(11泉州)6.下列化学用语表示正确的是 ( )A .两个氯原2Cl 2B .镁离子C .二氧化硫分子SO 2D .碳酸钠 NaCO 3(13泸州市)7.下列化学用语书写正确的是 ( )A. 2个镁原子:2MgB.钙离子:Ca +2C.五氧化二磷:05P 2D.氯化铝:A1C1(09苏州)8.下列物质的化学式的读法和写法都正确的是 ( )A .碳酸钠NaCO 3B .硫酸H 2SO 4C .氧化铁O 3Fe 2D .氢氧化钾K(OH)2(09福州)9.下列化学用语与含义相符的是 ( )A .2O —2个氧元素B .P 2O 5 — 五氧化二磷C .H 2—2个氢原子D .Ca —钙离子(09青岛)10.化学用语是国际通用的化学语言,下列有关说法正确的是 ( )A .2O 表示两个氧分子B .钠离子的符号为Na +C .一氧化碳的化学式是CoD .H 2O 中含有氧分子(11广西)11. 2011年3月11日日本因9.0级大地震引发了核泄漏事故。
初中化学化合价和化学式总结

初中化学化合价和化学式总结化学是一门研究物质的性质、结构、组成、变化规律以及它们之间的相互作用的科学。
化学是自然科学中一门非常重要的学科,也是理工类专业中一门基础的必修课。
在初中化学中,化合价和化学式是两个重要的概念,对于初学者来说是一个比较难以理解的部分。
下面将会对这两个概念进行总结,帮助初中化学学习者更好地理解和掌握。
一、化合价化合价是指元素与其他元素结合时所表现出的化学性质。
化合价可以帮助我们了解元素在化合物中的结合方式和元素之间的电子转移或共用情况。
化合价的大小决定了元素与其他元素形成化合物的可能性和形式。
1.单质的化合价:单质的化合价主要取决于元素所在的族别和周期。
例如,从第一周期到第七周期,元素的化合价逐渐增加。
周期表中,主族元素的化合价一般为族别数,即1A族元素的化合价为+1,2A族元素的化合价为+2、其中有一些特殊的例子,如氢原子的化合价为+1,氧原子的化合价为-2,氮原子的化合价为-32.化合物的化合价:化合物的化合价是指化合物中各元素的化合价之和。
根据化合价的大小,可以确定化合物中各元素的相对含量。
例如,氯化钠(NaCl)是一种非常常见的化合物,其中氯的化合价为-1,钠的化合价为+1、因此,氯化钠中钠的相对含量为1,氯的相对含量为13.化合价的计算:化合价的计算是基于元素与其他元素的电子转移或共用规律。
对于电子转移,如果一个非金属元素愿意捐出电子,则其化合价为正数;如果一个金属元素愿意接收电子,则其化合价为负数。
对于共用,如果两个非金属元素共用一个电子对,则它们的化合价都为正数。
二、化学式化学式是用化学符号和数字表示化合物的组成和结构。
化学式可以帮助我们了解化合物中各元素的相对含量和原子组成。
1.原子符号:化学式中使用的是元素的化学符号,如H表示氢,O表示氧,C表示碳等。
2.个数指示:化学式中通过数字表示元素的个数,如H2表示2个氢原子,O2表示2个氧原子。
3.括号使用:当化合物中含有多个相同的基团时,可以使用括号来表示。
初中常见化合价化学式及化学方程式
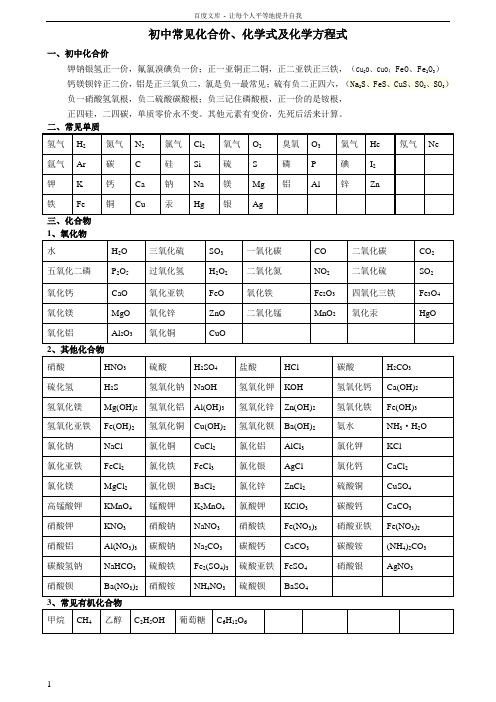
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
初中化学化合价和化学式总结(2篇)

初中化学化合价和化学式总结化学式与化合价要掌握的内容:能用化学式正确表示某些常见物质的组成记住常见元素及原子团的化合价要能根据化合价书写化学式及根据化学式判断元素化合价能利用相对原子质量、相对分子质量进行物质组成的简单计算能看懂常见商标中用化学式表示的物质成分及含量初步学会根据化学式计算相对分子质量、各元素的质量比或根据质量比求化学式、计算指定元素的质量分数1化学式1.概念:用元素符号和数字表示物质组成的式子【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个2.化学式表示的含义(一般包括宏观和微观)化学式的含义以H2O为例宏观表示一种物质表示水这种物质表示该物质有哪些元素组成的表示水由氧元素和氢元素组成微观表示该物质的一个分子或者一个原子表示一个水分子由分子构成的物质,还可以表示一个分子的构成情况表示一个水分子中由____个氢原子和____个氧原子构成备注:在化学式与元素符号前加上大于1的数字,都只具有微观意义,即只代表几个微观的微粒3.化学式的写法和读法2化合价含义:由于形成化合物的元素有固定的原子个数比,所以化学上就用“化合价”来表示原子之间相互化合的数目化合物中各元素的化合价通常是在化学式中各元素符号或原子团的正上方标记,一般把“+”“-”写在前,价数写在后。
如元素化合价与离子表示方法的区别和联系离子符号化合价正负号及数值标的位置元素符号的右上角元素符号的正上方正、负号及数值书写顺序数值在前,正、负号在后正、负号在前,数值在后联系离子所带电荷与化合价数值是一致的,已知离子符号可推测该元素的化合价,已知化合价也可以确定离子所带电荷和电性实例Mg2+、Ca2+、Cl-化合价的一般规律①单质中,元素的化合价为0,在化合物中,正、负化合价代数和为0②在化合物中,氢元素的化合价通常为+1价,氧元素的化合价通常显示-2价③金属元素在化合物里显正价,非金属元素在和金属元素化合时,通常显负价④一些元素在不同物质中可显不同的化合价,如Fe有+2、+3价,S有-2、+4、-6价备注:这里介绍两种化合价口诀供给同学们记忆:口诀1:一价钾钠氯氢银;二价氧钙钡镁锌;三铝四硅五价磷;二三铁,二四碳,二四六硫都齐全,铜汞二价最常见。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有关化学式计算的三种基础计算的延伸和含杂质的混合物中主要成分纯度的计算1、化合物Ca(ClOx )2的相对分子质量为207,则x为________。
2、某元素R的氧化物的化学式为R2O3,其相对分子质量为160,则元素R的相对原子质量为____________。
3、氧化物X2O3中元素X与O的质量比为9:8,则X的相对原子质量为_______4、下列铁的化合物中,铁元素的质量分数最大的是( )。
A.Fe3O4B.Fe2O3C.Fe2O3·H2O D.FeO5、下列物质中,氮元素的质量分数最大的是( )。
A.(NH4)2SO4B.NH4Cl C.NH4HCO3D.(NH4)3PO46、100g硝酸铵中含有多少Kg的氮元素?7、多少千克硝酸铵与1200千克的尿素中所含氮元素的质量相等?8、赤铁矿石(主要成分是Fe2O3)中铁元素的质量分数为56%,计算该矿石中氧化铁的质量分数9、有一不纯的(NH4)2SO4样品,其中氮元素的质量分数为20%,求样品里含(NH4)2SO4的质量分数?10、已知某石灰石样品(主要成分是CaCO3),中钙元素的质量分数为34%,则该样品中碳酸钙的质量分数为()11、黄金首饰的纯度常用“K”来表示,24K是纯金、标号为l8K的首饰中黄金的质量分数是( )。
A.25% B.75% C.18% D.36%已知混合物中某元素的质量分数和一种物质的某元素的质量分数来判断另一种物质1.某村使用的氮肥是含有杂质的硝酸铵,含氮量为38%;这种氮肥可能含有的杂质是(括号内为杂质的含氮量)( )。
A.NH4HCO3(18%) B.NH4Cl(26%) C.CO(NH2)2(47%) D. (NH4)2SO4(21%)2. MgO和另一种氧化物的混合物,经分析该混合物中氧元素的质量分数为26%,则另一种氧化物可能式下列中的() A. P2O5B. CuOC. CaOD.Al2O34.常温下,某气体可能由中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的 ( )①SO2 ②SO2、CO ③SO2、N2④CO 、N2⑤SO2、CO、N2A.①②③B. ②③⑤C.①②⑤D.①④⑤根据化学变化前后元素守恒计算化学式的组成1、下列物质在空气中完全燃烧,生成的CO2和H2O的质量比为11:9,则该物质可能是( )。
A.C2H4B.CH4C.CH3OH D.C2H5OH2、有一种有机物23g,在空气中完全燃烧后,共生成44g二氧化碳和27g水,则该有机物含碳元素的质量是________g,含氢元素的质量是________g,该有机物是由____________元素组成的。
3、有一包镁和氧化镁粉末的混合物,由实验测得其中氧元素的质量分数为32%,则其中镁的质量分数是( )。
(可能用到的相对原子质量:O——16,Mg——24) A.20% B.40% C.48% D.80%两种化合物中含有相同的一个量求其他的两的比1、含有等质量的氧元素的CO和CO2的质量比为 ( )A、1:2B、2:1C、14:11D、11:142、含有等质量的碳元素的CO和CO2的质量比为________,所含氧元素的质量比为_______,所含分子个数比为_________。
3、相同质量的二氧化碳和一氧化碳中所含碳元素的质量比为________,所含氧元素的质量比为_______ ,所含分子个数比为__________。
4、含有等质量的硫元素的二氧化硫和三氧化硫的质量比为_______,所含氧元素的质量比为________,所含硫元素的质量比为_______,分子个数比为_________。
5、含有等质量的氧元素的SO2与SO3的质量比为_______,所含硫元素的质量比为______,分子个数比为________。
6、相同质量的SO2与SO3中,所含硫元素的质量比为______,所含氧元素的质量比为_______,所含分子个数比为________。
7、要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三铁的质量比为() A、3:2 B、61:1 C、30;29 D、29:428、(1)有NaHCO3,KHCO3,NH4HCO3三种化合物,若三种物质中所含碳元素的质量相同,则所含氢元素的质量比为____________(2)有NaHCO3,KHCO3,NH4HCO3三种化合物,若三种物质中所含氢元素的质量相同,则所含氧元素的质量比为____________(3)有NaHCO3,KHCO3,NH4HCO3三种化合物,若三种物质中所含氢元素的质量相同,则所含钠元素、钾元素、氮元素的质量比为____________9、当硝酸铵(NH4NO3)与尿素[CO(NH2)2]所含氮元素的质量相同时,它们的质量比是( )。
A.1:1 B.2:3 C.4:3 D.8:310、当CuO和Cu2O含相等质量的铜元素时,它们的质量比是( )。
A.10:9B.9:l0C.l:2D.2:111、等质量的SO2和O2混合,混合气体中硫元素和氧元素的质量比为()A、1:1B、1:2C、1:3 D1:412、在FeO,Fe2O3,Fe3O4三种化合物中,与等质量铁元素相结合的氧元素的质量比为() A、6:9:8 B、12:8:9 C、2:3:6 D、1;3:413、(1)在相同质量的H2,O2,NH3,和CO2,四种气体中,含有分子数目最多的是()A、O2 B、NH3C、H2D、CO2.(2)等质量的下列气体中,所含的分子个数最多的是()A、H2 B、O2C、COD、N214、当SO2与SO3的质量比为1:1时,其所含的分子数之比为( )。
A.l:1B.2:1C.5:4D.4:515、纯净的SO2与SO3质量比为4:1时,氧原子的个数比为()A、2:3B、3:2C、1:4D、10:316.在11g干冰和在9g水中,所含氧元素的质量比是( )。
A.1:1B.1:2C.2:1D.3:2求化学式(一)根据化合价求化学式1、X、Y两种元素,X的化合价为+1价,Y元素的化合价为-2价,则X、Y两种元素形成的化合物的化学式是() A、X2Y B、Y X2C、X3Y2D、YX2、已知金属元素R(只有一种化合价)的氧化物化学式为R2O3,则它的氯化物的化学式为()A、RCl2 B、RCl3C、 R2Cl3D、RCl(二)根据相对分子质量求化学式1、化合物Cn H2nO的相对分子质量和CO2的相对分子质量相等,求此化合物的化学式_____2、某元素硝酸盐的相对分子质量比它氢氧化物(碱)的相对分子质量大90,则该元素的氢氧化物应为( )。
A.ROH B.R(OH)2 C.R(OH)3D.R(OH)4(三)根据元素质量比求化学式1、①某金属R的氧化物2.32g,其中金属的质量为1.68g,已知金属的相对原子质量为56,则此金属氧化物的化学式为()②某金属R的氧化物2.04g,其中R的质量为1.08g,已知R的相对原子质量为27,则此金属氧化物的化学式为()2、(1)一种氮的氧化物,氮和氧的质量比为7:4,则此氮的氧化物的化学式为_______(2)在氮的某种氧化物中,氮元素与氧元素的质量比为7:16,则该氧化物的化学式为________(3)某种氮的氧化物中,氮元素和氧元素的质量比为7:12,则该氧化物中氮原子和氧原子的个数比为____________。
(4)有一种铝的氧化物,铝和氧的质量比为9:8,此氧化物的化学式为________ 3.(1)在铁、硫、氧三种元素组成的化合物中,各元素质量比为Fe:S:O=7:4:8,则此化合物的名称是_____________。
(2) 在钙、碳、氧三种元素组成的化合物中,各元素质量比为Ca:C:O=10:3:12,则此化合物的名称是_____________。
4、(1)由X、Y两元素组成的化合物中,X、Y两元素的质量比为3:2,相对原子质量之比为2:1,则该化合物的化学式为_____________(2)由X、Y两元素组成的化合物中,X、Y两元素的质量比为3:2,相对原子质量之比为3:1,则该化合物的化学式为__________(四)根据元素的质量分数求化学式1、分析某一铁的氧化物,知其含铁70%,则该铁的氧化物的化学式是__________。
2、①已知A 、B两元素的质量分数分别为80%、20%相对原子质量比为4:1,则化合物的化学式为 ___________②已知A 、B两元素的质量分数分别为70%、30%相对原子质量比为7:2,则化合物的化学式为 _________3、药用阿司匹林的元素质量组成是:含碳60%, 含氧35.5%,其余为氢。
它的相对分子质量为180,试确定该药品的化学式为 ____________4.有一种氯化物,通过实验分析之后,测定它含74.7%的氯元素,则这种物质是( )。
A.NaCl B.KCl C.CaCl2 D.MgCl2化学式氯化钾________氯化钙________氯化钠________氯化镁________氯化铝________氯化锌________氯化铁________氯化亚铁________ 氯化钡________氯化银________氯化铵________氯化铜________碳酸钾________碳酸钙________碳酸钠________ 碳酸镁________ 碳酸钡________碳酸银_______碳酸铵_______ 硝酸钾_______硝酸钙_______硝酸钠_______硝酸镁_______ 硝酸铝_______硝酸锌_______硝酸铁_______硝酸亚铁______ 硝酸银_____硝酸钡_____ 硝酸铵_______ 硝酸铜________ 硝酸汞________氮化镁________氯气_______氧气_______氢气_______氮气_______ 氨气_______氦气_______氖气_______氩气_______甲烷_______氯化银______氯化氢____ 硫酸钡_______ 硫酸铵_______硫酸银_____ 硫酸铁_______ 硫酸亚铁________ 硫酸铜_______硫酸钾_______硫酸钠________硫酸镁______硫酸铝________硫酸锌________ 硫化钾_________硫化钠_______硫化钾_______硫化氢_______氮化镁_______氧化钾______氧化钙______氧化钠_______氧化镁_______氧化铝______ 氧化锌_____氧化钡______ 氧化汞_______四氧化三铁____氧化铁____氧化亚铁______二氧化碳____二氧化硫_______ 二氧化氮_______水_______双氧水_______一氧化碳_______一氧化氮_______五氧化二磷_______氢氧化钾_______氢氧化钙_______氢氧化钠______氢氧化镁______ 氢氧化铝________氢氧化锌______ 氢氧化铁______氢氧化亚铁_______氢氧化铜________氢氧化钡_______碳酸_______硫酸_______硝酸_______盐酸_______磷酸_______高锰酸钾_______锰酸钾_______氯酸钾_______二氧化锰_______ 碳酸氢氨_______ 碳酸氢钠_______。
