硫酸亚铁溶液的制备与性质实验的再改进_梁峻峰
实验一 贫血药硫酸亚铁的制备与测定

实验一贫血药硫酸亚铁的制备与测定一、实验目的1.了解无机药物的一般制备方法;2.了解无机药物的常用检测方法和检测指标。
二、实验原理本品是治疗缺铁性贫血的特效药。
临床上主要用于慢性失血(月经过多、痔疮出血、子宫肌瘤出血、勾虫病失血等)、营养不良、妊娠、儿童发育期等引起的缺铁性贫血。
用铁屑与稀硫酸反应可以制备硫酸亚铁,反应方程式如下:Fe + H2SO4 FeSO+ H24从水溶液中结晶出来一般为FeSO4•7H2O,由于硫酸亚铁中的Fe2+具有还原性,在酸性条件下,可与高锰酸钾发生如下反应:10FeSO4 + 2KMnO4 + 8H2SO45Fe2(SO)4 +K2SO4 + 2MnSO4 +8H2O 故利用已知准确浓度的KMnO4溶液测定产品中的FeSO4的含量,微过量的MnO4-呈现粉红色,指示终点。
三、实验材料、试剂与仪器1.材料pH试纸,滤纸。
2.主要试剂高锰酸钾标准溶液(0.02mo1/L),硫酸,硝酸铅,硝酸,硫代乙酰胺,醋酸-醋酸钠缓冲溶液(pH=3.5),抗坏血酸,三氧化二砷,铁屑,氢氧化钠,碘化钾,锌,氯化亚锡等。
3.仪器分析天平,布氏漏斗,量筒,吸滤瓶,抽气管(或真空泵),蒸发皿,表面皿,比色管,比色管架,水浴锅,烧杯,碘量瓶等。
四、实验步骤1.铁屑油污的除去称取5g铁屑,放入烧杯(100mL)中,加入20mL 10%的Na2CO3溶液,小心加热约10min,以除去铁屑表面的油污。
倾析除去碱液,并用水将铁屑洗净。
2.硫酸亚铁的制备在盛有洗净铁屑的烧杯中,加入38mLH2SO4溶液(3.0mol/L),放在石棉网上加小火热,使铁屑与稀硫酸发生反应(在通风橱中进行)。
在反应过程中要适当添加去离子水,以补充蒸发掉的水分。
当反应进行到不再产生气泡时,表示反应基本完成。
用普通漏斗趁热过滤,滤液盛于蒸发皿中。
此时溶液的pH值约为1左右。
小火加热蒸发至10ml 左右,冷却至大量晶体析出,进行减压过滤,并用少量乙醇淋洗晶体,尽量抽干后,再用滤纸吸干水分,称重计算产率。
硫酸亚铁片的处方工艺改进

肾 1% 听
3 1 1 1.0 03 1A6 03 1 0 x . 35x .1 5 e .4 8 3 5 . 0 9 1. 住5 3.3 11 2. x .5 82x 4 3x .7 43 0 8 4 1 1 51 土 2 加 1, 1 3 3 x .4 4_ 10 7 3 1 2 6 3 09 4
24 透皮吸收结果
以东食若碱的透皮吸收为指标 , 按下列公式
由表 中可 以 看 出 : 氮 酮在 实 验 条件 下 能 捍 度不 同地 促 进透 皮 吸 收 其中含 2 A酮的样 % 品 在 3 .n内 的 吸 收 量 0i 相 当 于 不含 氮酮 样 品 的 10 i 5mn的吸 收策 说 明 痛 立 消涂 膜 剂 具有 作用 迅 迷 的特 点 , 并呈 M 晕 l 和 时 间 的依 赖 关系 ,这 为 确定 临 床 用药 剂 量 和 用 药 时间 提 供 r实 验依
2 质J检查 a
时硫酸亚铁 片的处方工 艺进 行了改进.解决了硫酸亚铁片
崩解问题 关键 词 硫酸 亚铁 片; 处方工艺; 改进 在抗 贫血药 的钦制剂中 。 硫酸业铁应用最广, 一它易被吸收 , 刺 激1 _囚为硫酸亚铁 在十燥空气 ,立 即风化 , t } ‘ 在N空气’迅速7 } ’ l 化变质, 以硫酸亚铁 片只能用 f 所 法压片 b酸亚铁为水r性药物.溶解时产生的溶解压力使水分不易透 P i a 过溶液层到达片内 ,囚而崩解缓慢 ,片芯崩解就较慢,包 F W离 9 层,崩解更慢, 《 中国药 典》(95年版} 19 要求搪衣片崩解不加挡 板,所 以照以前处 方生产的硫酸亚铁 片的崩解不合格 虽然市场土 硫酸亚铁片f求徽大 ,但工厂生产较困难。作为找公司的 一 + 个技术 攻关项 目,我们对它的制备工艺做 了改进,取得 r 满意的效果 1 处方及制备 11 处方 与制备 .
硫酸亚铁实验报告

一、实验目的1. 掌握硫酸亚铁的制备方法。
2. 熟悉实验基本操作,如称量、溶解、过滤、蒸发等。
3. 掌握实验条件的控制方法,如温度、时间等。
4. 分析实验结果,了解硫酸亚铁的制备过程及影响因素。
二、实验原理硫酸亚铁是一种重要的无机化合物,广泛应用于医药、化工、食品等行业。
实验原理如下:铁屑与稀硫酸反应生成硫酸亚铁和氢气:Fe + H2SO4 → FeSO4 + H2↑将反应后的溶液过滤,除去不溶物,得到硫酸亚铁溶液。
然后通过蒸发浓缩、冷却结晶,得到硫酸亚铁晶体。
三、实验材料与仪器1. 实验材料:铁屑、稀硫酸、蒸馏水、玻璃棒、烧杯、漏斗、滤纸、蒸发皿、酒精灯、温度计、电子天平。
2. 仪器:铁架台、铁圈、石棉网。
四、实验步骤1. 称取3.5g铁屑,放入100mL烧杯中。
2. 量取20mL 3M稀硫酸溶液,加入烧杯中。
3. 将烧杯放置在铁架台上,用玻璃棒搅拌溶液,观察反应现象。
4. 将烧杯放在石棉网上,用酒精灯加热溶液,保持温度在60℃左右。
5. 反应30分钟后,停止加热,待溶液冷却至室温。
6. 将溶液过滤,收集滤液。
7. 将滤液转移至蒸发皿中,用酒精灯加热蒸发,直至溶液表面出现晶膜。
8. 停止加热,待晶体完全析出后,用滤纸吸干水分。
9. 称量晶体质量,计算产率。
五、实验结果与分析1. 实验结果根据实验数据,得到以下结果:实验组晶体质量/g 产率/%1 2.5 71.42 2.6 74.33 2.7 76.82. 结果分析(1)温度对实验的影响:随着温度的升高,硫酸亚铁的产率逐渐增加。
在60℃时,产率最高,说明在该温度下,反应进行得较为充分。
(2)反应时间对实验的影响:随着反应时间的延长,硫酸亚铁的产率逐渐增加。
在30分钟时,产率最高,说明在该时间范围内,反应已经基本完成。
(3)铁屑质量对实验的影响:实验结果表明,随着铁屑质量的增加,硫酸亚铁的产率也随之增加。
但增加幅度逐渐减小,说明在一定范围内,铁屑质量对产率的影响较大。
从硫酸亚铁的制备说起教学设计及反思
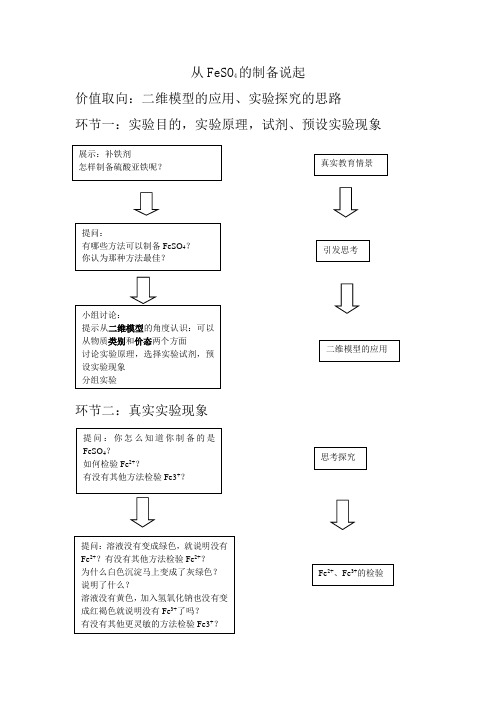
从FeSO4的制备说起
价值取向:二维模型的应用、实验探究的思路
环节一:实验目的,实验原理,试剂、预设实验现象
环节二:真实实验现象
环节三:分析干扰因素,抗干扰
教学反思:
不足:
1、学生实验操作需要规范,巡视学生的时候做到及时提醒,可以用多媒体展示台,让学生第一时间看到原生态的实验现象。
2、过滤操作需要让学生规范操作。
3、第一个学生回答用I-,应该及时鼓励学生,并且说明I-理论上是可以的,但是因为有I2生成,所以我们不选择。
课堂生成的东西还不能及时应对,按照自己的想法上课,没有过多的关注学生的反应和想法,对于学情的把握还不准确。
4、板书规范程度还要加强。
优点:
1、模型认知的应用,可以让元素化合物知识的学习更系统。
运用到之前学到的分类、氧化还原、离子反应的知识。
2、实验是化学的灵魂,要坚持一切从实践出发。
以后争取让学生多做实验,平时比较注意自己演示实验,学生动手能力比较差。
3、坚持,一定要坚持下去。
争取每节课都有自己的想法和思路。
硫酸亚铁制备透明氧化铁黄、红颜料的研究

硫酸亚铁制备透明氧化铁黄、红颜料的研究
透明氧化铁黄,首先要制得色相纯正,品质优良的氢氧化铁胶体。 判断分散体系是否为优质的氢氧化铁胶体的方法可用静置是否有 沉淀和丁达尔现象来作为依据。其中的化学反应方程式如下: Fe2 ( SO4 )3 + 6NaOH → 2Fe ( OH )3 + 3Na 2SO 4 通过实验, 确定反应温度在 45~60℃, 以适量六偏磷酸钠为分 散剂, 在约 20min 时间内以连续的方式加入质量浓度为 40%的氢氧 化钠水溶液可得到理想的氢氧化铁胶体。 三、透明氧化铁黄制备工艺: 氢氧化铁胶体属热力学不稳定体系,易转化为结晶体。透铁黄 的制备是在铁粉(或铁屑)存在的情况下,将 Fe(OH)3 胶体和高铁 的混合溶液在适当的温度下进行反应, 氢氧化铁经脱水, 粒子重排, 从无定型转化成α-水合氧化铁。相关化学反应式如下: 2Fe ( OH )3 →α-Fe2O3 ⋅ nH 2O + H 2O Fe2 ( SO4 )3 + 3Fe + 4H 2 O → 2 α-Fe2 O3 ⋅ nH 2O + 3FeSO4 + 3H 2 其中第二个反应式可分解为如下三个反应式: Fe2 ( SO4 )3 + 4H 2 O → 2Fe ( OH )3 + 3H 2SO4 Fe + H 2SO4 → FeSO4 + H 2 2Fe ( OH )3 →α-Fe2O3 ⋅ nH 2O + H 2O 我们研究和探讨了各种因素对透铁黄品质的影响。 1、 Fe(OH)3 粒径对透铁黄颜料粒具有非常大的的影响, Fe(OH)3 粒子的大小是决定所制得铁黄颜料是否透明的关键因素, 铁黄粒径 的大小与 Fe(OH)3 粒子的大小成正比;要制取粒子细微、均匀的纺 锤形透明氧化铁黄,首先要制得静置后无沉淀、有强丁达尔现象的 优质 Fe(OH)3 胶体。 2、转化温度是决定透铁黄含结合水多少的重要因素。转化温 度低,产物含结合水多,透铁黄色相暗;转化温度太高,产物含结 合水太少,色相呈桔黄色;要得到结合水分子数为 1.52 左右,呈柠 檬黄色相的透铁黄,应选择 85~90℃的转化温度。 3、转化时间也是关系到所制得透铁黄含结合水多少的一个重
氢氧化亚铁制备实验的设计

氢氧化亚铁制备实验的设计作者:刘彩虹张文兰刘丽君来源:《化学教学》2014年第09期摘要:针对氢氧化亚铁易被氧化,难于明显观察到其白色絮状且更难较长时间保存等问题,对制备氢氧化亚铁的装置进行了改进与设计。
利用医用输液器和注射器采用复分解反应制备氢氧化亚铁。
改进后的实验具有材料环保易得、装置简单、操作方便、实验快速、氢氧化亚铁保存长久等优点,非常适合课堂实验。
关键词:氢氧化亚铁;制备实验;化学实验教学文章编号:1005–6629(2014)9–0052–02 中图分类号:G633.8 文献标识码:B1 问题的提出氢氧化亚铁极易被氧气氧化,用一般的方法制备很难观察到白色的氢氧化亚铁沉淀,所以改进氢氧化亚铁的制备一直是中学化学实验研究的热点[1~4],但参考文献上报道的改进方法还有一些不尽如人意的地方。
如吴名胜老师的制备方法[5]耗时较长,制备低氧水需30分钟、配置硫酸亚铁和氢氧化钠溶液并除去其中的溶解氧需要约20分钟;所用油脂对实验后仪器的清洗带来不便,油脂一般不回收而直接倒入下水道,与环境不友好;还要用到多数中学化学实验室没有的离心机。
梁峻峰老师的方法[6]仅制备低氧水及低氧水中溶解氯化钠和氢氧化钠需要约35分钟,也用到油脂等有机物。
周红杰等[7]的方案一,观察到白色沉淀一般需要20分钟左右,且不能确保实验每次都能成功,不适合作为课堂实验;方案二和三用煤油存在清洗不便和造成环境污染等不足,也不能确保每次实验都能观察到氢氧化亚铁的白色沉淀(可能在加煤油和投入钠时会有少量空气进入)。
唐悦[8]的电解法在烧杯中进行实验,需要的油脂量更大;所需仪器多、反应原理复杂,不适合新授课教学。
因此对该实验作进一步的改进是很有必要的。
笔者经认真思考、讨论与反复实践,设计了以下的制备方法,取得了非常好的实验效果。
2 设计方案将铁粉和稀硫酸在配有特制双孔塞的试管中反应,产生的氢气排尽生成的硫酸亚铁溶液及试管中空气;用注射器抽取硫酸亚铁溶液后,再抽取新配制的浓氢氧化钠溶液,反应在注射器中进行;注射器针头插入橡胶塞中,确保注射器中的物质与空气隔绝。
有关硫酸亚铁铵制备实验的几点改进

硫酸亚铁铵的制备是大学无机化学的一个典型的综合实验,如果按照常规的实验室制法,实验中会出现产品产率低、杂质含量高和产生有毒气体等问题[1-2].本文针对实验中出现的上述问题,在对综合性设计性实验研究和探索的基础上进行反复实验操作,从缩短反应时间,减少环境污染,改进实验仪器装置等方面,对反应条件和实验装置进行了改进和优化,尤其是对实验过程的温度进行了关键性的探索,使整个制备实验达到了反应时间短、污染少、产品检测精确等良好效果.同时,为了提高实验产品检测的准确度,硫酸亚铁铵制备实验过程增加了对产品组分的检测.1实验原理硫酸亚铁铵是一种复盐,俗称摩尔盐.化学式为FeSO 4·(NH 4)2SO 4·6H 2O ,是浅蓝绿色单斜晶体.在空气中它比一般的亚铁盐稳定,不易被氧化,易溶于水不溶于乙醇,是一种常用的还原剂,在分析化学中常作为基准物质,用来直接配制标准溶液或标定未知溶液浓度[3-4].硫酸亚铁铵的制备分两步进行[5],第一步是铁屑与稀硫酸反应生成硫酸亚铁.第二步是将制得的硫酸亚铁与等物质的量的硫酸铵混合,利用复盐的溶解度比组成它的简单盐小的特性,经蒸发、浓缩、结晶制得硫酸亚铁铵复盐.反应方程式如下:Fe+H 2SO 4=FeSO 4+H 2↑FeSO 4+(NH 4)2SO 4+6H 2O=FeSO 4·(NH 4)2SO 4·6H 2O 在铁屑与稀硫酸反应时除放出H 2外,还夹杂少量H 2S 和PH 3等有毒气体及酸雾,为避免H 2S 、PH 3等有毒气体污染环境可用硫酸铜溶液来吸收气体中的有毒气体.硫酸亚铁铵产品中的杂质主要是Fe 3+,产品质量等级也常以Fe 3+含量来评定[6].2常规实验内容2.1铁屑的净化称取2.0g 铁屑,放入250mL 锥形瓶中,加入l0%Na 2CO 3溶液25mL ,于石棉网上小火加热煮沸约10min ,以除去铁屑上的油污.用倾析法倾去Na 2CO 3碱液,然后用蒸馏水清洗至中性,倾去洗涤水,以备待用.2.2硫酸亚铁的制备在250mL 锥形瓶中,放入洗净的铁屑,加入15mL3mol ·L -1H 2SO 4溶液(酸要过量30%),盖上带有玻璃导气管的塞子,玻璃导气管连接到含有CuSO4溶液的烧杯中,用CuSO 4溶液做吸收液除去H 2S 、PH 3等有毒气体,将锥形瓶放于石棉网上小火加热,反应过程中加少量水使原溶液体积保持不变,反应至铁屑残留物在溶液中不再冒气泡为止.趁热减压过滤,用少量蒸馏水洗涤残渣,抽干.将滤液转移至蒸发皿中.用滤纸吸干铁屑残渣后称重,计算出溶液中生成的FeSO 4的量.2.3硫酸亚铁铵晶体的制备由计算出的FeSO 4的量,按反应方程式计算并称取所需(NH 4)2SO 4晶体的质量,加入到上述制得的FeSO 4溶液中.调节混合溶液的pH 值为1.将溶液在石棉网上小火加热,蒸发浓缩至表面出现结晶薄膜为止(蒸发过程不要搅动溶液).静置,自然冷却至析出硫酸亚铁铵晶体.减压过滤除去母液,并用少量95%乙醇洗涤晶体,抽干.称量并计算产率.2.4硫酸亚铁铵晶体的检验利用Fe 3+的限量分析确定制备的硫酸亚铁铵纯度级别.有关硫酸亚铁铵制备实验的几点改进李晓春(赤峰学院化学系,内蒙古赤峰024000)摘要:通过分析硫酸亚铁铵的实验制备过程中出现的问题,对反应的实验装置和反应的条件进行了改进和探索,提高了产物的产率和纯度.同时增加了产物的组分检测步骤,使实验的数据和结果更加科学和准确.关键词:硫酸亚铁铵;制备实验;改进;纯度;产率中图分类号:O614.81文献标识码:A文章编号:1673-260X (2011)10-0027-02Vo l.27No .10Oct.2011第27卷第10期2011年10月赤峰学院学报(自然科学版)J o urnal o f Chifeng University (Natural S cience Editio n )27--. All Rights Reserved.3改进实验内容常规的硫酸亚铁铵制备实验存在着下列问题:(1)在硫酸亚铁制备过程中,锥形瓶中使用带盖的塞子,不利于及时补充蒸馏水以保持原溶液体积不变.同时,在闭合实验装置中,用于吸收有毒气体的硫酸铜溶液容易发生倒吸,进入锥形瓶中污染产物.(2)在硫酸亚铁制备过程中,没有说明水浴反应的适宜温度.在实际反应中,温度过高时,会析出硫酸亚铁(FeSO 4·H 2O)的白色晶体,减压过滤时会残留在滤纸上,降低产物的产率;温度过低时,反应不完全,影响产品的产率和纯度.(3)在硫酸亚铁铵晶体的检验过程中,只是通过晶体中所残留的三价铁离子的含量来确定产品的纯度,而忽视了产品自身纯度的检验.针对上述情况,通过多次实验探索,对本实验存在的问题进行了改进.从而缩短了整个反应的时间,提高了硫酸亚铁铵的产率.3.1实验装置的改进在硫酸亚铁制备的实验装置上(图1),增装了滴液漏斗,通过滴加蒸馏水来补加散失的水分,防止发生手动加水时出现有毒气体溢出的现象,避免了实验过程中有毒气体对环境的污染;同时在锥形瓶和吸收液之间增装了安全瓶,安全瓶是起着保护作用的安全装置,能够有效防止吸收液发生倒吸,从而进入锥形瓶中污染产物.3.2反应温度的改进在硫酸亚铁的制备过程中,随着温度的升高,反应速率加快.经过不同温度下的反应探索,发现:当水浴温度高于70℃时,会析出硫酸亚铁晶体从而降低产物的产率;水浴温度低于50℃时,由于反应不完全,降低了产物的产率和纯度.综合温度因素对产物的影响,将水浴温度控制在50~70℃较为适宜.所得到的产物的产率和纯度相对较高.3.3产品检验的改进在硫酸亚铁铵晶体的检验过程中,除了用比色法分析杂质Fe 3+的含量来确定制备的硫酸亚铁铵纯度级别外,还可以对硫酸亚铁铵晶体中的Fe 2+的含量进行滴定分析来确定产物的纯度.在滴定分析中,以二苯胺磺酸钠作为指示剂,用重铬酸钾标准溶液测定Fe 2+含量,反应终点时,过量少许重铬酸钾使指示剂有无色变为紫红色.由于在滴定过程中不断生成Cr 3+累积而现绿色,故终点由绿色变为蓝紫色.反应的离子方程式:Cr 2O 72++6Fe 2++14H+=2Cr 3++6Fe 3++7H 2O 具体的过程为:准确称取0.6~0.8g (准确至0.1mg)硫酸亚铁铵晶体三份,放入三个250mL 锥形瓶中,每份分别加入100mL 水、20mL3mol ·L -1硫酸溶液、1g 氟化铵固体、6~8滴二苯胺磺酸钠指示剂,用0.1500mol ·L -1重铬酸钾标准溶液进行滴定,溶液由深绿色变为紫色或蓝紫色即为终点.分别记下所用重铬酸钾标准溶液的体积.通过上述离子方程式的计量关系来计算Fe 2+的含量,再进一步计算硫酸亚铁铵晶体的纯度.使产品的纯度检测更加科学和准确.4实验结论将反应的实验装置改进后,使反应过程中产生的有毒气体污染减小到零,再进行全封闭式实验实行有效控温,大大缩短了反应时间,实现了无机化学实验的绿色化理念.———————————————————参考文献:〔1〕姜述琴,马荔,梁竹梅,杨涛,陈虹锦.硫酸亚铁铵制备实验的改进探索[J].实验室研究与探索,2005,24(7).〔2〕张喜英.硫酸亚铁铵制备实验小结[J].周口师专学报,1995(1):26-27.〔3〕杨绪红,李胜.两例无机化学实验的改进[J].咸宁学院学报,2003(3).〔4〕汪峰云,王小龙.硫酸亚铁铵制备的绿色化设计[J].大学化学,2006,21(1):51-54.〔5〕王锐.对硫酸亚铁铵制备实验的探讨[J].固原师专学报,2005,26(3):73-92.〔6〕高职高专化学教材编写组.无机化学实验[M]援高等教育出版社,2002.89-92.图1改进的硫酸亚铁制备实验装置(增装了滴液漏斗和安全瓶)28--. All Rights Reserved.。
硫酸亚铁铵制备实验的改进

硫酸亚铁铵制备实验的改进作者:魏海霞陈迪妹李荣强吴晓聪来源:《化学教学》2010年第07期文章编号:1005-6629(2010)07-0014-02 中图分类号:G633.8 文献标识码:B“硫酸亚铁铵的制备”是人教版和苏教版选修教材《实验化学》中的一个重要实验,开设本实验可使学生学到一系列化学合成的基本操作。
如称量、水浴加热、倾析、抽滤、溶解、蒸发、结晶等,并初步了解复盐的一般特征,但按照教材介绍的方法实验时,往往出现一些实验问题,笔者根据教学实践,对该实验的改进进行了一些探讨。
教材给出的实验方案如下:取5 g铁屑用15 mL 1 mol·L-1碳酸钠溶液浸泡、倾析,洗涤,晾干。
再取4.2 g洗净的铁屑与25 mL 3mol·L-1硫酸反应制得硫酸亚铁,减压热过滤后再与9.5 g硫酸铵晶体反应,制备硫酸亚铁铵复盐,利用复盐溶解度比组成它的简单盐溶解度小的特点,经蒸发、结晶,抽滤制得[1]。
1实验中出现的问题与分析(1)实验时间较长。
光水浴加热制备硫酸亚铁就需要40多分钟,在二个课时内较难完成整个实验。
其主要原因是,试剂用量较大,铁屑与稀硫酸反应较慢,操作步骤繁琐。
(2)亚铁离子的被氧化问题。
铁粉与稀硫酸随着反应进行,常会出现黄色溶液或黑色块状物,硫酸亚铁溶液与饱和硫酸铵混合时也会出现黄色现象,混合液进行蒸发浓缩时又易出现黄色溶液或黄色晶体。
其主要原因是,随着反应的进行,反应放热使反应液温度升高,在混合溶液时,酸度不够,饱和硫酸铵中混有溶解氧及其他氧化性杂质,蒸发浓缩时酸度不够,温度过高等。
(3)污染问题。
铁粉与稀硫酸反应时产生出刺鼻、呛人的气体。
这是由于铁屑不纯,与稀硫酸反应产生硫化氢、磷化氢等有毒气体。
(4)实验装置与设备问题。
大部分中学不具备常规减压过滤装置。
而且过滤时因压强差太大易发生固体透过滤纸现象,造成产率降低,操作也不方便。
2硫酸亚铁铵制备实验的改进针对以上问题,笔者根据中学教学实际,从缩短反应时间、减少环境污染、简化操作、提高产品纯度和产率等几个方面进行了探究,在教材给出的实验方案的基础上进行如下改进:(1)试剂微量化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸亚铁溶液的制备与性质实验的再改进
梁峻峰
(河北承德平泉县第一中学 067500)
摘要 由于Fe 2+极易被空气中的氧气氧化,故通常情况下配制的Fe 2+
溶液和在敞开环境中进
行的性质实验都无法达到预期效果。
经探究,优化了Fe 2+溶液的制备方法并对其性质实验进行改进,收到了良好的效果。
实验充分体现了简约性、微型化的设计理念,实现了废物的再利用。
关键词 硫酸亚铁 溶液配制 废物利用 制备方法
FeSO 4溶液与烧碱溶液的反应和Fe 3+、Fe 2+分
别与KSCN 溶液反应的对比实验是中学化学教学
的2个重要演示实验,但由于Fe 2+
极易被空气中的氧气氧化,故通常情况下配制的Fe 2+溶液和在敞开环境中进行的性质实验都无法达到预期效果。
因
此,Fe 2+
溶液的制备和实验过程中避免空气的影响
就成为Fe 2+
性质实验成败的关键。
鉴于此,笔者优化了Fe 2+溶液的制备方法并对其性质实验进行改进,收到了良好的效果。
1 实验装置(如图1、2所示
)
取2个用蒸馏水反复清洗过的青霉素针剂瓶(约
10mL ,其一带瓶塞)、一次性输液器(截取如图2所示的一部分并封闭进气管)等组装成微型实验装置(也可用透明胶带将针剂瓶固定在铁架台的立柱上)。
2 FeS O 4溶液的实验前制备
检验装置的气密性,取约0.2g 过量的还原性铁粉放入针剂瓶中,加满2%的稀硫酸,组装好仪器(用胶布将瓶塞与针剂瓶粘结的目的是为了防止在Fe 2+性质检验时瓶塞意外脱落)。
由于反应产生氢气,将针剂瓶中针管上方的液体逐渐排入另一针剂
瓶中,形成的空间充满氢气。
因氢气的密度比空气的小得多,继续反应逸出的氢气主要聚积在输液器的滴斗(输液器上端体积膨大的部分,生产厂家称之为滴斗)上方,不断产生的氢气使其中的空气全部排出体系而充满氢气。
这样,不仅使整套装置排除了空气的干扰,而且进入另一针剂瓶中的液体还为其形成了隔绝外界空气的液封,从而使其形成了一个封闭无氧的环境。
反应足够长的时间(约3~5h 乃至更长时间,为了方便起见,可第一天制备Fe 2+溶液,第二天进行性质实验),待针剂瓶的溶液中不再有气泡逸出并呈澄清透明浅绿色,过量的铁粉沉降于针剂瓶的底部,即得FeSO 4溶液。
由于反应放热,反应结束后,针剂瓶中的气体压力变小,会导致另一针剂瓶中的液体部分回流,滴斗可以防止排出的液体倒吸而导致实验失败的情况发生。
3 Fe 2+的性质实验
3.1 FeS O 4溶液与KSC N 溶液的反应
(1)取一只盛有煮沸(除溶解氧)过的KSCN 溶液的注射器,刺破针剂瓶的橡胶塞,轻缓地滴加溶液,Fe 2+遇KSCN 溶液不显红色(若用通常情况下配备
的Fe 2+
溶液作对照实验,一个不显红色,一个显浅红色,可形成强烈的视觉效果),且长时间颜色不发生变化,有利于学生充分观察,并获得正确的感性认识。
(2)再用另一只盛有新制氯水(或3%H 2O 2溶液、稀硝酸等其他氧化性试剂)的注射器向针剂瓶中滴加氯水,溶液迅速变成红色。
3.2 FeS O 4溶液与烧碱溶液的反应
(1)另取一套实验装置,用一支注射器吸取几经煮沸并冷却的新制NaOH 溶液(预先用该溶液洗涤2~3次),刺破瓶塞,将针头伸入到液面以下,向溶液中缓慢注入试剂,随着溶液的加入,先有白色胶状
沉淀生成,后转变为絮状,即Fe 2++2OH -=
Fe (OH )2↑,几分钟内沉淀的颜色不发生变化。
(2)再用另一支充满氧气的注射器向溶液中缓慢地通入气体,将清晰地看到白色絮状沉淀迅速变成灰绿色,逐渐变成红褐色,即4Fe (OH )2+O 2+2H 2O =4Fe (OH )3。
参 考 文 献
[1] 人民教育出版社化学室.全日制普通高级中学教科书(必修加
选修)化学第二册.第2版,北京:人民教育出版社,2007:79-80
[2] 梁峻峰.化学教育,2009,30(5):55
·84·化 学 教 育 2010年第3期。
