2010年高考试题——化学(江苏卷)
高考试题——化学(江苏卷)含试卷分析和试题解析
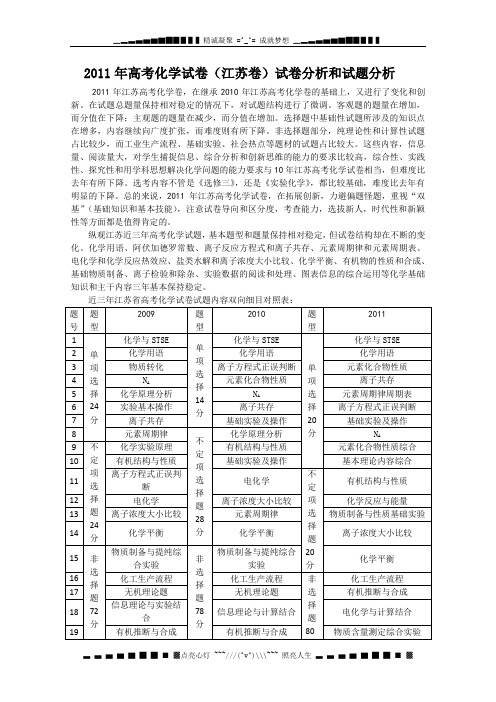
2011年高考化学试卷(江苏卷)试卷分析和试题分析2011年江苏高考化学卷,在继承2010年江苏高考化学卷的基础上,又进行了变化和创新。
在试题总题量保持相对稳定的情况下,对试题结构进行了微调。
客观题的题量在增加,而分值在下降;主观题的题量在减少,而分值在增加。
选择题中基础性试题所涉及的知识点在增多,内容继续向广度扩张,而难度则有所下降。
非选择题部分,纯理论性和计算性试题占比较少,而工业生产流程、基础实验、社会热点等题材的试题占比较大。
这些内容,信息量、阅读量大,对学生捕捉信息、综合分析和创新思维的能力的要求比较高,综合性、实践性、探究性和用学科思想解决化学问题的能力要求与10年江苏高考化学试卷相当,但难度比去年有所下降。
选考内容不管是《选修三》,还是《实验化学》,都比较基础,难度比去年有明显的下降。
总的来说,2011年江苏高考化学试卷,在拓展创新,力避偏题怪题,重视“双基”(基础知识和基本技能),注意试卷导向和区分度,考查能力,选拔新人,时代性和新颖性等方面都是值得肯定的。
纵观江苏近三年高考化学试题,基本题型和题量保持相对稳定,但试卷结构却在不断的变化。
化学用语、阿伏加德罗常数、离子反应方程式和离子共存、元素周期律和元素周期表、电化学和化学反应热效应、盐类水解和离子浓度大小比较、化学平衡、有机物的性质和合成、基础物质制备、离子检验和除杂、实验数据的阅读和处理、图表信息的综合运用等化学基础知识和主干内容三年基本保持稳定。
近三年江苏省高考化学试卷试题内容双向细目对照表:2012届高三化学复习,我看还是应该狠抓化学基础知识和主干内容,重视基础实验、重视学生操作能力的培养,注重课堂教学中学生学习思考性、灵活性和创新性的渗透,不断穿插生活中的化学常识、化学知识的应用和运用、化工生产流程、节能减排、绿色环保、新能源和新材料等方面的内容,提高学生的化学适应性和考场应变能力。
2011年江苏省高等学校招生考试化学试卷可能用到的相对的原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Ca:40 Mn:55 Fe:56 Cu:64 Zn:65 Br:80 Ag:108选择题(共40分)单项选择题:本题包括10小题,每小题2分,共计20分。
2010年高考化学真题(Word版)——全国1卷(试题+答案解析)

2010年普通高等学校招生全国统一考试(全国1卷)化学试题可能用到的相对原子质量:H 1 C 12N 14O 16Na 23Mg 24S 32Cu 64一、选择题6.下列判断错误的是( )A.沸点:NH3>PH3>AsH3B.熔点:Si3N4>NaCl>SiI4C.酸性:HClO4>H2SO4>H3PO4D.碱性:NaOH>Mg(OH)2>Al(OH)37.下列叙述正确的是( )A.Li在氧气中燃烧主要生成Li2O2B.将SO2通入BaCl2溶液可生成BaSO 3沉淀C.将CO2通入次氯酸钙溶液可生成次氯酸D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu8.能正确表示下列反应的离子方程式是( )A.将铜屑加入Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2OC.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO===Fe3++2H2O+NO↑D.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑9.下列叙述正确的是( )A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>bB.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7C.1.0×10-3mol·L-1盐酸的pH=3.0,1.0×10-8mol·L-1盐酸的pH=8.0D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=1110.如图是一种染料敏化太阳能电池的示意图。
电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:TiO2/S TiO2/S*(激发态)TiO2/S*―→TiO2/S++e-I+2e-―→3I-2TiO2/S++3I-―→2TiO2/S+I下列关于该电池叙述错误的是( )A.电池工作时,是将太阳能转化为电能B.电池工作时,I-在镀铂导电玻璃电极上放电C.电池中镀铂导电玻璃为正极D.电池的电解质溶液中I-和I的浓度不会减少11.下图表示4溴环己烯所发生的4个不同反应。
2010年高考试题精选2010年高考试题——(江苏卷)解析版280

2010年高考试题精选2010年高考试题--(江苏卷)解析版测试题 2019.91,16.人口迁移状况在一定程度上反映城市化过程。
下列推断正确的是 A.乙城市圈60年代城市化速度快、水平商B.乙城市圈90年代城市化速度慢、水平低C.丙城市圈90年代城市化速度快、水平高D.90年代,与丙城市圈相比,甲城市圈城市化速度快、水平较低2,图l0为我国某地区农业科技园区循环经济模式圈。
读图回答l7一l8题。
17.①、②、③、④、⑤的含义符合该循环系统的是A.种苗培育、饲料加工、排放、废弃物、饲料B.水窖集雨、饲料加工、供暖、废弃物、肥料C.种苗培育、水窖集雨、净化、废气、饲料D.水窖集雨、饲料加工、供暖、肥料、废弃物3,18.该园区农业生产的特点是A.小农经营 B.集约化程度低 C.商品率高 D.科技水平低4,(二)双项选择题:图11为我国某山体不同坡向垂直带谱示意图。
某校地理兴趣小组通过对该山体垂直带谱的分析.提出了不同的看法。
读图回答l9~20题。
19.关于垂直带谱的看法.正确的是A.东坡、南坡的带谱比北坡、西坡复杂.是因为山麓地面高度不同B.西坡的高山灌丛草甸带比东坡的高而窄.是因为西坡比较湿润C.北坡积雪冰川带的下限比南坡低是坡向造成的D.东坡积雪冰川带的下限比西坡低是地形造成的5,20.对山体位置的判断,正确的是A.地处南方湿润地区B.地处西北干旱地区C.位于湿润河谷一侧D.位于干热河谷一侧6,2010年3、4月间.我国西南数省遭遇大早。
而新疆堆吾尔自治区阿勒泰部分地区却在准备防洪。
据此回答21~22题。
21.西南地区发生旱灾的主要原因有A.属于湿润地区,农业用水量过大B.降水较常年同期偏少C.属于干旱地区,水资源不足D.气温较常年同期偏高,蒸发量大7,22.阿勒泰部分地区洪水的形成原因及应对措施有A.暴雨引发洪水.建立预警系统B.雨季降水形成洪水.修建水库C.积雪融化引发洪水.疏浚河道D.来自上游的洪水.修堤筑坝8, 大气中二氧化碳含量增多导致全球气候变化。
2010年高考(全国卷Ⅰ)(化学)附解析

2010年普通高等学校招生全国统一考试(全国卷Ⅰ)6.下列判断错误的是()A.熔点:Si3N4>NaCl>SiI4B.沸点:NH3>PH3>AsH3C.酸性:HClO4>H2SO4>H3PO4D.碱性:NaOH>Mg(OH)2>Al(OH)3解析:本题考查元素周期律,意在考查考生对化学基本概念和基本原理的理解和应用能力.Si3N4、NaCl、SiI4分别为原子晶体、离子晶体和分子晶体,故熔点大小顺序为:Si3N4>NaCl>SiI4,A项正确;NH3、PH3、AsH3均为分子晶体,且分子的组成和结构相似,由于NH3分子间存在氢键,其沸点最高,而PH3的相对分子质量小于AsH3的,因此分子间作用力PH3小于AsH3,则沸点PH3小于AsH3,B项错误;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,由于非金属性:Cl>S>P,故酸性:HClO4>H2SO4>H3PO4,C项正确;元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,由于金属性:Na>Mg>Al,故碱性:NaOH>Mg(OH)2>Al(OH)3,D项正确.答案:B7.下列叙述正确的是()A.Li在氧气中燃烧主要生成Li2O2B.将CO2通入次氯酸钙溶液中可生成次氯酸C.将SO2通入BaCl2溶液中可生成BaSO3沉淀D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu解析:本题考查元素化合物,意在考查考生对元素化合物知识的掌握程度.Li在氧气中燃烧生成Li2O,A项错误;将CO2通入次氯酸钙溶液中发生反应:CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO[CO2过量时,生成Ca(HCO3)2],B项正确;BaCl2溶液显中性,SO2通入BaCl2溶液中,无BaSO3沉淀生成,C项错误;将NH3通入热的CuSO4溶液中不能使Cu2+还原成Cu,D项错误.答案:B8.能正确表示下列反应的离子方程式的是()A.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2OC.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO-3===Fe3++2H2O+NO↑D.将铜屑加入含Fe3+的溶液中:2Fe3++Cu===2Fe2++Cu2+解析:本题考查离子方程式的正误判断,意在考查元素化合物知识.将铁粉加入稀硫酸中,发生反应的离子方程式为:Fe+2H+===Fe2++H2↑,A项错误;磁性氧化铁可以看做FeO·Fe 2O 3,溶于盐酸时发生反应的离子方程式为:Fe 3O 4+8H +===Fe 2++2Fe 3++4H 2O ,B 项错误;氯化亚铁和稀硝酸反应,离子方程式为:3Fe 2++4H ++NO -3===3Fe 3++NO ↑+2H 2O ,C 项错误;将铜屑加入含Fe 3+的溶液中发生氧化还原反应:2Fe 3++Cu===2Fe 2++Cu 2+,D 项正确. 答案:D9.下列叙述正确的是( )A .某醋酸溶液的pH =a ,将此溶液稀释1倍后,溶液的pH =b ,则a >bB .在滴有酚酞溶液的氨水中,加入NH 4Cl 至溶液恰好无色,则此时溶液的pH<7C .1.0×10-3 mol/L 盐酸的pH =3.0,1.0×10-8 mol/L 盐酸的pH =8.0 D .若1 mL pH =1的盐酸与100 mL NaOH 溶液混合后,溶液的pH =7,则NaOH 溶液的pH =11解析:本题考查电解质溶液,意在考查考生对水溶液中离子平衡的理解和应用能力.醋酸在稀释时,其电离程度增大,n (H +)增大,但c (H +)减小,因此pH 增大,故a<b ,A 项错误;在滴有酚酞溶液的氨水中,加入NH 4Cl 至溶液恰好无色,则此时溶液显弱碱性,B 项错误;pH =8.0的溶液为碱性溶液,因此1.0×10-8 mol/L 的盐酸其pH 不可能等于8,只能接近7,C 项错误;设NaOH 溶液的pH =b ,两溶液混合后溶液的pH =7,则1×10-3 L×10-1 mol/L =100×10-3 L ×10b -14 mol/L ,解得b =11,D 项正确.答案:D10.下图是一种染料敏化太阳能电池的示意图.电池的一个电极由有机光敏染料(S)涂覆在TiO 2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:TiO 2/S ――→hνTiO 2/S *(激发态)TiO 2/S *―→TiO 2/S ++e - I -3+2e -―→3I -2TiO 2/S ++3I -―→2TiO 2/S +I -3下列关于该电池叙述错误的是( )A .电池工作时,I -在镀铂导电玻璃电极上放电B .电池工作时,是将太阳能转化为电能C .电池的电解质溶液中I -和I -3的浓度不会减少D.电池中镀铂导电玻璃为正极解析:本题考查原电池的工作原理,意在考查化学基本原理的分析和应用能力.根据电池反应,TiO2电极流出电子,镀铂导电玻璃电极流入电子,故镀铂导电玻璃作正极,I-3在镀铂导电玻璃电极上发生还原反应I-3+2e-===3I-,A项错误,D项正确;电池工作时,有机光敏染料吸收太阳能,最终转化为电能,B项正确;根据电池反应,电池工作时,I-在负极放电和正极生成的物质的量相等,I-3在正极放电和负极生成的物质的量相等,故二者在电解质溶液中的浓度不变,C项正确.答案:A11.下图表示4-溴环己烯所发生的4个不同反应.其中,产物只含有一种官能团的反应是()A.①②B.②③C.③④D.①④解析:本题考查有机物的性质,意在考查考生对有机物官能团的认识.反应①为氧化反应,产物含有溴原子和羧基两种官能团;反应②为取代反应,产物含有羟基和碳碳双键两种官能团;反应③为消去反应,产物只含碳碳双键一种官能团;反应④为加成反应,产物只含溴原子一种官能团.故C项正确.答案:C12.一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314 mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于()A.3∶1 B.5∶3C.2∶3 D.1∶2解析:本题考查化学计算,意在考查考生对化学计算基本方法的应用能力.0.25 g磷的物质的量为0.25 g31 g/mol=0.008 mol,标准状况下314 mL氯气的物质的量为0.314 L22.4 L/mol=0.014 mol,则n(P)∶n(Cl)=0.008∶(0.014×2)=2∶7,设PCl3、PCl5的物质的量分别为x、y,则(x+y)∶(3x+5y)=2∶7,解得x∶y=3∶1,A项正确.答案:A13.下面关于SiO2晶体网状结构的叙述正确的是()A.最小的环上,有3个Si原子和3个O原子B.最小的环上,Si和O原子数之比为1∶2C.最小的环上,有6个Si原子和6个O原子D.存在四面体结构单元,O处于中心,Si处于4个顶角解析:本题考查晶体的结构,意在考查考生对常见晶体类型的空间结构的理解能力.二氧化硅晶体相当于将金刚石晶体中的C原子换成Si原子,同时在每两个Si原子中心连线上的中间加上一个O原子,最小的环上有12个原子(6个Si原子和6个O原子),A项错误,C项正确;最小的环上Si和O原子数之比为1∶1,B项错误;SiO2晶体为空间网状结构,每个Si原子与相邻的4个O原子以共价键相结合,前者位于四面体的中心,后者位于正四面体的4个顶点,D错.答案:C27.(15分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L.反应物A的浓度随时间的变化如下图所示.请回答下列问题:(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②________________________________________________________________________;③________________________________________________________________________;(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为________;(3)该反应的ΔH________0,其判断理由是________________________________________________________________________ ________________________________________________________________________;(4)该反应进行到4.0 min时的平均反应速率:实验②:v B=________;实验③:v C=________.解析:本题主要考查化学平衡,意在考查考生读图、表述和计算能力.(1)分析图象可知,①和②在平衡时刻A的浓度相等,且②的曲线斜率较大,说明反应速率较大,故是改变某一条件使反应加快,但平衡没有移动,故只可能是使用了催化剂.①和③相比较,平衡时刻③中A的浓度较小,曲线斜率较大,说明③的反应速率较大且平衡向正方向移动,而起始浓度相等,故只可能是升高温度.(2)由起始到平衡时刻Δc(A)=0.10 mol·L-1-0.060 mol·L-1=0.040 mol·L-1,故Δc(B)=0.080 mol·L-1,则B的转化率为0.080÷0.20×100%=40%;实验③平衡时刻,c(C)=0.060 mol·L-1.(3)由(1)可知,温度升高平衡向正方向移动,那么该反应正反应方向要吸热,ΔH>0.(4)观察图象可知,在第4.0 min时,②中c(A)=0.072 mol·L-1,③中c(A)=0.064 mol·L -1.②中v=(0.10 mol·L-1-0.072 mol·L-1)/4.0 min=0.007 mol·L-1·min-1,而v B=2v A=0.014Amol·L-1·min-1.③中v A=(0.1 mol·L-1-0.064 mol·L-1)/4.0 min=0.009 mol·L-1·min-1,而v C =v A=0.009 mol·L-1·min-1.答案:(1)加催化剂达到平衡的时间缩短,平衡时A的浓度未变温度升高达到平衡的时间缩短,平衡时A的浓度减小(2)40%(或0.4)0.060 mol/L(3)>温度升高,平衡向正反应方向移动,故该反应是吸热反应(4)0.014 mol/(L·min)0.009 mol/(L·min)28.(15分)有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂.纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同.现进行如下实验:①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D 中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶.根据上述实验信息,请回答下列问题:(1)能确定的溶液是(写出溶液标号与相应溶质的化学式):________________________________________________________________________ ________________________________________________________________________;(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________.解析:本题主要考查物质的推断,意在考查考生的逻辑推理能力.由A有刺激性气味,且与浓盐酸靠近有白雾,说明A为浓氨水.而F能溶于过量的氨水,说明其为AgNO3溶液.纯E为油状液体,故E为H2SO4.由C与E(H2SO4)和F(AgNO3)要产生不溶于硝酸的沉淀故其为BaCl2或BaBr2等.B与H2SO4反应生成无色无味的气体,说明其含CO2-3,但阳离子不能确定.故可以确定的是:A为浓氨水,F为AgNO3溶液,E为H2SO4.答案:(1)A:NH3,E:H2SO4,F:AgNO3,C:BaCl2(若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分)(2)B Na2CO3或K2CO3用铂丝蘸取少量B,在氧化焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液D Al2(SO4)3或MgSO4取少量D,向其中滴加NaOH溶液有沉淀生成,继续加过量NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶,则D为MgSO4溶液29.(15分)请设计CO2在高温下与木炭反应生成CO的实验.(1)在下面方框中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:(2)根据方框中的装置图,填写下表:(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中.改进后的优点是________________________________________________________________________ ________________________________________________________________________;(4)验证CO的方法是________________________________________________________________________ ________________________________________________________________________.解析:本题主要考查化学实验,意在考查考生实验设计和评价能力.(1)依据本题实验目的,需要设计实验CO2与木炭在高温条件下反应生成CO,题目已给出了CO2的制备装置,需要依次设计的是:CO2的除杂装置,CO2的干燥装置,CO2与木炭在高温条件下的反应装置,CO除杂装置.(2)CO2的除杂装置中可用NaHCO3溶液,CO2的干燥装置中可用浓硫酸,CO2与木炭在高温条件下的反应装置中要有木炭,CO除杂装置要吸收CO2,要用碱液.(3)题给装置不易控制气体生成的快慢且长颈漏斗容易漏气,用长颈漏斗和小试管就避免了这一问题.(4)要检验CO的存在,可将其点燃,再检验其产物中是否有CO2生成.答案:(1)(2)(3)可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封作用,防止反应激烈时气体经漏斗冲出(4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊30.(15分)有机化合物A~H的转换关系如下所示:请回答下列问题:(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是________,名称是________;(2)在特定催化剂作用下,A与等物质的量的H2反应生成E.由E转化为F的化学方程式是________________________________________________________________________ ________________________________________________________________________;(3)G 与金属钠反应能放出气体.由G 转化为H 的化学方程式是________________________________________________________________________ ________________________________________________________________________;(4)①的反应类型是________;③的反应类型是________;(5)链烃B 是A 的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B 所有可能的结构简式________________________________________________________________________ ________________________________________________________________________;(6)C 也是A 的一种同分异构体,他的一氯代物只有一种(不考虑立体异构),则C 的结构简式为________.解析:本题主要考查有机推断,意在考查考生的有机推理、同分异构体的书写和计算能力.(1)设烃A 的分子式为C x H y ,由燃烧通式计算可得:x +y /4=7,65<12x +y <75,故x =5,y =8.故其分子中含一个碳碳叁键,且含支链,碳碳叁键必在一端,烃A 为3-甲基-1-丁炔.(2)A 与等物质的量的H 2加成生成CH 2===CH —CH(CH 3)2,E 与Br 2发生加成反应生成F :CH 2BrCHBrCH(CH 3)2.(3)由F 水解生成G ,可推出G 为CH 2OHCHOHCH(CH 3)2,而G 与二元羧酸反应生成一种二元酯H.(4)反应①是加成反应,反应③是取代反应.(5)链烃B 分子中所有碳原子共平面,说明其必为二烯烃,且其催化加氢产物为正戊烷,故其可能的结构简式为:CH 2===CH —CH===CH —CH 3、CH 3CH 2C ≡CCH 3.答案:(1)(CH 3)2CHC ≡CH 3-甲基-1-丁炔(2)(CH 3)2CHCH===CH 2+Br 2――→CCl 4(CH 3)2CHCHCH 2BrBr(3)(CH 3)2CHCHCH 2OHOH +HOCCH 2CH 2OCOHO ――→H +△+2H 2O(4)加成反应(或还原反应) 取代反应 (5)CH 3CH===CHCH===CH 2(或写它的顺、反异构体)、CH 3CH 2C ≡CCH 3(6)。
2010年江苏省高三模拟试题(化学)Word版含答案

江苏省2010年度高三模拟考试化学试题可能用到的相对原子质量:H l C 12 N 14 0 16 Na 23 S 32 C1 35.5 Fe 56 Cu 64 Ag 108第1卷(选择题共42分)一、选择题(本题包括6小题,每小题3分,共18分。
每小题只有一个选项符合题意。
1化学与生活、生产密切相关。
F 列说法不止确的是A .低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放B 用稀取氧水清洗伤口可以杀菌消毒C “绿色化学”的核心是使原料尽可能全部转化为目标产物D .高纯度的硅单质广泛用于制作光导纤维2 . 下列有关化学用语或名称表达正确的是( )A.Mg 的原子结构示意图:B.乙酸分子的比例模型:C.22H 0的电子式:D. 的名称:2-乙基丙烷 3.某溶液中可能禽有Na +、Ca 2+、Br -、C032-、l -、S032-,六种离子中的几种。
①在该溶液中 滴加足量氯水后,有气泡产生、溶液呈橙黄色:②向呈橙黄色的溶液中加入BaCl 2溶液时无沉 淀生成;③橙黄色溶液不能使淀粉溶液变蓝。
根据上述实验事实推断,在该溶液中肯定都存 在的离子组是A Na +、Br -、C032- B Na +、S032-、l - C Ca 2+、l -、S032- D Ca 2+、C032- 、Br - 4研究发现,空气中少量的N02能参与硫酸型酸雨的形成,反应过程如下:①223SO +NO SO +NO → ②2224SO +H O H SO → ③222NO+O 2NO → 2NO 在上述过程中的作用,与24H SO 在下列变化中的作用相似的是A .加入少量24H SO 使淀粉水解B .碳酸钠与硫酸反应C .向铜和双氧水的混合物中加入硫酸D .潮湿的氯气通过盛有浓24H SO 的洗气瓶5.A 、B 、C 、D 、E 五种短周期元素,其原子序数逐渐增大。
元素A 的单质是密度最小的气体.元素B 的单质存在两种以上同素异形体,且其中一种是自然界中硬度最大的单质, 元素D 的最外层电子数是次外层电子数的二倍。
2010年全国高考理综卷(Ⅰ)化学试题命题特点及启示

重视考 生数据 处理 能力 的考核 , 为常态 , 成 每
年必 有 , 式多样 。 形
案例 3 1 .一定条 件 下磷 与 干燥 氯气反 应 , 2
若 0 2 磷 消 耗 掉 3 4 L 氯 气 ( 准 状 况 ) 则 . 5g 1m 标 ,
产 物 中 P 1与 P 1 C C 的物 质的量 之 比接 近 于 ( : A)
\
、
2 实验 考 评 核 估
s 、
21 0 0年 全 高 理 综 卷 (I) 学 试 题 国 考 化 命 题 特 点 及 、 白_ 口= = ;
口 李 俊 生 胡 志刚 李 敏。
1 .河北秦 皇 岛市第 一 中学 0 6 0 ;.福建 师范大 学化 学与材 料学 院 3 0 0 ; 600 2 5 0 7
4 依托 主 干知识 实验 事 实 , 考核分 析推 理 能力 根据 实验 事 实 以及 实验 现 象 , 用 推理 去 推 运 断物 质是 高考 化 学 试 题 所 采用 的 常见 方 法 , 对 但 推断 结果 或结 论 的进一 步深 化 考核则 是 今年 推 断
题 的又一 特点 。
060 60 0 3 .河北秦 皇 岛市新 世纪高 级 中学
21 0 0年全 国高 考理 综 卷 (I) 学试 题 的命 化 题 在延续 以往 高考命 题 的方 式外 又 出现 了一 些新
的特点 。
1 重 视 基 础 。 出主 干 知 识 的 综 合 考 察 突
r r
综观 2 1 0 0年 全 国高考 理 综 卷 (I) 每一 道 化 学 试题都 是 主干知 识 的 综合 考 察 , 点 是综 合 程 特
体 应用 , 试题 的综合 性强 。 2 密切 联 系社 会热 点 , 现新工作 原 理 等 知识 的渗 透 太 较 好地 考察 了考生 对这 些重 点 电化 学知识 的理 解 以及运 用情 况 , 题 具 有 适 当 的难 度 以及 较 好 的 试 区分度 , 一精 品试 题 。 是
江苏名校2010届高三化学试题汇编(氮及化合物1)全国通用

江苏 名校2010届高三化学试题汇编(氮及化合物1)安徽省萧县一中 李洪波1、[江苏省盐城市时杨中学2010届高三上学期期中考试]某稀硫酸和稀硝酸的混合溶液200 mL ,平均分成两份。
向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO 气体)。
向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
下列分析或结果错误..的是【AD 】A .原混合酸中NO 3-物质的量为0.2 mol B .OA 段产生的是NO ,AB 段的反应为Fe+2Fe 3+=3Fe 2+,BC 段产生氢气C .第二份溶液中最终溶质为FeSO 4D .H 2SO 4浓度为5 mol·L -12.【无锡市第一中学2009—2010学年度高三第一学期期中】某化肥厂生产硝酸铵过程如下:其中反应②为:4NO+3O 2+2H 2O===4HNO 3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
(1)写出反应①的化学方程式 。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中制备硝酸的氨气(不包含第③步被硝酸吸收的氨气)的体积分数最大值为 。
(3)若实际生产中,反应①中氨的转化率(或利用率)为a ,反应②中NO 的转化率为b ,反应③中氨的转化率为c ,硝酸完全转化。
则生产硝酸的氨气占所用氨气总量的体积分数为多少?在合成硝酸铵的全流程中,氨气的总利用率为多少?答案.(12分) (1)4NH 3+5O 2 ======= 4NO+6H 2O (3分)(2)0.091(3分)(3)1/(1+ab)(3分) 2abc/(1+ab)(3分)催化剂△3.【江苏省金陵中学河西分校2009-2010学年度第一学期期中考试】(12分)某课外小组利用以下装置探究氯气与氨气之间的反应。
其中A 、F 分别为氨气和氯气的发生装置,C 为纯净、干燥的氯气与氨气反应的装置。
请回答下列问题:(1)装置F 中发生反应的离子方程式 。
2010年高考理综化学试题及答案(全国卷I)

2010年高考(全国Ⅰ卷) 理科综合能力能力测试化学部分试题及答案本试卷分第I 卷(选择题)和第卷(非选择题)两部分,第I 卷1至4页,第Ⅱ卷5至12页。
考试结束后,将本试题卷和答题卡一并交回。
第I 卷相对原子质量(原子量): H1 C12 O 16 P31 Cl35。
5一、选择题(本题共13小题。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)6. 下列判断错误的是 ( )A .熔点:Si 3N 4>NaCl >SiI 4 B. 沸点:NH 3〉PH 3〉As 3C .酸性:HClO 4〉H 2SO 4〉H 3PO 4 D. 碱性: NaOH 〉Mg(OH )2>Al (OH )37. 下列叙述正确的是( )A . Li 在氧气中燃烧主要生成22Li OB . 将2CO 通入次氯酸钙溶液可生成次氯酸C . 将2SO 通入2BaCl 溶液可生成3Ba SO 沉淀D . 将3NH 通入热的4CuSO 溶液中能使2Cu +还原成Cu8. 能正确表示下列反应的离子方程式是( )A . 将铁粉加入稀释硫酸中:B . 将磁性氧化铁溶于盐酸:C . 将氯化亚铁溶液和稀硝酸混合:D . 将铜屑加入Fe 3+溶液中: 2 Fe 3++Cu=2 Fe 2+ Cu 2+9。
下列叙述正确的是( )A. 某醋酸溶液的PH = a ,将此溶液稀释1倍后,溶液的PH = b,则a>bB. 在滴有酚酞溶液的氨水中,加入NH 4Cl 的溶液恰好无色,则此时溶液的PH< 7C. 1。
0×10—3mol/L 盐酸的PH=3.0,1.0×10—8mol/L 盐酸PH =8。
0D 。
若1mL PH=1盐酸与100mL MaOH 溶液混合后,溶液PH=7,则NaOH 溶液的PH=1110。
右图是一种染料敏化太阳能电池的示意图。
电池的一个由有机光敏染料(S )涂覆TiO 2纳米晶体表面制成,另一电极由导电玻璃镀铂李自成,电池中发生的反应为:2TiO/S*+3I-→2TiO2/S + I3-2下列关于该电池叙述错误..的是()A。
