水溶液中六种氨基酸与两种酰胺的焓相互作用的研究
水溶液中乙酰胺与甲基吡啶异构体的焓相互作用

过 程 焓 变 以 及 各 自的 稀 释焓 , 用 Mc l n—M yr 论 利 Mia l ae 理
方程关联 得到各级焓 对作用 系数 ,获得 了溶质 一溶质和
溶 质 一溶 剂 相互 作 用 的重 要 信 息 。同 时 , 用 理 论 计 算 的 采
方法 , 分别研究了乙酰胺分子与甲基 吡啶 的三种异构体分
子 以 11比例 所 形 成 的 氢 键 络 合物 , 过 计 算 得 到 了各 自 : 通
实验数据依 Mc l n—Mae Mia l yr理论
进 行处 理 。
将实验 得 到 的酰 胺 溶 液 和 甲 醇 溶 液 的混 合 过 程 焓 变 A / H w 及计算得到了 △ / H w 值同时列 于表 1 。将表 1 数据进行 多元线性 回归分析 , 得到各级异系焓 作用 系数 及
物 空 间构 型 及键 角 、 长 的 分析 很 好 地 解 释 了热 效 应 的 不 同 。 键 关键词 : 胺 ; 酰 甲基 吡 啶 ; 对 作用 系数 ; 合 能 焓 结 中 图分 类号 :6 23 0 4 . 文 献 标 识 码 : A
蛋 白质是生命 活动 的物 质基础 ,它在细胞膜 的通透 性、 高等 生 物 的记 忆 活 动 等方 面 都 起着 十 分 重要 的作 用 ,所以对蛋 白质所含 基团 问相 互作用 的研究 十分重 要 。由于蛋 白质 自身结构 的复杂性 , 直接测量其热力学 性 质受 到了一定的限制 , 因此以氨基酸 、 、 肽 酰胺及其衍生 物作为 蛋 白质 模 型 分 子 的热 力 学 研 究 引 起 了广 泛 重
第 2 第 6期 9卷
水溶液中几种芳香族氨基酸_自堆叠作用

水溶液中几种芳香族氨基酸π-π自堆叠作用胡新根1,*朱玉青1余生1张贺娟1刘飞1于丽2(1温州大学化学与材料科学学院,浙江温州325027;2山东大学胶体与界面化学教育部重点实验室,济南250100)摘要:利用精密的流动混合微量热法测定了298.15K 时D/L -色氨酸、L -色氨酸、L -组氨酸和L -苯丙氨酸四种天然芳香族氨基酸水溶液的稀释焓,根据所建立的拟等步自堆叠作用的化学模型对实验数据进行了处理,计算得到模型参数K ΔH m .该化学作用参数与McMillan -Mayer 理论模型中的焓对作用系数具有高度一致性,即h xx =K ΔH m .结合文献报道的结果,认为芳核π-π自堆叠作用在本质上是一种特殊的疏水-疏水作用,一般表现为吸热效应;取代基空间位阻、芳核以外部分的静电、氢键和手性选择性作用等对芳核π-π自堆叠作用有显著影响;组合参数K ΔH m 实际上描述了芳核π-π自堆叠作用平衡及焓变的综合效应.关键词:芳香族氨基酸;π-π自堆叠;稀释焓;微量热法;化学作用模型中图分类号:O642Aromatic π-πSelf -Stacking of Some Aromatic Amino Acids inAqueous SolutionsHU Xin -Gen 1,*ZHU Yu -Qing 1YU Sheng 1ZHANG He -Juan 1LIU Fei 1YU Li 2(1College of Chemistry and Materials Engineering,Wenzhou University,Wenzhou 325027,Zhejiang Province,P.R.China ;2Key Laboratory for Colloid and Interface Chemistry of the Ministry of Education,Shandong University,Jinan 250100,P.R.China )Abstract :Dilution enthalpies of some aromatic amino acids such as D/L -α-tryptophan,L -α-tryptophan,L -α-tyrosine and L -α-phenylalanine in aqueous solutions at 298.15K were determined by sensitive mixing -flow microcalorimetry.A chemical interaction model for quasi -isodemic self -stacking was proposed and used to process the calorimetric data from which the model parameter K ΔH m was calculated.The chemical interaction parameter (K ΔH m )agrees well with and provides good insights into the pairwise enthalpic interaction coefficient (h xx )in the McMillan -Mayer approach for the existence of the equation K ΔH m =h xx .Combined with results from literature we considered that aromatic π-πself -stacking is essentially a kind of special hydrophobic interaction manifesting commonly as an endothermic effect.Noteworthy effects arising from substituent hindrance,electrostatic interaction,hydrogen bonding and chiral recognition which are directed away from the aromatic core exert on aromatic π-πself -stacking.In nature,the composite parameter K ΔH m describes a complex effect between the equilibrium and an enthalpic change of aromatic π-πself -stacking.Key Words :Aromatic amino acid;π-πself -stacking;Dilution enthalpy;Microcalorimetry;Chemicalinteraction model[Article]物理化学学报(Wuli Huaxue Xuebao )Acta Phys.-Chim.Sin .,2009,25(4):729-734Received:October 17,2008;Revised:January 9,2009;Published on Web:February 18,2009.*Corresponding author.Email:hxgwzu@.国家自然科学基金(20673077)、胶体与界面化学教育部重点实验室(山东大学)开放课题(200506)资助项目鬁Editorial office of Acta Physico -Chimica Sinica芳香族分子间的相互作用(π-π,OH-π,NH-π和阳离子-π)在化学和生物学的许多领域都非常重要,这些相互作用控制了芳香族分子的晶体结构、生物系统的稳定性以及分子识别过程[1-4].在蛋白质折叠过程中,氨基酸残基之间的相互作用是一个决定性的因素[5],对认识蛋白质的高级结构非常关键.在各种氨基酸残基中,极性基团间的氢键作用和芳香性残基间可能的π-π相互作用对决定蛋白质的April 729Acta Phys.-Chim.Sin.,2009Vol.25结构起着重要影响[6,7].Burley等[8]在对一组34个蛋白质的研究中发现,大约60%的芳香性侧链涉及了π-π相互作用,而80%的这种作用通过联系蛋白质二级结构的不同要素对稳定其三级结构有贡献.另外,π-π相互作用在与化学和生化过程相关的质子偶合电子转移反应(PCET)中也普遍存在[9].这类弱相互作用的大小和物理起源对理解各种分子聚集体的结构与性质是必需的,同时对发展材料和药物设计策略也相当重要的.在理论上进行模拟计算是研究芳香族分子上述弱相互作用的一种重要途径[5],而在实验上人们往往利用合适的分子模型系统进行研究[10,11].近年来,对生物体系中弱的非键相互作用的能量学(energetics)研究引起了人们的重视[12-17].作为研究工作的继续[18],本文建立了一种描述水溶液中芳香族分子拟等步的π-π自堆叠作用的化学模型,用于处理D/L-色氨酸、L-色氨酸、L-组氨酸和L-苯丙氨酸水溶液的稀释焓实验数据,并结合文献报道的结果,对芳核π-π自堆叠作用的焓效应及其影响因素作了讨论.1芳核π-π自堆叠作用的化学模型对于芳香族溶质M的π-π自堆叠作用,假设可视同如下化学反应[18]:M i-1+M=M i,i叟2(1)K i=b(M i)b(M i-1)b(M)=b(M i)(K2K3…K i-1)[b(M)]i,i叟2(2)式中b(M i)为物种M i的质量摩尔浓度.设反应的摩尔焓变为ΔH m,i,平衡常数为K i,并假定溶液的稀释过程热效应主要是缔合物种M i的解堆叠作用产生的,则对于一定物质的量n的溶质M在质量为m s 的溶剂中无限稀释的稀释焓(以每kg溶剂计)为Δdil H∞=nm sΔdil H∞m=-[b(M2)ΔH m,2+b(M3)(ΔH m,2+ΔH m,3)+…]=-{K2[b(M)]2ΔH m,2+K2K3[b(M)]3(ΔH m,2+ΔH m,3)+…}(3)式中,Δdil H∞m为每摩尔溶质无限稀释的稀释焓.溶液的总质量摩尔浓度b t为b t=n/m s=b(M)+2b(M2)+3b(M3)+…=b(M)+2K2[b(M)]2+3K2K3[b(M)]3+ (4)=b(M){1+2K2[b(M)]+3K2K3[b(M)]2+…}定义物种M i的配分函数(权重分数)为单体:α=b(M)b t=11+2K2[b(M)]+3K2K3[b(M)]2+…(5a) i聚体:αi=ib(M i)b t=i(K2K3…K i-1K i)[b(M)]i-11+2K2[b(M)]+3K2K3[b(M)]2+…,i叟2(5b)假定M分子的二聚作用是主要的,其平衡常数K2较大;但在二聚之后,每一步π-π自堆叠作用的模式和强度都相同,可看作是拟等步堆叠(quasi-isodemic packing),即假定每一步堆叠作用的平衡常数和摩尔反应焓变都相等:K=K2/β=K3=K4=…=K i,i叟3(6)ΔH m=ΔH2=ΔH3=…=ΔH i,i叟3(7)式中β表示二聚和三聚作用的强度比.则式(3)和(4)分别可变为Δdil H∞m=-βKΔH m[b(M)]2{1+2Kb(M)+3K2[b(M)]2+…}/b t(8)b t=b(M){1+2βKb(M)+3βK2[b(M)]2+…}(9)若以无限稀释溶液为参考态,则溶液的相对表观摩尔焓LΦ为LΦ=-Δdil H∞m=βKΔH m b(M)·(1+2Kb(M)+3K2[b(M)]2+…)/(1+2βKb(M)+3βK2[b(M)]2+…)(10)在稀溶液中,若Kb(M)垲1,βKb(M)垲1,则如下展开式成立:[1-Kb(M)]-2=1+2Kb(M)+3K2[b(M)]2+…(11a)β[1-Kb(M)]-2-β+1=1+2βKb(M)+3βK2[b(M)]2+…(11b)故由式(9)得b t=b(M){β[1-Kb(M)]-2-β+1}(12)由式(10)得LΦ=βKΔH m[b(M)]2b t[1-Kb(M)]2=KΔH m{1-βK[1-βKb(M)]2b t}2b t(13)式(13)展开后得到LΦ=KΔH m b t[1-2βKb t+5βK2b2t+…](14)对于稀溶液(b t垲1mol·kg-1)或较弱的自堆叠作用(K垲1kg·mol-1),式(13)中右边的高次项可以忽略.则对任意的稀释过程(b i→b f),其摩尔稀释焓为Δdil H m(b i→b f)=LΦ(b f)-LΦ(b i)=KΔH m(b f-b i)-2βK2ΔH m(b2f-b2i)+5βK3ΔH m(b3f-b3i)+ (15)由实验测得的摩尔稀释焓Δdil H m(b i→b f),根据式(15)进行多元线性回归分析,可以求得KΔH m的值.730No.4胡新根等:水溶液中几种芳香族氨基酸π-π自堆叠作用K ΔH m 称为对分子化学作用参数(pairwise molecular chemical interaction parameter).2实验部分2.1仪器与试剂采用LKB -2277BioActivity Monitor 精密微热量计的流动混合检测系统测量稀释焓.待测溶液和纯溶剂分别由两台微蠕动泵(LKB BROMMA 2132)输入热量计的混合池,在池中迅速混合、反应,然后流出,在流动过程中,反应的热功率被检测,经放大、显示、记录.仪器的温度控制精度为0.0005K,热功率测量精度优于0.2%,检测极限为2μW.实验所用D/L -色氨酸、L -色氨酸、L -组氨酸和L -苯丙氨酸均为Sigma 试剂,使用前用甲醇-水混合溶剂重结晶处理并真空干燥至少48h.L -酪氨酸因为在中性条件下在水中溶解度太小,稀释热很小,所以没有进行测定.溶液配制用水为二次重蒸水.2.2方法与步骤当热量计恒温系统及检测系统达到热平衡后,用溶剂水设定基线,进行电标定.然后,溶液和溶剂分别通过一对蠕动泵以一定体积流速比(v 1∶v 2)泵入热量计的混合池.当稀释过程产生的热功率(P )达到稳定值后记录P 值.质量流速f 1和f 2则以称重法进行标定,流速精度优于0.1%.总体积流速(v 1+v 2)对电标定值有较大影响,在不同总流速下测定时必须重新进行电标定.实验发现,总体积流速不变,改变进样流速比,热标定值基本不变.通过调整两台蠕动泵的体积流速比(v 1∶v 2)就可以方便地改变稀释比,而不必每次进行电标定.另外,总流速在40mL ·h -1以下时,测得KCl 水溶液的稀释焓与总体积流速呈线性关系,可以直线外推至零,说明在这一流速以下两种试液能充分混合稀释.实验中控制体积流速比(v 1∶v 2)为20∶10,15∶15,10∶20,总流速为30,单位为mL ·h -1.稀释焓的计算公式为Δdil H m =P /(c i f 2)(16)稀释后溶液的浓度为b f =b i f 2/[f 1(b i M 2+1)+f 2](17)式中,f 2和f 1为溶液和溶剂的质量流速(mg ·s -1),b i 和b f 为溶液稀释前和稀释后的质量摩尔浓度(mol ·kg -1),c i 为以每kg 溶液计的溶液的稀释前浓度(mol ·kg -1),M 2为溶质的摩尔质量(kg ·mol -1).每个浓度下的稀释热功率P 都平行测定三次,取其平均值根据式(16)计算摩尔稀释焓.b i and b f are the initial and final molalities of solutes.The values in parentheses are the experimental errors.表1298.15K 时D/L -色氨酸、L -色氨酸、L -组氨酸和L -苯丙氨酸水溶液的摩尔稀释焓Table 1Molar dilution enthalpies of aqueous solutions of D/L -α-tryptophan,L -α-tryptophan L -α-histidine andL -α-phenylalanine at 298.18Kb i (mol ·kg -1)b f(mol ·kg -1)Δdil H m,exp b i(mol·kg -1)b f D/L -α-tryptophan L -α-tryptophan0.05110.033422.97(0.19)0.02110.01380.05110.023236.18(0.32)0.02110.00960.05110.017343.85(0.39)0.02110.00720.04520.029420.24(0.13)0.01820.01190.04520.020431.87(0.28)0.01820.00830.04520.015238.63(0.24)0.01820.00620.04050.026218.05(0.11)0.01650.01080.04050.018228.43(0.22)0.01650.00750.04050.013634.46(0.27)0.01650.00560.03550.022915.78(0.09)0.01440.00940.03550.015924.85(0.21)0.01440.00650.03550.011930.12(0.25)0.01440.00490.02990.019513.46(0.07)0.01210.00790.02990.013621.20(0.18)0.01210.00550.02990.010125.69(0.13)0.01210.00410.02540.016411.28(0.05)0.01070.00720.02540.011417.76(0.07)0.01070.00490.02540.008521.52(0.12)0.01070.00360.02030.01319.06(0.04)0.00890.00580.02030.009114.26(0.09)0.00890.00430.02030.006817.29(0.11)0.00890.0034Δdil H m,exp(kJ ·mol -1)-21.09(0.13)-33.17(0.21)-40.21(0.32)-18.41(0.14)-28.68(0.17)-34.76(0.25)-16.72(0.08)-26.26(0.19)-31.31(0.24)-14.61(0.06)-22.69(0.16)-27.58(0.19)-12.31(0.11)-19.17(0.09)-23.11(0.14)-10.61(0.09)-16.86(0.08)-20.33(0.13)-8.95(0.07)-14.02(0.11)-17.31(0.13)b i(mol ·kg -1)L -α-histidine 0.13970.13970.13970.11130.11130.11130.09520.09520.09520.08010.08010.08010.06920.06920.06920.05210.05210.05210.04560.04560.0456b f(mol·kg -1)0.09450.06500.04750.07530.05180.03790.06440.04430.03240.05420.03730.02720.04680.03220.02350.03530.02420.01770.03090.02120.0155Δdil H m,exp(kJ ·mol -1)28.25(0.21)46.85(0.33)58.11(0.45)22.57(0.12)37.14(0.26)46.05(0.36)19.39(0.07)32.15(0.22)40.02(0.18)16.24(0.11)26.86(0.14)33.34(0.23)14.03(0.08)23.21(0.12)28.27(0.21)10.56(0.08)17.47(0.11)21.56(0.16)9.21(0.07)15.29(0.11)19.05(0.13)b i (mol ·kg -1)L -α-phenylalanine 0.15010.15010.15010.11130.11130.11130.07270.07270.07270.05210.05210.05210.04880.04880.04880.04520.04520.04520.04090.04090.0409b f (mol ·kg -1)0.10210.06610.04780.07550.04890.03530.04940.03250.02310.03520.02280.01650.03320.02150.01550.03040.01970.01420.02730.01770.0128Δdil H m,exp(kJ ·mol -1)-61.06(0.41)-104.50(0.82)-125.80(0.97)-43.28(0.34)-74.43(0.55)-89.86(0.49)-27.17(0.12)-46.98(0.21)-56.89(0.33)-18.87(0.12)-32.73(0.24)-39.77(0.18)-17.75(0.07)-30.81(0.26)-37.38(0.27)-16.21(0.06)-28.13(0.17)-34.13(0.15)-14.46(0.07)-25.12(0.09)-30.55(0.16)731Acta Phys.-Chim.Sin.,2009Vol.25 3结果与讨论D/L-色氨酸、L-色氨酸、L-组氨酸和L-苯丙氨酸在298.15K时不同质量摩尔浓度的摩尔稀释焓数据见表1.根据式(15)进行多元线性回归分析,求得KΔH m的值,见表2.根据McMillan-Mayer统计热力学理论[19],非电解质水溶液的稀释焓常用以下方程进行处理:Δdil H m=h xx(b f-b i)+h xxx(b2f-b2i)+ (18)对比方程(18)和(15),得到h xx=KΔH m,说明本文的化学作用参数KΔH m与McMillan-Mayer理论中的焓对作用系数h xx之间具有高度的一致性.表2中还列举了根据文献报道的一些芳香族非电解质在水中的稀释焓计算得到的KΔH m,部分直接引用了h xx的值.在McMillan-Mayer理论中,h xx被认为是溶剂介入的溶质-溶质相互作用(solvent-mediated solute-solute interaction)在焓效应上的一种度量:h xx=鄣(g xx/T)鄣(1/T)鄣鄣p=g xx+Ts xx=u xx+λRT g xx-RTM1-(E0Φ)21鄣鄣(19)式(19)中,u xx是超额内能的第二维里系数,λ是溶剂的热膨胀系数,E0Φ是溶质的标准偏摩尔膨胀率, M1和V01分别是溶剂的摩尔质量和体积.在理论上,焓对作用系数h xx和自由能对作用系数g xx可通过对两个溶剂化溶质分子的平均力势(potential of mean force,PMF)[19]积分求得;在混合溶剂中平均力势不仅与两个溶质分子的取向有关,而且还与所有水分子和共溶剂分子的取向有关.可见,h xx不仅反映了溶质-溶质直接作用,而且反映了无限稀释时由于溶质-溶剂、溶质-共溶剂、溶剂-共溶剂相互作用的重新分布引起的影响,因此h xx实际上是综合反映了溶质-溶质、溶质-溶剂各种相互作用的复杂效应.尽管McMillan-Mayer理论在很多情况下运用是成功的,但在h xx的理论解释和理论计算上还存在相当多的困难.根据本文提出的化学作用模型,由于h xx=KΔH m,因此h xx实际上既包含了对分子作用过程(pairwise molecular interaction,PMI)中的化学平衡因素(ΔG m=-RT ln K),又包含了热效应因素(ΔH m).因此借助化学作用模型可以更好地理解McMillan-Mayer理论中h xx的物理意义,尤其对于存在较强非键作用的分子体系,如疏水缔合、氢键缔合和π-π堆叠等.根据h xx=KΔH m,由于平衡常数K>0,因此h xx 值的符号由热效应ΔH m来决定.当ΔH m>0时,h xx> 0,例如在疏水-疏水作用或亲水-疏水作用占优势的情况下;当ΔH m<0时,h xx<0,例如在亲水-亲水作用占优势的情况下.另外值得注意的是,如果体系中存在其它较强的影响化学作用平衡(K)的复杂因表2298.15K时一些芳香族非电解质在水中的化学作用参数(KΔH m)Table2Chemical interaction parameters(KΔH m)of some aromatic nonelectrolytes in water at298.15K Aromatic compound h xx=KΔH m/(J·kg·mol-2)L or D/L-α-Tryptophan D-L:-1282(8)[this work]-1368(25)[24]L-L:2864(24)[this work]2900(170)[25]L-α-histidine-634(5)[this work]-631(7)[24]-620(10)[25]L-phenylalanine1074(10)[this work]1229(29)[24]1140(30)[25]L-phenylalanine(in acidic solution)2750(238)[12]L-tyrosine(in acidic solution)563(75)[12]D-p-hydroxyphenylglycine-726(8)[16]phenol816(8)[12]4-hydroxyphenylacetic acid-2032(134)[12] pyridine1192[14]o-methylpyridine(α-picoline)598[14]m-methylpyridine(β-picoline)2828[14]p-methylpyridine(γ-picoline)3577[14]The values in parentheses are the experimental errors.732No.4胡新根等:水溶液中几种芳香族氨基酸π-π自堆叠作用素,例如静电作用、氢键、取代基位阻、手性识别等,就会显著影响h xx的绝对值大小.芳核的π-π堆叠作用在本质上包含了van der Waals、疏水和静电作用[20].每一种成分的相对贡献和大小,以及芳核采取何种几何模式进行堆叠与芳核本身的结构与性质有关[10].由于包含了疏水成分,因此它是一种非常令人感兴趣的分子识别要素;同时如果其中的静电成分比较显著,这种作用还具有选择性.Hunter等[21]在这种相互作用的静电成分基础上提出了几种几何堆叠构型(图1),认为静电成分是芳核的四极矩引起的.比如苯环,虽然没有净的偶极,但有非偶的电荷分布,在其环面上电子密度较大,而在其周边上较小,从而产生四极矩.三种可能的堆叠几何构型分别是边-面型(edge-to-face)、偏置型(offset)和面-面型(face-to-face),环表面的覆盖程度依次增大.当一个或两个环面上的电子密度较低时,第二种模式就比较常见.第三种模式常见于供体-受体作用,以及具有相反四极矩的化合物,此时环面是相互吸引的.例如苯-六氟苯的相互作用,根据计算具有-15.5kJ·mol-1的稳定化能[22],其中静电成分有着不可忽视的贡献[23].本文认为,以芳环(包括芳杂环)为中心的π-π堆叠作用,虽然其成分比较复杂,但仍然可以看作是一种特殊的疏水-疏水作用,其内在的van der Waals 力和静电作用成分对疏水作用具有协同效应.因此芳核的π-π堆叠作用一般都表现为吸热效应(KΔH m>0),除非对分子作用过程的疏水协同性遭到严重的取代基空间阻碍,或者遭受芳核以外部分的静电、氢键等作用的破坏,或者由于芳核以外部分存在手性中心而受到手性选择作用的影响.如表2所示,纯水中L-苯丙氨酸的KΔH m值是一个较大的正值.其对分子作用过程,一方面因为分子具有较大的疏水区域(C6H5CH2—),所以疏水-疏水作用占绝对优势;而另一方面,由于氨基酸两性离子所带的正、负电荷头基之间静电作用的存在,因此也可以大大降低同手性分子间(L-L)疏水作用的协同性.与在中性溶液中相比,L-苯丙氨酸在酸性溶液中随着羧基的质子化,所带负电荷消失,对分子作用过程中疏水协同性反而增强,表现为较大的吸热效应,因此其KΔH m是一个更大的正值.同在酸性溶液中, L-酪氨酸因为比苯丙氨酸在芳环上多了一个—OH 官能团,与水分子之间可以形成氢键,使两性离子在对分子作用过程中的疏水协同性进一步降低,吸热效应更小,所以KΔH m值也较小.尤其有意思的是,D/L-色氨酸与L-色氨酸的KΔH m值出现了反号.在同手性情况下(L-L),KΔH m是一个很大的正值((2864±24)J·kg·mol-2);而在消旋情况下(D-L), KΔH m是一个较大的负值(-(1282±8)J·kg·mol-2).与其它氨基酸不同的是,色氨酸的芳香结构部分是由一个苯环和一个吲哚环连接而成的.苯环是疏水性的,吲哚环则具有一定的亲水性.吲哚环与两性离子头基扩展形成了一个较大的水结构破坏区域,结果使得同手性分子(L-L)在发生π-π堆叠作用时,可以采取更为合适的构型,疏水成分得到显著增强,因此表现出很大的吸热效应(KΔH m>0).而对于消旋体系(D-L),由于堆叠构型不合适(如采取edge-to-face的构型)疏水成分不强,分子的亲水部分在对分子作用过程中起决定作用,因此表现出较大的放热效应(KΔH m<0).L-组氨酸分子中带有一个咪唑环,与吲哚环类似具有亲水性,因此在发生π-π堆叠作用时疏水成分较少,而主要是与两性离子头基一起扩展而成的结构破坏区域在起决定作用,因此它的KΔH m是负值.表2中苯酚的KΔH m=816J·kg·mol-2,是一个较大正值,说明苯酚分子在水中具有较大的疏水能力,其对分子作用过程中疏水-疏水作用占优势,表现为吸热效应;与之相比,对羟基苯乙酸尽管在分子结构上增加了一个疏水性的—CH2—基,分子的(a)edge-to-face(b)offset(c)face-to-face图1芳核π-π堆叠作用的几何构型[21]Fig.1Geometric configurations of aromaticπ-πstacking [21]733Acta Phys.-Chim.Sin.,2009Vol.25疏水性得到增强,但因为同时又多了一个亲水性较强的—COOH官能团,尤其—COOH的存在造成对分子作用过程中分子疏水区域并排重叠(juxtaposition)的严重空间阻碍,反而使得亲水-亲水作用占据了绝对优势,因此KΔH m是一个很大的负值(KΔH m=(-2032±134)J·kg·mol-2).而具有手性中心的D-对羟苯基甘氨酸,在分子结构上比对羟基苯乙酸多了一个亲水性的—NH2基团,按理应该具有更负的KΔH m,但实际是KΔH m=(-726±8)J·kg·mol-2.说明芳核外部的手性中心在起识别作用,使得π-π堆叠时环表面覆盖度增大,疏水成分得到增强,削弱了对分子作用过程的亲水-亲水效应.对于表2中属芳杂环的吡啶及其甲基取代衍生物,Yu等[14]报道了它们的稀释焓,并从溶质-溶剂相互作用角度对甲基的位置异构取代产生的焓对作用作了初步探讨.如表2所示,这些化合物在水溶液中KΔH m值的递变如下:o-methylpyridine<pyridine<m-methylpyridine<p-methylpyridine,而且均为正值.说明在吡啶环上甲基的引入和甲基在环上的取代位置直接影响了π-π堆叠作用的几何构型,使得疏水成分发生不同程度的变化.邻位取代时吡啶环的疏水成分最小,对位取代时最大.UV 光谱等研究也表明[26,27],吡啶及其衍生物在水溶液中存在自缔合现象,吡啶环上取代基的种类、数目和取代位置,以及分子不同的质子解离形态对自缔合作用有重要影响;在大多数情况下光谱效应表现为减色效应(hypochromic effects),因此认为其自缔合模式是吡啶环的垂直π-π堆叠.在少数情况下,例如吡啶-2,6-二羧酸的单质子解离形态,则表现为增色效应(hyperchromic effects),其自缔合模式是吡啶环之间通过氢键的共线连接.4结论综上所述,微量热法是研究溶液中分子间非键相互作用的一种可靠方法,稀释焓可以用拟等步自堆叠作用的化学模型进行处理,模型参数KΔH m描述了对分子作用过程(PMI)中平衡和焓变的综合效应.所研究的四种芳香族氨基酸及其它芳香族化合物的π-π堆叠作用都可以看作是一种特殊的疏水-疏水作用,静电作用、取代基空间位阻、氢键和手性选择性作用等对疏水协同性都具有重要影响.References1Tsuzuki,S.Structure&bonding,intermolecular forces and clusters I.Berlin/Heidelberg:Springer,2005:115,149-1932Meyer,E.A.;Castellano,R.K.;Diederich,F.Angew.Chem.Int.Ed.,2003,42(11):12103Dougherty,D.A.J.Nutr.,2007,137(6):1504S4Xue,Y.;Davis,A.V.;Balakrishnan,G.;Stasser,J.P.;Staehlin,B.M.;Focia,P.;Spiro,T.G.;Penner-Hahn,J.E.;O′Halloran,T.V.Nature Chem.Biol.,2008,4(2):1075Chelli,R.;Gervasio,F.L.;Procacci,P.;Schettino,V.J.Am.Chem.Soc.,2002,124(21):61336McGaughey,G.B.;Gagné,M.;Rappé,A.K.J.Biol.Chem.,1998, 273(25):154587Hunter,C.A.;Singh,J.;Thornton,J.M.J.Mol.Biol.,1991,218(4):8378Burley,S.K.;Petsko,G.A.Science,1985,229(4708):239Dilabio,G.A.;Johnson,E.R.J.Am.Chem.Soc.,2007,129(19): 619910Waters,M.L.Current Opinion in Chemical Biology,2002,6(6):736 11Ishida,T.;Ueda,H.;Segawa,K.;Doi,M.;Inoue,M.Arch.Biochem.Biophys.,1990,78(1):21712Castronuovo,G.;Niccoli,M.Thermochim.Acta,2005,433(1-2):51 13Yu,L.;Yuan,S.L.;Hu,X.G.;Lin,R.S.Chem.Eng.Sci.,2006, 61(2):79414Yu,L.;Hu,X.G.;Lin,R.S.;Xu,G.Y.J.Therm.Anal.Calori., 2006,83(2):26915Yu,L.;Zhu,Y.;Hu,X.G.;Pang,X.H.J.Chem.Eng.Data,2006, 51(3):111016Liu,M.;Lin,R.S.;Sun,D.Z.J.Solution Chem.,2006,35(7):1007 17Yu,L.;Gen,F.;Hu,X.G.;Lin,R.S.;Li,Z.J.Therm.Anal.Calori.,2008,92(3):77118Hu,X.G.;Yu,L.;Lin,R.S.;Fang,Y.Y.;Li,W.B.Acta Phys.-Chim.Sin.,2006,22(8):1037[胡新根,于丽,林瑞森,方盈盈,李文兵.物理化学学报,2006,22(8):1037]19McMillan,Jr.W.G.;May,J.E.J.Chem.Phys.,1945,13(7):276 20Hunter,C.A.;Lawson,K.R.;Perkins,J.;Urch,C.J.J.Chem.Soc., Perkin Trans.2,2001,(5):65121Hunter,C.A.;Sanders,J.K.M.J.Am.Chem.Soc.,1990,112(14): 552522West,A.P.;Mecozzi,S.;Dougherty,.Chem., 1997,10(5):34723Cozzi,F.;Siegel,J.S.Pure Appl.Chem.,1995,67(5):68324Palecz,B.J.Am.Chem.Soc.,2002,124(21):600325Castronuovo,G.;Elia,V.;Velleca,F.J.Solution Chem.,1995,24(12):120926Peral,F.;Gallego,E.J.Mol.Struct.,1994,326:5927Peral,F.J.Mol.Struct.,1992,266:373734。
分子对接全

蛋白质二级结构的主要形式
• -螺旋 ( -helix ) • -折叠 ( -pleated sheet ) • -转角 ( -turn ) • 无规卷曲 ( random coil )
-螺旋
-折叠
-转角和无规卷曲
-转角
无规卷曲是用来阐述没有确定规律性的那部 分肽链结构。
❖ 定量指标,需要结合分子动力学进一步评价
AutoGrid 格点中相关能量的计算
AutoDock 构象搜索及评价
❖ 免费软件/
AutoDock分子对接的流程:
1.围绕受体活性位点的氨基酸残基形成一个盒 子(box),并划分成格点; 2.用配体不同类型的原子作为探针(probe)进 行扫描,计算格点能量; 3.对配体在box范围内进行构象搜索; 4.根据配体的不同构象、方向、位置及能量进 行评分,最后对结果进行排序。
蛋白质分子中各亚基的空间排布及亚基接 触部位的布局和相互作用,称为蛋白质的四级 结构。
亚基之间的结合力主要是疏水作用,其次 是氢键和 结 构
从一级结构到四级结构
血红蛋白
二、酶及其抑制剂
酶是由活细胞产生的对其特异的底物 起高效催化作用的蛋白质。
酶的分子组成
❖ 单纯酶(simple enzyme):仅由氨基酸残基构成 ❖ 结合酶(conjugated enzyme)
苏氨酸 threonine Thr T 5.60
3. 酸性氨基酸 4. 碱性氨基酸
天冬氨酸 aspartic acid Asp D 2.97 谷氨酸 glutamic acid Glu E 3.22
赖氨酸
lysine
Lys K 9.74
精氨酸 arginine Arg R 10.76
华中农业大学07--11年食品化学硕士研究生入学考试试题及答案

华中农业大学二O0七年食品化学硕士研究生入学考试816食品化学一、名词解释(共20分,每题2分)1、疏水相互作用:疏水基团尽可能聚集(缔合)在一起以减少它们与水分子的接触。
2、水分活度:指食品中水的蒸汽压与同温度下纯水的饱和蒸汽压的比值。
3、Maillard reaction:指羰基与氨基经缔合,聚合生成类黑色素的反应。
4、淀粉老化:淀粉溶液经缓慢冷却或淀粉凝胶经长期放置,会变为不透明甚至产生沉淀的现象,被称为淀粉的老化。
5、酸价:指中和1克油脂中游离脂肪酸所需的氢氧化钾的毫克数。
6、油脂的自动氧化:是活化的含烯底物(如油脂分子中所含的不饱和脂肪酸)与基态氧之间发生的自由基反应。
7、盐析作用:一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程。
如:加浓(NH4)2SO4使蛋白质凝聚的过程;在乙酸的酯化反应中加入饱和碳酸钠溶液,降低乙酸乙酯溶解度,使其分层现象更明显的过程。
8、Essential amino acid(并举一例):体内合成的量不能满足机体需要,必须从食物中摄取的氨基酸。
有赖氨酸、色氨酸、苯丙氨酸、蛋氨酸(甲硫氨酸)、苏氨酸、异亮氨酸、亮氨酸、缬氨酸。
9、肌红蛋白的氧合作用:肌红蛋白和分子氧之间形成共价键结合为氧合肌红蛋白的过程称为氧合作用。
10、气味的阈值:指能够感受到的该物质气味的最低浓度。
二、填空(共20分,每空1分)1、冷冻法保藏食品时利用了(低温)效应,而结冰对食品保藏有两种非常不利的后果,即(膨胀效应)和(浓缩效应)。
2、糖类化合物参与的褐变反应属于(非酶)褐变,包括有(美拉德反应)和(焦糖化作用)。
3、在高温下长时间加热的油炸油,酸价(升高),黏度(增加),发烟点(降低),碘值(降低)。
4、稳定蛋白质三级结构的键力有(氢键)、(离子键)、(疏水相互作用力)、二硫键和(范德华力)等。
5、亚硝酸盐用于腌肉制品中的作用有(抑菌)、(发色剂)和(增加制品的风味)。
6、面粉精制后白度(增加),(纤维物质)和(矿物质)减少。
食品化学复习题及答案

⾷品化学复习题及答案第2章⽔分习题⼀、填空题1 从⽔分⼦结构来看,⽔分⼦中氧的 6 个价电⼦参与杂化,形成 4 个SP3杂化轨道,有近似四⾯体的结构。
2 冰在转变成⽔时,净密度增⼤,当继续升温⾄3.98时密度可达到最⼤_,继续升温密度逐渐减⼩。
3 液体纯⽔的结构并不是单纯的由氢键构成的四⾯体形状,通过H-桥的作⽤,形成短暂存在的多变形结构。
4 每个⽔分⼦最多能够和四个⽔分⼦通过氢键结合,每个⽔分⼦在三维空间有相同的氢键给体和氢键受体。
因此⽔分⼦间的吸引⼒⽐NH3和HF要⼤得多5 在⽣物⼤分⼦的两个部位或两个⼤分⼦之间,由于存在可产⽣氢键作⽤的基团,⽣物⼤分⼦之间可形成由⼏个⽔分⼦所构成的⽔桥。
6 当蛋⽩质的⾮极性基团暴露在⽔中时,会促使疏⽔基团缔合或发⽣疏⽔相互作⽤,引起蛋⽩质折叠;若降低温度,会使疏⽔相互作⽤减弱,⽽氢键增强__。
7 ⾷品体系中的双亲分⼦主要有脂肪酸盐、蛋⽩脂质、糖脂、极性脂类、核酸等,其特征是同⼀分⼦中同时存在亲⽔和疏⽔基团。
当⽔与双亲分⼦亲⽔部位羧基、羟基、磷酸基、羰基、含氮基团等基团缔合后,会导致双亲分⼦的表观增溶。
8 ⼀般来说,⾷品中的⽔分可分为结合⽔和体相⽔两⼤类。
其中,前者可根据被结合的牢固程度细分为化合⽔、邻近⽔、多层⽔,后者可根据其⾷品中的物理作⽤⽅式细分为滞化⽔、⽑细管⽔9 ⾷品中通常所说的⽔分含量,⼀般是指常压下,100~105℃条件下恒重后受试⾷品的减少量10 ⽔在⾷品中的存在状态主要取决于天然⾷品组织、加⼯⾷品中的化学成分、化学成分的物理状态。
⽔与不同类型溶质之间的相互作⽤主要表现在离⼦和离⼦基团的相互作⽤、与⾮极性物质的相互作⽤、与双亲分⼦的相互作⽤、与中性基团的相互作⽤等⽅⾯。
11 ⼀般来说,⼤多数⾷品的等温线呈S 形,⽽⽔果等⾷品的等温线为J 形。
12 吸着等温线的制作⽅法主要有_解吸等温线和回吸等温线两种。
对于同⼀样品⽽⾔,等温线的形状和位置主要与试样的组成、物理结构、预处理、温度、制作⽅法等因素有关。
蛋白质水合能力的测定

蛋白质水合能力的测定1. 简介蛋白质是生物体内重要的功能性分子,具有广泛的功能和结构多样性。
水合能力是指蛋白质分子与水分子间的相互作用能力,其在蛋白质的稳定性、溶解性以及功能性中起着重要作用。
测定蛋白质的水合能力有助于了解其在生物体内的功能和结构特性。
2. 蛋白质水合能力的影响因素蛋白质的水合能力受多种因素影响:2.1 氨基酸组成氨基酸的性质直接影响蛋白质的水合能力。
极性氨基酸具有较强的水合能力,而疏水氨基酸则较弱。
蛋白质中不同种类、顺序和数量的氨基酸会对其水合能力产生重要影响。
2.2 空间构象蛋白质的空间构象决定了其分子表面和内部的水合数。
蛋白质分子的表面积越大,可以与水分子接触的区域就越多,从而增加其水合能力。
此外,空间构象还影响到蛋白质的孔道结构和水分子在其中的分布。
2.3 温度和pH值温度和pH值可以改变蛋白质的水合状态。
通常情况下,提高温度和酸性环境会降低蛋白质的水合能力,而碱性环境则会增加其水合性质。
但需要注意的是,不同蛋白质对温度和pH值的响应可能存在差异。
2.4 盐浓度盐浓度对蛋白质的水合能力有显著影响。
低盐浓度会增加蛋白质的水合性质,而高盐浓度则会削弱其水合能力。
这是因为盐离子在水溶液中会与蛋白质和水分子相互作用,改变它们之间的水合状态。
3. 测定方法测定蛋白质的水合能力需要考虑到蛋白质与水分子间的相互作用以及水分子在蛋白质分子中的分布。
以下列举几种常用的测定方法:3.1 拉曼光谱法拉曼光谱法通过测量蛋白质与水分子之间的振动模式来评估其水合能力。
不同振动模式对应着不同的化学键,可以得到蛋白质分子中水分子的分布情况。
3.2 核磁共振法核磁共振法可以观察蛋白质分子内部的水分子分布以及与蛋白质分子间的相互作用。
通过对氢原子的共振信号进行分析,得到蛋白质的水合能力信息。
3.3 表面电位法表面电位法通过测量蛋白质分子的表面电位来评估其水合态。
水合程度高的蛋白质通常带有较为负性的表面电位。
蛋白质变性机理与变性时的热力学参数研究进展

第 17 卷 第 5 期 2005 年 9 月
化 学 进 展
PROGRESS IN CHEMISTRY
Vol . 17 No. 5 Sep . , 2005
蛋白质变性机理与变性时的热力学参数研究进展 3
卢 雁 3 3 李向荣
(河南师范大学化学与环境科学学院 新乡 453007)
摘 要 生物大分子是近年来生命科学的研究热点和难点之一 ,而对蛋白质变性的研究有助于深刻揭 示生命现象的机理 。利用光谱学和热力学可以分别从微观和宏观角度对蛋白质变性进行研究 ,并由此得到 表征蛋白质变性的热力学参数 。这对深入了解蛋白质的折叠与伸展 、变性机理 、结构稳定性及生命体的新陈 代谢等问题具有很大意义 。近年来 ,国内外学者在此方面做了大量的工作 ,主要涉及蛋白质在水溶液中的变 性机理 、在有变性剂存在下水溶液中的变性机理及在含有其它物质水溶液中的变性机理 。用来表征蛋白质 变性的热力学参数有热容 、变性自由能 、变性焓和变性熵等 。本文对这些研究进行了概述 。
2002 年 , Salvetti 等[12] 在 pH = 215 , T = 293 — 368K 的 条 件 下 , 用 温 度 调 节 扫 描 量 热 TMSC (temperature modulated scanning calorimetry) 的方法测 定了溶菌酶变性时的吸热效应和反应平衡 。这种技 术可以单独测定热的可逆焓变 ,同时伴随热的不可 逆焓变 。结果发现溶菌酶的热变性过程为 :天然态 Ω 伸 展 中 间 态 →变 性 态 ( native state Ω unfolded (intermediate) state →denatured state) 。这个结论符合 一般的观点 :认为像溶菌酶这样小的一域球蛋白 ,变 性的第一步应为可逆伸展过渡态 ,第二步则为不可 逆变性 。
食品化学总结_2
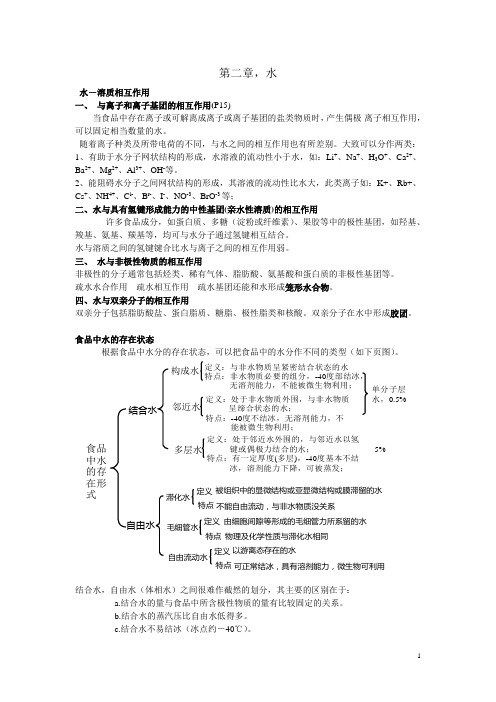
第二章,水水-溶质相互作用一、 与离子和离子基团的相互作用(P15)当食品中存在离子或可解离成离子或离子基团的盐类物质时,产生偶极-离子相互作用,可以固定相当数量的水。
随着离子种类及所带电荷的不同,与水之间的相互作用也有所差别。
大致可以分作两类:1、有助于水分子网状结构的形成,水溶液的流动性小于水,如:Li +、Na +、H 3O +、Ca 2+、Ba 2+、Mg 2+、Al 3+、OH -等。
2、能阻碍水分子之间网状结构的形成,其溶液的流动性比水大,此类离子如:K+、Rb+、Cs +、NH 4+、C l-、B r-、I -、NO -3、BrO -3等;二、水与具有氢键形成能力的中性基团(亲水性溶质)的相互作用许多食品成分,如蛋白质、多糖(淀粉或纤维素)、果胶等中的极性基团,如羟基、羧基、氨基、羰基等,均可与水分子通过氢键相互结合。
水与溶质之间的氢键键合比水与离子之间的相互作用弱。
三、 水与非极性物质的相互作用非极性的分子通常包括烃类、稀有气体、脂肪酸、氨基酸和蛋白质的非极性基团等。
疏水水合作用 疏水相互作用 疏水基团还能和水形成笼形水合物。
四、水与双亲分子的相互作用双亲分子包括脂肪酸盐、蛋白脂质、糖脂、极性脂类和核酸。
双亲分子在水中形成胶团。
食品中水的存在状态根据食品中水分的存在状态,可以把食品中的水分作不同的类型(如下页图)。
结合水,自由水(体相水)之间很难作截然的划分,其主要的区别在于:a.结合水的量与食品中所含极性物质的量有比较固定的关系。
b.结合水的蒸汽压比自由水低得多。
c.结合水不易结冰(冰点约-40℃)。
食品中水的存在形式构成水定义:与非水物质呈紧密结合状态的水特点:非水物质必要的组分,-40度部结冰,无溶剂能力,不能被微生物利用;邻近水定义:处于非水物质外围,与非水物质呈缔合状态的水;特点:-40度不结冰,无溶剂能力,不能被微生物利用;多层水定义:处于邻近水外围的,与邻近水以氢 键或偶极力结合的水;特点:有一定厚度(多层),-40度基本不结 冰,溶剂能力下降,可被蒸发;单分子层水,0.5%5%结合水自由水被组织中的显微结构或亚显微结构或膜滞留的水滞化水不能自由流动,与非水物质没关系毛细管水由细胞间隙等形成的毛细管力所系留的水物理及化学性质与滞化水相同自由流动水以游离态存在的水可正常结冰,具有溶剂能力,微生物可利用定义特点定义特点定义特点d.结合水不能作为溶质的溶剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
文章编号:1673-2103(2006)02-0059-04水溶液中六种氨基酸与两种酰胺的焓相互作用的研究杨 艳,赵 燕,孙海涛,张洪琳Ξ(曲阜师范大学化学科学学院,山东曲阜273165) 摘 要:用2277热活性检测仪测定了310.15K下,甘氨酸、L-丙氨酸、L-缬氨酸、L-丝氨酸、L-苏氨酸和L-脯氨酸6种α-氨基酸分别与N-甲基乙酰胺、N,N-二甲基乙酰胺分子在水溶液中的混合过程的焓变,根据McMillan2Mayer理论得到了各级焓对作用系数,并比较了各级焓对作用系数.结果表明,氨基酸与N,N-二甲基乙酰胺的焓对作用系数大于与N-甲基乙酰胺的焓对作用系数.由于N,N-二甲基乙酰胺中—CH3基团的增加,对丝氨酸的焓对作用系数改变较大.用溶质-溶质相互作用和溶质-溶剂相互作用理论对结果进行了解释.关键词:α-氨基酸;N-甲基乙酰胺;N,N-二甲基乙酰胺;异系焓作用中图分类号:O642.1 文献标识码:A 氨基酸是组成蛋白质的基本结构单位,被认为是蛋白质研究的模型化合物.研究氨基酸在水溶液中热力学性质有助于了解复杂生物体系中的各种相互作用.天然环境中存在的众多有机物,对蛋白质的溶解度、变性行为、解缔成次一级结构和酶的活性等都有很大影响[1].近年来以氨基酸、肽、酰胺及其衍生物作为蛋白质模型分子的热力学研究引起了广泛重视[2,3].大多数蛋白质的天然环境并不是单纯的水溶液,而是含有许多有机物质的复杂环境.酰胺类物质是一种重要的生物功能分子,它有类似肽结构和—CH3的存在,可以作为提供球蛋白内部氨基酸残基模型所处的模型环境,水可以从外部渗入到球形蛋白质内部,构成混合溶剂环境[4],研究酰胺分子与氨基酸分子相互作用具有很重要的意义.前人的报道中有α-丁氨酸与酰胺的焓相互作用的研究[5].本文选择N-甲基乙酰胺及N,N-二甲基乙酰胺作为研究对象,利用2277热活性检测仪的流动混合测量系统,分别测定N-甲基乙酰胺及N,N-二甲基乙酰胺在水溶液中与6种典型的不带侧基的α-氨基酸(甘氨酸、L-丙氨酸、L-缬氨酸、L-丝氨酸、L-苏氨酸和L-脯氨酸)的混合过程焓变及这些溶质在水溶液中稀释焓.利用McMillan2Mayer理论方程关联得到各级异系焓作用系数,重点讨论了氨基酸的不同侧基对异系焓对作用系数的贡献,并比较了N-甲基乙酰胺、N,N-二甲基乙酰胺与各氨基酸焓对作用系数变化规律.1 实验部分1.1 仪器与试剂混和过程焓变和稀释焓用2277活性检测仪(瑞典产)的流动混和测量系统测定.并配以一对2132精密蠕动泵匀速输液.溶液配制使用H ANG PI NG FA1604型天平,误差为±0.1mg.测量计的电标定精度(300μW量程)为±0.1%,测量精度±0.2%;蠕动泵流泵流速精度优于0.1%.实验温度为310.15K,恒温控制精度为±0.0002K.甘氨酸、L-丙氨酸、L-缬氨酸、L-丝氨酸、L -苏氨酸和L—脯氨酸均为生化试剂(上海华美生物工程公司),干燥后置真空硅胶干燥箱内48h后使用.分析纯N-甲基乙酰胺及N,N-二甲基乙酰胺(天津市科密欧化学试剂开发中心).水为新制备的二次蒸馏水.不同质量摩尔浓度的溶液用称量法配制,在12h内使用.1.2 实验步骤当量热计恒温水浴和检测系统达到热平衡后,用溶剂水设定基线并进行电标定.氨基酸水溶液和酰胺水溶液分别由同一台2132蠕动泵的A和B两95第28卷第2期V ol.28 N o.2 菏泽学院学报Journal of Heze University2006年4月Oct. 2006Ξ收稿日期:2005-05-13作者简介:杨艳(1980-),女,湖北荆门人,硕士研究生,研究方向:溶液热力学.轮(流速比f1∶f2为15∶15)匀速输入热量计的混合池,待系统达到热平衡后,记录热功率数值,重复测定3次取平均值.由于流动混合测量系统的出样管与进样管串连,检测信号实际是两者的热信号之差,因此使液体流动过程中与管壁摩擦产生的热效应相互抵消.以每kg溶剂水计的溶质(x和y)的稀释焓ΔHdil(J.kg-1)可直接按下式计算:ΔHdil=p f A+f B-m x,i c x f A式中P为溶质的稀释热功率,m x,i为稀释前溶液的质量摩尔浓度,f A为溶液的流速,f B为溶剂水的流速,c x为溶质的量浓度.稀释后溶液的质量摩尔浓度m x为:m x=m x,i f A f B(m x,i c x+1)+f Ax溶质的溶液和y溶质溶液的混合过程焓变ΔH mix (J・kg-1)按下式计算:ΔHmix=p3f A+f B-m x,i c x f A-m y,i c y f B式中p3为混合过程热功率,f A,f B分别为溶质x和溶质y的流速,m x,i,m y,i分别为这两种溶液混合前的质量摩尔浓度.由于实验热功率测定的相对误差小于±0.2%,蠕动泵流速精度为0.2%,因此最终得到的混合过程焓变和稀释焓的误差小于±1%[6].2 结果与讨论2.1 数据处理与结果实验数据依McMillan2Mayer理论[7]进行处理.由于三分子以上的相互作用十分复杂,这里仅讨论两分子作用.对含有两种不同溶质x和y的水溶液,可用过量焓[8,9]理论对氨基酸与酰胺分子的异系相互作用进行研究.实验得到了氨基酸(x)溶液和酰胺(y)溶液在的混合过程焓变ΔH mix/w1,经过计算得到了ΔH3/w1值.将氨基酸与酰胺的焓变和各浓度的质量摩尔浓度用多元线性回归分析,得到各级异系焓作用系数,分别列于表1、表2,各相关系数R2均在0.99以上.结果表明,在水溶液中6种氨基酸与N,N-二甲基乙酰胺的相互作用均为吸热过程,焓对作用系数(h xx)表现为正值(h xx>0).而6种氨基酸与N-甲基乙酰胺,除带极性侧链—CH2OH的丝氨酸与之的相互作用为放热过程(h xx<0),其它5种氨基酸与N-甲基乙酰胺的相互作用作用均为吸热过程(h xx>0).将表1中焓对作用系数(h xy)和表2中的焓对作用系数(h xy)一并列于图1(单位:J・kg・m ol-2).表1 氨基酸与N-甲基乙酰胺的各级焓作用系数(310.15K)溶质x+y h xy h xxy h xyy R2甘氨酸+N-甲基乙酰胺L-丙氨酸+N-甲基乙酰胺L-缬氨酸+N-甲基乙酰胺L-丝氨酸+N-甲基乙酰胺L-苏氨酸+N-甲基乙酰胺L-脯氨酸+N-甲基乙酰胺462.04597.94668.38-913.70506.89223.65154.01199.31222.79-304.56168.9674.55-294.414407.2116071337.101121.40239.130.997520.997350.997720.989010.997460.99695 注:系数单位分别为h xy:(J・kg・m ol-2);h xxy:(J・kg2・m ol-3);h xyy:(J・kg2・m ol-3).表2 氨基酸与N,N-二甲基乙酰胺的各级焓作用系数(310.15K)溶质x+y h xy h xxy h xyy R2甘氨酸+N,N-二甲基乙酰胺L-丙氨酸+N,N-二甲基乙酰胺L-缬氨酸+N,N-二甲基乙酰胺L-丝氨酸+N,N-二甲基乙酰胺L-苏氨酸+N,N-二甲基乙酰胺L-脯氨酸+N,N-二甲基乙酰胺506.11622.94921.362651.4669.87329.15168.71207.65307.12883.79223.30109.72-558.30513.79-1326-5519‘565.10459.920.997660.997960.998960.990680.999410.99828图1 氨基酸分别与N-甲基乙酰胺和N.N-二甲基乙酰胺的焓对作用系数关系2.2 讨论焓对作用系数h xy是溶液中两个溶质分子x和y 靠近时相互作用热效应的量度.这个过程伴随着溶质分子溶剂化共球的交盖,部分的溶剂结构重组,溶质-溶剂相互作用的变化及溶质-溶质之间的直接相互作用[10].在氨基酸-酰胺-水三元体系中,氨基酸与N -甲基乙酰胺、N,N-二甲基乙酰胺的焓对作用系数h xy的大小主要决定于这两种溶质分子间的直接相互作用,不同氨基酸分子与N-甲基乙酰胺和N, N-二甲基乙酰胺的相互作用主要包括:(1)氨基酸与酰胺分子的离子-耦极相互作用,它对h xy具有负贡献;(2)氨基酸分子中的—OH基团与酰胺分子中非极性基团—CH3的亲水-疏水相互作用,它对h xy 也具有负贡献;(3)氨基酸α-碳上的非极性侧基与062006年 菏泽学院学报 第2期酰胺分子上的非极性基团间的疏水-疏水相互作用,它们对h xy具有正贡献;(4)氨基酸两性部分与酰胺分子中非极性基团的疏水-离子作用,它对h xy具有正贡献.两分子间的h xy值的相对大小主要决定于上述作用的竞争平衡.从图1可以看出:氨基酸与N-甲基乙酰胺分子的h xy的变化为:h xy(L-丝氨酸)<h xy(L-脯氨酸)<h xy(甘氨酸)<h xy(L-苏氨酸)<h xy(L-丙氨酸)<h xy(L-缬氨酸).氨基酸与N,N-二甲基乙酰胺分子的h xy变化为:h xy(L-脯氨酸)<h xy(甘氨酸)<h xy(L-丙氨酸)<h xy(L-苏氨酸)<h xy(L-缬氨酸)<h xy(L-丝氨酸).焓对作用系数h xy的大小主要取决于氨基酸侧链的差异,h xy值随疏水烷基侧链的增长而增大,丙氨酸和缬氨酸比甘氨酸分别多一个甲基和异丙基,因此各焓对作用系数表现为增大趋势.所以对两种酰胺分子而言,h xy(甘氨酸)<h xy(L-丙氨酸)<h xy (L-缬氨酸).且因为在N-甲基乙酰胺和N,N-二甲基乙酰胺分子中所带的疏水基团较多,与甘氨酸、丙氨酸、缬氨酸在水溶液中占主导作用的表现为(3)和(4),故这两种酰胺与这三种氨基酸的焓对作用系数h xy表现为正值.丝氨酸因为α-碳上有一个亲水基团—OH,作用(2)增强,对h xy的负贡献增加.丝氨酸与N-甲基乙酰胺的h xy表现为负值:-913.67J・kg・m ol-2.丝氨酸在与N,N-二甲基乙酰胺的作用中,虽然(2)的作用增强,但由于N,N-二甲基乙酰胺的非极性基团增加,(3)和(4)作用较大,h xy表现为正值,且在与N,N-二甲基乙酰胺的相互作用中表现为最大,为: 883.79J・kg・m ol-2.邵爽等研究的丝氨酸与甲脲、二甲脲的焓相互作用也是如此[7].对于苏氨酸,因侧链同时含有亲水性的—OH基和疏水性的—CH3基, (2)和(3)同时存在,h xy值取决于这两种作用的竞争.实验结果表明(3)占主导作用.脯氨酸因具有独特的五元吡咯环结构,在确定焓对性质方面有特殊的重要性[11].实验得到脯氨酸与N-甲基乙酰胺和N,N-二甲基乙酰胺的h xy均为正值.说明吡咯环具有相当的疏水性.这与前人所得结论一致[7].比较同一种氨基酸分别与N-甲基乙酰胺和N,N-二甲基乙酰胺的h xy值,可以发现,同一种氨基酸分子与N-甲基乙酰胺分子的h xy值均小于它与N,N-二甲基乙酰胺分子的h xy值,这是由于N,N -二甲基乙酰胺分子比N-甲基乙酰胺分子多一个疏水性的—CH3,它与氨基酸分子间的疏水-疏水作用比N-甲基乙酰胺分子要大一些.3 结论 用流动量热法得到了甘氨酸、L-丙氨酸、L-缬氨酸、L-丝氨酸、L-苏氨酸和L-脯氨酸六种α-氨基酸分别与N-甲基乙酰胺、N,N-二甲基乙酰胺分子间的各级异系焓作用系数.结果表明,氨基酸的两性离子部分和极性的羟基对异系焓作用系数h xy均有负贡献,而其侧基α-碳上的非极性脂肪侧基和五元吡咯环结构对h xy有正贡献;比较各氨基酸分子与N-甲基乙酰胺、N,N-二甲基乙酰胺分子相互作用的h xy,发现N,N-二甲基乙酰胺分子由于引进了一个非极性基团—CH3,增强了分子的疏水性.其焓对作用系数表现为N,N-二甲基乙酰胺分子的h xy均大于N-甲基乙酰胺分子的h xy.参考文献:[1] K ent H E,Lilley T H,M ilburn P J.Lnteractions between ter2minally substituted amino acids in an aqueous and anon-aqueous environment[J].S olution Chem,1985,14:101-104.[2] Bartlomiej palecz,Henryk Piekarski.S tudies of hom ogeneousinteractions between zwitterions of several L-α-amino acidsin water at a tem perature of298.15K[J].Journal of m olecularliquids,2000,84(3):279-288.[3] 任小玲,倪亚明,林瑞森,等.甘氨酸在DMF/水和乙醇/水混合溶剂中的焓对相互作用[J].化学学报,1999,5:36-38.[4] S ijpkes A H,S tan eke P O,Sams on G.Enthalpies of interac2tion of s ome N-acetyl amides of L-serine,L-threonineand L-hydroxyproline diss olved in N,N-dimenthylformamide at298.15K[J].Therm o him Acta,1990,167:65-72.[5] 卢雁,张春富,卢锦梭.α-丁氨酸与酰胺在水溶液中的焓相互作用研究[J].河南师范大学学报,2001,29(2):28.[6] 曹来润,张洪林,孙海涛,等.热活性检测器性能测试及细菌热谱图的测定[J].曲阜师范大学学报(自然科学版),1994,20(1):71-76.[7] 邵爽,林瑞森,胡新跟,等.水溶液中氨基酸与二甲脲的焓相互作用[J].浙江大学学报,2001,28(3):271-275.[8] Frig on R P,Lee J C.S tabilization of calf-brain microtubuleprotein by surcrose[J].Arch Biochem Biophy,1972,153:578-581.[9] LiY u,Rui-Sen Lin,X in-G en Hu,et al.Enthalpic Interac2tion of Amino Acids with E thanol in Aqueous S olutions at25162006年 杨艳,等:水溶液中六种氨基酸与两种酰胺的焓相互作用的研究 第2期℃[J].Journal of S olution Chemistry,2003,32(3):273-281.[10] Piekarski H,Waliszewsk D.Hydration effect on urea2non2electrolyte enthalpic pair interaction coefficients.Diss olutionenthalpies of urea in aqueous s olution of alkoxyethanols at298.15K[J].Therm ochimica Acta,1995,258:67-70. [11] 邵爽,胡新根,林瑞森.水溶液中八种氨基酸与尿素的焓相互作用[J].化学学报,2000,58:1240-1246.The Study of the E nthalpic I nteractions betw een Six kinds of Amino Acid and Tw o Acid Amides in Aqueous Solutions at310.15KY ANG Y an,ZHAO Y an,SUN Hai2tao,ZHANG H ong2lin(C ollege of Chemical Science,Qu fu N ormal University,Qu fu Shangdong273165,China)Abstract:The enthalpies of mixing of tw o acid amides and six kinds of aqueous amino acid s olutions(glycine,L2alanine, L2serine,L2valine,L2proline and L2threonine)in aqueous s olutions have been determined at310.15K by2277flow mi2 cro calorimetric system.The data have been analyzed in terms of the McMillan2Mayer theory to obtain the enthalpic pair interaction coefficient(hxy)and com pared with the enthalpic pair interaction coefficients of tw o acid amide with six amino acids.The results show that because of the m ore CH3in N,N2dimethyl acetamide,which makes its difference from the Enthalpic of N2methyl with amino acids.The results are discussed in terms of s olute2s olute and s olute2s olvent interactions theory.K ey w ords:aminoacids;N2methyl acetamide;N,N2dimethyl acetamide;enthalpic interaction coefficient(上接第11页)(x2-x)f(x1)+(x1-x2)f(x)+(x-x1)f(x2)≤0,令 x=x1+x22,则x2-x=x2-x12=x-x1,从而有x2-x12f(x1)+(x1-x2)fx1+x22+x2-x12f(x2)≤0.若x1=x2,则(1)式中等号成立;若x1≠x2,则有f x1+x22≥f(x1)+f(x2)2.参考文献:[1] ΦихтенгольпΓМ.微积分学教程[M].第2版.北京:人民教育出版社,1959.292.[2] 同济大学数学教研室.高等数学[M].第4版.北京:高等教育出版社,1996.97.[3] 汪林.数学分析中的问题和反例[M].昆明:云南科技出版社,1990.76.Tw o Su fficient and N ecessary Conditions of the Convex FunctionLIU H ong2ji,X UE Ming2zhi(Dept.of C om put.Sci.,Shangqiu T eachers C ollege,Shangqiu Henan476000,China)Abstract:In this paper,the difinition of convex function is first extended,then gives tw o sufficient and necessary condi2 tions for convex function,similarly als o may used to the definition of convex function.K ey w ords:convex function;equivalence;su fficient and necessary condition262006年 菏泽学院学报 第2期。
