第3章 自由基聚合-2
合集下载
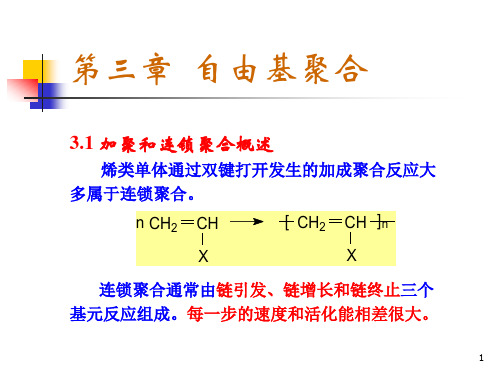
第三章自由基聚合

低,位阻效应大,一般不能自聚合。但有时能与其他单 体共聚,如马来酸酐能与苯乙烯共聚。
HC CH
Cl
O O O
C H
C H
Cl
(3) 三取代、四取代,一般不能聚合,但也有例外:取 代基为小体积的氟代乙烯 。
F F C H C H F F C H C F F F H2C C F F C C F
F
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更 易聚合,若两个取代基均体积较大(如1,1-2苯基乙烯), 则只能形成二聚体。
(2) 具有共轭效应的烯类单体 ∏电子云流动性大,易诱导极化,可随进攻试剂 性质的不同而取不同的电子云流向,可进行多种机 理的聚合反应(自由基、阴离子和阳离子聚合)。 如苯乙烯、甲基苯乙烯、丁二烯及异戊二烯等等 。 + + R H2C CH R H2C CH
+
单烯CH2=CHX中取代基电负性不同和聚合倾向的关系图
(二) 位阻效应
位阻效应是由取代基的体积、数量、位置等 所引起的。在动力学上它对聚合能力有显著的影 响,但它不涉及对活性种的选择。
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更
易聚合,但两个取代基均体积较大(如1,1-2苯基乙烯),
则只能形成二聚体。
H2C
C
(2) 1,2 双取代的烯类化合物,因结构对称,极化程度
第三章 自由基聚合
1. 单体聚合的选择性 2. 四种基元反应及自由基聚合的特征 3. 引发反应、引发剂种类及其使用条件 4. 聚合速率方程的推导、公式、使用 5. 聚合速率以及分子量的影响因素 6. 分子量的公式及其使用条件 7. 阻聚剂和烯丙基的自阻聚作用
HC CH
Cl
O O O
C H
C H
Cl
(3) 三取代、四取代,一般不能聚合,但也有例外:取 代基为小体积的氟代乙烯 。
F F C H C H F F C H C F F F H2C C F F C C F
F
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更 易聚合,若两个取代基均体积较大(如1,1-2苯基乙烯), 则只能形成二聚体。
(2) 具有共轭效应的烯类单体 ∏电子云流动性大,易诱导极化,可随进攻试剂 性质的不同而取不同的电子云流向,可进行多种机 理的聚合反应(自由基、阴离子和阳离子聚合)。 如苯乙烯、甲基苯乙烯、丁二烯及异戊二烯等等 。 + + R H2C CH R H2C CH
+
单烯CH2=CHX中取代基电负性不同和聚合倾向的关系图
(二) 位阻效应
位阻效应是由取代基的体积、数量、位置等 所引起的。在动力学上它对聚合能力有显著的影 响,但它不涉及对活性种的选择。
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更
易聚合,但两个取代基均体积较大(如1,1-2苯基乙烯),
则只能形成二聚体。
H2C
C
(2) 1,2 双取代的烯类化合物,因结构对称,极化程度
第三章 自由基聚合
1. 单体聚合的选择性 2. 四种基元反应及自由基聚合的特征 3. 引发反应、引发剂种类及其使用条件 4. 聚合速率方程的推导、公式、使用 5. 聚合速率以及分子量的影响因素 6. 分子量的公式及其使用条件 7. 阻聚剂和烯丙基的自阻聚作用
高分子化学课件第三章 自由基共聚合

m1= d[M1] = k11[M1*][M1] + k21[M2*][M1] (i)
m2 d[M2]
k12[M1*][M2] + k22[M2*][M2]
第三章 自由基共聚合
(3)假设共聚反应是一个稳态过程,即总的活性中心的浓 度[M1*+M2*]恒定,[M1*]和[M2*]的消耗速率等于[M1*]和 [M2*]的生成速率,并且 M1* 转变为M2*的速率等于M2*转 变为M1*的速率;
二元共聚合的理论研究较系统深入,而三元及三元以上共 聚合复杂,理论研究很少,但实际应用的例子颇多。ABS, SBS
三元以上聚合,一般以两种单体确定主要性质,另外单体 改性。
二元共聚物根据两单体单元在分子链上的排列方式可分四 类:
第三章 自由基共聚合
(1)无规共聚物(random copolymer) 两种单体单元的排列没有一定顺序,A单体单元相邻的单
第三章 自由基共聚合
四种竞争链增长反应:
k11 M1* + M1
k12 M1* + M2
k21 M2* + M1
k22 M2* + M2
M1* R11 = k11[M1*][M1]
M2* R12 = k12[M1*][M2]
M1*
R21 = k21[M2*][M1]
M2* R22 = k22[M2*][M2]
若含一段A链与一段B链,如~AAAAAAA-BBBBBBBBBB~, 称AB型二嵌段共聚物;如果是由一段A链接一段B链再届一 段A链,如~AAAAAA-BB~BBB-AAAAAAA~,则称ABA型 三嵌段共聚物;若由多段A链和多段B链组成,则称(AB)n型 多嵌段共聚物。
第三章 自由基共聚合
高分子化学第三章 自由基聚合

• 链转移反应前后,自由基的数目未变。
35
1. 向单体转移
· ~~CH2-CH + CH2=CH Cl Cl
· ~~CH=CH + CH3-CH Cl Cl
• 注意CH2=CHCl单体
36
2. 向溶剂或链转移剂转移
X ~~CH2CH · + YS X ~~CH2CHY + S ·
• 溶剂:
• 链转移剂:有较强的链转移能力的化合
1 2
[I ]
1
2
[M ] (3—35式)
注意本方程的适用范围
73
二、温度对聚合速率的影响
• 阿累尼乌斯公式:K=Ae–Ea/RT
其中:K=kp(kd/kt)½ 则:Ea=Ep+Ed/2–Et/2
74
一般情况下: Ep≈29kJ•mol–1, Ed≈126kJ•mol–1 Et≈17kJ•mol–1
10
一、 聚合的可能性
• 主要取决于双键上取代基的空间 效应
11
1.烯类单体: CXY=CMN
(1)一取代( CH2=CHX)
可均聚合
12
(2)二取代
(CH2=CXY、CHX=CHY) (a)1,1——二取代:一般不考虑空 间位阻效应,可均聚合。
注意:CH2=C(Ar)2只能形成二聚体
13
(b)1,2——二取代
54
2.半衰期
[I] ln = Kd t [I0]
• 60℃
ln2 t½ = K d
(3—17)
t½ >6h,低活性引发剂 1h< t½ <6h,中活性引发剂 t½ <1h,高活性引发剂
55
3. 引发效率
3高分子化学 第三章 自由基聚合2

19
链引发反应
引发剂分解速率常数与温度之间的关系遵循阿累尼
乌斯(Arrhenius)经验公式。
kd
A e Ed/RT d
(3—18)
或
lnk d lnA d Ed /RT
(3—19)
不同温度测得某一引发剂的多个分解速率常数,作lnkd1/T 图,得一直线,由截距求得Ad,由斜率求Ed。 由于Ed 为正值,从式可知,随温度升高, kd增大。
RCH2 CH + CH2 CH
X
X
RCH2CHCH2CH XX
RCH2CH [ CH2CH ]n CH2CH
X
X
X
两个基本特征: (1)放热反应。 (2)链增长反应活化能低,反应速率极高。
5
自由基聚合机理
自由基聚合反应中,结构单元间的连接存在“头- 尾”、“头-头”(或“尾-尾”)两种可能的形式,一般 以头-尾结构为主。
诱导分解实际上是自由基向引发剂的转移反应。
O
O
O
O
Mx +
COOC
MxO C
+
CO
整个过程中自由基数量没有增加,但消耗了一个引发剂分子,
从而使引发剂效率降低。
过氧化物容易发生诱导分解。
Mx + ROOH
MxOH + RO
25
(2)笼蔽效应(cage effect) 当体系中引发剂浓度较低时,引发剂分子处于单体或溶 剂的包围中而不能发挥作用,称为笼蔽效应。 偶氮二异丁腈在笼子中可能发生的副反应:
HO OH 2HO
过氧化类引发剂的典型代表:过氧化二苯甲酰(dibenzoyl peroxide , BPO)。
BPO的分解分两步,第一步分解成苯甲酰自由基,第二 步分解成苯基自由基,并放出CO2。
第三章自由基聚合工艺

第3章 自由基聚合生产工艺
3.1 自由基聚合工艺基础 3.2 本体聚合生产工艺 3.3 悬浮聚合生产工艺 3.4 溶液聚合生产工艺 3.5 乳液聚合生产工艺
3.1 自由基聚合工艺基础
◆自由基聚合反应是当前高分子合成工业中应用最广泛 的化学反应之一
◆自由基聚合反应适用单体:乙烯基单体、二烯烃类单 体
影响聚合物平均分子量的主要因素:反应温度、引发 剂浓度和单体浓度、链转移剂的种类和用量
(1)聚合反应温度升高,所得聚合物的平均分子量降低 (2)引发剂用量对聚合物平均分子量发生显著的影响。
(动力学链长V=K[M]/[I]0.5
(3)链转移反应导致所得聚合物的分子量显著降低,对 获得高分子量聚合物不利,但可用来控制产品的平均 分子量,甚至还可用来控制产品的分子量。
混炼后用于成型 注塑成型用 假牙齿、牙托等
聚合物溶液 直接用于纺丝或溶解后
或颗粒
纺丝
聚合物溶液 直接用来转化为聚乙烯 醇
表2 四种聚合方法的工艺特点
聚合方法
聚合 主要操作方式 过程 反应温度控制
单体转换率 分离 工序复杂程度 回收 及后 动力消耗 处理 过程 产品纯度
废水废气
本体聚 乳液聚合 合
连续 连续
7.氯乙烯自由聚合时,聚合速率用 引发剂用量 调 节,而聚合物的相对分子质量用 聚合温度 控制。
第3章 自由基聚合生产工艺
3.1 自由基聚合工艺基础 3.2 本体聚合生产工艺 3.3 悬浮聚合生产工艺 3.4 溶液聚合生产工艺 3.5 乳液聚合生产工艺
3.2 本体聚合生产工艺
本体聚合:单体中加有少量引发剂或不加引发剂依赖热 引发,而无其他反应介质存在的聚合实施方法。
① 过氧化物类
通式:R-O-O-H 或 R-O-O-R (R可为烷基、芳基、酰基、碳酸酯基、磺酰基等)
3.1 自由基聚合工艺基础 3.2 本体聚合生产工艺 3.3 悬浮聚合生产工艺 3.4 溶液聚合生产工艺 3.5 乳液聚合生产工艺
3.1 自由基聚合工艺基础
◆自由基聚合反应是当前高分子合成工业中应用最广泛 的化学反应之一
◆自由基聚合反应适用单体:乙烯基单体、二烯烃类单 体
影响聚合物平均分子量的主要因素:反应温度、引发 剂浓度和单体浓度、链转移剂的种类和用量
(1)聚合反应温度升高,所得聚合物的平均分子量降低 (2)引发剂用量对聚合物平均分子量发生显著的影响。
(动力学链长V=K[M]/[I]0.5
(3)链转移反应导致所得聚合物的分子量显著降低,对 获得高分子量聚合物不利,但可用来控制产品的平均 分子量,甚至还可用来控制产品的分子量。
混炼后用于成型 注塑成型用 假牙齿、牙托等
聚合物溶液 直接用于纺丝或溶解后
或颗粒
纺丝
聚合物溶液 直接用来转化为聚乙烯 醇
表2 四种聚合方法的工艺特点
聚合方法
聚合 主要操作方式 过程 反应温度控制
单体转换率 分离 工序复杂程度 回收 及后 动力消耗 处理 过程 产品纯度
废水废气
本体聚 乳液聚合 合
连续 连续
7.氯乙烯自由聚合时,聚合速率用 引发剂用量 调 节,而聚合物的相对分子质量用 聚合温度 控制。
第3章 自由基聚合生产工艺
3.1 自由基聚合工艺基础 3.2 本体聚合生产工艺 3.3 悬浮聚合生产工艺 3.4 溶液聚合生产工艺 3.5 乳液聚合生产工艺
3.2 本体聚合生产工艺
本体聚合:单体中加有少量引发剂或不加引发剂依赖热 引发,而无其他反应介质存在的聚合实施方法。
① 过氧化物类
通式:R-O-O-H 或 R-O-O-R (R可为烷基、芳基、酰基、碳酸酯基、磺酰基等)
3-自由基聚合(2)

[I] ln [ I ]0
-k t
四价铈盐和醇、醛、酮、胺等组成的氧化-还原体系, 可有效地引发烯类单体聚合或接枝聚合(如淀粉接枝丙烯 腈)。
Ce
4+
+
H C
H C
Ce 3+ +
OH OH
CH + CH O HO
+ H+
26
(ii)油溶性氧化—还原引发体系 氧化剂:氢过氧化物、二烷基过氧化物、二酰基过氧化 物等。 还原剂:叔胺、环烷酸盐、硫醇、有机金属化合物,如 [Al(C2H5)3]、 [B(C2H5)3] 等。
特征:放热反应、活化能低—20-34kJ/mol、速率 常数高、聚合度增大。
6
在链增长反应过程中,不仅研究反应速率,还需 考察增长反应对大分子微结构的影响。
在链增长反H2CH CH2 CH + CH2 X CH X X X or CHCH2 CH2CH X X
Rd
d [I] dt
k d [I]
负号—代表[I]随时间t的增加而减少; kd— 分解速率常数,单位为s-1。
29
将上式积分,得:
[I] ln [ I ]0
-k t
d
[I]0—引发剂的起始浓度, 单位为mol/L
[I] —时间为t时的引发剂 浓度,单位为mol/L
[I] e -k d t [ I ]0
2
C O
2
+ 2 CO2
BPO按两步分解。第一步均裂成苯甲酸基自由基, 有单体存在时,即引发聚合;无单体存在时,进一步 分解成苯基自由基,并放出CO2,但分解不完全。
21
3、无机过氧类引发剂
代表物:无机过硫酸盐,如过硫酸钾K2S2O8和 (NH4)2S2O8,这类引发剂能溶于水,多用于乳液聚合和 水溶液聚合。
《材化高分子化学》第3章 自由基聚合
E = 105~150 kJ/mol (3—1)
kd = 10-4~10-6 s-1
(3—2)
19
第三章 自由基聚合
b. 单体自由基的形成
R + CH2 CH X
RCH2 CH X
由初级自由基与单体加成产生,为放热反应, 活
化能低,反应速度快。
E = 20 ~ 34 kJ/mol
(3—3)
20
第三章 自由基聚合
(CH3)2C N N C (CH3)2
2 (CH3)2C + N2
CN
CN
CN
优点:
(1)分解只形成一种自由基,无诱导分解。 (2)常温下稳定。80℃以上剧烈分解。
35
第三章 自由基聚合
(2)有机过氧化类引发剂
最简单的过氧化物:过氧化氢。活化能较高, 220kJ/mol,一般不单独用作引发剂。
HO OH 2HO
7
第三章 自由基聚合
分子中含有推电子基团,如烷基、烷氧基、苯基、乙 烯基等,碳=碳双键上电子云增加,有利于阳离子聚合进 行。
δ
CH2 CH Y
注意:丙烯分子上有一个甲基,具有推电子性和超共轭双 重效应,但都较弱,不足以引起阳离子聚合,也不能进行 自由基聚合。只能在配位聚合引发体系引发下进行配位聚 合。
30
第三章 自由基聚合
3.4.2 自由基聚合反应的特征
(1)可分为链引发、链增长、链终止等基元反应。 各基元反应活化能相差很大。其中链引发反应速率 最小,是控制聚合过程的关键。
慢引发、快增长、有转移,速终止。
与逐步缩聚机理特征比较见p75表3-6。
31
第三章 自由基聚合
(2)只有链增长反应使聚合度增加。从单体转化为 大分子的时间极短,瞬间完成。体系中不存在聚合 度递增的中间状态(p75图3-2)。聚合度与聚合时间 基本无关。
第3章 自由基共聚

k 12 [M1 ][ M 2 ] [M ] 2 k 21 [M1 ]
代入
d[M1 ] k11 M1 M1 k 21 M M1 2 d[M 2 ] k 22 M 2 M 2 k12 M1 M 2
得:
d[M 1 ] k 11k 21[M 1 ] k 12 k 21[M 1 ][ M 2 ] 2 d[M 2 ] k 22 k 12 [M 2 ] k 12 k 21[M 1 ][ M 2 ]
n CH2=CH + mCH2=CH Cl
共聚
[CH2 CH]n [CH2 CH ]m Cl OCOCH 3
OCOCH 3
根据参加反应单体的单元数,共聚反应可分为:
二元共聚: 三元共聚: 多元共聚: 两种单体 三种单体 3种或3种以上单体 共同进行反应
3.1 引言
二、 共聚物类型
共聚物按大分子链中单体链节的排列方式可分为下列四种: (1)无规共聚物(random copolymer)
链引发(initiation): 2个引发反应。
I R
R M1 RM
ki,1 1
Ri,1 ki ,1
R M
1
R M 2 RM
ki, 2
2
Ri,2 ki , 2 R M 2
3.2 二元共聚物组成
链增长(propagation):4个增长反应
3.2 二元共聚物组成
链终止(termination): 3个终止反应
M M1
M M2
2
1
死大分子
kt,11
Rt ,11 2kt ,11 M
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
CN
N2
BPO分解及其副反应更复杂。
C6H5COO OOCC6H5 C6H5COO 2 C6H5COO
+ C6H5 + CO2
2C6H5 + 2CO2 C6H5 C6H5
+
C6H5COOC6H5 + CO2
2CO2
引发剂效率随单体、溶剂和引发剂的特性、种类有不同 程度的变化。
3 自由基聚合 3.5 引发剂
消耗掉一分子引发剂,而自由基数目并没有增加。
3 自由基聚合 3.5 引发剂
19
3.5.4 引发剂效率
诱导分解的影响因素:
引发剂种类:AIBN无诱导分解,ROOH容易诱导分解; 引发剂浓度:浓度大易诱导分解;������ 单体的相对活性:丙烯腈(AN)、St等活性较高的单体,能 迅速与引发剂作用引发增长,引发效率高。VAc等低活性
引发剂的温度选用范围
温度范围/℃ 高温 >100 中温 40~100 Ed/kJmol-1 138~188 110~138 引发剂举例 异丙苯过氧化氢,特丁基过氧化氢,过氧化二异丙苯,过 氧化二特丁基 过氧化苯甲酰,过氧化十二酰,AIBN,过硫酸盐 氧化还原体系:过氧化氢-亚铁盐,过硫酸盐-NaHSO3,异 丙苯过氧化氢-亚铁盐,过氧化苯甲酰-二甲基苯胺
第3章
自由基聚合 主要内容
单体对不同连锁聚合机理的选择性;
自由基聚合反应机理及其特征; 主要热引发剂种类、引发机理和引发剂分解动力学; 自由基聚合反应动力学及影响自由基聚合反应速率和分子 量的因素;
掌握引发效率、稳态、自由基等活性理论、自动加速、
动力学链长、聚合度、链转移、阻聚及缓聚等基本概念。
常用的有机过氧化物引发剂有烷基过氧化氢(RC-OO-H)、二烷基过氧化物(R-O-O-R’)、过氧化酯 (RCOOOR’)、过氧化二酰(RCOOOCOR’)和过氧化二碳
酸酯(ROOC-O-O-COOR’)等。
3 自由基聚合 3.5 引发剂
8
(2)有机过氧类引发剂 过氧化物受热分解时,过氧键均裂生成两个自由基,如:
kd Ad e
Ed RT
lnkd lnAd Ed RT
3 自由基聚合 3.5 引发剂
16
工业上衡量引发剂活性的定量指标: 过氧化二碳酸二环己酯 60℃下t1/2:
t1/2< 1h:高活性引发剂,如DCPD (1h); 1h<t1/2< 6h:中活性引发剂,如BPPD (2.1h); t1/2> 6h:低活性引发剂,如AIBN (16h) 过氧化二碳酸二苯氧乙酯
高-低(中)活性引发剂复合使用
常温聚合一定时间后,提高聚合温度进行后聚合
3 自由基聚合 3.5 引发剂
25
3.5.5 引发剂的选择 选择引发剂时还须考虑的因素: 与体系中其他组分有无反应;������
是否易着色、有无毒性等;������
贮存、运输安全、使用方便、经济效益等。 引发剂用量的确定需经过大量的试验。
3 自由基聚合 3.5 引发剂
17
3.5.4 引发剂效率 引发剂分解后,只有一部分能够引发聚合,而另一部分
由于诱导分解和笼蔽效应伴随的副反应而消耗。
引发聚合的部分引发剂占引发剂分解或消耗总量的分数 称为引发剂效率 (f)。 引发剂分解速率 Rd=kd[I], 引发速率 Ri = 2fkd[I] 副反应:使引发剂效率下降。
O C O +
O C O
3 自由基聚合 3.5 引发剂
14
3.5.3 引发剂分解动力学
R O O R' R N N R' RO + R'O R + R' + N2
单分子一级反应
引发剂分解速率
d[I] Rd k d [I ] dt
注意kd的单位 s-1,min-1,h-1
t=0 时引发剂浓度为[I]0,上式积分得
CH3 CH3 H3C C N N C CH3 CN CN 偶氮二异丁腈 (AIBN) CH3 2 H3C C CN + N2
45~80℃
3 自由基聚合 3.5 引发剂
5
(1)偶氮类引发剂
在45~80℃使用,一级反应,无诱导分解,产生一种
自由基,分解产生氮气;稳定,存储安全;
因为氰基的共轭,甲基的超共轭,自由基稳定,无脱 氢能力,故不能作接枝聚合引发剂。
大多数引发剂可观察到这些现象,偶氮类引发剂易发生。
AIBN分解形成自由基后,可能偶合成稳定分子。
3 自由基聚合 3.5 引发剂
21
(CH3)2C C(CH3)2 +N2 (CH3)2CN NC(CH3)2 CN CN [2(CH3)2C
+
N2 ]
CN CN (CH3)2C C N C(CH3)2 CN
[I] ln kd t [I]0
3 自由基聚合 3.5 引发剂
15
3.5.3 引发剂分解动力学
引发剂半衰期( t1/2): 引发剂分解至起始浓度一半所需的时间
t1 2
[I]0 1 ln 2 0.693 ln kd [I]0 /2 kd kd
kd与温度有关,t1/2与温度有关,同一引发剂在不同温度 下有不同的t1/2。
低温 -10~40
极低温 < -30
63~110
<63
过氧化物-烷基金属(三乙基铝,三乙基硼,二乙基铅),氧烷基金属
3 自由基聚合 3.5 引发剂
24
3.5.5 引发剂的选择 为了控制聚合速率,使之均速反应,常采用高 - 低 ( 中 ) 活性引发剂复合使用的方法; 若体系具有还原性 ( 如 NaCNS 的水溶液聚合 ) 则不宜使 用过氧类引发剂。 工业上,通常:
的单体,对自由基的捕捉能力较弱,使引发效率降低。
3 自由基聚合 3.5 引发剂
20
3.5.4 引发剂效率 笼蔽效应(Cage Effect) 引发剂的浓度相对很低,处于单体或溶剂的笼子包围中。
引发剂分解产生的初级自由基,处于周围分子(如单体和溶剂
分子)的包围,像处在笼子中一样,形成稳定分子,使引发剂 效率降低。这一现象称之为笼蔽效应。
3 自由基聚是聚合动力学的主要研究内容。聚 合速率的研究目的:在理论上探明聚合机理,实际上为生 产控制提供依据。 定义:Rp——单位时间内单体消耗量或聚合物的生成量。
d[M] d[P] Rp dt dt
转化率(Conversion):参加反应的单体量占总单体量的百分比。
22
3.5.5 引发剂的选择 1. 由聚合方法选择引发剂类型。 本体、悬浮和溶液聚合选用偶氮类和过氧类油溶性引
发剂,乳液聚合和水溶液聚合则选用水溶性过硫酸盐引 发剂或氧化-还原引发剂。
2. 由聚合温度选择活化能或半衰期适当的引发剂,使自由
基形成速率和聚合速率适中。
3 自由基聚合 3.5 引发剂
23
3 自由基聚合 3.5 引发剂
18
3.5.4 引发剂效率
引发自由基的再结合: 以BPO为例
O Ph C O + Ph O Ph C O Ph 2 Ph Ph Ph
诱导分解 (induced decomposition) 自由基向引发剂的链转移反应。
O O Ph C O O C Ph + Ph O O Ph C O Ph + Ph C O
3 自由基聚合 3.5 引发剂
11
无机物/无机物氧化还原体系
HO OH + Fe
2+
水溶性
-
HO + OH + Fe3+
竞争反应 HO + H2O2 H O O + H2O2 HO + Fe
2+
H O O + H2O HO + H2O + O2 HO + Fe
3+
影响H2O2的效率和反应重现性,多被过硫酸盐体系代替。 属于双分子反应,1分子氧化剂只形成一个自由基; 若还原剂过量,则进一步与自由基反应,使活性消失。 故还原剂用量一般较氧化剂少 。
总的原则为:低活性用量多,高活性用量少,一般为
单体量的0.01%~0.1%。
3 自由基聚合 3.5 引发剂
26
3.7 聚 合 速 率
自由基聚合各基元反应对总聚合速率都有所贡献。链
转移反应一般不影响聚合速率,可暂不考虑。 从三个基元反应的动力学方程推导出发,依据等活性、 长链和稳态三个基本假设推导聚合反应总的动力学方程。 分析影响聚合反应速率的一些因素。
Δ[M] [M]0 [M] C 100% 即 [M] [M]0 (1 C ) [M]0 [M]0
33.7 自由基聚合 聚合速率
28
3.7.1 概述
d[M] dC Rp [M]0 dt dt
可用C ~ t 曲线表示聚合过程中速率的变化 通常呈S型。据此,
可将聚合过程分为:
3 自由基聚合 3.5 引发剂
12
无机物/无机物氧化还原体系 常用的是:过硫酸盐 + 低价盐
-
O3SOOSO3- + HSO3O3SOOSO3- + Fe
2+
SO42- + SO4- + HSO3 SO4 + SO4
2-
-
+ Fe
3+
有机物/无机物氧化还原体系:有机过氧化物 + 低价盐
R-O-O-R + Fe2+ R-O-O-H + Fe2+ R-O-O C R' + Fe O
O O C O O C 过氧化苯甲酰(BPO) O C O + CO2 2 O C O
CN
N2
BPO分解及其副反应更复杂。
C6H5COO OOCC6H5 C6H5COO 2 C6H5COO
+ C6H5 + CO2
2C6H5 + 2CO2 C6H5 C6H5
+
C6H5COOC6H5 + CO2
2CO2
引发剂效率随单体、溶剂和引发剂的特性、种类有不同 程度的变化。
3 自由基聚合 3.5 引发剂
消耗掉一分子引发剂,而自由基数目并没有增加。
3 自由基聚合 3.5 引发剂
19
3.5.4 引发剂效率
诱导分解的影响因素:
引发剂种类:AIBN无诱导分解,ROOH容易诱导分解; 引发剂浓度:浓度大易诱导分解;������ 单体的相对活性:丙烯腈(AN)、St等活性较高的单体,能 迅速与引发剂作用引发增长,引发效率高。VAc等低活性
引发剂的温度选用范围
温度范围/℃ 高温 >100 中温 40~100 Ed/kJmol-1 138~188 110~138 引发剂举例 异丙苯过氧化氢,特丁基过氧化氢,过氧化二异丙苯,过 氧化二特丁基 过氧化苯甲酰,过氧化十二酰,AIBN,过硫酸盐 氧化还原体系:过氧化氢-亚铁盐,过硫酸盐-NaHSO3,异 丙苯过氧化氢-亚铁盐,过氧化苯甲酰-二甲基苯胺
第3章
自由基聚合 主要内容
单体对不同连锁聚合机理的选择性;
自由基聚合反应机理及其特征; 主要热引发剂种类、引发机理和引发剂分解动力学; 自由基聚合反应动力学及影响自由基聚合反应速率和分子 量的因素;
掌握引发效率、稳态、自由基等活性理论、自动加速、
动力学链长、聚合度、链转移、阻聚及缓聚等基本概念。
常用的有机过氧化物引发剂有烷基过氧化氢(RC-OO-H)、二烷基过氧化物(R-O-O-R’)、过氧化酯 (RCOOOR’)、过氧化二酰(RCOOOCOR’)和过氧化二碳
酸酯(ROOC-O-O-COOR’)等。
3 自由基聚合 3.5 引发剂
8
(2)有机过氧类引发剂 过氧化物受热分解时,过氧键均裂生成两个自由基,如:
kd Ad e
Ed RT
lnkd lnAd Ed RT
3 自由基聚合 3.5 引发剂
16
工业上衡量引发剂活性的定量指标: 过氧化二碳酸二环己酯 60℃下t1/2:
t1/2< 1h:高活性引发剂,如DCPD (1h); 1h<t1/2< 6h:中活性引发剂,如BPPD (2.1h); t1/2> 6h:低活性引发剂,如AIBN (16h) 过氧化二碳酸二苯氧乙酯
高-低(中)活性引发剂复合使用
常温聚合一定时间后,提高聚合温度进行后聚合
3 自由基聚合 3.5 引发剂
25
3.5.5 引发剂的选择 选择引发剂时还须考虑的因素: 与体系中其他组分有无反应;������
是否易着色、有无毒性等;������
贮存、运输安全、使用方便、经济效益等。 引发剂用量的确定需经过大量的试验。
3 自由基聚合 3.5 引发剂
17
3.5.4 引发剂效率 引发剂分解后,只有一部分能够引发聚合,而另一部分
由于诱导分解和笼蔽效应伴随的副反应而消耗。
引发聚合的部分引发剂占引发剂分解或消耗总量的分数 称为引发剂效率 (f)。 引发剂分解速率 Rd=kd[I], 引发速率 Ri = 2fkd[I] 副反应:使引发剂效率下降。
O C O +
O C O
3 自由基聚合 3.5 引发剂
14
3.5.3 引发剂分解动力学
R O O R' R N N R' RO + R'O R + R' + N2
单分子一级反应
引发剂分解速率
d[I] Rd k d [I ] dt
注意kd的单位 s-1,min-1,h-1
t=0 时引发剂浓度为[I]0,上式积分得
CH3 CH3 H3C C N N C CH3 CN CN 偶氮二异丁腈 (AIBN) CH3 2 H3C C CN + N2
45~80℃
3 自由基聚合 3.5 引发剂
5
(1)偶氮类引发剂
在45~80℃使用,一级反应,无诱导分解,产生一种
自由基,分解产生氮气;稳定,存储安全;
因为氰基的共轭,甲基的超共轭,自由基稳定,无脱 氢能力,故不能作接枝聚合引发剂。
大多数引发剂可观察到这些现象,偶氮类引发剂易发生。
AIBN分解形成自由基后,可能偶合成稳定分子。
3 自由基聚合 3.5 引发剂
21
(CH3)2C C(CH3)2 +N2 (CH3)2CN NC(CH3)2 CN CN [2(CH3)2C
+
N2 ]
CN CN (CH3)2C C N C(CH3)2 CN
[I] ln kd t [I]0
3 自由基聚合 3.5 引发剂
15
3.5.3 引发剂分解动力学
引发剂半衰期( t1/2): 引发剂分解至起始浓度一半所需的时间
t1 2
[I]0 1 ln 2 0.693 ln kd [I]0 /2 kd kd
kd与温度有关,t1/2与温度有关,同一引发剂在不同温度 下有不同的t1/2。
低温 -10~40
极低温 < -30
63~110
<63
过氧化物-烷基金属(三乙基铝,三乙基硼,二乙基铅),氧烷基金属
3 自由基聚合 3.5 引发剂
24
3.5.5 引发剂的选择 为了控制聚合速率,使之均速反应,常采用高 - 低 ( 中 ) 活性引发剂复合使用的方法; 若体系具有还原性 ( 如 NaCNS 的水溶液聚合 ) 则不宜使 用过氧类引发剂。 工业上,通常:
的单体,对自由基的捕捉能力较弱,使引发效率降低。
3 自由基聚合 3.5 引发剂
20
3.5.4 引发剂效率 笼蔽效应(Cage Effect) 引发剂的浓度相对很低,处于单体或溶剂的笼子包围中。
引发剂分解产生的初级自由基,处于周围分子(如单体和溶剂
分子)的包围,像处在笼子中一样,形成稳定分子,使引发剂 效率降低。这一现象称之为笼蔽效应。
3 自由基聚是聚合动力学的主要研究内容。聚 合速率的研究目的:在理论上探明聚合机理,实际上为生 产控制提供依据。 定义:Rp——单位时间内单体消耗量或聚合物的生成量。
d[M] d[P] Rp dt dt
转化率(Conversion):参加反应的单体量占总单体量的百分比。
22
3.5.5 引发剂的选择 1. 由聚合方法选择引发剂类型。 本体、悬浮和溶液聚合选用偶氮类和过氧类油溶性引
发剂,乳液聚合和水溶液聚合则选用水溶性过硫酸盐引 发剂或氧化-还原引发剂。
2. 由聚合温度选择活化能或半衰期适当的引发剂,使自由
基形成速率和聚合速率适中。
3 自由基聚合 3.5 引发剂
23
3 自由基聚合 3.5 引发剂
18
3.5.4 引发剂效率
引发自由基的再结合: 以BPO为例
O Ph C O + Ph O Ph C O Ph 2 Ph Ph Ph
诱导分解 (induced decomposition) 自由基向引发剂的链转移反应。
O O Ph C O O C Ph + Ph O O Ph C O Ph + Ph C O
3 自由基聚合 3.5 引发剂
11
无机物/无机物氧化还原体系
HO OH + Fe
2+
水溶性
-
HO + OH + Fe3+
竞争反应 HO + H2O2 H O O + H2O2 HO + Fe
2+
H O O + H2O HO + H2O + O2 HO + Fe
3+
影响H2O2的效率和反应重现性,多被过硫酸盐体系代替。 属于双分子反应,1分子氧化剂只形成一个自由基; 若还原剂过量,则进一步与自由基反应,使活性消失。 故还原剂用量一般较氧化剂少 。
总的原则为:低活性用量多,高活性用量少,一般为
单体量的0.01%~0.1%。
3 自由基聚合 3.5 引发剂
26
3.7 聚 合 速 率
自由基聚合各基元反应对总聚合速率都有所贡献。链
转移反应一般不影响聚合速率,可暂不考虑。 从三个基元反应的动力学方程推导出发,依据等活性、 长链和稳态三个基本假设推导聚合反应总的动力学方程。 分析影响聚合反应速率的一些因素。
Δ[M] [M]0 [M] C 100% 即 [M] [M]0 (1 C ) [M]0 [M]0
33.7 自由基聚合 聚合速率
28
3.7.1 概述
d[M] dC Rp [M]0 dt dt
可用C ~ t 曲线表示聚合过程中速率的变化 通常呈S型。据此,
可将聚合过程分为:
3 自由基聚合 3.5 引发剂
12
无机物/无机物氧化还原体系 常用的是:过硫酸盐 + 低价盐
-
O3SOOSO3- + HSO3O3SOOSO3- + Fe
2+
SO42- + SO4- + HSO3 SO4 + SO4
2-
-
+ Fe
3+
有机物/无机物氧化还原体系:有机过氧化物 + 低价盐
R-O-O-R + Fe2+ R-O-O-H + Fe2+ R-O-O C R' + Fe O
O O C O O C 过氧化苯甲酰(BPO) O C O + CO2 2 O C O
