《无机及分析化学》第八章课后题答案教案资料
《无机及分析化学》第八章课后题答案

第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2B ) B. S (AB )>S (A 2B )C. S (AB )=S (A 2 B )D. 不能确定不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水纯水 B. 在0.1mol ·L -1 HCl 中C. 在0.1mol ·L -1 NH 4Cl 中D. 在0.1mol ·L -1 Mg Cl 2 中(3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3C. AgNO 3,KSCN D. AgNO 3,NH 4SCN (4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄荧光黄 C. 曙红曙红 D. 铁铵矾铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低偏低 B.偏高偏高 C.无影响无影响 D. 正负误差不定正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型类型 有关,而且还与溶液中相应离子相应离子 浓度浓度 有关。
; 4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为 1.05×1.05×1010-5 , 1.1×1.1×1010-4 。
无机及分析化学第八章答案
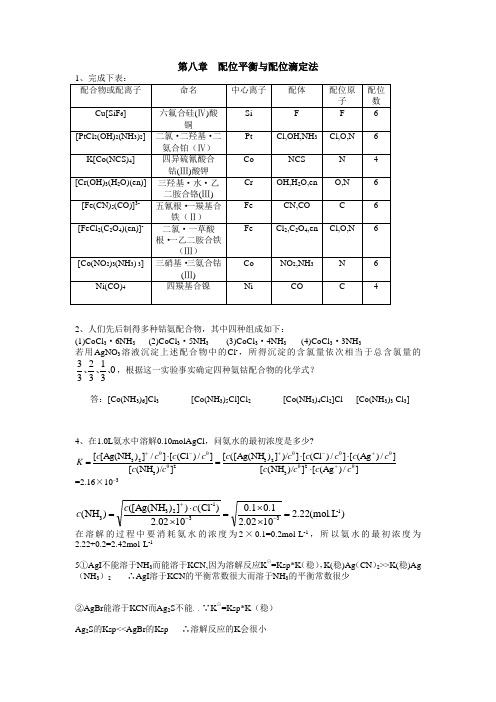
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
兰叶青无机及分析化学课后习题答案(所有章节)

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= ·mol -1W=-p 外△V ≈-n R T =-×=- kJ ·mol -1 △U = Q + W= +(-)= kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。
无机及分析化学课后习题与答案

第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是( )A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D 。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
《无机及分析化学》1-12章习题答案

第一章 气体和溶液 (15页)
17. 聚沉能力由大到小排列: A. 100 mL0.005mol·L-1KI 和100 mL0.01mol·L-1
AgNO3 制成的为正溶胶,所以排列顺序为: AlCl3 K3[Fe(CN)6] MgSO4 (电荷同由小到大) B. 100 mL0.005mol·L-1 AgNO3和100 mL0.01mol·L-1 KI制成的为负溶胶,所以排列顺序为: K3[Fe(CN)6] AlCl3 MgSO4(电荷同由大到小)
13.
2SO2(g) + O2(g) = 2SO3(g)
n平衡
1.90
0.95 1.10
K K p( p ) B K C ( Rp T ) B
c(ScO (2S)O c3()O2)RpT1
1.1208.0 010.31 1.2 90.9 58.31151 00.5 031
第三章 化学反应速率和化学平衡 (56页)
V=1425∕900=1.58 L
c=1 25.2 0∕1.5.81 0 =.0 151 .80m1 o8 l·.L6 0 -1 0 9. 40.:0 6.6 00 :5.33 1:2:1
T bm B 0 .05 0 1 .50 00 M K b m A0 .51 9 .0 20 1g 8 m 0-1o
⑸ 减小容器体积
n(Cl2)增大
⑹ 减小容器体积
p(Cl2)增大
⑺ 减小容器体积
K⊖不变
⑻ 升高温度
K⊖增大
⑼ 升高温度
p(HCl)增大
⑽ 加N2 ⑾ 加催化剂
无机及分析化学第八章答案

第八章 思考题与习题8-2 判断题 (1)√ (2)× (3)√8-3 填空题(1)1.51 ,1.509,MnO 42-,Mn 3+ ; (4) 0.86±0.0592/2;(5) 5.6×104 ; (6) 高锰酸钾, 重铬酸钾, 碘量 ;(7) H 2SO 4 ,Mn 2+ , 75~85 , 自身指示剂 , 无, 红。
8-4 选择题1 A ;2 B ;3 B ;4 A ;5 B ;6 B ;7 D ; 8 D ; 9 C ; 10 C ; 11 B ; 12 D.8-5用离子电子法配平下列电极反应解 (1)MnO -4+ 2H 2O + 3e = MnO 2 +4OH - (碱性介质)(2)CrO -24+ 4H 2O + 3e = Cr(OH)3 + 5OH - (碱性介质)(3)H 2O 2+ 2H + + 2e = 2H 2O (酸性介质)(4)H 3AsO 4+ 2H + + 2e = H 3AsO 3 + H 2O (酸性介质)(5)O 2+ 2H + + 2e = H 2O 2(aq) (酸性介质)8-6计算题1.解 :(1)查表:φθ(Cl 2/Cl -)=1.358、φθ(Br 2/ Br -)=1.066、φθ(I 2/ I -)=0.536、φθ(Fe 3+/Fe 2+)=0.771、φθ(MnO 4-/Mn 2+)=1.5072解:(1) 电极反应: (+):MnO 2 + 4H + + 2e -=Mn 2+ + 2H 2O ( -):Cl 2 + 2e -= 2Cl - 或 2Cl - - 2e= Cl 2如果设计成原电池,则原电池符号为:(-)Pt | Cl 2(p 1)| Cl - (c 1)|| Mn 2+ (c 2) , H +(c 3)| MnO 2 | Pt (+)(2) 查表得:φθ(MnO 2/Mn 2+)=1.22V φθ(Cl 2/Cl -)=1.36V ,εө=φθ(MnO 2/Mn 2+)-φθ(Cl 2/Cl -)=1.22-1.36= -0.14<0,在标态下该反应不能正向自发进行。
农业出版社无机及分析化学习题解答汇总完整版
无机及分析化学(Ⅰ)习题解答目录第1章分散体系 (1)第2章化学热力学基础 (8)第3章化学反应速率和化学平衡 (15)第4章物质结构 (22)第5章分析化学概述 (27)第6章酸碱平衡 (31)第7章酸碱滴定法 (36)第8章沉淀溶解平衡 (44)第9章重量分析法和沉淀滴定法 (49)第10章配位化合物 (53)第11章配位滴定法 (62)第12章氧化还原反应 (67)第13章氧化还原滴定法 (78)第14章电势分析法 (83)第15章吸光光度分析法 (86)第16章试样分析中常用的分离方法简介 (90)第17章重要生命元素简述 (93)第18章原子核化学简介 (96)第1章 分散体系1-1.人体注射用的生理盐水中,含有NaCl 0.900%,密度为1.01g·mL -1,若配制此溶液3.00×103g ,需NaCl 多少克?该溶液物质的量浓度是多少?解:配制该溶液需NaCl 的质量为:m (NaCl)=0.900%×3.00×103g=27.0g该溶液的物质的量浓度为:-1-13-1-327.0g/58.5g mol (NaCl)==0.155mol L (3.0010g/1.01g m L )10c ⋅⋅⨯⋅⨯ 1-2.把30.0g 乙醇(C 2H 5OH)溶于50.0g 四氯化碳(CCl 4)中所得溶液的密度为1.28g∙mL -1,计算:(1)乙醇的质量分数;(2)乙醇的物质的量浓度;(3)乙醇的质量摩尔浓度;(4)乙醇的摩尔分数。
解:(1)w (C 2H 5OH) =25254(C H OH)30.0g (C H OH)(CCl )30.0g 50.0gm m m =++=0.38 (2)-12525-1-3(C H OH)30.0g/46g mol (C H OH)[(30.0+50.0)g /1.28g mL ]10n c V ⋅=⋅⨯==10.4mol·L -1 (3)b (C 2H 5OH) =-125-3430.0g(C H OH)46g mol (CCl )50.010kgn m ⋅=⨯=13.0mol·kg -1 (4)x (C 2H 5OH) =-125254-1-130.0g(C H OH)46g mol =30.0g 50.0g (C H OH)+(CCl )+46g mol 153.6g mol n n n ⋅⋅⋅ =0.650.660.650.33=+ 1-3.将5.0g NaOH 、NaCl 、CaCl 2分别置于水中,配成500mL 溶液,试求c (NaOH)、c (NaCl)、c (12CaCl 2)。
无机及分析化学第八章选择题及答案
无机及分析化学第八章选择题及答案16. Al3+与EDTA形成( C)A. 非计量化合物B. 夹心化合物C. 鳌合物D. 聚合物17. 下列几种物质中最稳定的是( A)A. [Co(en)3]Cl3B. [Co(NH3)6] (NO3)3C. [Co(NH3)6]Cl2D. Co(NO3)318. 下列配离子在强酸中能稳定存在的是(D)A. [Fe(C4)]3- B. [AlF6]3-C. [Mn(NH3)6]2+ D. [AgCl2]-13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A)A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)38. AgCl在1mol?L?1氨水中比在纯水中的溶解度大。
其原因是:( B )(A)盐效应(B)配位效应(C)酸效应(D)同离子效应10. 在下列浓度相同的溶液中,AgI具有最大溶解度的是:( D)A.NaCl B. AgNO3 C. NH3· HO D. KCN7. 下列物质,能在强酸中稳定存在的是 ( D )A. [Ag(S2O3)2]3- B. [Ni(NH3)6]2+C. [Fe(C2O4)3]3- D. [HgCl4]2-9. 用EDTA直接滴定有色金属离子,终点所呈现的颜色是:(D )A.指示剂-金属离子配合物的颜色 B. 游离指示剂的颜色C. EDTA-金属离配合物的颜色D. (B)和(C)的混合颜色8.下列说法何种错误(C )A.配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B.螯合物以六员环、五员环较稳定。
C.配位数就是配位体的个数。
D.二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
14.在配位反应中,一种配离子可以转化成()配离子,即平衡向生成()的配离子方向移动。
( C)(A)不稳定的更难解离的(B)更稳定的更易解离的(C)更稳定的更难解离的(D)不稳定的更易解离的11、下列说法何种欠妥C(1)配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
大学无机化学第八章试题及答案
第八章 沉淀溶解平衡各小节目标:第一节:溶度积常数1;了解溶度积常数及其表达式,溶度积和溶解度的关系。
2:学会用溶度积原理来判断沉淀是产生、溶解还是处于平衡状态(饱和溶液),3:大致了解盐效应和同离子效应对溶解度的影响。
第二节:沉淀生成的计算利用溶度积原理掌握沉淀生成的有关计算。
(SP Q K θ>将有沉淀生成)第三节:沉淀的溶解和转化1:利用溶度积原理掌握沉淀溶解和转化的计算(SP Q K θ<沉淀溶解)2:可以判断溶液中哪种物质先沉淀。
用KSP 的表达式,计算溶液中相关离子的浓度。
习题一 选择题1. Ag 3PO 4在0.1 mol/L 的Na 3 PO 4溶液中的溶解度为( )(《无机化学例题与习题》吉大版)(已知Ag 3PO 4的K 0sp = 8.9×10-17)A. 7.16×10-5B.5.7×10-6C. 3.2×10-6D. 1.7×10-62.已知Sr 3(PO 4)2的溶解度为1.7×10-6 mol/L ,则该化合物的容度积常数为( )(《无机化学例题与习题》吉大版)A. 1.0×10-30B. 1.1×10-28C. 5.0×10-30D. 1.0×10-123.已知Zn (OH )2的容度积常数为3.0×10-17,则Zn (OH )2在水中的容度积为( )(《无机化学例题与习题》吉大版)A. 2.0×10-6mol/LB. 3.1×10-6 mol/LC. 2.0×10-9 mol/LD. 3.1×10-9 mol/L4.已知Mg (OH )2的K 0sp =5.6×10-12,则其饱和溶液的pH 为( )(《无机化学例题与习题》吉大版)A. 3.65 B3.95 C. 10.05 D. 10.355.下列化合物中,在氨水中溶解度最小的是( )(《无机化学例题与习题》吉大版)A. Ag 3PO 4B. AgClC. Ag BrD. AgI6.CaCO 3在相同浓度的下列溶液中溶解度最大的是( )(《无机化学例题与习题》吉大版)A. NH 4AcB. CaCl 2C. NH 4ClD. Na 2CO 37.难溶盐Ca3(PO4)2在a mol/L Na3 PO4溶液中的溶解度s与容度积K0sp关系式中正确的是()(《无机化学例题与习题》吉大版)A. K0sp =108s5B. K0sp =(3s)3 +(2s + a)2C. K0sp = s5D. s3·(s + a)28.下列难溶盐的饱和溶液中,Ag+浓度最大和最小的一组是()(《无机化学例题与习题》吉大版)A. Ag2CrO4和AgClB. Ag2CrO4和AgSCNC. AgSCN和Ag2C2O4D. Ag2C2O4和AgSCN9. AgCl和Ag2CrO4的容度积分别为1.8×10-10和1.1×10-12,则下面叙述中正确的是()(《无机化学例题与习题》吉大版)A. AgCl与Ag2CrO4的容度积相等B. AgCl的容度积大于Ag2CrO4C. AgCl的容度积小于Ag2CrO4D. 都是难溶盐,容度积无意义10.BaSO4的相对分子质量为233,K0sp = 1.1×10-10,把1.0×10-3mol的BaSO4配成10dm3溶液,BaSO4未溶解的质量为()(《无机化学例题与习题》吉大版)A. 0.0021gB.0.021gC.0.21gD. 2.1g11.向Mg(OH)2饱和溶液中加入MgCl2,使Mg2+浓度为0.010mol/L,则该溶液的pH为()(已知Mg(OH)2的K0sp = 5.6×10-12)(《无机化学例题与习题》吉大版)A. 9.1B.9.4C. 8.4D. 4.612.在0.10 mol/LFe2+溶液中通入H2S至饱和(0.10 mol/L),欲使Fe2+不生成FeS沉淀,溶液的pH应是()(已知FeS的K0sp =6.3×10-18;H2S的K0a1·K0a2 = 1.4×10-20) (《无机化学例题与习题》吉大版)A. pH≥2.33B. pH≥3.53C. pH≤3.53D. pH≤2.3313.混合溶液中KCl,KBr,KSCN和K2CrO4浓度均为0.010 mol/L,向溶液中滴加0.010 mol/L AgNO3溶液时,最先和最后沉淀的是()(《无机化学例题与习题》吉大版)A. Ag2CrO4,AgClB. AgSCN ,AgClC. AgBr,Ag2CrO4D. AgCl,Ag2CrO414.下列叙述正确的是()(《无机化学例题与习题》吉大版)A.容度积大的难溶盐,其容度积肯定大B.向含AgCl固体的溶液中加入少量水,溶液达到平衡后,AgCl溶解度不变C.难溶电解质在纯水中溶解达到平衡时,其离子浓度的乘积为该物质的容度积D. AgCl的导电性弱,所以为弱电解质15.下列各对离子的混合溶液中均含有0.30 mol/L HCl,不能用H2S进行分离的是()(已知K0sp:PbS 8.0×10-28,Bi2S3 1.0×10-97,CuS 8.0×10-36,MnS 2.5×10-13,CdS 8.0×10-27,ZnS 2.5×10-22)(《无机化学例题与习题》吉大版)A.Cr3+,Pb2+B.Bi3+,Cu2+C. Mn2+,Cd2+D. Zn2+,Pb2+16.已知在Ca3(PO4)2的饱和溶液中,c (Ca2+)=2.0×10-6 mol•L-1, c (PO43-)=2.0×10-6 mol•L-1,则Ca(PO4)2的KӨSP为( )A.2.0×10-29B.3.2×10-12C.6.3×10-18D.5.1×10-2717.已知KӨsp(CaF2)=1.5×10-10, 在0.2501L mol•L-1的Ca(NO3)2溶液中能溶解CaF2 ( )A. 1.0×10-5gB. 3.8×10-4gC. 2.0×10-5gD. 1.0×10-4g18.已知KӨsp(Ag2SO4)=1.8×10-5, KӨsp(AgCl)=1.8×10-10, KӨsp(BaSO4)=1.8×10-10, 将等体积的0.0020 mol•L-1 Ag2SO4与2.0×10-6 mol•L-1的BaCl2的溶液混合,将会出现( )A. BaSO4沉淀B. AgCl 沉淀C. AgCl和BaSO4沉淀D.无沉淀19.下列有关分步沉淀的叙述中正确的是()A.溶度积小者一定先沉淀出来B.沉淀时所需沉淀试剂浓度小者先沉淀出来C.溶解度小的物质先沉淀出来D.被沉淀离子浓度大的先沉淀20.欲使CaCO3在水溶液中溶解度增大,可以采用的方法是().A.1.0mol•L-1 Na2CO3 B.加入2.0mol•L-1 NaOHC. 0.10mol•L-1CaCl2D.降低溶液的PH值21.向饱和AgCl溶液中加水,下列叙述中正确的是( )A. AgCl的溶解度增大 B .AgCl的溶解度、Ksp均不变C .AgCl的Ksp增大D .AgCl溶解度增大22.已知K(ZnS)=2×10-2 。
分析化学课后答案第8章
分析化学课后答案第8章第八章电位分析法思考题1. 参比电极和指示电极有哪些类型?它们的主要作用是什么?答:参比电极包括标准氢电极(SHE),标准氢电极是最精确的参比电极,是参比电极的一级标准。
实际工作中常用的参比电极是甘汞电极和银-氯化银电极。
参比电极电位恒定,其主要作用是测量电池电动势,计算电极电位的基准。
指示电极包括金属-金属离子电极,金属-金属难溶盐电极,汞电极,惰性金属电极,离子选择性电极。
指示电极能快速而灵敏的对溶液中参与半反应的离子活度或不同氧化态的离子的活度比,产生能斯特响应,主要作用是测定溶液中参与半反应的离子活度。
2. 直接电位法的依据是什么?为什么用此法测定溶液pH时,必须使用标准pH缓冲溶液?答:直接电位法是通过测量电池电动势来确定待测离子活度的方法,其主要依据是E=Φ参比—ΦMn+/M= Φ参比—ΦθMn+/M —lnαMn+式中Φ参比和ΦθMn+/M在温度一定时,都是常数。
由此式可知,待测离子的活度的对数与电池电动势成直线关系,只要测出电池电动势E,就可求得αMn+。
测定溶液的pH时是依据:E = ΦHg2Cl2/Hg —ΦAgCl/Ag— K + 0.059 pH试+ ΦL , 式中ΦHg2Cl2/Hg ,ΦAgCl/Ag ,K ,ΦL在一定的条件下都是常数,将其合并为Kˊ,而Kˊ中包括难以测量和计算的不对称电位和液接电位。
所以在实际测量中使用标准缓冲溶液作为基准,并比较包含待测溶液和包含标准缓冲溶液的两个工作电池的电动势来确定待测溶液的pH值,即:25℃时Es = Ksˊ+ 0.059pHs, Ex = Kxˊ+ 0.059pHx,若测量Es和Ex时的条件保持不变,则Ksˊ= Kxˊ,pHx =pHs+ (Ex -Es)/0.059 ,由此可知,其中标准缓冲溶液的作用是确定Kˊ。
3. 简述pH玻璃电极的作用原理。
答:玻璃电极的主要部分是一个玻璃泡,泡的下半部是对H+ 有选择性响应的玻璃薄膜,泡内装有pH一定的0.1mol·L-1的HCl内参比溶液,其中插入一支Ag-AgCl电极作为内参比电极,这样就构成了玻璃电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2 B )B. S (AB )>S (A 2 B )C. S (AB )=S (A 2 B )D. 不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水 B. 在0.1mol ·L -1 HCl 中 C. 在0.1mol ·L -1 NH 4Cl 中 D. 在0.1mol ·L -1 Mg Cl 2 中 (3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3 C. AgNO 3,KSCN D. AgNO 3,NH 4SCN (4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄 C. 曙红 D. 铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低 B.偏高 C.无影响 D. 正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型 有关,而且还与溶液中相应离子 浓度 有关。
;4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为 1.05×10-5 , 1.1×10-4 。
;三、简答题6.试用溶度积规则解释下列事实解:(1)CaCO3沉淀溶于稀HCl :CaCO3 Ca2++CO32-,在稀HCl中存在H+,能与CO32-结合生成HCO3-和H2CO3,导致平衡向右移动,直到完全溶解。
(2)AgCl沉淀中加入I-,能生成淡黄色的AgI沉淀:AgCl沉淀中加入I-,能生成淡黄色的AgI沉淀,由于AgI的溶解度比AgCl的溶解度小,所以在AgCl沉淀中加入I-,会发生沉淀的转化,AgCl(白色沉淀)+ I- AgI(黄色沉淀)+ Cl-,生成黄色的AgI沉淀。
(3)CuS沉淀不溶于HCl,却溶于HNO3:CuS的溶解度非常小,不溶于强酸,遇到HNO3能溶解是因为HNO3氧化性很强,能将S2-氧化,使CuS溶解,发生的反应如下:3CuS(s)+2NO3-(aq)+ 8H+(aq)=3Cu2+(aq)+2NO(g)+3S(s)+4H2O(l) (4)AgCl沉淀不溶于水,而溶于氨水:AgCl Ag++Cl-,加入氨水后,NH3能与Ag+结合生成配离子Ag(NH3)2+而溶解,总反应如下,AgCl+2 NH3 [Ag(NH3)2]++Cl-。
7.在莫尔法中为何要控制指示剂K2CrO4的浓度?为何溶液的酸度应控制在6.5~10.5?如果在pH=2时滴定Cl-,分析结果会怎样?解:莫尔法中要控制指示剂K2CrO4的浓度:K2CrO4本身显黄色,浓度太高,影响终点的颜色观察,浓度太低会使滴定剂AgNO3过量产生正误差。
溶液的酸度应控制在6.5~10.5:酸性较大,会使CrO42-转化为Cr2O72-,导致指示剂灵敏度下降;碱性太强,Ag+与OH-会生成黑色Ag2O影响分析结果。
如果在pH=2时滴定Cl-,会使滴定剂消耗过量,产生较大的正误差。
8.用银量法测定下列试剂,各应选择何种方法确定终点较为合适(1)BaCl2 解:佛尔哈德法(2)KCl 解:莫尔法(3)NH4Cl 解:佛尔哈德法(4)Na2CO3+NaCl 解:佛尔哈德法(5)NaBr 解:莫尔法四、计算题9.已知25℃时,AgI溶度积为8.5×10-17,求(1)在纯水中;(2)在0.01mol∙L-1KI 溶液中AgI的溶解度。
解:(1)设在纯水中的溶解度为S ,θsp K =( S )2=8.52×10-17,则1917θsp L mol 102.91052.8---⋅⨯=⨯==K S(2)在0.01mol·L -1KI 溶液中AgI 的溶解度为S ′,K sp = S ′·(0.01+ S ′ )=8.52×10-17,则,0.01+ S ′ ≈ 0.01,S ′ = K sp /0.01=8.5×10-15mol ∙L -110.将等体积的0.004 mol ·L -1AgNO 3溶液和0.004 mol ·L -1的K 2CrO 4溶液混合,有无砖红色的Ag 2CrO 4沉淀析出?已知θspK (Ag 2CrO 4)=1.1×10-12。
)CrO Ag (100.82004.02004.0)CrO ()(Ag 42θsp 92θ242θK c c c c Q >⨯=⋅⎪⎭⎫ ⎝⎛=⎥⎦⎤⎢⎣⎡⋅⎥⎦⎤⎢⎣⎡=--+ 有砖红色沉淀析出。
11.1L 溶液中含有4molNH 4Cl 和0.2molNH 3,试计算:(1)溶液的[OH -]和pH ;(2)在此条件下若有Fe(OH)2沉淀析出,溶液中Fe 2+的最低浓度为多少?已知 θsp K (Fe(OH)2)=4.9×10-17。
解:(1)4+θθθθa ab 3θθb 3(NH )4pH p lg 14p (NH )lg 14 4.74lg 7.94(NH )0.2c c c c K K c c c c =-=--=--= 7814w 1009.91010.1100.1)c(H )(---+-⨯==⨯⨯===K OH c (2) )OH ()Fe ()Fe(OH)(222θsp -+⋅=c c K527172θ2θsp θ2109.5)1009.9(1087.4]/)OH ([)Fe(OH)(/)Fe (----+⨯=⨯⨯==c c K c c 12.在0.1mol ·L -1ZnCl 2溶液中通入H 2S 气体至饱和,如果加入盐酸以控制溶液的pH ,试计算开始析出ZnS 沉淀和Zn 2+沉淀完全时溶液的pH 。
已知(ZnS)=2.5×10-22, 2S)=1.3×10-7, (H 2S)=7.1×10-15。
解:ZnS 开始沉淀时S 2-的浓度为2122θsp θ2105.21.0105.21.0)ZnS (/)S (---⨯=⨯==K c c对反应:H 2S2H + + S 2-a 2K K a 1K sp 7.96[]θ2θ22θθa θa /)S H ()/(S /)H (22c c c c c c KK K -+⨯=⋅=[]121157θ2θa θa θ2θ109.1105.2101.7103.11.0/)S (/)S H (/)H (21-----+⨯=⨯⨯⨯⨯⨯=⋅⋅=cc K Kc c c c pH=0.72Zn 2+完全沉淀时S 2-的浓度为175225θsp θ2105.2101105.2101)ZnS (/)S (-----⨯=⨯⨯=⨯=K c c []θ2θ22θθa θa /)S H ()/(S /)H (22c c c c c c KK -+⨯=⋅ []317157θ2θa θa θ2θ109.1105.2101.7103.11.0/)S (/)S H (/)H (21-----+⨯=⨯⨯⨯⨯⨯=⋅⋅=cc K Kc c c cpH=2.7213. 某溶液中含有Ca 2+和Ba 2+,浓度均为0.10mol ·L -1,向溶液中滴加Na 2SO 4溶液,开始出现沉淀时2-4SO 浓度应为多大?当CaSO 4开始沉淀时,溶液中剩下的Ba 2+浓度为多大?能否用此方法分离Ca 2+和Ba 2+?已知 Ksp (BaSO 4)=1.08×10-10,Ksp(CaSO 4)=4.93×10-5。
解:BaSO 4开始沉淀时,溶液中c (SO 42-)为:910θ2θ4θ241008.110.01008.1/)Ba (/)BaSO (/)SO (--+-⨯=⨯===c c c k c c spCaSO 4开始沉淀时,溶液中c (SO 42-)为:945θ2θ4θ241008.11093.410.01093.4/)Ca (/)CaSO (/)SO (---+-⨯>⨯=⨯===c c c k c c sp先沉淀的是BaSO 4,此时c (SO 42-)为1.08×10-9 mol·L -1 当CaSO 4开始沉淀时,溶液中的c (Ba 2+)为:57410θ24θ4θ2100.110.21093.41008.1/)SO (/)BaSO (/)Ba (-----+⨯<⨯=⨯⨯===cc c k c c sp 故可用此法分离Ca 2+和Ba 2+。
14.某溶液中含有Mg 2+离子,其浓度为0.01mol ·L -1,混有少量Fe 3+杂质,欲除去Fe 3+杂质,应如何控制溶液的pH 。
已知 Ksp(Fe(OH)3)=2.8×10-39,(Mg(OH)2)=5.6×10-12。
解:使Fe 3+完全沉淀所需OH -的最低平衡浓度为)OH ()Fe ()Fe(OH)(333θsp -+⋅=c c K35393θ33θsp θ100.11079.2/)Fe ()Fe(OH)(/)OH (--+-⨯⨯==cc K c cc (OH -)=6.5×10-12mol ∙L -1,pH=14 – pOH =2.8 使Mg 2+开始沉淀所需OH -的最低平衡浓度为:θ2θ22θsp /)OH (/)M ()(OH)M (c c c g c g K -+⋅=010.01061.5/)Mg ()Mg(OH)(/)OH (12θ22θsp θ-+-⨯==c c K c cc (OH -)=2.4×10-5mol ∙L -1,pH=14-lg c (OH -)=9.4 应控制pH 在2.8到9.4之间。
15.用Na 2CO 3溶液处理AgI 沉淀,使之转化为Ag 2CO 3沉淀,这一反应的共同平衡常数为多少?如果在1L Na 2CO 3 溶液中要溶解0.01molAgI ,Na 2CO 3的最初浓度应为多少?这种转化能否实现?已知θsp K (AgI)=8.5×10-17,θsp K (Ag 2CO 3)=8.5×10-12。
