盐类的水解实验报告
盐类水解_实验报告

一、实验目的1. 掌握盐类水解的基本原理和规律。
2. 通过实验验证盐类水解的现象,加深对盐类水解的理解。
3. 学会运用PH试纸、PH计和酸碱指示剂进行实验操作。
二、实验原理盐类水解是指盐在水中溶解后,离子与水分子发生反应,生成弱电解质的过程。
盐类水解的实质是破坏了水的电离平衡,促进了水的电离。
盐类水解的程度与盐中弱酸根离子或弱碱阳离子的性质有关,越弱越水解。
三、实验材料与仪器1. 实验材料:NaCl、Na2CO3、NaHCO3、NH4Cl、NH4NO3、Na2SO4、AlCl3、NaOH、Ba(OH)2、酚酞、甲基橙、PH试纸、PH计2. 实验仪器:试管、烧杯、滴管、酒精灯、加热器、石棉网、玻璃棒四、实验步骤1. 分别取一定量的NaCl、Na2CO3、NaHCO3、NH4Cl、NH4NO3、Na2SO4、AlCl3、NaOH、Ba(OH)2等盐类固体,加入适量的蒸馏水,溶解后分别倒入试管中。
2. 向各试管中加入几滴酚酞指示剂,观察溶液颜色变化。
3. 使用PH试纸和PH计分别测定各溶液的PH值。
4. 对比不同盐类溶液的PH值,分析盐类水解对溶液酸碱性的影响。
5. 观察加热后溶液颜色和PH值的变化,验证盐类水解的吸热性质。
五、实验结果与分析1. 实验结果(1)NaCl溶液:无色,PH值约为7,不显酸碱性。
(2)Na2CO3溶液:酚酞指示剂呈红色,PH值约为9,显碱性。
(3)NaHCO3溶液:酚酞指示剂呈红色,PH值约为8,显碱性。
(4)NH4Cl溶液:酚酞指示剂呈无色,PH值约为5,显酸性。
(5)NH4NO3溶液:酚酞指示剂呈无色,PH值约为5,显酸性。
(6)Na2SO4溶液:无色,PH值约为7,不显酸碱性。
(7)AlCl3溶液:酚酞指示剂呈无色,PH值约为4,显酸性。
(8)NaOH溶液:酚酞指示剂呈红色,PH值约为13,显碱性。
(9)Ba(OH)2溶液:酚酞指示剂呈红色,PH值约为13,显碱性。
2. 分析(1)强碱弱酸盐(如Na2CO3、NaHCO3)水解后显碱性,因为水解生成的弱酸根离子与水分子反应,使溶液中OH-浓度增大。
盐类的水解平衡实验报告

一、实验目的1. 理解盐类水解平衡的概念和原理。
2. 观察和分析不同盐类水解平衡的现象。
3. 掌握实验操作方法和数据记录方法。
二、实验原理盐类水解平衡是指盐在水中溶解时,其阳离子或阴离子与水发生反应,生成弱酸或弱碱的过程。
水解平衡常数(Kw)表示水解反应的平衡程度。
根据水解平衡原理,可以分析不同盐类的水解平衡现象,以及影响水解平衡的因素。
三、实验材料1. 实验仪器:烧杯、玻璃棒、滴定管、移液管、电子天平、pH计、酸碱指示剂等。
2. 实验试剂:氯化钠、氢氧化钠、硫酸铵、醋酸钠、硫酸铜等。
四、实验步骤1. 实验一:观察氯化钠溶液的水解平衡现象(1)将少量氯化钠溶解于蒸馏水中,制成一定浓度的溶液。
(2)用pH计测定溶液的pH值。
(3)观察并记录溶液的颜色变化。
2. 实验二:观察氢氧化钠溶液的水解平衡现象(1)将少量氢氧化钠溶解于蒸馏水中,制成一定浓度的溶液。
(2)用pH计测定溶液的pH值。
(3)观察并记录溶液的颜色变化。
3. 实验三:观察硫酸铵溶液的水解平衡现象(1)将少量硫酸铵溶解于蒸馏水中,制成一定浓度的溶液。
(2)用pH计测定溶液的pH值。
(3)观察并记录溶液的颜色变化。
4. 实验四:观察醋酸钠溶液的水解平衡现象(1)将少量醋酸钠溶解于蒸馏水中,制成一定浓度的溶液。
(2)用pH计测定溶液的pH值。
(3)观察并记录溶液的颜色变化。
5. 实验五:观察硫酸铜溶液的水解平衡现象(1)将少量硫酸铜溶解于蒸馏水中,制成一定浓度的溶液。
(2)用pH计测定溶液的pH值。
(3)观察并记录溶液的颜色变化。
五、实验结果与分析1. 实验一:氯化钠溶液的pH值为7,呈中性。
溶液颜色无变化。
2. 实验二:氢氧化钠溶液的pH值大于7,呈碱性。
溶液颜色无变化。
3. 实验三:硫酸铵溶液的pH值小于7,呈酸性。
溶液颜色无变化。
4. 实验四:醋酸钠溶液的pH值大于7,呈碱性。
溶液颜色无变化。
5. 实验五:硫酸铜溶液的pH值小于7,呈酸性。
盐的水解_实验报告

一、实验目的1. 了解盐类水解的概念及其影响因素。
2. 掌握盐类水解实验的基本操作方法。
3. 分析盐类水解产物的酸碱性质。
二、实验原理盐类水解是指盐在水中溶解后,离子与水分子发生反应,生成弱电解质的过程。
盐类水解的程度与盐的组成、酸碱的强弱及温度等因素有关。
1. 弱酸强碱盐的水解:强碱的阳离子与弱酸的阴离子结合生成弱酸强碱盐,在水中水解,产生碱性溶液。
例如:Na2CO3 + H2O ⇌ NaHCO3 + NaOH2. 弱碱强酸盐的水解:强酸的阴离子与弱碱的阳离子结合生成弱碱强酸盐,在水中水解,产生酸性溶液。
例如:NH4Cl + H2O ⇌ NH3·H2O + HCl3. 弱酸弱碱盐的水解:弱酸弱碱盐在水中水解,产生酸性和碱性溶液,水解程度取决于酸碱的强弱。
例如:CH3COONH4 + H2O ⇌ CH3COOH + NH3·H2O三、实验仪器与药品1. 仪器:烧杯、试管、滴管、玻璃棒、PH试纸、酸碱指示剂等。
2. 药品:Na2CO3、NH4Cl、CH3COONH4、NaCl、酚酞、甲基橙等。
四、实验步骤1. 准备实验溶液:(1)配制0.1mol/L Na2CO3溶液;(2)配制0.1mol/L NH4Cl溶液;(3)配制0.1mol/L CH3COONH4溶液;(4)配制0.1mol/L NaCl溶液。
2. 观察溶液酸碱性:(1)取少量Na2CO3溶液,滴加酚酞指示剂,观察溶液颜色变化;(2)取少量NH4Cl溶液,滴加甲基橙指示剂,观察溶液颜色变化;(3)取少量CH3COONH4溶液,滴加酚酞指示剂,观察溶液颜色变化;(4)取少量NaCl溶液,滴加酚酞指示剂和甲基橙指示剂,观察溶液颜色变化。
3. 分析实验结果:(1)Na2CO3溶液呈碱性,说明Na2CO3发生了水解;(2)NH4Cl溶液呈酸性,说明NH4Cl发生了水解;(3)CH3COONH4溶液呈中性,说明CH3COONH4发生了水解,但水解程度较小;(4)NaCl溶液无明显颜色变化,说明NaCl不发生水解。
盐类的水解实验报告
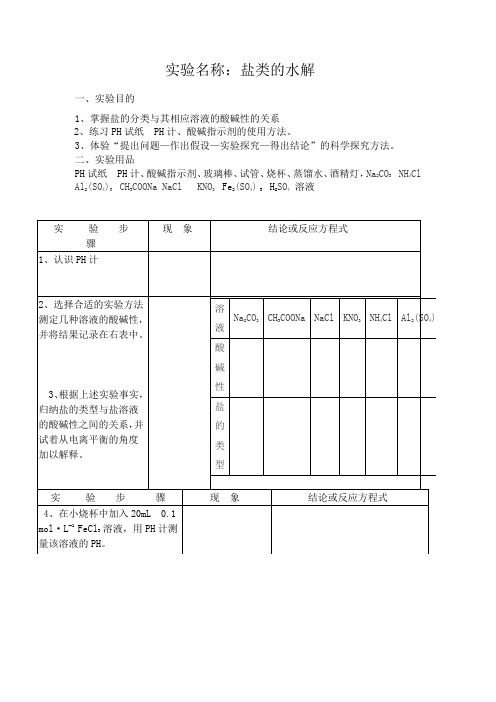
实验名称:盐类的水解
一、实验目的
1、掌握盐的分类与其相应溶液的酸碱性的关系
2、练习PH试纸 PH计、酸碱指示剂的使用方法。
3、体验“提出问题—作出假设—实验探究—得出结论”的科学探究方法。
二、实验用品
PH试纸 PH计、酸碱指示剂、玻璃棒、试管、烧杯、蒸馏水、酒精灯,Na
2CO
3
NH
4
Cl
Al
2(SO
4
)
3
CH
3
COONa NaCl KNO
3
Fe
2
(SO
4
)
3
H
2
SO
4
溶液
三、问题和讨论:
1、教材上选取的六种盐具有代表性,分别代表了强酸强碱盐,强碱弱酸盐,强酸弱碱盐;同时六种盐的酸根和阳离子都是中学阶段常见的,便于学生理解。
2、如果条件允许各种类型的盐可以相应的增加几种,增加实验的可信度,让学生理解信服。
3、切忌用自来水配制溶液,因为自来水显酸性,应该用蒸馏水配制。
化学水解盐实验报告

一、实验目的1. 了解盐类水解的概念和原理。
2. 掌握盐类水解实验的操作步骤。
3. 分析盐类水解对溶液酸碱性的影响。
4. 培养学生的实验操作能力和观察、分析问题的能力。
二、实验原理盐类水解是指盐溶液中的阳离子或阴离子与水分子反应,生成弱酸或弱碱的过程。
根据盐的组成,盐类水解可分为酸式盐水解、碱式盐水解和酸碱盐水解。
在实验中,我们通过观察溶液的颜色变化、pH值变化等现象,来判断盐类是否发生水解。
三、实验仪器和药品1. 仪器:烧杯、试管、滴定管、pH计、玻璃棒、滤纸、滤液漏斗、铁架台(带铁圈)、蒸发皿、酒精灯、坩埚钳、胶头滴管等。
2. 药品:NaCl、Na2CO3、CH3COONa、NH4Cl、NH4NO3、酚酞指示剂、甲基橙指示剂、盐酸、氢氧化钠等。
四、实验步骤1. 酸式盐水解实验(1)取少量NaCl溶液于试管中,滴加酚酞指示剂,观察溶液颜色变化。
(2)滴加盐酸,观察溶液颜色变化。
(3)滴加氢氧化钠,观察溶液颜色变化。
2. 碱式盐水解实验(1)取少量Na2CO3溶液于试管中,滴加酚酞指示剂,观察溶液颜色变化。
(2)滴加稀盐酸,观察溶液颜色变化。
(3)滴加氢氧化钠,观察溶液颜色变化。
3. 酸碱盐水解实验(1)取少量CH3COONa溶液于试管中,滴加酚酞指示剂,观察溶液颜色变化。
(2)滴加稀盐酸,观察溶液颜色变化。
(3)滴加氢氧化钠,观察溶液颜色变化。
4. NH4Cl和NH4NO3水解实验(1)取少量NH4Cl溶液于试管中,滴加酚酞指示剂,观察溶液颜色变化。
(2)滴加稀盐酸,观察溶液颜色变化。
(3)滴加氢氧化钠,观察溶液颜色变化。
五、实验结果与分析1. 酸式盐水解实验NaCl溶液加入酚酞指示剂后,溶液颜色无明显变化;加入盐酸后,溶液颜色无明显变化;加入氢氧化钠后,溶液颜色由无色变为红色,说明NaCl发生水解。
2. 碱式盐水解实验Na2CO3溶液加入酚酞指示剂后,溶液颜色由无色变为红色,说明Na2CO3发生水解;加入稀盐酸后,溶液颜色由红色变为无色,说明Na2CO3水解生成的碱被酸中和;加入氢氧化钠后,溶液颜色无明显变化。
盐的水解实验报告

一、实验目的1. 理解盐类水解的概念和原理。
2. 掌握盐类水解实验的操作步骤。
3. 观察和分析盐类水解的现象,得出实验结论。
二、实验原理盐类水解是指盐在水溶液中与水发生反应,生成弱酸或弱碱的过程。
根据盐的组成,可以分为酸式盐、碱式盐和正盐。
酸式盐水解后溶液呈酸性,碱式盐水解后溶液呈碱性,正盐一般不发生水解。
实验原理:将不同类型的盐溶解于水中,观察溶液的酸碱性变化,从而判断盐是否发生水解。
三、实验仪器与试剂1. 实验仪器:烧杯、玻璃棒、滴定管、pH试纸、蒸馏水、标准碱液。
2. 实验试剂:NaCl(氯化钠)、Na2CO3(碳酸钠)、NH4Cl(氯化铵)、CH3COONa (乙酸钠)、Al2(SO4)3(硫酸铝)。
四、实验步骤1. 取一定量的NaCl溶解于蒸馏水中,配制成0.1mol/L的NaCl溶液。
2. 取一定量的Na2CO3溶解于蒸馏水中,配制成0.1mol/L的Na2CO3溶液。
3. 取一定量的NH4Cl溶解于蒸馏水中,配制成0.1mol/L的NH4Cl溶液。
4. 取一定量的CH3COONa溶解于蒸馏水中,配制成0.1mol/L的CH3COONa溶液。
5. 取一定量的Al2(SO4)3溶解于蒸馏水中,配制成0.1mol/L的Al2(SO4)3溶液。
6. 将上述溶液分别用pH试纸测定其酸碱性。
7. 对pH值较低的溶液,用滴定管滴加标准碱液,直至溶液的pH值达到中性。
8. 观察并记录实验现象。
五、实验结果与分析1. NaCl溶液:pH值为7,呈中性,未发生水解。
2. Na2CO3溶液:pH值为11,呈碱性,发生水解。
3. NH4Cl溶液:pH值为4,呈酸性,发生水解。
4. CH3COONa溶液:pH值为8,呈碱性,发生水解。
5. Al2(SO4)3溶液:pH值为3,呈酸性,发生水解。
根据实验结果,可以得出以下结论:1. 酸式盐(如Na2CO3、NH4Cl)水解后溶液呈碱性,碱式盐(如CH3COONa)水解后溶液呈碱性,正盐(如NaCl)不发生水解。
专科盐类水解实验报告(3篇)

第1篇一、实验目的1. 了解盐类水解的概念和原理。
2. 掌握盐类水解实验的操作步骤和注意事项。
3. 通过实验观察盐类水解现象,验证盐类水解的规律。
4. 提高实验操作技能和数据分析能力。
二、实验原理盐类水解是指盐在水中溶解时,由于盐中的阳离子或阴离子与水分子发生反应,导致溶液中氢离子或氢氧根离子浓度发生变化,从而引起溶液酸碱性的改变。
根据盐的组成,盐类水解可分为以下几种情况:1. 强酸强碱盐:这类盐在水中不发生水解,溶液呈中性。
2. 强酸弱碱盐:这类盐的阳离子与水分子反应,生成弱碱和氢离子,溶液呈酸性。
3. 强碱弱酸盐:这类盐的阴离子与水分子反应,生成弱酸和氢氧根离子,溶液呈碱性。
4. 弱酸弱碱盐:这类盐的阳离子和阴离子都与水分子反应,生成弱酸和弱碱,溶液的酸碱性取决于水解程度。
三、实验材料与仪器1. 实验材料:氯化钠、硫酸铵、碳酸钠、醋酸钠、氢氧化钠、盐酸、酚酞指示剂、PH试纸、烧杯、试管、滴管、酒精灯等。
2. 实验仪器:分析天平、pH计、电子显微镜、电导率仪等。
四、实验步骤1. 分别取氯化钠、硫酸铵、碳酸钠、醋酸钠、氢氧化钠溶液于烧杯中,用PH试纸测定其PH值,记录结果。
2. 分别取少量氯化钠、硫酸铵、碳酸钠、醋酸钠溶液于试管中,加入酚酞指示剂,观察溶液颜色变化。
3. 分别取少量氯化钠、硫酸铵、碳酸钠、醋酸钠溶液于试管中,加入氢氧化钠溶液,观察溶液颜色变化。
4. 分别取少量氯化钠、硫酸铵、碳酸钠、醋酸钠溶液于试管中,加入盐酸,观察溶液颜色变化。
5. 使用pH计测定各溶液的PH值,记录结果。
6. 计算各溶液的离子浓度,分析盐类水解的规律。
五、实验结果与分析1. 实验结果:- 氯化钠溶液:PH值为7,溶液呈中性。
- 硫酸铵溶液:PH值为5,溶液呈酸性。
- 碳酸钠溶液:PH值为11,溶液呈碱性。
- 醋酸钠溶液:PH值为8,溶液呈碱性。
- 氢氧化钠溶液:PH值为14,溶液呈碱性。
2. 分析:- 氯化钠为强酸强碱盐,不发生水解,溶液呈中性。
盐类水解实验报告

盐类水解实验报告1.通过观察和比较不同盐类在水中的溶解情况,了解盐类的溶解性。
2.掌握盐类溶解的影响因素,进一步理解溶液中盐的离子行为。
3.探讨盐类溶解时的热效应对溶液的影响。
实验原理:1.溶解性:溶解性是指一种物质在一定条件下在溶剂中的溶解程度。
盐类的溶解性与其晶体结构、离子电荷、离子半径等因素有关。
对于一些可以与水发生离解反应的盐类,如氯化钠(NaCl)、硝酸钠(NaNO3),由于其离子相对稳定,所以在水中具有较好的溶解性;而对于一些离子间作用较强的盐类,如氯化银(AgCl)、磷酸钙(Ca3(PO4)2),由于其离子间的相互吸引作用较大,所以溶解度较低。
2.热效应:溶解盐类时,常会伴随着吸热或放热反应。
当盐类溶解时吸热反应大于放热反应时,溶解过程会吸热,产生温度降低;而当吸热反应小于放热反应时,溶解过程会放热,产生温度升高。
这是由于溶解盐类时,离子和水分子之间的相互作用导致的。
实验步骤:1.准备:a. 准备所需的盐类,如氯化钠、硝酸钠、氯化银和磷酸钙。
b. 准备蒸馏水和玻璃容器。
c. 准备温度计、热力计和称量器具等实验设备。
2.溶解实验:a. 将一定质量的盐类样品逐渐加入一定体积的蒸馏水中,并轻轻搅拌直至完全溶解。
b. 记录每次加入盐类样品后溶液的外观和温度变化。
c. 重复上述步骤,对于每一种盐类样品都进行溶解实验。
实验结果:1.溶解性:根据实验观察和记录,可以得到不同盐类在水中的溶解性顺序。
以本次实验为例,氯化钠和硝酸钠溶解度较高,可以迅速溶解在水中,而氯化银和磷酸钙溶解度较低,需要较长时间才能完全溶解。
2.热效应:实验中观察到,当溶解盐类时,有些盐会使溶液温度升高,有些盐则会使溶液温度降低。
这是由于不同盐的离子化反应过程中所伴随的吸热或放热反应导致的。
实验讨论:1.溶解性:实验结果展示了不同盐类在水中的溶解性差异,进一步说明了溶解性与盐类离子特性之间的关系。
溶解性的差异主要是由于盐类晶体结构、离子电荷和离子半径等因素的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验名称:盐类的水解
一、实验目的
1、掌握盐的分类与其相应溶液的酸碱性的关系
2、练习PH试纸 PH计、酸碱指示剂的使用方法。
3、体验“提出问题—作出假设—实验探究—得出结论”的科学探究方法。
二、实验用品
PH试纸 PH计、酸碱指示剂、玻璃棒、试管、烧杯、蒸馏水、酒精灯,Na
2CO
3
NH
4
Cl Al
2
(SO
4
)
3
CH
3COONa NaCl KNO
3
Fe
2
(SO
4
)
3
H
2
SO
4
溶液
、
问
题
和
讨
论
:
1、
教材
上选
取的
六种
盐具
有代
表
性,
分别
代表
了强酸强碱盐,强碱弱酸盐,强酸弱碱盐;同时六种盐的酸根和阳离子都是中学阶段常见的,便于学生理解。
2、如果条件允许各种类型的盐可以相应的增加几种,增加实验的可信度,让学生理解信服。
3、切忌用自来水配制溶液,因为自来水显酸性,应该用蒸馏水配制。
