大学化学期末试题
太原理工大学《有机化学》2020-2021学年第一学期期末试卷
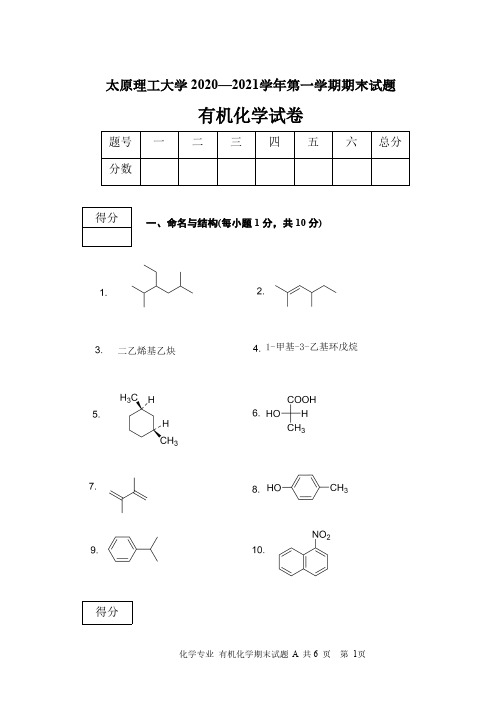
题太原理工大学2020—2021学年第一学期期末试题有机化学试卷号一二三四五六总分分数一、命名与结构(每小题1分,共10分)得分得分二、选择题(每小题2分,共20分)123456789101.烷烃在卤代反应中,不同氢的活性次序是()。
A.3。
H>2。
H>1。
HB.1。
H>2。
H>3。
HC.活性次序相同D.不能卤代2.下列烯烃相对最稳定的是()。
3.下列碳正离子稳定性最大的是()。
4.傅克酰基化反应中,常用的酰基化剂是()。
A卤代烃B烯烃和醇C酰卤D酸酐5.下列化合物中,具有手性碳的是()。
A.CH3CH2CHBrCH3B.(CH3)2CHCHBrCH(CH3)2C.CH3CH2CHBrCH2CH3D.CH3CH2CBr2CH36.下列两个化合物属于()。
A对映体B非对映体C同一化合物D顺反异构体7.含有n个不相同的手性碳,有多少个旋光异构体()。
A2n个B2n-1个C2个D比2n个少8.顺-1-甲基-4-异丙基环己烷的优势构象是()9.进行SN1反应速率最快的是()。
A.2-环戊基-2-溴丁烷B1-环戊基-1-溴丙烷C.2-环戊基-1-溴丁烷D.溴甲基环戊烷10.下列四种自由基,稳定性最强的是()。
得分三、完成下列反应(每空2分,共30分)四、区别下列各组化合物(每小题5分,共15分)1.2-甲基丁烷3-甲基-1-丁烯3-甲基-1-丁炔2.3-溴环己烯氯代环己烷碘代环己烷3.1-丁醇2-丁醇2-甲基-2-丙醇五、简答及合成题(每小题5分,共15分)1.不对称烯烃和卤化氢加成时符合马氏规则,什么是马氏规则?举例说明。
得分得分2.由3.以1-溴丁烷为原料合成戊酸。
六、推测结构(共10分)分子式为C 9H 12,,的芳香烃A,用酸性高锰酸钾氧化后,得到二元酸。
将A 进行硝化,只得到两种一硝基产物。
试推测A 的结构式。
并写出各步反应式。
得分。
大学有机化学期末试题及答案

《有机化学》(上)期末试题一、名词解释(5小题, 每小题2分, 共10分)1.有机物: 。
2.同分异构现象: 。
3.共扼效应: 。
4、亲电试剂: 。
5.自由基: 。
二、命名或写出结构式(10小题, 每小题2分, 共20分)1.CH3CH2 CH2CH(CH2 CH3) CH2 CH2 CH2 CH2CH3。
2. 。
3. 。
4. 。
5.CH3CH(Br)CH2 CH2 CH3 。
6.CH3CH=CHCH2C≡CCH3 。
7、3-甲基己烷。
8、3-甲基-4-乙基-5-丙基壬烷。
9、螺[3·4]辛烷。
10、(Z)-2-丁烯。
三、完成下列反应(10小题, 每小题2.5分, 共25分)1. ()2. ()3、4、5、6、7、()8、9、10、四、推导结构(3小题, 每小题5分, 共15分)1、两个化合物A和B, 分子式都是C7H14, A与KMnO4/H+溶液共热可生成2-甲基丁酸和乙酸, B与Br2/CCl4溶液或KMnO4溶液都不反应, B 分子中含有二级碳原子5子个, 一级和三级碳原子各1个, 试写出A、B 的结构式。
2.化合物甲, 其分子式为C5H10, 能吸收1分子氢, 与KMnO4/H2SO4 作用生成一分子C4酸。
但经臭氧氧化还原水解后得到两个不同的醛, 试推测甲可能的构造式。
这个烯烃有没有顺反异构呢?3.有一炔烃, 分子式为C6H10 , 当它加氢后可生成2-甲基戊烷, 它与硝酸银氨溶液作用生成白色沉淀。
求这一炔烃的构造式。
五、鉴别下列化合物(2小题, 每小题5分, 共10分)1.鉴别丁烯、丁烷、丁炔2.鉴别丁烯、甲基环丙烷、丁烷六、有机合成(2小题, 每小题5分, 共10分)1.由丙烯合成丙醇2.由乙炔合成2-己炔七、反应历程(2小题, 每小题5分, 共10分)1、写出下列反应的历程:CH3CH=CH2+ HBr CH3CH(Br)CH32. 写出下列反应的历程:CH3CH=CH2+ HBr 过氧化物CH3CH2CH2Br《有机化学》(上)期末试题参考答案一、名词解释(5小题, 每小题2分, 共10分)1.有机物: 含有碳元素的化合物。
《大学化学》期末考试试卷附答案

《大学化学》期末考试试卷附答案一、选择题(共15小题,每小题3分,共45分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小D、先增大后减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、 0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等D、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、 NaBrC、 CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、 s区B、d区C、 f区D、 p区7、质量作用定律只适用于()。
A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应D、已进行完的反应8、对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()。
A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是( )。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为()。
A、1B、2C、3D、012、等温等压下且不做非体积功条件下,反应自发进行的判据是()。
A、ΔHΘ<0B、ΔSΘ<0C、ΔG<0D、ΔfHmΘ<013、水具有反常的沸点,是因为分子间存在()。
A、色散力B、诱导力C、取向力D、氢键14、欲配制pH=5.0的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适?()。
吉林大学普通化学期末试题

吉林大学09—10学年第一学期普通化学A 试卷一、每小题只有一个选项符合题意,请将答案的代码填入题末的括号内。
(每小题1分, 共10分)1、干冰升华吸收能量以克服…………………………………..………… ( ) A 、 键能 B 、 取向力 C 、 色散力 D 、 诱导力2、金属表面因氧气分布不均匀而被腐蚀,称为差异充气腐蚀,此时金属溶解处是( )A 、在氧气浓度较大的部位;B 、在氧气浓度较小的部位;C 、在凡有氧气的部位;D 、以上均不正确。
3、下列各组量子数中不合理的是…………………………………………………. ( )A 、2,1,0,+21B 、2,2,0,+21C 、2,0,0, -21D 、1,0,0,+21 4、酸雨是指雨水的pH 小于……………………………………………………………( ) A 、6.5; B 、6.0; C 、5.6; D 、7.05、通常线性非晶态高聚物中,适宜作塑料且加工性能较好的是…………………...( ) A 、T g 值和T f 值均高; B 、T g 值和T f 值均低; C 、T g 值低,T f 值高; D 、T g 值高,T f 值低。
6、AgCl 在下列物质中溶解度最大的是……………………………………………….( )A 、纯水;B 、6 mol·kg –1 NH 3·H 2O ;C 、0.1 mol·kg –1NaCl 溶液;D 、0.1 mol·kg –1BaCl 2溶液。
7、下列物质中 不等于零的是:..………………………………………….( )A 、I 2(g );B 、C (石墨); C 、Fe (s );D 、Cl 2(g )8、稀土金属通常保存在………………………………………………………………( )A 、汽油中;B 、柴油中;C 、煤油中;D 、酒精中。
9、下列离子属于9 ~17电子构型的是……………………………………………….( )A 、Br - ;B 、Sc 3+; C 、Zn 2+; D 、Fe 2+10、下列分子中,偶极矩不为零的是…………………………………………………( )A 、NCl 3;B 、BF 3 ;C 、CCl 4 ;D 、CS 2二、每小题有一个或两个选项符合题意,请将答案的代码填入题末的括号内。
河南理工大学2020年《普通化学》期末试题及答案

一、填空题:(每空1分,共30分)1、一定温度范围内,反应2NO+Cl 2→2NOCl 符合质量作用定律,则反应级数为 ,速率方程为 若其它条件不变,将NO 的浓度增加到原来的2倍,则反应速率为原速率 倍。
2、配合物 [Cr(en)2Br 2] Cl 的名称为 ,配位数为 ;配合物溴化六氨合钴(Ⅲ)的化学式为 。
3、Van der Waals 力可分为 、 和 。
对于大多数分子,三种力中 是主要的作用力。
4、将氧化还原反应2MnO 4- + 16H + + 10Cl - = 2Mn 2+ + 5Cl 2 + 8H 2O 设计成原电池,其中正极发生 反应; 反应式为 ,负极发生 反应。
5、配合物价键理论认为,中心原子与配体间的结合力是 。
6.在 0.1 mol·L -1 HAc 溶液中加入少量 NaAc 固体后,HAc 解离度将______ ___,解离常数_________ (增大、减小或不变)。
7、冬天公路上撒盐以使冰融化,此时的G ∆值符号为 ,S ∆值符号为 。
8、在多电子原子中,轨道的能量是由 和 决定的。
9、 在含有Cl —和CrO 42-的混合溶液中(浓度均为0. 1mol• L -1)逐滴加入Ag +, 先沉淀。
沉淀刚开始析出时,Ag +离子浓度为 。
继续加入Ag +,当另一种离子开始沉淀时,Ag +离子浓度为 ,Cl —离子浓度为 (Ks(AgCl)= 1.77×10-10,Ks(Ag 2CrO 4)= 1.1×10-12)。
10、往HAc 溶液中加入适量的 和 都可配成缓冲溶液。
11、基态原子的电子组态为[Ar]3d 54s 2的元素属于第 周期第 族,原子序号 为 ,元素符号为 。
二、是非题:(每题1分、共10分) 1、催化剂能同时改变反应速率和化学平衡2.当溶液中有几种离子均可与沉淀剂发生沉淀反应时,溶度积小的离子一定先沉淀。
3、酸碱质子理论认为:所谓酸碱反应,实质是两对共轭酸碱对之间的质子转移反应。
大学化学---期末考试题

姓名:专业班级:一、是非题:请在各题括号中,用“√”、“×”分别表示题文中叙述是否正确。
(本大题分10小题,每小题2分,共20分)()1.对不同类型的难溶电解质,不能认为溶度积大的溶解度也一定大。
()2.凡含氢和氧的化合物分子间都有氢键。
()3. 键的极性越强,分子的极性也越强。
()4. φΘ值越大,则电对中氧化型物质的氧化能力越强。
()5. 一般说来,第一电离能越小的金属元素,其金属性越强。
()6. 配合物的K fΘ越大,表明内界和外界结合越牢固。
()7. 磁量子数m=1的原子轨道必定都是p轨道。
()8. 标准状态下,元素稳定单质S mΘ=0。
()9. 系统经一系列变化又回到初态,此过程中系统的一切状态函数的变化量为0。
()10. 知道了化学反应方程式,就知道了化学反应级数。
二、选择题(每题1分,共20分)(1)以下各函数不是状态函数的是:a.H b.W c.S d.G(2)在298K,100kPa下,反应2H2(g)+O2(g)=2H2O(1) Δr H mΘ= -572 kJ·mol-1则H2O(l)的Δf H mΘ为:a.572 kJ·mol-1b.-572 kJ·mol-1c.286 kJ·mol-1d.-286 kJ·mol-1(3)N的氢化物(NH3)的熔点都比它同族中其他氢化物的熔点高得多,这主要由于NH3:a.分子量最小b.取向力最强c.存在氢键d.诱导力强(4)在298K时石墨的标准摩尔生成焓Δf H mΘ为:a.大于零b.小于零c.等于零d.无法确定(5)已知电极反应Cu2++2e = Cu的φΘ为,则电极反应2Cu =2Cu2+ +4e的φΘ值为:a.-b.c.-d.(6)下列物质中,哪个是非极性分子:a.H2O b.CO2c.HCl d.NH3(7)不挥发的溶质溶于水后会引起:a .沸点降低b .熔点升高c .蒸气压升高d .蒸气压下降(8)某化学反应在任何温度下都可以自发进行,需满足的条件:a .Δr H m Θ<0 Δr S m Θ>0b .Δr H m Θ>0 Δr S m Θ<0c .Δr H m Θ<0 Δr S m Θ<0d .Δr H m Θ>0 Δr S m Θ>0 (9)极性共价化合物的实例是:a .KClb .HClc .CCl 4d .BF 3(10)某元素原子基态的电子构型为1s 22s 22p 63s 23p 5,它在周期表中的位置是:a .p 区ⅦA 族b .s 区ⅡA 族c .ds 区ⅡB 族d .p 区Ⅵ族 (11)某温度时,反应)(g NH (g)H 23(g)N 21322=+,K Θ= 5108⨯则在相同温度下,反应2NH 3(g)=N 2(g)+3H 2(g) 的K Θ为:a .5108⨯b .×10-6c .8×105d .(8×105)2 (12)在醋酸溶液中加入固体NaAc 后,醋酸的离解度:a .没变化b .微有上升c .剧烈上升d .下降(13)BaSO 4的K sp Θ=×10-8,把它放在 mol ·L -1 Na 2SO 4溶液中,它的溶解度是: a .不变,因K sp Θ是常数 b .×10-5c .×10-2d .×10-6 (14)以下各组物质具有缓冲作用的是:a .Na 2HPO 4—Na H 2PO 4b .HCl —NaClc .NaOH —NH 3·H 2Od .HAc —HCl (15)当n =2,l 的取值为:a .1,2b .-1,0c .0,1d .2,3(16)φΘ(Cl 2/Cl -)=,φΘ(Cu 2+/Cu)=,反应Cu 2+(aq)+2Cl -(aq )=Cu(s)+Cl 2 (g)的εΘ值是:a .b .c .d .+(17)不合理的一套量子数(n ,l ,m ,m s )是:a .4,0,0,21+b .4,0,-1,21- c .4,3,+3,21- d .4,2,0,21+(18)在下列符号表示的轨道中,其不可能存在的是:a .1sb .3dc .4pd .2f (19)角量子数l 描述核外电子运动状态的:a .电子能量高低;b .电子自旋方向;c .电子云形状;d .电子云的空间伸展方向;(20)某难溶电解质M 2A 的溶解度s=×10-3mol ·L -1,其K sp Θ为:a .×10-5b .×10-9c .×10-6d .×10-9三、填空题(每空1分,共20分)1. 根据阿仑尼乌斯方程,随温度的升高,其速率常数k将();对不同反应(A 1=A2),其活化能越大,速率常数k将()。
大学有机化学期末考试原题试卷(A)

、、
、下列卤代烃与AgNO
、2-甲基氯丁烷
、3-甲基-1-丁烯
、下列物质能发生碘仿反应的是(
、乙酸B、乙醇
7、下列化合物中沸点最高的是(
、CH3CH CH3
、CH3CH OCH2CH3
8、下列各组物质中互为同分异构体的是(
七、推断结构式。
(15分)
1、化合物A分子式为C6H12O,不与托伦试剂或饱和亚硫酸氢钠反应,但能与羟胺反应,A经催化氢化得分子式C6H14O的B。
B与浓硫酸共热得分子式C6H12的C。
C经臭氧氧化再还原水解,生成分子式均为C3H6O的D和E。
D能发生碘仿反应,但不能发生银镜反应;E能发生银镜反应,但不能发生碘仿反应。
试写出A、B、C、D、E的构造式。
(不必写反应式)(9分)
2、某化合物A的分子式为C8H14O,A可迅速使溴水褪色,也能与苯肼反应生成黄色沉淀,但不能发生银镜反应。
A经酸性高锰酸钾氧化生成丙酮及另一化合物B。
B具有酸性,与NaOI反应生成碘仿和丁二酸。
试写出A、B可能的构造式。
(不必写反应式)(6分)试卷︵B ︶
第4页︵共4页︶
河南科技大学教务处。
大连理工大学有机化学期末题

有机化学试题(B 卷)一、 用系统命名法命名或写出结构式(10分)1.OHCH 3COOHCH 3NO 2NO 22H 5N(C 2H 5)2SCH 32.3.5.6.7.48.HOH CH 3C 2H 5(标明R/S)CH 2=CHCH 2CCH 3O(CH 3)3NCH 2CH 2CH 3Cl+-9.10.烯丙基苄基醚乙酸酐二、完成反应式(写出主要产物,每问1分,共22分)<1.+?CH 3CH=CH 2HBr 22Mg ?23?2.CH 3CHCH 3OH?HCN OH -?3.+OHCH 3COCl?4.+??OC H 3HI+5.+??CHO+HCHO+6.?7.稀碱CH CHH 2O24HgSO+??8.++??9.(CH 3CO)2OAlCl 3Zn-Hg +??10.(CH 3)3NCH 2CH 2Cl+??11.CH 3CH 2CH 2COOHNaOH??CH 3COOCH 3n-C 4H 9OH +2OCH 3CH 2COOHBr 2P(1)NaOH/H O 3+?三、判断下列反应是否正确,正确者画“√”,错误者画“×”(4分)(CH 3)3C-Br(CH 3)3C-CNNaCN1.2.CH 3COCH 2CH 2COOCH 34(2)H 3O +CH 3CHCH 2CH 2COOCH 3OH3.CH 3CH 2CHN(CH 3)3CH 3[]OH -+CH 3CH 2CH=CH 2+(CH 3)3N 4.+NaBr+H 2OBrBr O 2NNa 2CO 3, H O 130℃OHBrO 2N( )()()()四、有机物理化性质比较(17分)1、下列化合物亲电取代反应由快到慢的顺序为( )ab cdeCH 3ClNO 2OH《2、下列化合物酸性由强到弱的顺序为( )abcdOH CH 3OHNO 2OHNO 2NO 2NO 2OH3、下列化合物碱性由强到弱的顺序为( )a b c d(C 2H 5)4NOH C 2H 5NH 2NH 2N4、下列化合物亲核加成反应由快到慢的顺序为( )a bcde HCHOCHOCH 3COCH 3CH 3CHOCOCH 35、下列化合物沸点由高到低的顺序为( )CH 3COOHCH 3CONH 2CH 3CH 2OH CH 3CHO a. b. c. d.五、选择题(12分)1、常温下能使稀KMnO 4溶液褪色的化合物是( )/abc d CH 3CH 2CH3CH 3CH=CH 2CH 3CCH2、能溶于NaOH 水溶液的化合物是( )abcdCH 2NO 2ClCOOHCH 2CH 2OH3、能形成分子内氢键的化合物是( )abcdCHO OHOHNO 2OHCH 3OHNO 24、能与饱和NaHSO 3溶液反应生成白色沉淀的化合物有( )abcd COCH 3O CH 3CHOC 2H 5OH5、能与AgNO 3/醇溶液反应生成AgCl 沉淀的化合物有( )abc d CH 2=CHCl CH 3CH=CHCH 2ClClCH 2Cl6、羧酸衍生物水解反应速度最快得是( )(CH 3CONH 2a. b. c. d.CH 3COOC 2H 5CH 3COCl(CH 3CO)2O7、下列醇最容易脱水的是( )a. b. c.CH 3CH-C-CH 3CH 3OHCH 3CH 3CH 2CH 2CH 2OH CH 3CH 2CHCH 3OH六、用简单化学方法鉴别下列各组化合物(8分)1.a b c CH 3CH 2CH 2CH 2OHCH 3CHCH 2CH 3(CH 3)3COH OH2.a b c d CH 3CH 2CH 2CH 2CHO CH 3CH 2COCH 2CH 3CH 3CH 2CH 2COCH 3CH 3CH 2CH 2CH 2CH 2OH3.NH 2NHCH 3N(CH 3)2a.b.c.七、推断结构(10分)1、某化合物A (C 14H 12O 3N 2),不溶于水和稀酸或稀碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、判断题(每题0.5分,共5分)(在题后括号内正确的打√,错误的打×)
1. 内能、焓和热都是状态函数。
( f )
2. 缓冲比固定,缓冲对浓度越大,缓冲溶液的pH值越大( f )
3. 固体硝酸盐在高温下均是强氧化剂。
(t )
4.对于Fe原子,其轨道的能量只与主量子数有关。
( f )
5.非极性分子与极性分子间不可能存在氢键。
( t )
6.在冰晶石Na3[AlF6]配合物中,配体为F原子。
( f )
7.由非极性共价键形成的分子一定具有非极性。
( t )
8. 全由共价键结合的物质均形成分子晶体。
( f )
9. 极性分子与极性分子间只存在诱导力和取向力。
( f )
10. 同一金属元素高价态的氯化物比低价态的溶沸点低。
( t )
二、选择题(每题1分,共15分,请将答案填在表格中)
1、决定镁原子轨道能级的量子数是 b 。
A、n
B、n, l
C、n, l, m
D、n, l, m, m S
2、下列各组量子数中合理的是 d 。
A、n=1 l=1 m=0
B、n=2 l=0 m=1
C、n=2 l=2 m=2
D、n=4 l=3 m= -2
3、在密闭容器中,盛有二氧化氮气体,在等温下建立下列平衡:
2NO2(红棕色)=N2O4(无色);ΔH < 0。
若降低温度,则颜色将 b 。
A、变深
B、变浅
C、不变
D、不一定
4、下列分子中分子偶极矩为零的是 a 。
A、BeCl2
B、SiHCl3
C、PH3
D、H2O
5、下列含氢化合物中存在氢键的是 d 。
A、HCl
B、N2
C、CH4
D、硝酸
6、下列各组作用力中都不具有方向性的是a 。
A.离子键、金属键
B.氢键、金属键
C.共价键、氢键
D.共价键、离子键
7、下列硝酸盐中热分解产物有金属单质的是 c 。
A 、KNO 3
B 、Mg(NO 3)2
C 、AgNO 3
D 、Cu(NO 3)2
8、氧化数为+3的铬在碱性溶液中的主要存在形式为 c 。
A 、Cr 2O 72-
B 、CrO 42-
C 、CrO 2-
D 、Cr 3+
9、下列配离子中为平面四边形结构的有 a 。
A 、[Ni(CN)4]2-(μm =0)
B 、[Cu(NH 3)2]+
C 、[Co(CN)6]3- (μm =0)
D 、[Zn(H 2O)4]2+
10、下列物质中热稳定性最好的为 d 。
A 、MgCO 3
B 、Mg(HCO 3)2
C 、H 2CO 3
D 、SrCO 3
11、当n=3时,l 可取 c 。
A 、1,2
B 、3,2,1
C 、2,1,0
D 、2,1,-1
12、下列氯化物中水解度最大的是 c 。
A 、NaCl
B 、FeCl 2
C 、FeCl 3
D 、BCl 3
13、下列物质中,酸性最强的是 b 。
A 、H 3AsO 3
B 、HClO 4
C 、H 3PO 4
D 、H 3AsO 4
14、反应CH 3OH(l) + NH 3(g) = CH 3NH 2(g) + H 2O(g) 在标准条件下,某温度时,
自发向右进行,若反应的θrH ∆=171-⋅mol kJ ,θrG ∆=171-⋅mol kJ ,则关于该反应表述正确的是 d 。
A. 0>∆θrH
,0<∆θrG ; B. 0<∆θrH ,0>∆θrG ; C. 0>∆θrH ,0>∆θrG ; D. 0<∆θrH ,0<∆θrG 。
15、根据ϕθ(Fe 3+/Fe 2+)=0.77 V ,ϕθ(Fe 2+/Fe)= -0.44 V , ϕθ(Cu 2+/Cu)=0.34 V ,判断
下列不能共存的物质是 b 。
A 、Cu 2+和Fe 2+
B 、Fe 3+和Cu
C 、Fe 3+和Cu 2+
D 、Fe 2+和Cu
三、填空题:(每空1分,共30分)
1、某元素的价层电子构型为3d 14s 2,该元素属于 周期 族 区,这三个电子的四个量子数分别为 、 、
2、Fe 3+离子的核外电子分布式为 ,配离子[FeF 6]3-磁矩为5.9 B.M.,
[Fe(CN)6]3-磁矩为2.0 B.M.,中心离子采用的杂化轨道,前者为 ,后者为 ,两者的空间构型为 ,下列反应的方向:
[FeF 6]3- + 6CN - [Fe(CN)6]3- + 6F -
3、配合物K[Co(NH3)2(H2O)BrCl2]的名称是,外界是,内界是,配位体是,配位原子是,配位数是,中心离子是,配离子的电荷是。
4、某反应在恒温下∆H>0,∆S>0,则反应自发进行的条件是。
5、标准状态下,将反应Br2 + Fe2+ = 2Br-+ Fe3+ 组成原电池,
φθ(Br2/Br–)=1.07 V,φθ(Fe3+/Fe2+)=0.77 V。
原电池符号为
6、原子轨道以头碰头的方式重叠形成键,以肩并肩的方式重叠形成键。
7、用热力学函数符号表示下列状态的热力学特征。
恒温恒压条件下,放热反应的小于零;标准状态,298K时,稳定单质的和等于零;自发进行的反应的小于零。
8、在相同浓度的Cl-和CrO42-的混合溶液中,逐滴加入稀AgNO3溶液,先生成
沉淀,后生成沉淀。
这种现象叫做。
(已知:K SP (AgCl) =1.80×10-10,K SP (Ag2CrO4)=1.12×10-12)
四、完成并配平下列反应方程(每题2分,共10分)。
1.SnCl2 + H2O →碱式氯化锡+氯化氢
2.Cr3+ + OH-(过量)+ H2O2→铬酸根+水
3.Cr2O72- + Ba2+→前面加水生成铬酸钡+氢离子
4.H2O2 + MnO4- + H+→二价锰离子+水+氧气
5.NO2- + H+ + Fe2+→一氧化氮+三价铁离子+水
五、简答题(共20分)
1、试判断下列化合物的熔点高低顺序,并作简单说明。
(6分)
NaCl、MgCl2、AlCl3、SiCl4
离子的半径减小,极化能力增强使离子键向共价键过渡熔点降低
2.Fe3+离子的外层电子结构为3s23p63d5,已知[Fe(CN)6]3-的磁距为1.7 B.M,[FeF6]3-的磁距为5.9 B.M,试用配合物价键理论解释原因,并说明二者构型,
比较二者的稳定性。
(7分)
3.试用杂化轨道理论解释SiF4的空间构型为正四面体型。
(7分)
六、计算题(共20分)
1.在298 K时,计算AgCl分别在纯水、0.1 mol·dm-3 AgNO3溶液、0.1 mol·dm-3 Na2S2O3溶液中的溶解度(以mol·dm-3表示)。
(6分)
(已知:Kθ稳,[Ag(S2O3)2]3-=2.9×1013,Kθsp(AgCl)=1.6×10-10)
2、已知298K 时Φθ(MnO4-/Mn2+)=1.51V,Φθ(Fe3+/Fe2+)= +0.77V,
F=96485C ·mol-1,若将此两电对组成电池:
(1)请写出标准状态下原电池符号;
(2)当pH=2,其它离子均处于标准态时的电池电动势E为多少?
(3)计算电池反应在298K 时Δr Gθ和Kθ。
(8分)
3、在50cm3 0.1mol⋅dm-3的K[Ag(CN)2]溶液中加入等体积的0.1mol⋅dm-3KI的溶液,计算说明有无沉淀生成。
(6分)。
