大学化学期末试题
太原理工大学《有机化学》2020-2021学年第一学期期末试卷
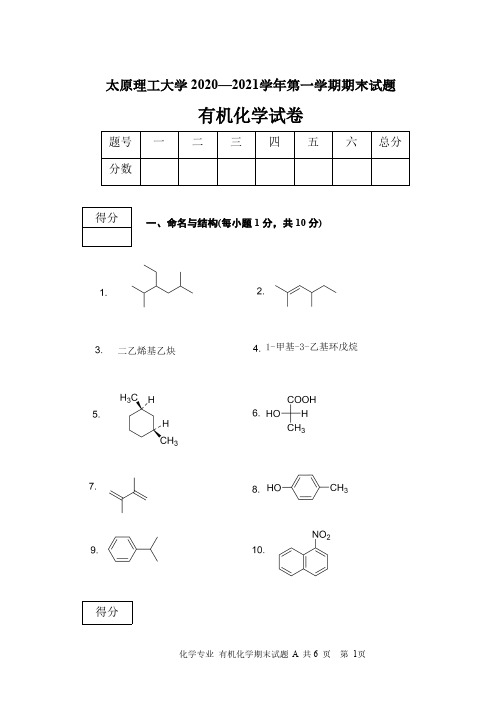
题太原理工大学2020—2021学年第一学期期末试题有机化学试卷号一二三四五六总分分数一、命名与结构(每小题1分,共10分)得分得分二、选择题(每小题2分,共20分)123456789101.烷烃在卤代反应中,不同氢的活性次序是()。
A.3。
H>2。
H>1。
HB.1。
H>2。
H>3。
HC.活性次序相同D.不能卤代2.下列烯烃相对最稳定的是()。
3.下列碳正离子稳定性最大的是()。
4.傅克酰基化反应中,常用的酰基化剂是()。
A卤代烃B烯烃和醇C酰卤D酸酐5.下列化合物中,具有手性碳的是()。
A.CH3CH2CHBrCH3B.(CH3)2CHCHBrCH(CH3)2C.CH3CH2CHBrCH2CH3D.CH3CH2CBr2CH36.下列两个化合物属于()。
A对映体B非对映体C同一化合物D顺反异构体7.含有n个不相同的手性碳,有多少个旋光异构体()。
A2n个B2n-1个C2个D比2n个少8.顺-1-甲基-4-异丙基环己烷的优势构象是()9.进行SN1反应速率最快的是()。
A.2-环戊基-2-溴丁烷B1-环戊基-1-溴丙烷C.2-环戊基-1-溴丁烷D.溴甲基环戊烷10.下列四种自由基,稳定性最强的是()。
得分三、完成下列反应(每空2分,共30分)四、区别下列各组化合物(每小题5分,共15分)1.2-甲基丁烷3-甲基-1-丁烯3-甲基-1-丁炔2.3-溴环己烯氯代环己烷碘代环己烷3.1-丁醇2-丁醇2-甲基-2-丙醇五、简答及合成题(每小题5分,共15分)1.不对称烯烃和卤化氢加成时符合马氏规则,什么是马氏规则?举例说明。
得分得分2.由3.以1-溴丁烷为原料合成戊酸。
六、推测结构(共10分)分子式为C 9H 12,,的芳香烃A,用酸性高锰酸钾氧化后,得到二元酸。
将A 进行硝化,只得到两种一硝基产物。
试推测A 的结构式。
并写出各步反应式。
得分。
大学有机化学期末试题及答案

《有机化学》(上)期末试题一、名词解释(5小题, 每小题2分, 共10分)1.有机物: 。
2.同分异构现象: 。
3.共扼效应: 。
4、亲电试剂: 。
5.自由基: 。
二、命名或写出结构式(10小题, 每小题2分, 共20分)1.CH3CH2 CH2CH(CH2 CH3) CH2 CH2 CH2 CH2CH3。
2. 。
3. 。
4. 。
5.CH3CH(Br)CH2 CH2 CH3 。
6.CH3CH=CHCH2C≡CCH3 。
7、3-甲基己烷。
8、3-甲基-4-乙基-5-丙基壬烷。
9、螺[3·4]辛烷。
10、(Z)-2-丁烯。
三、完成下列反应(10小题, 每小题2.5分, 共25分)1. ()2. ()3、4、5、6、7、()8、9、10、四、推导结构(3小题, 每小题5分, 共15分)1、两个化合物A和B, 分子式都是C7H14, A与KMnO4/H+溶液共热可生成2-甲基丁酸和乙酸, B与Br2/CCl4溶液或KMnO4溶液都不反应, B 分子中含有二级碳原子5子个, 一级和三级碳原子各1个, 试写出A、B 的结构式。
2.化合物甲, 其分子式为C5H10, 能吸收1分子氢, 与KMnO4/H2SO4 作用生成一分子C4酸。
但经臭氧氧化还原水解后得到两个不同的醛, 试推测甲可能的构造式。
这个烯烃有没有顺反异构呢?3.有一炔烃, 分子式为C6H10 , 当它加氢后可生成2-甲基戊烷, 它与硝酸银氨溶液作用生成白色沉淀。
求这一炔烃的构造式。
五、鉴别下列化合物(2小题, 每小题5分, 共10分)1.鉴别丁烯、丁烷、丁炔2.鉴别丁烯、甲基环丙烷、丁烷六、有机合成(2小题, 每小题5分, 共10分)1.由丙烯合成丙醇2.由乙炔合成2-己炔七、反应历程(2小题, 每小题5分, 共10分)1、写出下列反应的历程:CH3CH=CH2+ HBr CH3CH(Br)CH32. 写出下列反应的历程:CH3CH=CH2+ HBr 过氧化物CH3CH2CH2Br《有机化学》(上)期末试题参考答案一、名词解释(5小题, 每小题2分, 共10分)1.有机物: 含有碳元素的化合物。
《大学化学》期末考试试卷附答案

《大学化学》期末考试试卷附答案一、选择题(共15小题,每小题3分,共45分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小D、先增大后减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、 0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等D、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、 NaBrC、 CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、 s区B、d区C、 f区D、 p区7、质量作用定律只适用于()。
A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应D、已进行完的反应8、对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()。
A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是( )。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为()。
A、1B、2C、3D、012、等温等压下且不做非体积功条件下,反应自发进行的判据是()。
A、ΔHΘ<0B、ΔSΘ<0C、ΔG<0D、ΔfHmΘ<013、水具有反常的沸点,是因为分子间存在()。
A、色散力B、诱导力C、取向力D、氢键14、欲配制pH=5.0的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适?()。
吉林大学普通化学期末试题

吉林大学09—10学年第一学期普通化学A 试卷一、每小题只有一个选项符合题意,请将答案的代码填入题末的括号内。
(每小题1分, 共10分)1、干冰升华吸收能量以克服…………………………………..………… ( ) A 、 键能 B 、 取向力 C 、 色散力 D 、 诱导力2、金属表面因氧气分布不均匀而被腐蚀,称为差异充气腐蚀,此时金属溶解处是( )A 、在氧气浓度较大的部位;B 、在氧气浓度较小的部位;C 、在凡有氧气的部位;D 、以上均不正确。
3、下列各组量子数中不合理的是…………………………………………………. ( )A 、2,1,0,+21B 、2,2,0,+21C 、2,0,0, -21D 、1,0,0,+21 4、酸雨是指雨水的pH 小于……………………………………………………………( ) A 、6.5; B 、6.0; C 、5.6; D 、7.05、通常线性非晶态高聚物中,适宜作塑料且加工性能较好的是…………………...( ) A 、T g 值和T f 值均高; B 、T g 值和T f 值均低; C 、T g 值低,T f 值高; D 、T g 值高,T f 值低。
6、AgCl 在下列物质中溶解度最大的是……………………………………………….( )A 、纯水;B 、6 mol·kg –1 NH 3·H 2O ;C 、0.1 mol·kg –1NaCl 溶液;D 、0.1 mol·kg –1BaCl 2溶液。
7、下列物质中 不等于零的是:..………………………………………….( )A 、I 2(g );B 、C (石墨); C 、Fe (s );D 、Cl 2(g )8、稀土金属通常保存在………………………………………………………………( )A 、汽油中;B 、柴油中;C 、煤油中;D 、酒精中。
9、下列离子属于9 ~17电子构型的是……………………………………………….( )A 、Br - ;B 、Sc 3+; C 、Zn 2+; D 、Fe 2+10、下列分子中,偶极矩不为零的是…………………………………………………( )A 、NCl 3;B 、BF 3 ;C 、CCl 4 ;D 、CS 2二、每小题有一个或两个选项符合题意,请将答案的代码填入题末的括号内。
河南理工大学2020年《普通化学》期末试题及答案

一、填空题:(每空1分,共30分)1、一定温度范围内,反应2NO+Cl 2→2NOCl 符合质量作用定律,则反应级数为 ,速率方程为 若其它条件不变,将NO 的浓度增加到原来的2倍,则反应速率为原速率 倍。
2、配合物 [Cr(en)2Br 2] Cl 的名称为 ,配位数为 ;配合物溴化六氨合钴(Ⅲ)的化学式为 。
3、Van der Waals 力可分为 、 和 。
对于大多数分子,三种力中 是主要的作用力。
4、将氧化还原反应2MnO 4- + 16H + + 10Cl - = 2Mn 2+ + 5Cl 2 + 8H 2O 设计成原电池,其中正极发生 反应; 反应式为 ,负极发生 反应。
5、配合物价键理论认为,中心原子与配体间的结合力是 。
6.在 0.1 mol·L -1 HAc 溶液中加入少量 NaAc 固体后,HAc 解离度将______ ___,解离常数_________ (增大、减小或不变)。
7、冬天公路上撒盐以使冰融化,此时的G ∆值符号为 ,S ∆值符号为 。
8、在多电子原子中,轨道的能量是由 和 决定的。
9、 在含有Cl —和CrO 42-的混合溶液中(浓度均为0. 1mol• L -1)逐滴加入Ag +, 先沉淀。
沉淀刚开始析出时,Ag +离子浓度为 。
继续加入Ag +,当另一种离子开始沉淀时,Ag +离子浓度为 ,Cl —离子浓度为 (Ks(AgCl)= 1.77×10-10,Ks(Ag 2CrO 4)= 1.1×10-12)。
10、往HAc 溶液中加入适量的 和 都可配成缓冲溶液。
11、基态原子的电子组态为[Ar]3d 54s 2的元素属于第 周期第 族,原子序号 为 ,元素符号为 。
二、是非题:(每题1分、共10分) 1、催化剂能同时改变反应速率和化学平衡2.当溶液中有几种离子均可与沉淀剂发生沉淀反应时,溶度积小的离子一定先沉淀。
3、酸碱质子理论认为:所谓酸碱反应,实质是两对共轭酸碱对之间的质子转移反应。
大学化学---期末考试题

姓名:专业班级:一、是非题:请在各题括号中,用“√”、“×”分别表示题文中叙述是否正确。
(本大题分10小题,每小题2分,共20分)()1.对不同类型的难溶电解质,不能认为溶度积大的溶解度也一定大。
()2.凡含氢和氧的化合物分子间都有氢键。
()3. 键的极性越强,分子的极性也越强。
()4. φΘ值越大,则电对中氧化型物质的氧化能力越强。
()5. 一般说来,第一电离能越小的金属元素,其金属性越强。
()6. 配合物的K fΘ越大,表明内界和外界结合越牢固。
()7. 磁量子数m=1的原子轨道必定都是p轨道。
()8. 标准状态下,元素稳定单质S mΘ=0。
()9. 系统经一系列变化又回到初态,此过程中系统的一切状态函数的变化量为0。
()10. 知道了化学反应方程式,就知道了化学反应级数。
二、选择题(每题1分,共20分)(1)以下各函数不是状态函数的是:a.H b.W c.S d.G(2)在298K,100kPa下,反应2H2(g)+O2(g)=2H2O(1) Δr H mΘ= -572 kJ·mol-1则H2O(l)的Δf H mΘ为:a.572 kJ·mol-1b.-572 kJ·mol-1c.286 kJ·mol-1d.-286 kJ·mol-1(3)N的氢化物(NH3)的熔点都比它同族中其他氢化物的熔点高得多,这主要由于NH3:a.分子量最小b.取向力最强c.存在氢键d.诱导力强(4)在298K时石墨的标准摩尔生成焓Δf H mΘ为:a.大于零b.小于零c.等于零d.无法确定(5)已知电极反应Cu2++2e = Cu的φΘ为,则电极反应2Cu =2Cu2+ +4e的φΘ值为:a.-b.c.-d.(6)下列物质中,哪个是非极性分子:a.H2O b.CO2c.HCl d.NH3(7)不挥发的溶质溶于水后会引起:a .沸点降低b .熔点升高c .蒸气压升高d .蒸气压下降(8)某化学反应在任何温度下都可以自发进行,需满足的条件:a .Δr H m Θ<0 Δr S m Θ>0b .Δr H m Θ>0 Δr S m Θ<0c .Δr H m Θ<0 Δr S m Θ<0d .Δr H m Θ>0 Δr S m Θ>0 (9)极性共价化合物的实例是:a .KClb .HClc .CCl 4d .BF 3(10)某元素原子基态的电子构型为1s 22s 22p 63s 23p 5,它在周期表中的位置是:a .p 区ⅦA 族b .s 区ⅡA 族c .ds 区ⅡB 族d .p 区Ⅵ族 (11)某温度时,反应)(g NH (g)H 23(g)N 21322=+,K Θ= 5108⨯则在相同温度下,反应2NH 3(g)=N 2(g)+3H 2(g) 的K Θ为:a .5108⨯b .×10-6c .8×105d .(8×105)2 (12)在醋酸溶液中加入固体NaAc 后,醋酸的离解度:a .没变化b .微有上升c .剧烈上升d .下降(13)BaSO 4的K sp Θ=×10-8,把它放在 mol ·L -1 Na 2SO 4溶液中,它的溶解度是: a .不变,因K sp Θ是常数 b .×10-5c .×10-2d .×10-6 (14)以下各组物质具有缓冲作用的是:a .Na 2HPO 4—Na H 2PO 4b .HCl —NaClc .NaOH —NH 3·H 2Od .HAc —HCl (15)当n =2,l 的取值为:a .1,2b .-1,0c .0,1d .2,3(16)φΘ(Cl 2/Cl -)=,φΘ(Cu 2+/Cu)=,反应Cu 2+(aq)+2Cl -(aq )=Cu(s)+Cl 2 (g)的εΘ值是:a .b .c .d .+(17)不合理的一套量子数(n ,l ,m ,m s )是:a .4,0,0,21+b .4,0,-1,21- c .4,3,+3,21- d .4,2,0,21+(18)在下列符号表示的轨道中,其不可能存在的是:a .1sb .3dc .4pd .2f (19)角量子数l 描述核外电子运动状态的:a .电子能量高低;b .电子自旋方向;c .电子云形状;d .电子云的空间伸展方向;(20)某难溶电解质M 2A 的溶解度s=×10-3mol ·L -1,其K sp Θ为:a .×10-5b .×10-9c .×10-6d .×10-9三、填空题(每空1分,共20分)1. 根据阿仑尼乌斯方程,随温度的升高,其速率常数k将();对不同反应(A 1=A2),其活化能越大,速率常数k将()。
大学有机化学期末考试原题试卷(A)

、、
、下列卤代烃与AgNO
、2-甲基氯丁烷
、3-甲基-1-丁烯
、下列物质能发生碘仿反应的是(
、乙酸B、乙醇
7、下列化合物中沸点最高的是(
、CH3CH CH3
、CH3CH OCH2CH3
8、下列各组物质中互为同分异构体的是(
七、推断结构式。
(15分)
1、化合物A分子式为C6H12O,不与托伦试剂或饱和亚硫酸氢钠反应,但能与羟胺反应,A经催化氢化得分子式C6H14O的B。
B与浓硫酸共热得分子式C6H12的C。
C经臭氧氧化再还原水解,生成分子式均为C3H6O的D和E。
D能发生碘仿反应,但不能发生银镜反应;E能发生银镜反应,但不能发生碘仿反应。
试写出A、B、C、D、E的构造式。
(不必写反应式)(9分)
2、某化合物A的分子式为C8H14O,A可迅速使溴水褪色,也能与苯肼反应生成黄色沉淀,但不能发生银镜反应。
A经酸性高锰酸钾氧化生成丙酮及另一化合物B。
B具有酸性,与NaOI反应生成碘仿和丁二酸。
试写出A、B可能的构造式。
(不必写反应式)(6分)试卷︵B ︶
第4页︵共4页︶
河南科技大学教务处。
大连理工大学有机化学期末题

有机化学试题(B 卷)一、 用系统命名法命名或写出结构式(10分)1.OHCH 3COOHCH 3NO 2NO 22H 5N(C 2H 5)2SCH 32.3.5.6.7.48.HOH CH 3C 2H 5(标明R/S)CH 2=CHCH 2CCH 3O(CH 3)3NCH 2CH 2CH 3Cl+-9.10.烯丙基苄基醚乙酸酐二、完成反应式(写出主要产物,每问1分,共22分)<1.+?CH 3CH=CH 2HBr 22Mg ?23?2.CH 3CHCH 3OH?HCN OH -?3.+OHCH 3COCl?4.+??OC H 3HI+5.+??CHO+HCHO+6.?7.稀碱CH CHH 2O24HgSO+??8.++??9.(CH 3CO)2OAlCl 3Zn-Hg +??10.(CH 3)3NCH 2CH 2Cl+??11.CH 3CH 2CH 2COOHNaOH??CH 3COOCH 3n-C 4H 9OH +2OCH 3CH 2COOHBr 2P(1)NaOH/H O 3+?三、判断下列反应是否正确,正确者画“√”,错误者画“×”(4分)(CH 3)3C-Br(CH 3)3C-CNNaCN1.2.CH 3COCH 2CH 2COOCH 34(2)H 3O +CH 3CHCH 2CH 2COOCH 3OH3.CH 3CH 2CHN(CH 3)3CH 3[]OH -+CH 3CH 2CH=CH 2+(CH 3)3N 4.+NaBr+H 2OBrBr O 2NNa 2CO 3, H O 130℃OHBrO 2N( )()()()四、有机物理化性质比较(17分)1、下列化合物亲电取代反应由快到慢的顺序为( )ab cdeCH 3ClNO 2OH《2、下列化合物酸性由强到弱的顺序为( )abcdOH CH 3OHNO 2OHNO 2NO 2NO 2OH3、下列化合物碱性由强到弱的顺序为( )a b c d(C 2H 5)4NOH C 2H 5NH 2NH 2N4、下列化合物亲核加成反应由快到慢的顺序为( )a bcde HCHOCHOCH 3COCH 3CH 3CHOCOCH 35、下列化合物沸点由高到低的顺序为( )CH 3COOHCH 3CONH 2CH 3CH 2OH CH 3CHO a. b. c. d.五、选择题(12分)1、常温下能使稀KMnO 4溶液褪色的化合物是( )/abc d CH 3CH 2CH3CH 3CH=CH 2CH 3CCH2、能溶于NaOH 水溶液的化合物是( )abcdCH 2NO 2ClCOOHCH 2CH 2OH3、能形成分子内氢键的化合物是( )abcdCHO OHOHNO 2OHCH 3OHNO 24、能与饱和NaHSO 3溶液反应生成白色沉淀的化合物有( )abcd COCH 3O CH 3CHOC 2H 5OH5、能与AgNO 3/醇溶液反应生成AgCl 沉淀的化合物有( )abc d CH 2=CHCl CH 3CH=CHCH 2ClClCH 2Cl6、羧酸衍生物水解反应速度最快得是( )(CH 3CONH 2a. b. c. d.CH 3COOC 2H 5CH 3COCl(CH 3CO)2O7、下列醇最容易脱水的是( )a. b. c.CH 3CH-C-CH 3CH 3OHCH 3CH 3CH 2CH 2CH 2OH CH 3CH 2CHCH 3OH六、用简单化学方法鉴别下列各组化合物(8分)1.a b c CH 3CH 2CH 2CH 2OHCH 3CHCH 2CH 3(CH 3)3COH OH2.a b c d CH 3CH 2CH 2CH 2CHO CH 3CH 2COCH 2CH 3CH 3CH 2CH 2COCH 3CH 3CH 2CH 2CH 2CH 2OH3.NH 2NHCH 3N(CH 3)2a.b.c.七、推断结构(10分)1、某化合物A (C 14H 12O 3N 2),不溶于水和稀酸或稀碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学化学期末试卷加答案学院________ 姓名_________ 学号_________闭卷考试时间:120分钟一、选择题<每小题1.5分,共24分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将<)。
A、增大B、不变C、减小2、当主量子数n=3时,则角量子数l的取值为<)。
A、1、2、B、 0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g>+O2(g>=2NO2(g>达到平衡,是因为<)。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等4、下列化合物晶体中,既存在离子键又存在共价键的是<)。
A、H2OB、 NaBrC、 CH3OHD、Na2O25、蔗糖的凝固点为<)。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为<)。
A、 s区B、d区C、 f区D、 p区7、质量作用定律只适用于<)A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应8、对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于<)。
b5E2RGbCAPA、1B、6C、3D、129、下列物质中熔点最高的是<)A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是( >。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为<)。
A、1B、2C、3D、012、等温等压下且不做非体积功条件下,反应自发进行的判据是A、ΔHΘ<0B、ΔSΘ<0C、ΔG<0D、ΔfHmΘ<013、水具有反常的沸点,是因为分子间存在<)。
A、色散力B、诱导力C、取向力D、氢键14、欲配制pH=5.0的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适?<)A、HF (pKa=3.45>B、CH3COOH (pKa=4.75>C、NH3·H2O (pKb=4.75>D、HCN(pKa=9.31>15、对于下列基元反应:A + 2B = C,其速率常数为k,若某个时刻(时间以s 计>,A的浓度为2mol/L,B的浓度为3mol/L,则反应速率v=<)。
p1EanqFDPwA、6k mol·L-1 ·s-1B、12k mol·L-1 ·s-1C、18k mol·L-1 ·s-1D、36k mol·L-1 ·s-116、在温度T的标准状态下,若已知反应A→2B的标准摩尔反应焓△rHΘm,1,与反应2A→C的标准摩尔反应焓△rHΘm,2,则反应C→4B的标准摩尔反应焓△rHΘm,3与△rHΘm,1及△rHΘm,2的关系为△rHΘm,3=<)。
DXDiTa9E3dA、2△rHΘm,1+△rHΘm,2B、△rHΘm,1-2△rHΘm,2C、△rHΘm,1+△rHΘm,2D、2△rHΘm,1-△rHΘm,2二、填空题<21分)1、原电池 (->Pt |Fe2+(C1>,Fe3+(C2>|| Fe2+(C3>,Fe3+(C4>| Pt(+>负极上发生的电极反应式:____________________;正极上发生的电极:________________________。
该电池属于____________电池。
RTCrpUDGiT1、根据热力学第一定律,封闭体系的热力学能变化值反应的ΔU=____________。
2、决定电子运动状态的四个量子数中,__________反映了原子轨道的形状;_______反映了原子轨道的空间取向;对于自旋量子数ms,可以取的数值只能为__________________。
5PCzVD7HxA3、在等温等压条件下,某反应的KΘ=1,则其ΔrGmΘ的值等于_______________。
4、同离子效应能使弱电解质的解离度______________。
如HAc溶液中加入_________________或_________________<两类物质)均能起到同离子效应的作用。
jLBHrnAILg5、在等温下,若化学平衡发生移动,其平衡常数___________(填减小、增大、不变>。
6、原子轨道沿两核连线以“头碰头”方式重叠形成的共价键叫_______键,以“肩并肩”方式重叠形成的共价键叫_______键。
xHAQX74J0X7、根据杂化轨道理论,BF3分子中B采取_______杂化,BF3的空间构型为____________;NH3分子中N采取_________杂化, NH3的空间构型为____________。
LDAYtRyKfE8、已知PbI2的溶度积Ks=8.49×10-9,则PbI2在0.010 mol/dm3Pb(NO3>2溶液中的溶解度为_________ mol/dm3。
Zzz6ZB2Ltk9、已知MnO+8H++5e-=Mn2++4H2O,φ(MnO/Mn2+>=1.51V。
试根据能斯特公式确定φ(MnO/Mn2+>与pH的关系式是_________________________________。
dvzfvkwMI110、CCl4分子与H2O分子间的相互作用力有___________________________。
rqyn14ZNXI三、问答题<每题6分,共计18分)1、写出7N原子、25Mn原子、20Ca2+的核外电子排布式?7N:25Mn:20Ca2+2、影响化学反应速率的主要因素有哪些?质量作用定律的意义是什么?对一般的化学反应,速率方程式的反应级数能否直接根据化学反应方程式来写?为什么?EmxvxOtOco3、当铜锌原电池(->Zn |Zn2+(1mol/L> || Cu2+(1mol/L>| Cu(+>工作一段时间后,原电池的电动势是否发生变化?为什么?SixE2yXPq5四、是非题<每题1分,共计7分)1、1、反应的ΔH就是反应的热效应。
<)2、2、催化剂能改变反应历程,降低反应的活化能,但不能改变反应的ΔrGmΘ。
<)3、3、两种分子酸HX溶液和HY溶液有同样的pH,则这两种酸的浓度相同。
<)4、4、多电子原子轨道的能级只与主量子数n有关。
<)5、5、电极电势的数值与电极反应的写法无关,而平衡常数的数值随反应式的写法而变。
<)6、对于某一化学反应,若升高温度,其正反应速率v增加,逆反应速率v减小。
<)7、在微观粒子中,只有电子具有波粒二象性。
<)五、计算题<共30分)1<6分)计算下列反应的(1>ΔrHmΘ(298.15K>;(2> 298.15K进行1mol反应时的体积功w` 和<3)ΔrUmΘ(298.15K>。
R=8.314J•mol-1•K-16ewMyirQFLCH4(g> + 4 Cl2(g> = CCl4(l> + 4 HCl(g> ΔfHmΘ(298.15K>/kJ•mol-1 -74.81 0 -135.44 -92.307kavU42VRUs2、<6分)某温度时,8.0molSO2和4.0molO2在密闭容器中进行反应生成SO3气体,测得起始时和平衡时<温度不变)系统的总压力分别为300kPa和220kPa。
试利用上述实验数据求该温度时2SO2(g> + O2(g> = 2SO3(g>的标准平衡常数和SO3的转化率。
y6v3ALoS893、<9分)已知,如果在溶液中加入NaCl,使产生AgCl沉淀后,溶液中的[Cl–]=1mol/L,试计算其电极电位。
M2ub6vSTnP4、<9分)向含有KCl、KI各0.01mol·l-1的混合溶液中,逐滴加入沉淀剂AgNO3溶液,那种离子先沉淀?氯离子沉淀时溶液中碘离子的浓度是多少?0YujCfmUCw已知:Ks(AgI>=8.51×10-17 ,Ks(AgCl>=1.77×10-10《大学化学基础》试卷2<答案)一、选择题<每小题1.5分,共24分)12345678C B CD C D B B910111213141516A C C C DBC D二、填空题<21分)1. Fe2+–e = Fe 3+、Fe 3++e = Fe2+、浓差电池2.ΔU = q+w_eUts8ZQVRd3. 角量子数,磁量子数,±1/24. 0 kJ/mol5. 降低,醋酸盐,强酸6. 不变7. σ键,π键8. sp2,平面三角形;不等性sp3,三角锥形9. 9.2×10-4mol/L。
10. φ(MnO/Mn2+>=φ(MnO/Mn2+>–<0.05917/5)lg[C Mn2+/(C 8H+• C MnO4->]sQsAEJkW5T11.色散力、诱导力三、问答题<每题6分,共计18分)1、7N:1s22s22p325Mn:1s22s22p63s23p63d54s220Ca2+:1s22s22p63s23p62、影响化学反应速率的主要因素有:浓度、温度、压力和催化剂。
质量作用定律的意义:对于元反应,化学反应速率与反应物的浓度<以反应方程式中反应物的化学计量系数为指数)的乘积成正比。
GMsIasNXkA反应级数指反应速率方程中各反应物浓度的指数之和。
对于元反应,反应速率方程等于反应物浓度<以方程式中其系数为指数)的乘积,因此其反应级数为方程式中反应物的系数之和。
对于复杂反应,反应速率方程并不一定等于反应物浓度<以方程式中其系数为指数)的乘积,,所以反应级数不能直接根据反应方程式来写。
TIrRGchYzg3、原电池的电动势会发生变化。
铜锌原电池工作一段时间后,电解质溶液中的铜离子浓度降低,锌离子浓度增大,根据能斯特公式可知,随着铜离子浓度降低,锌离子浓度增大,原电池电动势变小。
7EqZcWLZNX四、是非题<每题1分,共计7分)1.<×)2.<√)3.<×)4.<×)5.<√)6.<×)7.<×)lzq7IGf02E五、计算题<共30分)1、<6分)ΔrHmΘ= 4×(-92.307>+(-135.44>-(-74.81>=-429.86 kJ/mol zvpgeqJ1hkw体=–p·△V= –△nRT = –(-1>×8.314×298.15= 2.48kJ/molΔrUmΘ=ΔrHmΘ+ w体=-429.86kJ/mol +2.48kJ/mol=-427.38 kJ/molNrpoJac3v12、<6分) 2SO2(g> + O2(g> = 2SO3(g>起始量(mol> 8.0 4.0 P总压=300kPa1nowfTG4KIP SO2=300kPa×8/(8+4> =200 kPa P O2=300kPa×4/(8+4> =100 kPafjnFLDa5Zo平衡分压(Pa> 200–2x 100–x 2x P总压=220kPa tfnNhnE6e5200–2x +100–x+2x = 220 x=80kPaSO2(g>的转化率=2×80/200=80%3、(9分>解:根据电极电位的能斯特公式上面计算得到的电极电位实际上是下电对的标准电极电位。
