初中化学复习资料(人教版)Word版
人教版中考化学总复习资料汇总全册

九年级化学学问点物质的用处:【性质确定用处】油脂 供能及储能:动物脂肪——牛油、奶油;植物油——菜籽油、花生油、豆油……; 维生素 〔不供能〕蔬菜、水果。
缺维生素A ——夜盲症、缺维生素C ——坏血病;无机盐 〔不供能〕微量元素缺乏:铁——贫血;锌——生长缓慢发育不良;硒——表皮角质化、癌症;碘——甲状腺肿大;氟——龋齿。
常量元素缺乏:钙——佝偻病、骨质疏松易骨折;水 〔不供能〕六大养分素之一。
塑料聚乙烯塑料可包装食品,它具有热塑性可加热封口;炒菜锅手柄、插头(座)用热固性塑料;化学符号 元素符号:C 、H 、O 、Mg 、Fe 、Cu 、Hg 、……【意义:表示一种元素;及该元素的一个原子】 化学式:C 、O 2、Mg 、CO 2、CaO 、HCl 、NaOH 、NaCl 、NaHCO 3、CuSO 4、FeSO 4、FeCl 2……【意义:表示一种物质;物质的组成元素;一个分子;一个分子的构成。
】离子符号:【留意离子符号及下面化合价的“两同两不同〞】〖多个分子、原子或离子可在符号前添系数〗、、、、、、、、、、、、、、-+-+-+-+-+-+-+34322324223HCO NH NO Ag OH Ca CO Na SO H Cl Ba O Fe化合价:⋯⋯-+-+-+-+-+-+-+-+-+、、、、、、、、、、131413112223122412122224233222402)(HCO NH NO Ag OH Ca CO Na SO H Cl Ba O S O Fe O C O3.微粒构成物质、元素组成物质: 【地壳中前四位元素:氧—O 、硅—Si 、铝—Al 、铁—Fe 】分子、原子模型:—可能是CO ;—可能是H 2、O 2;—CO 2;—H 2O 。
微粒的性质:共同点:“小〞、“动〞、“间〞。
【说明现象】【分子及原子的本质区分:化变中可不行分】氨在空气中扩散、品红在水中扩散、湿衣服晾干〔水的蒸发〕、闻到花香等现象说明分子在不停的运动着;物质的三态变更、物体的热胀冷缩、酒精及水混合后总体积变小等现象说明分子间有间隔,且间隔大小会发生变更。
(完整word版)人教版_初三化学全册必背知识点(精华)
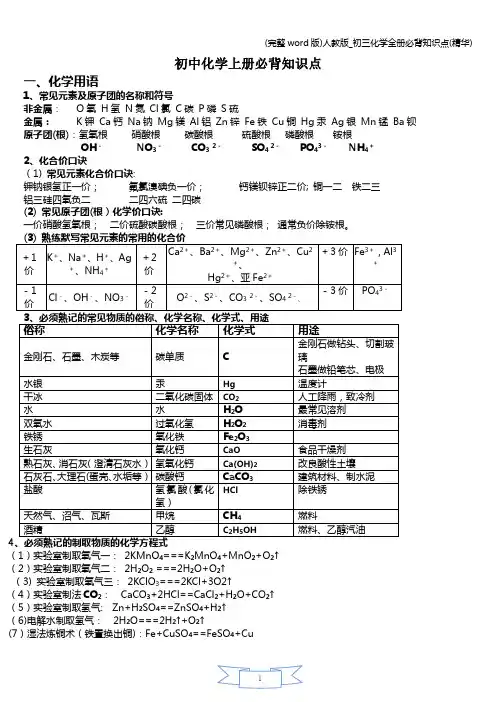
初中化学上册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OH-NO3-CO32-SO4 2-PO43-NH4+2、化合价口诀(1) 常见元素化合价口诀:钾钠银氢正一价;氟氯溴碘负一价;钙镁钡锌正二价; 铜一二铁二三铝三硅四氧负二二四六硫二四碳(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
4(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al ,Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) ,除了有颜色的固体,其他固体一般为白色。
2、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫磺:淡黄色4、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
最全面(完整word版)人教版初中化学知识点总结归纳(精华版)

人教版初中化学知识点总结归纳一、基本概念1. 物质的变化及性质(1) 物理变化:没有新物质生成的变化。
①宏观上没有新物质生成,微观上没有新分子生成。
②常指物质状态的变化、形状的改变、位置的移动等。
例如:水的三态变化、汽油挥发、干冰的升华、木材做成桌椅、玻璃碎了等等。
(2) 化学变化:有新物质生成的变化,也叫化学反应。
①宏观上有新物质生成,微观上有新分子生成。
②化学变化常常伴随一些反应现象,例如:发光、发热、产生气体、改变颜色、生成沉淀等。
有时可通过反应现象来判断是否发生了化学变化或者产物是什么物质。
(3) 物理性质:物质不需要发生化学变化就能表现出来的性质。
①物理性质也并不是只有物质发生物理变化时才表现出来的性质;例如:木材具有密度的性质,并不要求其改变形状时才表现出来。
②由感官感知的物理性质主要有:颜色、状态、气味等。
③需要借助仪器测定的物理性质有:熔点、沸点、密度、硬度、溶解性、导电性等。
(4) 化学性质:物质只有在化学变化中才能表现出来的性质。
例如:物质的金属性、非金属性、氧化性、还原性、酸碱性、热稳定性等。
2. 物质的组成原子团:在许多化学反应里,作为一个整体参加反应,好像一个原子一样的原子集团。
离子:带电荷的原子或原子团。
元素:具有相同核电荷数(即质子数)的一类原子的总称。
3. 物质的分类(1) 混合物和纯净物混合物:组成中有两种或多种物质。
常见的混合物有:空气、海水、自来水、土壤、煤、石油、天然气、爆鸣气及各种溶液。
纯净物:组成中只有一种物质。
①宏观上看有一种成分,微观上看只有一种分子;②纯净物具有固定的组成和特有的化学性质,能用化学式表示;③纯净物可以是一种元素组成的(单质),也可以是多种元素组成的(化合物)。
(2) 单质和化合物单质:只由一种元素组成的纯净物。
可分为金属单质、非金属单质及稀有气体。
化合物:由两种或两种以上的元素组成的纯净物。
(3) 氧化物、酸、碱和盐氧化物:由两种元素组成的,其中有一种元素为氧元素的化合物。
(完整word版)人教版初中化学知识点总结(绝对全-中考必备)

第1单元走进化学世界1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。
2、我国劳动人民商代会制造青铜器,春秋战国时会炼铁、炼钢。
3、绿色化学-----环境友好化学 (化合反应符合绿色化学反应)①四特点P6(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染4、蜡烛燃烧实验(描述现象时不可出现产物名称)(1)火焰:焰心、内焰(最明亮)、外焰(温度最高)(2)比较各火焰层温度:用一火柴梗平放入火焰中。
现象:两端先碳化;结论:外焰温度最高(3)检验产物 H2O:用干冷烧杯罩火焰上方,烧杯内有水雾CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊(4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。
说明石蜡蒸气燃烧。
5、吸入空气与呼出气体的比较结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多(吸入空气与呼出气体成分是相同的)6、学习化学的重要途径——科学探究一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象;7、化学实验(化学是一门以实验为基础的科学)一、常用仪器及使用方法(一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶可以直接加热的仪器是--试管、蒸发皿、燃烧匙只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀)可用于固体加热的仪器是--试管、蒸发皿可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶不可加热的仪器——量筒、漏斗、集气瓶(二)测容器--量筒量取液体体积时,量筒必须放平稳。
视线与刻度线及量筒内液体凹液面的最低点保持水平。
量筒不能用来加热,不能用作反应容器。
量程为10毫升的量筒,一般只能读到0.1毫升。
(三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。
)注意点:(1)先调整零点(2)称量物和砝码的位置为“左物右码”。
(3)称量物不能直接放在托盘上。
初中化学复习资料(人教版)资料

初中化学复习资料化学方程式一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O22CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO2(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O(3)氧气的来源:13. 玻义耳研究空气的成分实验 2HgO Hg+ O2 ↑14. 加热高锰酸钾:2KMnO4K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15. 过氧化氢在二氧化锰作催化剂条件下分解反应: 2H2O2MnO2 2H2O+ O2 ↑(实验室制氧气原理2)16加热氯酸钾(二氧化锰):2KCl3 MnO2 2KCl+3O2↑二、自然界中的水:17. 水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑18. 生石灰溶于水:CaO + H2O = Ca(OH)219. 二氧化碳可溶于水: H2O + CO2 = H2CO3三、质量守恒定律:20. 镁在空气中燃烧:2Mg + O2点燃 2MgO21. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu22. 氢气还原氧化铜:H2 + CuO Cu + H2O四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃CO224. 碳在氧气中不充分燃烧:2C + O2点燃2CO25. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑26. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)27.煤炉的底层:C + O2点燃 CO228.煤炉的中层:CO2 + C高温2CO29.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2(3)二氧化碳的制法与性质:30.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl = CaCl2 + H2O + CO2↑31.碳酸不稳定而分解:H2CO3 = H2O + CO2↑32.二氧化碳可溶于水:H2O + CO2 = H2CO333.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑34.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 = CaCO3↓+ H2O(4)一氧化碳的性质:35.一氧化碳还原氧化铜:CO+ CuO Cu + CO236.一氧化碳的可燃性:2CO + O2点燃2CO2其它反应:37.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑五、燃料及其利用:38.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O39.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O40.氢气中空气中燃烧:2H2 + O2点燃2H2O六、金属(1)金属单质 + 氧气-------- 金属氧化物(化合反应)41.镁在空气中燃烧:2Mg + O2点燃2MgO42.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O443. 铜在空气中受热:2Cu + O22CuO44. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)45. 锌和稀硫酸(实验室制氢气)Zn + H2SO4 = ZnSO4 + H2↑46. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑47. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑48. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑49. 锌和稀盐酸Zn + 2HCl= ZnCl2 + H2↑50. 铁和稀盐酸Fe + 2HCl = FeCl2 + H2↑51. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑52. 铝和稀盐酸2Al + 6HCl= 2AlCl3 + 3H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐(置换反应)53. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu54. 铝和硫酸铜溶液反应:2Al +3 CuSO4 = Al2(SO4)3 + 3Cu55. 铜和硝酸汞溶液反应:Cu + AgNO3 = Cu(NO3)2 + Ag(3)金属铁的治炼原理:56.3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属-------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水(复分解反应)57. 氧化铁和稀盐酸反应(除铁锈):Fe2O3 + 6HCl = 2FeCl3 + 3H2O58. 氧化铁和稀硫酸反应(除铁锈):Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O59. 氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O60. 氧化铜和稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)61. 盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O62. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O63. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O64. 硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐(复分解反应)65.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑66.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑67.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl = NaCl + H2O + CO2↑68. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 = BaSO4↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水(复分解反应)69.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O70.苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O71.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O(2)碱 + 酸-------- 盐 + 水(中和反应)72.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O73. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O(3)碱 + 盐 -------- 另一种碱 + 另一种盐(复分解反应)74. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属 + 另一种盐(复分解反应)75. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐(复分解反应)76.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl = NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐(复分解反应)77. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐(复分解反应)78.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 = AgCl↓ + NaNO379.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl各种学习资料,仅供学习与交流。
人教版初中化学总复习资料

人教版初中化学总复习资料Part I (Basic Concepts and Principles)___1.Physical changes are the result of molecular n。
while chemical changes are the result of atomic n。
The result of ion movement can be either a physical or chemical change.2.es of the same element have the same chemical properties。
such as 12C。
14C。
etc.3.Ions of the same element have different properties due to their different charges。
such as Fe2+ and Fe3+.4.Molecules composed of the same type of atom have identical chemical properties。
___.5.The dic table of elements has seven ds。
each consisting of one row。
and 18 groups。
with the n of the 8th。
9th。
and 10th groups。
which together form one family。
The other 15 groups。
each consisting of one column。
are called families。
with a total of 16 families.6.Note: the statement "MnO2 has two oxygen atoms" is incorrect!___1.The scope and nship een physical and chemical properties:Physical PropertiesSolubility。
(word完整版)人教版初中化学知识点总结(绝对全,中考必备),推荐文档
第 1 单元走进化学世界1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。
2、我国劳动人民商代会制造青铜器,春秋战国时会炼铁、炼钢。
3、绿色化学-----环境友好化学(化合反应符合绿色化学反应)①四特点P6(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染4、蜡烛燃烧实验(描述现象时不可出现产物名称)(1)火焰:焰心、内焰(最明亮)、外焰(温度最高)(2)比较各火焰层温度:用一火柴梗平放入火焰中。
现象:两端先碳化;结论:外焰温度最高(3)检验产物 H2O:用干冷烧杯罩火焰上方,烧杯内有水雾CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊(4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。
说明石蜡蒸气燃烧。
5、吸入空气与呼出气体的比较结论:与吸入空气相比,呼出气体中 O2的量减少,CO2和 H2O 的量增多(吸入空气与呼出气体成分是相同的)6、学习化学的重要途径——科学探究一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象;7、化学实验(化学是一门以实验为基础的科学)一、常用仪器及使用方法(一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶可以直接加热的仪器是--试管、蒸发皿、燃烧匙只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀)可用于固体加热的仪器是--试管、蒸发皿可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶不可加热的仪器——量筒、漏斗、集气瓶(二)测容器--量筒量取液体体积时,量筒必须放平稳。
视线与刻度线及量筒内液体凹液面的最低点保持水平。
量筒不能用来加热,不能用作反应容器。
量程为 10 毫升的量筒,一般只能读到 0.1 毫升。
(三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1 克。
)注意点:(1)先调整零点(2)称量物和砝码的位置为“左物右码”。
(3)称量物不能直接放在托盘上。
人教版初中化学总复习资料
人教版初中化学总复习资料初中化学总复习资料物质的变化和性质一、物质的变化1物理变化:宏观:没有生成其它物质的变化。
微观:构成物质的分子本身没有变化。
2化学变化:宏观:生成了其它物质的变化。
微观:分子发生了变化,变成了新物质的分子。
3区别:化学变化中有新物质生成,而物理变化中没有。
4联系:化学变化中一定有物理变化,物理变化中不一定有化学变化。
注意:1化学变化的基本特征:有其它物质生成。
2化学变化中的现象:颜色改变,放出气体,生成沉淀,吸热或放热,发光等。
3判断是否为化学变化的依据是是否有新物质生成,而不是现象。
二、物质的性质1、化学性质:物质在化学变化中表现出来的性质。
常见化学性质:可燃性,氧化性,还原性,酸性,碱性,稳定性。
2、物理性质:物质不需要发生化学变化就表现出来的性质.常见物理性质:物质的颜色,状态、气味、硬度、密度、熔点、沸点、溶解性、挥发性、导电性、导热性、延展性等。
●石墨变金刚石的变化是化学变化。
●“日照香炉生紫烟,遥看瀑布挂前川”指的是物理变化。
二、物理性质和化学性质●氮气和稀有气体可以做保护气。
这虽然不包含化学变化,但利用了它们的化学性质稳定性。
初中化学总复习资料化学是一门以实验为基础的科学1 实验探究的过程:提出问题----猜想与假设-----设计实验-----实验验证-----收集整理实验数据-----解释与结论-----反思与评价。
2 、◆检验燃烧后是否有H2O生成的方法:将干冷烧杯罩在火焰上方,若有水珠产生,则有水生成。
◆检验混合气体中是否有H2O 的方法:将混合气体通过无水CuSO4粉末,白色粉末变成蓝色,则证明有水。
◆检验混合气体中是否有H2O通常放在第一步;除去水蒸气,通常放在最后一步。
◆除去混合气体中的水蒸气的方法:将混合气体通过盛浓硫酸的洗气瓶。
或通过盛有固体干燥剂如:氢氧化钠固体、生石灰、碱石灰等的干燥管。
3 、检验物质燃烧后是否有CO2生成的方法:将沾有澄清石灰水的烧杯罩在火焰上方,若石灰水变浑浊,则证明有CO2生成。
(完整word版)人教版初中化学总复习知识点汇总.docx
甲烷是无色无味,密度比空气小,极难溶于水。俗名沼气(天然气的主要成分是)
2、金刚石(C)是自然界中最硬的物质,石墨(C)是最软的矿物之一,活性炭、
炭具有强烈的吸附性,焦炭用于冶铁,炭黑加到橡胶里能够增加轮胎的耐磨性。
金刚石和石墨的物理性质有很大差异的原因是:碳原子排列的不同。
若测得水面上升小于1/5体积的原因可能是:①红磷不足,氧气没有全部消耗完②装置漏
气③没有冷却到室温就打开弹簧夹。
2、法国化学家拉瓦锡提出了空气主要是由氧气和氮气组成的。舍勒和普利斯特里先后用不同的
方法制得了氧气。
3、空气的成分按体积分数计算,大约是氮气为、氧气为、稀有气体(混合物)为
0.94%、二氧化碳为0.03%、其它气体和杂质为0.03%。空气的成分以氮气和氧气为主,属于
初中化学总复习知识点汇总
(绪言)
1、化学是一门研究物质的组成、结构、性质以及变化规律的以实验 为基础自然科学。物理和化
学的共同点:都是以实验为基础的自然科学.
2、化学变化和物理变化的根本区别是:有没有新物质的生成。化学变化中伴随发生一些如放热、
发光、变色、放出气体、生成沉淀等现象。
3、物理性质——状态、气味、熔点、沸点、硬度、密度、延展性、溶解性、挥发性、导电性、
吸附性等。
4、化学性质——氧化性、还原性、金属活动性、活泼性、稳定性、腐蚀性、毒性等。
5、绿色粉末碱式碳酸铜加热后,①绿色粉末变成黑色,②管口出现小水滴,③石灰水变浑浊。
Cu2(OH)2CO3—
(空气)
1、空气中氧气含量的测定:实验现象:①红磷(不能用木炭、硫磺、铁丝等代替)燃烧时有大
量白烟生成,②同时钟罩内水面逐渐上升,冷却后,水面上升约1/5体积。
最新人教版初中化学复习资料大全(共32页)
最新人教版初中化学复习资料大全第1单元化学改变了世界1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。
2、我国劳动人民商代会制造青铜器,春秋战国时会炼铁、炼钢。
3、绿色化学-----环境友好化学(化合反应符合绿色化学反应)①四特点P6(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染4、蜡烛燃烧实验(描述现象时不可出现产物名称)(1)火焰:焰心、内焰(最明亮)、外焰(温度最高)(2)比较各火焰层温度:用一火柴梗平放入火焰中。
现象:两端先碳化;结论:外焰温度最高(3)检验产物H2O:用干冷烧杯罩火焰上方,烧杯内有水雾CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊(4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。
说明石蜡蒸气燃烧。
5、吸入空气与呼出气体的比较结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多(吸入空气与呼出气体成分是相同的)6、学习化学的重要途径——科学探究一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象;7、化学实验(化学是一门以实验为基础的科学)一、常用仪器及使用方法(一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶可以直接加热的仪器是--试管、蒸发皿、燃烧匙只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀)可用于固体加热的仪器是--试管、蒸发皿可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶不可加热的仪器——量筒、漏斗、集气瓶(二)测容器--量筒量取液体体积时,量筒必须放平稳。
视线与刻度线及量筒内液体凹液面的最低点保持水平。
量筒不能用来加热,不能用作反应容器。
量程为10毫升的量筒,一般只能读到0.1毫升。
(三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。
)注意点:(1)先调整零点(2)称量物和砝码的位置为“左物右码”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学复习资料
化学方程式
一、氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2△ 2CuO
4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O
6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2点燃 SO2
8. 碳在氧气中充分燃烧:C + O2点燃 CO2
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O
12.酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O
(3)氧气的来源:
13. 玻义耳研究空气的成分实验 2HgO △ Hg+ O2 ↑
14. 加热高锰酸钾:2KMnO4△ K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)
15. 过氧化氢在二氧化锰作催化剂条件下分解反应: 2H2O2MnO2 2H2O+ O2 ↑(实
验室制氧气原理2)
16加热氯酸钾(二氧化锰):2KCl3 MnO2 2KCl+3O2↑
二、自然界中的水:
17. 水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
18. 生石灰溶于水:CaO + H2O = Ca(OH)2
19. 二氧化碳可溶于水: H2O + CO2 = H2CO3
三、质量守恒定律:
20. 镁在空气中燃烧:2Mg + O2点燃 2MgO
21. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
22. 氢气还原氧化铜:H2 + CuO △ Cu + H2O
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2点燃 CO2
24. 碳在氧气中不充分燃烧:2C + O2点燃 2CO
25. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
26. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
27.煤炉的底层:C + O2点燃 CO2
28.煤炉的中层:CO2 + C高温2CO
29.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2
(3)二氧化碳的制法与性质:
30.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
31.碳酸不稳定而分解:H2CO3 = H2O + CO2↑
32.二氧化碳可溶于水: H2O + CO2 = H2CO3
33.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑34.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 = CaCO3↓+ H2O
(4)一氧化碳的性质:
35.一氧化碳还原氧化铜:CO+ CuO △Cu + CO2
36.一氧化碳的可燃性:2CO + O2点燃 2CO2
其它反应:
37.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
五、燃料及其利用:
38.甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O
39.酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O
40.氢气中空气中燃烧:2H2 + O2点燃 2H2O
六、金属
(1)金属单质 + 氧气-------- 金属氧化物(化合反应)41.镁在空气中燃烧:2Mg + O2点燃 2MgO
42.铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
43. 铜在空气中受热:2Cu + O2△ 2CuO
44. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)
45. 锌和稀硫酸(实验室制氢气)Zn + H2SO4 = ZnSO4 + H2↑
46. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
47. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
48. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
49. 锌和稀盐酸Zn + 2HCl= ZnCl2 + H2↑
50. 铁和稀盐酸Fe + 2HCl = FeCl2 + H2↑
51. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑
52. 铝和稀盐酸2Al + 6HCl= 2AlCl3 + 3H2↑
(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐(置换反应)
53. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
54. 铝和硫酸铜溶液反应:2Al +3 CuSO4 = Al2(SO4)3 + 3Cu
55. 铜和硝酸汞溶液反应:Cu + AgNO3 = Cu(NO3)2 + Ag
(3)金属铁的治炼原理:
56.3CO+ 2Fe2O3高温4Fe + 3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸 + 金属 -------- 盐 + 氢气(见上)
(2)酸 + 金属氧化物-------- 盐 + 水(复分解反应)
57. 氧化铁和稀盐酸反应(除铁锈):Fe2O3 + 6HCl = 2FeCl3 + 3H2O
58. 氧化铁和稀硫酸反应(除铁锈):Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
59. 氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O
60. 氧化铜和稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
61. 盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O
62. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O
63. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O
64. 硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐(复分解反应)
65.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
66.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
67.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl = NaCl + H2O + CO2↑
68. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 = BaSO4↓+ 2HCl
2、碱的化学性质
(1)碱 + 非金属氧化物 -------- 盐 + 水(复分解反应)
69.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O
70.苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O
71.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O
(2)碱 + 酸-------- 盐 + 水(中和反应)
72.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O
73. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O
(3)碱 + 盐 -------- 另一种碱 + 另一种盐(复分解反应)
74. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液)+ 金属单质------- 另一种金属 + 另一种盐(复分解反应)75. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐(复分解反应)
76.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl = NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐(复分解反应)
77. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐(复分解反应)
78.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 = AgCl↓ + NaNO3
79.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
(注:可编辑下载,若有不当之处,请指正,谢谢!)
推荐精选。
