中考化学工业流程图题专题复习题(附答案)
中考化学流程图综合经典题附详细答案

一、中考初中化学流程图1.黄铜矿(主要成分2CuFeS )经初步处理后,所得溶液甲中的溶质为243Fe SO ()、4CuSO 及24H SO 。
某同学通过废铁屑与溶液甲反应,制取补血剂的原料碳酸亚铁并回收铜。
主要步骤如下图所示:温馨提示:2434+Fe (SO )Fe=3FeSO﹙1﹚操作a 的名称是________,该操作中会用到玻璃棒,其作用是___________ 。
﹙2﹚不溶物的成分为___________________ 。
﹙3﹚步骤Ⅰ中生成铜的化学方程式为_________;废铁屑中含有少量铁锈,却对产物的成分没有影响,原因是________。
步骤Ⅲ中加入一种可溶性试剂可实现转化,从复分解反应的条件分析,该试剂可以是___________(填化学式)溶液。
【答案】过滤 引流 Cu 、Fe 44=Fe+CuSO FeSO +Cu 铁锈可与硫酸反应生成硫酸铁,硫酸铁再和铁反应生成硫酸亚铁 23Na CO【解析】【分析】铁和硫酸铜反应生成硫酸亚铁和铜,氧化铁能和稀硫酸反应生成硫酸铁和水,硫酸铁能和铁反应生成硫酸亚铁。
【详解】(1)操作a 的名称是过滤,该操作中会用到玻璃棒,其作用是引流;(2)不溶物的成分为铁和硫酸铜反应生成的铜和过量的铁;故不溶物的成分为Cu 、Fe 。
(3)步骤I 中,铁和硫酸铜反应生成硫酸亚铁和铜,生成铜的化学方程式为44=Fe+CuSO FeSO +Cu ;废铁屑中含有少量铁绣,却对产物的成分没有影响,原因是铁锈中的氧化铁能和稀硫酸反应生成硫酸铁,硫酸铁能和铁反应生成硫酸亚铁。
步骤Ⅲ中,加入碳酸钠溶液时,碳酸钠能和硫酸亚铁反应生成碳酸亚铁和硫酸钠,从而得到碳酸亚铁,因此从复分解反应的条件分析,该试剂可以是Na 2CO 3溶液。
2.某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO 2)和少量石灰石。
下图是利用该镁矿石制备七水硫酸镁(MgSO 4·7H 2O)的工艺流程。
中考化学真题专项练习题工业流程题
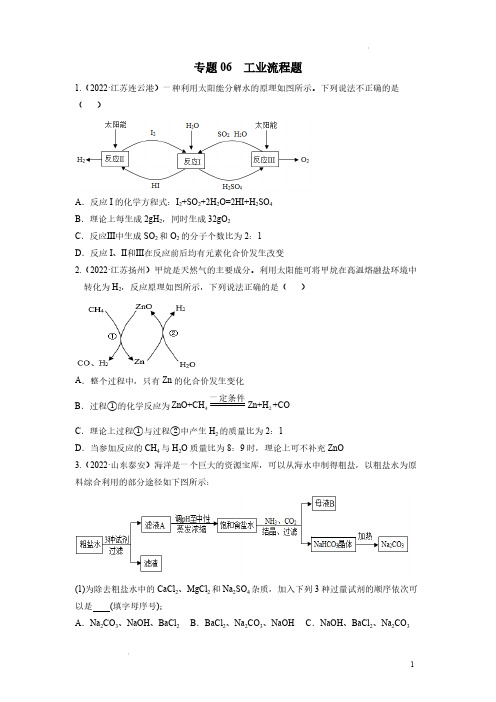
专题06 工业流程题1.(2022·江苏连云港)一种利用太阳能分解水的原理如图所示。
下列说法不正确的是()A.反应I的化学方程式:I2+SO2+2H2O=2HI+H2SO4B.理论上每生成2gH2,同时生成32gO2C.反应Ⅲ中生成SO2和O2的分子个数比为2:1D.反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变2.(2022·江苏扬州)甲烷是天然气的主要成分。
利用太阳能可将甲烷在高温熔融盐环境中转化为H2,反应原理如图所示,下列说法正确的是()A.整个过程中,只有Zn的化合价发生变化Zn+H+COB.过程①的化学反应为ZnO+CH2C.理论上过程①与过程②中产生H2的质量比为2:1D.当参加反应的CH4与H2O质量比为8:9时,理论上可不补充ZnO3.(2022·山东泰安)海洋是一个巨大的资源宝库,可以从海水中制得粗盐,以粗盐水为原料综合利用的部分途径如下图所示:(1)为除去粗盐水中的CaCl2、MgCl2和Na2SO4杂质,加入下列3种过量试剂的顺序依次可以是(填字母序号);A.Na2CO3、NaOH、BaCl2B.BaCl2、Na2CO3、NaOH C.NaOH、BaCl2、Na2CO3(2)按加入试剂的正确顺序,过滤后的滤液A中溶质有_______(填化学式):(3)写出生成碳酸氢钠的化学方程式;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是。
(4)若向分离出NaHCO3晶体后的母液B(含有NH4C1)中加入过量Ca(OH)2,则可获得一种可以循环使用的物质,其化学式是____。
4.(2022·江西)某化工厂以生产钛白粉的主要副产物(含硫酸亚铁)为原料,制取含高纯度氧化铁的氧化铁红,其工业流程如下:(1)操作1能得到硫酸亚铁晶体,说明硫酸亚铁的溶解度随温度的升高而_______。
(2)实验室中完成操作2时,玻璃棒的作用是_________。
2024年中考化学+工业流程专题复习
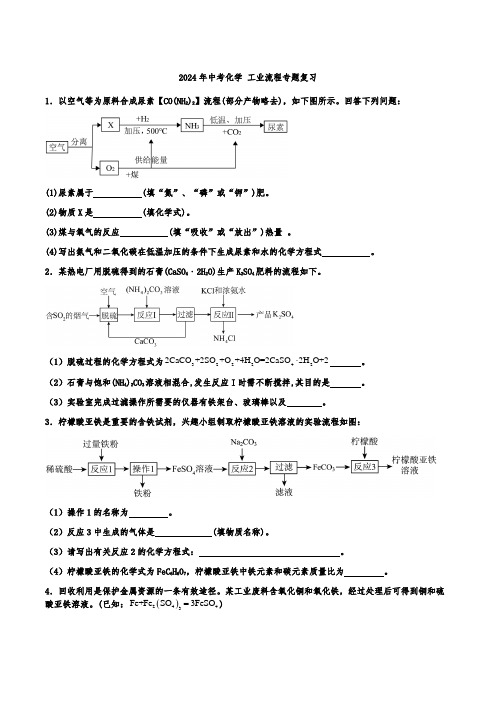
2024年中考化学 工业流程专题复习1.以空气等为原料合成尿素【CO(NH 2)2】流程(部分产物略去),如下图所示。
回答下列问题:(1)尿素属于 (填“氮”、“磷”或“钾”)肥。
(2)物质X 是 (填化学式)。
(3)煤与氧气的反应 (填“吸收”或“放出”)热量 。
(4)写出氨气和二氧化碳在低温加压的条件下生成尿素和水的化学方程式 。
2.某热电厂用脱硫得到的石膏(CaSO 4﹒2H 2O)生产K 2SO 4肥料的流程如下。
(1)脱硫过程的化学方程式为3222422CaCO +2SO +O +4H O=2CaSO 2H O+2⋅ 。
(2)石膏与饱和(NH 4)2CO 3溶液相混合,发生反应I 时需不断搅拌,其目的是 。
(3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及 。
3.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:(1)操作1的名称为 。
(2)反应3中生成的气体是 (填物质名称)。
(3)请写出有关反应2的化学方程式: 。
(4)柠檬酸亚铁的化学式为FeC 6H 6O 7,柠檬酸亚铁中铁元素和碳元素质量比为 。
4.回收利用是保护金属资源的一条有效途径。
某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液。
(已知:()2443Fe+Fe SO 3FeSO =)(1)溶液B 中的溶质是 。
(2)过程Ⅱ充分反应后,还应有的实验操作是 。
(3)过程Ⅲ加入适量A 的作用是 。
(4)A-F 中含铁元素的有 (填序号)。
5.某校化学实验室废液桶中收集了溶有大量4FeSO 、4CuSO 的废液,小轩想从中回收金属铜和硫酸亚铁晶体,设计了如图实验方案。
结合实验方案回答下列问题。
(1)操作a 、b 、c 都需要用到的玻璃仪器是 ;(2)向废液中加入过量金属A 发生的反应的化学方程式为 ;(3)向滤渣中加入适量B 溶液后观察到的实验现象是 ;经过操作b 后得到的液体中含有的阳离子为 (填离子符号)。
中考化学流程题题(含答案)

中考化学流程题题(含答案)一、中考化学流程题1.我国制碱工业先驱﹣﹣侯德榜发明了“侯氏制碱法”。
在充分利用空气资源和海洋资源的基础上,结合“侯氏制碱法”的基本原理,模拟流程如图:(查阅资料)在通常情况下,1体积的水约能溶解700体积的氨气。
请回答下列问题:(1)操作a的名称是___________。
(2)写出沉淀池中发生反应的化学方程式:___________。
(3)为了提高产率,往沉淀池中通入气体时应先通入___________(填“X”或“NH3”)。
(4)除去纯碱中少量碳酸氢钠的方法是___________。
(5)上述流程中可以循环利用的物质除了NH3外,还有___________(填化学式)。
2.金属材料在生活与科技发展中起着重要的作用。
结合以下材料回答:金属钼(Mo)是人体及动植物必需的微量元素,也可以增强合金的某些机械性能和耐腐蚀性,镀金钼丝纤维常用在航天通信方面,只有头发丝四分之一细,其性能稳定。
我国的钼矿储量非常丰富,下图是模拟化工生产中制备金属钼的实验流程图(已知钼酸为难溶于水和酸的黄色晶体):(提示:无水硫酸铜遇水变蓝色)(1)钼能制成细丝,是利用了钼的__________性。
表面镀金,原因之一是利用了金的化学性质__________。
(2)完成图1过程①中反应的化学方程式:2MoS2+7O2高温2MoO3+4__________。
其中产物MoO3中钼元素的化合价为_______。
A -3B +3C +4D +6(3)步骤②和③反应完成后都要进行的操作是__________;用到的玻璃仪器除了玻璃棒、烧杯还有__________。
(4)步骤⑥吸收尾气生成铵盐和水的化学方程式为__________,检验该铵盐中阴离子所需要的试剂为__________。
(5)若选用下图装置按序连接完成步骤⑤的反应,同时检验该反应产生的氧化物。
①装置C中所盛的试剂是__________(填试剂名称);证明装置B中已经发生反应的现象是__________。
中考化学考点拓展:工业流程(框图)题(含答案解析)

工业流程(框图)题1.(6分)近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如图所示。
第1题图(1)写出氯化钠的一种用途。
(2)根据流程图,写出②中吸收SO2的反应的化学方程式。
(3)若要测定海水电解后所得溶液的pH,其方法是。
(4)反应③中氢气在氯气中燃烧生成氯化氢气体,通过此反应,你对燃烧有什么新的认识?。
(5)用海水处理二氧化硫的现实意义是。
【答案】(1)作调味品(合理即可)(1分)(2)SO2+NaOH ═ NaHSO3(2分)(3)用玻璃棒蘸取少量电解后的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH(1分)(4)燃烧不一定要有氧气参与(1分)(5)吸收二氧化硫,减少酸雨的形成(合理即可)(1分)【解析】(1)氯化钠在生活和生产中有很多用途,如生活中氯化钠可作调味品,医疗上可用于配制生理盐水,农业上用氯化钠溶液来选种等等。
(2)根据反应②,二氧化硫与氢氧化钠反应生成NaHSO3。
(3)测定溶液pH的方法是用玻璃棒蘸取少量待测液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH。
(4)氢气在氯气中燃烧没有氧气参加,说明燃烧不一定需要氧气参与。
(5)二氧化硫是大气污染物之一,会引起酸雨的形成,用海水处理二氧化硫可减少大气污染。
2.(7分)有一种工业废水,已知其中含有大量硫酸亚铁,少量硫酸铜和硫酸钠。
现设计一种既经济又合理的方法回收金属铜和硫酸亚铁晶体,其主要流程如图所示:第2题图(1)写出工业废水中加入铁粉后发生的反应的化学方程式,加入铁粉后进行过滤,用到的玻璃仪器有烧杯、漏斗和。
(2)加入稀硫酸并进行操作Ⅰ的目的是。
A. 分离出铜和增加滤液①B. 除去过量的铁粉和分离出铜C. 除去过量的铁粉和增加滤液①(3)实验室稀释浓硫酸的具体操作为。
【答案】(1)Fe + CuSO4 ═ FeSO4 + Cu(2分)玻璃棒(1分)(2)B(1分)(3)将浓硫酸沿烧杯壁缓缓注入水中,并用玻璃棒不断进行搅拌(1分)(4)降温结晶(或冷却结晶)(1分)制备钠盐(其他合理答案均可)(1分)【解析】(1)根据实验目的要收集铜和硫酸亚铁,所以应加入过量的铁来置换出铜,铁和硫酸铜反应生成了铜和硫酸亚铁,可以写出该反应的化学方程式为Fe + CuSO4 ═ FeSO4 + Cu;过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒。
中考化学压轴题专题复习——流程图的综合含答案解析

一、中考初中化学流程图1.高纯氧化铁可作为现代电子工业的材料,以下是硫铁矿烧渣(主要成分为Fe 2O 3、FeO 、SiO 2)为原料制备高纯氧化铁(Fe 2O 3)的生产流程示意图:[(NH 4)2CO 3溶液呈碱性,40℃以上时(NH 4)2CO 3分解]。
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器玻璃棒、_______、烧杯等。
(2)写出通入CO 后所发生反应的化学方程式_______(任意写一个)。
(3)在该生产流程中当加入(NH 4)2CO 3后,应该控制的条件是 ______ 。
(4)滤液Ⅱ中可回收的物质在农业上可做 _____(5)写出在空气中煅烧FeCO 3的化学方程式_____。
【答案】漏斗 3CO+Fe 2O 3高温2Fe+3CO 2(或FeO+CO 高温Fe+CO 2) 温度控制在40℃以下(或控制溶液的酸碱度) 氮肥或肥料 322324FeCO +O 2Fe O +4CO 高温【解析】【分析】【详解】 (1)操作Ⅰ、操作Ⅱ都是将固体与液体分开,操作为过滤,过滤操作用到的玻璃仪器玻璃棒、漏斗、烧杯等。
(2)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,氧化亚铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe 2O 3+3CO 高温2Fe+3CO 2,FeO+CO 高温Fe+CO 2。
(3)因为40℃以上时(NH 4)2CO 3分解,因此加入(NH 4)2CO 3后,温度控制在40℃以下;(NH 4)2CO 3溶液呈碱性,所以要控制酸碱性。
(4)滤液Ⅱ中可回收的产品中含有硫酸铵,在生活中可作为氮肥。
(5)在空气中煅烧FeCO3,是碳酸亚铁和氧气在高温下生成二氧化碳和氧化铁,对应的化学反应方程式4FeCO3+O2高温2Fe2O3+4CO2。
故答案为:(1)漏斗;(2)3CO+Fe2O3高温2Fe+3CO2(或FeO+CO高温Fe+CO2);(3)温度控制在40℃以下(或控制溶液的酸碱度);(4)氮肥或肥料;(5)4FeCO3+O2 高温2Fe2O3+4CO2。
中考化学压轴题专题复习—流程图的综合含答案(1)

一、中考初中化学流程图1.工业上用菱锰矿[主要成分为MnCO 3,含FeCO 3、Cu 2(OH)2CO 3、SiO 2等杂质]为原料来制取二氧化锰,其生产流程示意图如下:回答下列问题:(1)加盐酸之前,需要将菱锰矿粉碎,目的是________(2)操作②是______,此操作过程中用的玻璃仪器有玻璃棒、______、 _______,其中玻璃棒的作用是________。
(3)向菱锰矿中加入盐酸,MnCO 3、FeCO 3、Cu 2(OH)2CO 3都溶解并转化为MnCl 2、FeCl 2、CuCl 2。
盐酸与MnCO 3反应的化学方程式为_______________。
滤渣1主要成分是二氧化硅,需要洗涤,洗涤的目的是________________,可以通过在最后一次洗涤液中滴加________(填化学式)溶液,若无明显现象,则已洗涤干净。
(4)加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应为:2FeCl 2 + H 2O 2 + 4H 2O = 2Fe(OH)3↓ + 4HCl ,该反应化合价发生变化的元素是氧和________(填元素名称)。
(5)加入Na 2S 、MnS 等硫化物,均可将MnCl 2中混有的CuCl 2转化为CuS 沉淀除去,但实际生产中选用MnS ,其原因是________。
【答案】增大反应物的接触面积,加快反应速率,使反应更充分 过滤 烧杯 漏斗 引流 32222HCl + MnCO = MnCl + CO + H O ↑ 回收滤渣表面的MnCl 2(答案合理即可) AgNO 3 铁 不引入新杂质【解析】【分析】【详解】(1)将菱锰矿粉碎,可以增大反应物之间的接触面积,提高反应速率,使反应更充分; (2)操作②实现了固液分离,故操作②是过滤。
过滤需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗,玻璃棒的作用是:引流;(3)盐酸与MnCO 3反应生成氯化锰、二氧化碳和水,该反应的化学方程式为:32222HCl + MnCO = MnCl + CO + H O ↑;向菱锰矿中加入盐酸,MnCO 3、FeCO 3、Cu 2(OH)2CO 3都溶解并转化为MnCl 2、FeCl 2、CuCl 2,且该生产流程是生成二氧化锰,故洗涤滤渣的目的是:回收滤渣表面的MnCl 2; 滤液中含有氯离子,银离子能与氯离子反应生成氯化银白色沉淀,故可以通过在最后一次洗涤液中滴加AgNO 3溶液,若无明显现象,则已洗涤干净;(4)氯化亚铁中铁元素的化合价为+2价,氢氧化铁中铁元素的化合价为+3价,故铁元素的化合价发生了改变;(5)加入Na2S,Na2S与氯化铜反应生成CuS和氯化钠,虽然除去了氯化铜,但是引入了新的杂质氯化钠,如果用MnS,MnS与氯化铜反应生成CuS和氯化锰,不会引入新的杂质,故填:不引入新杂质。
2024届中考化学综合专项复习训练(流程题)含答案

已知:①电石渣中的杂质滩溶于水,也不与溶液反应,溶液呈酸性;4NH Cl 4NH Cl ②“浸取”时的主要反应为;24232Ca(OH)+2NH Cl=CaCl +2NH H O ⋅③“碳化”时的主要反应为.3223422CaCl +2NH H O+CO =CaCO +2NH Cl+H O ⋅↓(1)实验室进行过滤操作时,玻璃棒的作用是。
(3)Ⅲ中发生复分解反应,生成一种盐和一种过氧化物,则反应的化学方程式是 。
(4)减压能够降低蒸管温度,从化学性质角度说明V 中采用减压蒸馏的原因:。
22H O Ⅱ.的应用22H O 火箭动力助燃剂:在火箭推进器中装有液态的肼和过氧化氢。
当它们混合时,即产生()24N H 大量和水蒸气,并放出大量热。
2N (5)写出该反应的化学方程式:。
(6)该反应用于火箭推进剂,与传统化石燃料燃烧相比,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:。
3.(23-24九年级下·江苏扬州·阶段练习)粮食安全是“国之大者”。
(1)守住良田沃土,保障粮食安全。
①土壤酸化不利于农作物生长。
要改良酸化土壤,可选用的物质为 。
A .B .熟石灰C .稀硫酸3KNO ②某农田改良后为5.4,该地区常见农作物最适宜生长的土壤范围如下:pH pH 农作物茶树油菜水稻萝卜pH5.0 5.5- 5.8~6.76.0~7.07.0~7.5该农田适合种植的农作物是。
③化肥和农药对农业增产有重要作用。
下列说法不正确的是 。
A .铵态氮肥不能与草木灰混用B .磷酸二氢钾(K 2H 2PO 4)属于钾肥C .为增加农作物产量,大量使用化肥和农药④碳酸氢铵需密封保存于阴凉处,用化学方程式解释原因。
()43NH HCO (2)科技创新,开辟产粮新路径。
我国科学家利用合成葡萄糖,该方案先用碳电还原法将转化为醋酸,再利用微生物2CO 2CO 发酵获得葡萄糖。
①将资源化利用,可减少效应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题三工业流程图题1.(原创)太湖水经苏州胥江水厂处理的大致流程如下:从沉淀池中出来的水经过沙滤池的操作称为:______________。
经沙滤池后的水在灭菌池中被通入的臭氧(O3)进行杀菌处理,再经一系列后续处理成为自来水进入千家万户;在深度处理区,炭滤池中活性炭的作用是______________________。
2.(2013年梅州)我国化学家侯德榜发明了联合制碱法,其生产纯碱和副产品氯化铵的工艺流程如下图所示:(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液显________色。
(2)写出反应Ⅰ的化学方程式:____________________________;该反应的基本类型为____________。
(3)操作a的过程是蒸发浓缩、________、过滤。
(4)上述工艺流程中可循环利用的物质是________。
3.(2013年佛山)硫酸钙转化为K2SO4和CaCl2•6H2O的工艺流程如下:(1)吸收过程中发生了化合反应,化学方程式为:________________________________。
(2)操作Ⅰ的名称为__________,沉淀的主要物质为__________(填化学式)。
(3)蒸氨过程中涉及的反应类型为__________(填编号)。
A.复分解反应B.化合反应C.分解反应D.置换反应(4)操作Ⅲ包含一系列操作:蒸发浓缩、__________、过滤、洗涤、干燥。
(5)可循环利用的物质除了NH3外,还有____________(填化学式)。
4.氯化钙是多用途的干燥剂和建筑防冻剂。
实验室里用石灰石和盐酸制备二氧化碳的含酸废液(含有MgCl2、FeCl3等)通过以下途径制得无水氯化钙。
(1)操作Ⅰ的名称为____________,操作Ⅱ的名称为______________。
滤渣的化学成分有________。
(2)石灰乳的作用:①______________________;②__________________。
写出其中一个反应的化学方程式:______________________________________________。
5.(2012年肇庆)某食盐样品中含有少量沙土、氯化钙和氯化镁。
以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程。
根据流程图回答:(1)操作Ⅰ的名称是______________,加入的试剂A是______________,沉淀是__________;(2)写出NaOH与杂质反应的化学方程式:______________________________;(3)加入试剂B的目的是____________________________________________________;(4)蒸发结晶时用到玻璃棒的作用是____________________________________。
6.氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。
某工厂以石灰石为原料生产二水氯化钙(CaCl2•2H2O)的流程如下。
原料石灰石中含有的杂质主要是MgCO3、MgSO4和Al2O3。
(1)石灰石粉溶解时,Al2O3发生反应的化学方程式为:____________________________。
(2)加入BaCl2除去的杂质离子是________________;加入Ca(OH)2除去的杂质离子是__________。
(3)检验“滤液”酸碱性,如果显碱性,还需加入适量的________(填化学式)提高产品纯度。
7.高纯度的氧化铜可用作颜料、有机合成催化剂等,以下是用粗铜粉氧化法获取高纯度氧化铜的流程图。
回答下列问题:(1)1∶1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把________慢慢注入________中,并不断搅拌。
(2)写出硫酸与氧化铜反应的化学方程式:______________________________________。
(3)写出固体B所含的物质:____________________。
(4)洗涤固体B应使用的试剂是________________。
8.煤是社会生产、生活中最重要的能源,工业上常把煤进行气化和液化处理,使煤变成清洁能源。
煤气化和液化流程示意图如下图所示:(1)第①步操作发生的是________变化(填“物理”或“化学”)。
(2)第②步是精炼煤与水蒸气的反应,化学方程式为:________________________。
(3)第③步反应的基本类型属于__________。
(4)含硫化合物洗液经过提炼后,可用来制硫酸,过程是含硫化合物氧化得到SO2,SO2进一步氧化得到X,X与水反应得到H2SO4,则X的化学式为________。
(5)从“绿色化学”的角度分析,煤的气化和煤的液化生产流程的优点:___________________________________________________________ ________________________________________________________________________ _____________。
9.(2012年广东)下面是某工厂苛化法生产烧碱的示意图。
请回答下列问题:(1)X的化学式:________。
(2)生石灰可以由__________(填名称)高温煅烧而得,其反应的化学方程式为:___________________________________________________________ _____________。
(3)操作②的名称是__________;结晶得到的固体烧碱中可能含有少量的__________(写化学式);烧碱有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,可先用较多的水冲洗,再涂上稀__________溶液。
(4)滤液C可加入反应池循环再利用,目的是降低生产成本和防止__________。
10.某校课题研究小组到电镀厂考察,了解到铁件镀铜的主要工艺流程如下:流程Ⅰ:碱洗流程Ⅱ:酸洗流程Ⅲ:电镀流程Ⅳ:废水处理铁质待镀件→用过量的烧碱溶液将待镀件表面的油污清洗干净→用过量的稀硫酸将待镀件表面的锈迹进行清除→以过量的硫酸铜溶液为电镀液在待镀件表面镀铜→结合流程中提供的信息回答:(1)流程Ⅱ废水中含有的物质有__________________________________;(2)经测定:流程Ⅳ中废水的pH为4,废水中一定没有________________________;(3)流程Ⅳ废水中除流程Ⅰ、Ⅱ引入的物质外,还含有________________;请设计简单方案来证明你的推断:__________________________________________。
11.(原创)四氧化三铁可用于医疗器械、电子等工业。
某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
制备Fe3O4的实验流程如下:(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为:____________________________(写一个即可)。
(2)操作a的名称为__________。
该操作需要的玻璃仪器有烧杯、玻璃棒、__________等。
玻璃棒在此操作中的主要作用是__________。
(3)溶液1所含溶质有________________________(至少写两种);溶液3所含溶质的主要成分为______________________。
专题三工业流程图题1.过滤吸附水中的色素和异味等2.(1)红(2)2NaHCO3=====△Na2CO3+CO2↑+H2O 分解反应(3)冷却结晶(4)CO23.(1)CO2+H2O+NH3===NH4HCO3(2)过滤CaCO3 (3)AB(4)冷却结晶(5)CO2、CaO4.(1)过滤冷却结晶(或结晶) Mg(OH)2、Fe(OH)3(2)①中和废液中的酸②使废液中的镁、铁元素充分沉淀2HCl+Ca(OH)2===CaCl2+2H2O(合理即可)5.(1)过滤碳酸钠(或Na2CO3) 碳酸钙(或CaCO3)(2)2NaOH+MgCl2===Mg(OH)2↓+2NaCl(3)除去NaOH和Na2CO3(4)搅拌,防止局部过热导致飞溅6.(1)Al2O3+6HCl===2AlCl3+3H2O(2)硫酸根离子(或SO2-4) 镁离子(或Mg2+)(3)HCl7.(1)浓硫酸水(2)CuO+H2SO4===CuSO4+H2O(3)Fe、Cu (4)稀硫酸8.(1)物理(2)C+H2O(气)=====高温CO+H2(3)化合反应(4)SO3(5)原料全部转化为产品(或原子利用率100%等),实现“零排放”(或不对环境造成污染等)9.(1)H2O (2)大理石CaCO3=====高温CaO+CO2↑(3)蒸发浓缩Ca(OH)2 硼酸(4)污染环境(合理均可)10.(1)H2SO4、Fe2(SO4)3、FeSO4 (2)NaOH(3)CuSO4 取少量废水,插入一打磨光亮的铁片,一段时间后取出观察,铁片上有红色的铜,说明废水中含有CuSO4 11.(1)2NaOH+ZnSO4===Zn(OH)2↓+Na2SO4[或2NaOH+FeSO4===Fe(OH)2↓+Na2SO4](2)过滤漏斗引流(搅拌)(3)硫酸镁、硫酸钠、氢氧化钠(两种即可) 硫酸亚铁。
