化工能量衡算
化工设计竞赛11-能量衡算计算书(0001)

目录1能量衡算 (3)1.1 概述 (3)1.2 热量衡算原理 (3)1.3 热量衡算任务 (3)1.4 热量衡算 (4)1.4.1 醋酸乙烯反应工段热量衡算 (4)1.4.2 精馏工段热量衡算 (5)1.4.3 吸收工段热量衡算 (9)1.4.4 污水处理工段热量衡算 (11)1.5 总结 (12)1能量衡算1.1 概述拟建一套年产11万吨的醋酸乙烯装置,在全工艺段中伴随着物料从一个体系或单元进入另一个体系或单元,在发生质量传递的同时也伴随着能量的消耗、释放和转化。
其中的能量变换数量关系可以从能量衡算求得,对于新设计的车间,可以由此确定设备的热负荷。
再根据设备的热负荷大小、所处理物料的性质及工艺要求选择恰当的设备。
下述能量衡算,可以为后续设计工作中提高热量的利用率,降低能耗提供主要依据。
1.2 热量衡算原理工程依据化工设计中关于热量衡算的基本思想和要求,遵循基本规范与实际工艺相结合的原则,进行热量衡算书的编制。
其中一个主要依据是能量平衡方程:∑∑∑+=loutinQ QQ其中,∑inQ——表示输入设备热量的总和; ∑outQ——表示输出设备热量的总和;∑lQ ——表示损失热量的总和。
对于连续系统:Q + W =∑H out - ∑H in其中,Q ——设备的热负荷。
W ——输入系统的机械能。
∑H out ——离开设备的各物料焓之和。
∑H in ——进入设备的各物料焓之和。
在进行全厂热量衡算时,是以单元设备为基本单位,考虑由机械能转换、化学反应释放和单纯的物理变化带来的热量变化。
最终对全工艺段进行系统级的热量平衡计算,进而用于指导节能降耗设计工作。
1.3 热量衡算任务在进行醋酸乙烯装置的热量衡算中,主要通过定量计算完成下述基本任务: ①确定工艺单元中物料输送机械(如泵)所需要的功率,以便于进行设备的设计和选型;②确定精馏等单元操作中所需要的热量或冷量以及传递速率,计算换热设备的尺寸,确定加热剂和冷却剂的消耗量,为后续设计中比如供汽、供冷、供水等专业提供设备条件;③确定为保持一定反应温度所需移除或者加入的热传递速率,指导反应器的设计和选型;④提高热量内部集成度,充分利用余热,提高能量利用率,降低能耗;⑤最终计算出总需求能量和能量的费用,并由此确定工艺过程在经济上的可行性。
化工生产过程物料衡算能量衡算介绍课件

化工生产过程的特点
01 连续性:化工生产过程通常为连续生产,以保证生产效 率和产品质量。
02 复杂性:化工生产过程涉及多种化学反应和物理变化, 过程复杂,需要精确控制。
03 安全性:化工生产过程涉及易燃、易爆、有毒等危险物质, 需要严格控制生产条件和操作流程,确保生产安全。
04 环保性:化工生产过程会产生废气、废水、废渣等污染物, 需要采取有效措施进行环保处理,降低对环境的影响。
物料衡算能量衡算在化工生产过程中的作用
物料衡算:计算物料的投入和产出,确保生产过程的物料平衡,提高生产效 率。
能量衡算:计算生产过程中的能量消耗和产出,优化生产工艺,降低能耗, 提高能源利用率。
物料衡算能量衡算相结合:综合考虑物料和能量的平衡,优化生产工艺,降 低生产成本,提高生产效益。
物料衡算能量衡算在化工生产过程中的应用:广泛应用于化工生产过程的设 计、优化和改进,提高生产过程的安全性、环保性和经济性。
物料衡算在质量管理中的应用:物料衡算可以帮助分析产品 质量情况,从而制定质量控制措施和优化质量管理。
能量衡算的概念
能量衡算是化工生产过程中对能量 进行计算和分析的方法
能量衡算的目的是为了优化生产过 程,提高能源利用效率
能量衡算主要包括热能、机械能、 电能等能量的计算和分析
能量衡算可以帮助企业降低生产成 本,减少能源消耗,提高生产效率
视觉效果:运用色彩、图片、动画等元素,提高课 件的视觉效果和吸引力
互动设计:设置提问、讨论、练习等互动环节,提 高学员的参与度和学习效果
课件制作工具:选择合适的课件制作工具,如 PowerPoint、Keynote等,提高制作效率和质量
能量衡算的应用
优化生产工艺:通过能量衡 算,可以优化生产工艺,提 高生产效率
化工计算能量衡算

化工计算能量衡算能量衡算在化工工程中起着重要的作用,它是对化工过程中能量的流动和转化进行定量分析的方法。
通过能量衡算,可以评估化工过程的能源效率、分析能量损失和寻找节能措施,从而降低能耗和减少环境污染。
能量衡算的基本原理是能量守恒定律和热力学第一定律。
能量守恒定律表明在一个封闭的系统中,能量的总量不变,只能从一种形式转化为另一种形式。
热力学第一定律则描述了能量的转化过程中,能量的转化量等于外界对系统做功与系统从外界吸收的热量之和。
在化工过程中,能量衡算可以分为热平衡和物质平衡两个方面。
热平衡主要关注能量的转化和传递过程,物质平衡则主要关注物质的进出和转化过程。
热平衡是能量衡算的重要部分,它涉及到反应器、换热器、蒸馏塔等设备的能量平衡。
对于反应器而言,通过测量进出口温度、压力以及反应热等参数,可以计算出反应过程中的能量变化。
对于换热器而言,通过测量进出口温度、流体流量以及传热系数等参数,可以计算出传热过程中的能量变化。
对于蒸馏塔而言,通过测量进出口温度、压力以及回流比等参数,可以计算出蒸馏过程中的能量变化。
通过对这些设备进行能量平衡计算,可以评估它们的能量效率,找出能量损失的原因,并采取相应措施进行改善。
物质平衡是能量衡算的另一个重要部分,它涉及到化工过程中物质的进出和转化过程。
通过对物质的进出口流量、浓度以及反应速率等参数进行测量,可以计算出物质的转化率和反应速率,进而计算出化工过程中所需的能量。
物质平衡计算还可以用于确定化工过程的最优操作条件,从而达到节能的目的。
除了这些基本原理和方法,能量衡算还可以通过建立模型和使用计算软件进行复杂的能量计算。
化工过程中的能量转化往往非常复杂,涉及到多个反应过程、多个换热器以及各种流体流动过程。
通过对这些过程进行建模,并使用计算软件进行模拟和优化,可以更加准确和高效地进行能量衡算。
总之,能量衡算是化工工程中的重要环节,它可以评估能源效率、分析能量损失和寻找节能措施。
热量衡算
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
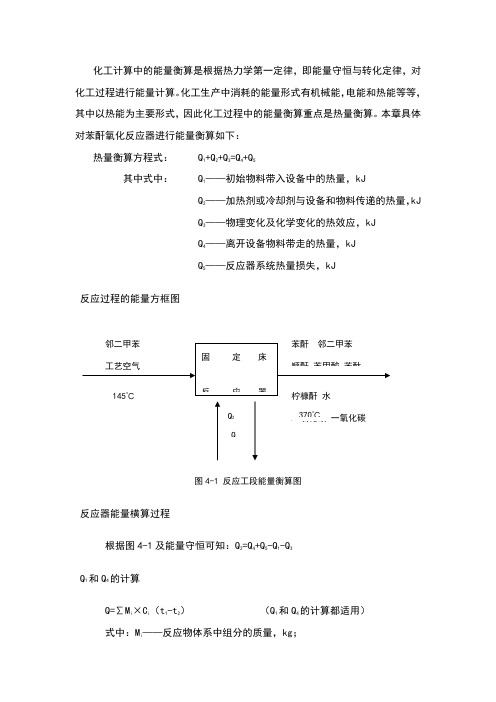
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q1+Q2+Q3=Q4+Q5其中式中: Q1——初始物料带入设备中的热量,kJQ2——加热剂或冷却剂与设备和物料传递的热量,kJQ3——物理变化及化学变化的热效应,kJQ4——离开设备物料带走的热量,kJQ5——反应器系统热量损失,kJ反应过程的能量方框图图4-1 反应工段能量衡算图反应器能量横算过程根据图4-1及能量守恒可知:Q2=Q4+Q5-Q1-Q3Q1和Q4的计算Q=∑Mi×Ci(t1-t2)(Q1和Q4的计算都适用)式中:Mi——反应物体系中组分的质量,kg;C i ——组分i 在0-T℃时的平均比热容,KJ/; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)表4-1 各物相平均比热容所以: ()21i i 4t C M Q t -=∑=××(370-145)+××225+××225+××225+××225+××225+××225+××225+××225+××225+××225=.4kJ 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
物料化学变化过程,除化学反应外,往往伴随着物料状态变化热效率,但本工艺流程中物理过程热效率较低,可以忽略不计,该过程皆为放热反应,则过程热效率可以由下式计算:主反应:C 8H 10+3O 2→C 8H 4O 3+3H 2O + Q 3-1=×103×=×103kJ/h副反应:CH 3C 6H 4CH 3+→C 4H 2O 3(顺酐)+4CO 2+4H 2O + Q 3-2=×103×=×103kJ/hCH 3C 6H 4CH 3+3O 2→C 6H 5COOH (苯甲酸)+CO 2+2H 2O +Q3-3=×103×=×103kJ/hCH3C6H4CH3+2O2→C8H6O2(苯酞)+2H2O +Q3-4=×103×=×103kJ/hCH3C6H4CH3+→C5H5O3(柠槺酐)+3CO+3H2O +Q3-5=×103×=×103kJ/hCH3C6H4CH3+→8CO+5H2O +Q3-6=×103×=×103kJ/hCH3C6H4CH3+→8CO2+5H2O +Q3-7=×103×=×103kJ/h 继而得到:Q 3 = Q3-1+Q3-2+Q3-3+Q3-4+Q3-5+Q3-6+Q3-7 =×103kJ/hQ5的计算该反应中的热损失按5%计算,即:Q 5=5%×(Q1+Q3)=5%×(0+×103)=×103kJ/hQ2的计算Q2为熔岩移出反应器的热量,由反应器热量守恒可知:Q 2=Q4+Q5-Q1-Q3=.8kJ/h反应器能量衡算表根据以上计算列出氧化反应工段能量衡算表格如下:表4-2 反应工段能量衡算表(吸收热量为“+”,释放热量为“-”)。
化工计算 第五章能量衡算 第五节无化学反应过程的能量衡算

第五节 无化学反应过程的能量衡算
二、相变过程的热量衡算 气化和冷凝、熔化和凝固、升华和凝华这类相变过程
往往伴有显著的内能和相态变化,这种变化常成为过程热 量衡算的主体,不容忽略。相变过程的热量变化体现在物 系的相态发生变化而非温度的变化,进行热量衡算时需要 利用相变热的数据。
1.相变热 在恒定压力和温度下,1mol的物质发生相态变化时
H 4
C p(甲苯,液()110.8-10)
H
+
v(甲苯)
C dT 323
384 p (甲苯,气)
42780kJ kmol 1
高职高专“十一五”规划教材《化工计算》
第五节 无化学反应过程的能量衡算
将计算填入进出口焓表
物质 苯(液)
n 进/kmol H m,进, / (kJ·kmol-1)
0.5
高职高专“十一五”规划教材《化工计算》
第五节 无化学反应过程的能量衡算
将数据或表达式代入: H1 H 3 H 2 H 4 有: 2688000 0 784000 25116 (T4 30)
解得: T4=105.8℃
所以富吸收油的出口温度为 105.8℃
高职高专“十一五”规划教材《化工计算》
0
n 出/ kmol H m,出/ (kJ·kmol-1)
0.259
5338
甲苯(液)
0.5
0
0.389
6280
苯(气)
-
-
0.241
37600
甲苯(气)
-
-
0.111
42780
总能量衡算
Q=ΔH=Σn出H m,出-Σn进H m,进 =(0.259×5338)+(0.389×6280)+(0.241×37600)+(0.111×42780)-0 =17630 kJ·kmol-1
化工设计物料衡算与能量衡算

化工设计物料衡算与能量衡算1. 引言在化工工程领域,进行物料衡算和能量衡算是设计过程中必不可少的一部分。
物料衡算和能量衡算的准确性对于化工工程的安全运行和高效生产至关重要。
本文将介绍化工设计中的物料衡算和能量衡算的基本原理和方法。
2. 物料衡算2.1 物料平衡原理物料平衡是化工设计中的一项基本工作,它基于质量守恒定律和能量守恒定律。
物料平衡的目的是确定进料、出料和中间流程中物料的流量和组成。
物料平衡的计算可以用以下公式表示:$$ \\text{进料量} = \\text{出料量} + \\sum\\text{反应物料量} + \\sum \\text{中间流程物料量} $$2.2 物料平衡计算步骤进行物料平衡计算时,需要按照以下步骤进行:1.确定系统边界:将化工系统划分为进料、出料和中间流程三个部分,并确定它们之间的物料流动关系。
2.收集物料数据:收集进料和出料的物料流量和组成数据,以及反应物料和中间流程物料的数据。
3.建立物料平衡方程:根据物料平衡原理,建立物料平衡方程。
4.解方程:根据已知数据和已建立的物料平衡方程,解方程求解未知量。
5.检查计算结果:检查计算结果是否符合物料平衡原理,如有差异则进一步分析和调整。
2.3 物料平衡实例分析下面以酯化反应过程为例,进行物料平衡计算。
2.3.1 系统边界划分将酯化反应系统划分为进料、出料和中间流程三部分。
进料包括酸和醇,出料为酯。
中间流程包括未反应的酸和醇。
2.3.2 物料数据收集收集进料和出料的物料流量和组成数据,以及反应物料和中间流程物料的数据。
假设进料中的酸的流量为100 kg/h,醇的流量为50 kg/h,反应物料中未反应的酸的流量为10 kg/h,未反应的醇的流量为5 kg/h。
2.3.3 建立物料平衡方程根据物料平衡原理,建立物料平衡方程。
酸的平衡方程:100 kg/h = 10 kg/h + 出料量醇的平衡方程:50 kg/h = 5 kg/h + 出料量2.3.4 解方程根据已知数据和已建立的物料平衡方程,解方程求解未知量。
化工设计概论物料衡算与能量衡算
CH3OH HCHO
H2O N2
13
基准:1 mol CH3OH 根据反应方程式 O2(需要)= 0.5 mol;
O2(输入)= 1.5 × 0.5 = 0.75 mol; N2(输入)= N2(输出)= 0.75(79/21)= 2.82 mol CH3OH为限制反应物 反应的CH3OH = 0.75 × 1 = 0.75 mol 因此,HCHO(输出)= 0.75mol
17
二、能量衡算可以解决的问题
(4)为充分利用余热,必须采取有效措施,使过程的 总能耗降低到最低程度。为提高能量利用率,降 低能耗提供重要依据。
(5)最终确定总需求能量和能量的费用。
18
三、能量平衡方程式
能量衡算平衡方程式
△E = Q - W △E:表示体系能量总变化; Q: 表示体系从环境吸收的热量; W: 表示环境对体系所做的功。
100.0
15
§3.2 能量衡算
一、能量衡算定义
根据能量守恒定律,利用能量传递和转化 的规则,用以确定能量比例和能量转变的定量 关系的过程称为能量衡算。
16
二、能量衡算可以解决的问题
(1)确定物料输送机械和其它操作机械所需要的功率; (2)确定各单元操作过程所需热量或冷量,及其传递
速率;计算换热设备的工艺尺寸;确定加热剂或 冷却剂的消耗量,为其他专业如供汽、供冷、供 水专业提供设条件; (3)化学反应常伴有热效应,导致体系的温度上升或 下降,为此需确定为保持一定反应温度所需的移 出或加入的热传递速率;
19
四、热量衡算
1、热量衡算有两种情况: 1)对单元设备做热量衡算; 2)整个过程的热量衡算。
(当各个工序或单元操作之间有热量交换时, 必须做全过程的热量衡算。)
化工计算-能量衡算
能量衡算:Q=ΔH=0(绝热操作)
n水(H出-H进)水= n醇(H出-H进)醇 (H进)水=1507kJ/mol (H出)水=49460kJ/mol (H进)醇=0(基准)
H
醇
(19.05 9.1510-2 T )dT 出
723
T
9.1510-2 2 2 19.05(T 723) (T 723 ) kJ / mol 2 4.57510 2 T 2 19.05T 37688kJ mol /
流程图
500kg/h 44atm,450℃ 60m/s 5m
500kg/h 1atm, 360m/s
Q题过程
物料衡算
m=500/3600=0.139kg/s 能量衡算 m 2 0.139 2 EK u2 u1 (3602 602 ) 103 8.76kJ / s 2 2 EP m g( z 2 z1 ) 0.139 9.81 (5) 6.82 103 kJ / s
Clausius—Clapeyron方程
H v ln P* B RT
d ln P * H v 2 dT RT
Watson公式(已知T1时ΔHv,求T2时ΔHv)
H v 2
Tc T2 H v 1 T T c 1
0.38
标准熔化热 ΔHm(J/mol)≈9.2Tm(用于金属元素) ≈25Tm(用于无机化合物) ≈50Tm(用于有机化合物)
3
废热锅炉的能量衡算
甲醇蒸气离合成设备时的温度为450℃,经 废热锅炉冷却。废热锅炉产生4.5atm饱和 蒸汽。已知进水温度20℃,压力4.5atm。 进料水与甲醇的摩尔比为0.2。假设锅炉是 绝热操作,求甲醇的出口温度。
化工生产过程物料衡算和能量衡算
化工生产过程物料衡算和能量衡算一、物料衡算物料衡算主要是对物料在生产过程中的流动进行定量分析和计算。
它包括物料的进出口流量、过程中的转化和损失等方面。
物料衡算的目的是确定物料的流动情况,以控制和优化生产过程。
物料衡算通常涉及以下几个方面:1.原料的输入和产物的输出:从化工生产过程的角度来看,物料衡算的第一步是确定原料的输入和产物的输出。
这可以通过物料的质量或体积以及流量来衡量。
2.过程中的转化:化工生产过程中,原料经过一系列的化学反应、物理过程和分离步骤,转化成所需的产物。
物料衡算需要确定过程中每个反应、过程或分离步骤涉及的物料流量和转化率,以及产物的纯度和收率。
3.丢失与损耗:化工生产过程中常常存在物料的丢失和损耗,如挥发、固体颗粒的落地损失等。
物料衡算需要考虑这些损耗,并尽量减少它们的发生。
物料衡算的重要性在于通过对物料流动的定量分析,可以帮助工程师了解和控制生产过程中的物料转化、损耗和产物生成情况,从而优化生产过程。
二、能量衡算能量衡算是对化工生产过程中能量转换的定量分析和计算。
它涉及到能源的输入与输出以及能量的转化。
能量衡算可用于改善能源效率,减少能源消耗和废弃物的排放。
能量衡算主要包括以下几个方面:1.能源输入:能源是化工生产过程中的重要驱动力之一,常见的能源包括电能、燃料、蒸汽等。
能量衡算需要确定能源的类型、质量或热值、消耗量和运用效率。
2.能量转化:化工生产过程中会发生能量的转化,如化学反应产生的热能、电能转化为机械能等。
能量衡算需要考虑这些能量转化过程,并计算能量的转化率和损耗。
3.能源的输出:化工生产过程中也会有能源的输出,如废热、废气、废水等。
能量衡算需要确定这些能源输出的类型、质量或热值、排放量以及处理方式。
能量衡算的目的是优化能源的利用,提高能源效率,减少能源消耗和环境污染。
通过定量分析和计算能量流动,能量衡算可以帮助工程师了解和控制能源输入与输出,寻找能源转化和能耗的瓶颈,提出改进方案,提高生产过程的能量利用率。
化工计算能量衡算
化工计算能量衡算引言化工过程中,能量的衡算是一个重要的步骤。
能量衡算可以帮助工程师了解化工过程中的能量转化和能量损失情况,从而优化工艺和提高能源利用效率。
本文将介绍化工计算能量衡算的基本原理和方法,并以实际案例进行说明。
一、能量的基本概念在进行能量的衡算之前,我们需要先了解能量的基本概念和单位。
能量是物体或系统所具有的做功能力,它是物质存在的一种属性。
能量的单位通常用焦耳(J)表示。
以下是一些常见的能量单位:•千焦(kJ)= 10^3 J•兆焦(MJ)= 10^6 J•吉焦(GJ)= 10^9 J此外,化学工程中经常使用的能量单位还有千卡(kcal)和英尺磅(ft-lbf)等。
二、能量转化和传递能量在化工过程中会发生转化和传递。
常见的能量转化包括热能转化为机械能、化学能转化为热能等。
能量传递则是指能量从一个物体传递到另一个物体。
能量转化和传递的过程可以通过能量平衡方程表示。
能量平衡方程的一般形式为:$$E_{in} - E_{out} = \\Delta E_{sys}$$其中,E in表示系统收入的能量,E out表示系统输出的能量,$\\Delta E_{sys}$表示系统内能的变化。
能量平衡方程是能量衡算的基础,通过对各个能量项进行计算和衡量,可以得到系统能量的全面情况。
三、能量衡算的方法能量衡算的方法包括物料平衡法、焓平衡法和热力学计算法等。
下面分别介绍这些方法的主要原理和应用。
3.1 物料平衡法物料平衡法是一种根据物料的进出量来计算能量收支的方法。
它基于质量守恒定律,假设在化工过程中物料是不可压缩和不可消失的。
使用物料平衡法进行能量衡算的一般步骤如下:1.确定系统边界,包括进出口和反应器等;2.收集进出口的物料信息,包括物料的质量、温度、压力等;3.列出物料平衡方程,根据质量守恒定律得到进出口物质量的关系;4.根据进出口物料的属性,计算出相应的能量。
物料平衡法可以应用于各种化工过程,包括反应器、蒸馏塔、萃取塔等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制药生产过程中包含有化学过程和物理过程,往往伴随着能量变化,因此必须进行能
量衡算。
又因生产中一般无轴功存在或轴功相对来讲影响较小,因此能量衡算实质上
是热量衡算。
生产过程中产生的热量或冷量会使物料温度上升或下降,为了保证生产
过程在一定温度下进行,则外界须对生产系统有热量的加入或排除。
通过热量衡算,
对需加热或冷却设备进行热量计算,可以确定加热或冷却介质的用量,以及设备所需
传递的热量。
热量衡算的基础
热量衡算按能量守恒定律“在无轴功条件下,进入系统的热量与离开热量应该平衡”,在实际中对传热设备的衡算可由下式表示
Q1+Q2+Q3=Q4+Q5+Q6 (1—1)
式中: Q1—所处理的物料带入设备总的热量,KJ;
Q2—加热剂或冷却剂与设备和物料传递的热量(符号规定加热剂加入热
量为“+”,冷却剂吸收热量为“-”),KJ;
Q3—过程的热效率,(符号规定过程放热为“+”;过程吸热为“-”) Q4—反应终
了时物料的焓(输出反应器的物料的焓) Q5—设备部件所消耗的热量,KJ;
Q6—设备向四周散失的热量,又称热损失,KJ;
热量衡算的基准可与物料衡算相同,即对间歇生产可以以每日或每批处理物料基准。
(计算传热面积的热负荷必须以每小时作为基准,而该时间必须是稳定传热时间)热
量衡算温度基准,一般规定25℃。
热量衡算式中各项计算从(1—1)式中可得:
Q2 =Q 4+Q5+Q6-Q1-Q3 (1—2)
式中各项可用以下计算方法(1)Q1和Q4的计算
Q1和Q4均可以用下式计算:
Q=∑miciT1(T2)
式中: mi—反应物体系中组分I的质量,Kg;
ci—组分i在0—T℃时的平均比热容,KJ/(Kg*℃)或KJ/(Kmol·℃);
T1(T2)—反应物系反应前后的温度,℃
(2)Q3的计算
Q3 作为过程的热效率分为化学反应热效应和物理过程热效应,在这次反应中由于物理过程热效应较低,相比化学反应热效应可忽略不计,故过程热效应可由下式表示:
Q3?Qr?Qp
式中 Qr—化学反应热效应,KJ;
Qp—物理过程热效应,KJ;(可忽略不计)Qr可通过标准化学反应热qr0计算:
Qr?(1000GA/MA)qr
式中 qr0—标准化学反应热,KJ/mol;
GM
A—参与化学反应的A物质质量,Kg;—A物质分子量。
qr??(qc)R??(qc)P
A
反应体系中各物质标准焓为:乙苯(40.219KJ/mol)苯(33.871 KJ/mol)甲苯(18.029KJ/mol)
qr=(33.871+18.029-40.219)KJ/mol=51.86KJ/mol =Q3=(1000×35430×
51.86/104.15)=17641860.78KJ
Qr
Q 5=∑Micpi (T2—T1)
Mi——设备上i部件质量,kg;
cpi——设备上i部件比热容,kJ/(kg?℃) T1——设备各部件初温,℃; T2——设备各部件终温,℃。
设备向四周散失的热量(Q6)的计算 Q6=∑Aα t(TW2一T0)t ×10-3 A——设备散热表面积,m2;
α t——散热表面向四周介质的联合给热系数,W/(m2?℃); Tw2——四壁向四周散热时的表面温度,℃; To——周围介质温度,℃; t ——过程持续时间,s。
由加热剂或冷却剂传给设备和物料的热量的计算 Q2=Q4+Q5+Q6-Q1-Q3
选定加热剂(或冷却剂),即可从有关手册查出该物质cp,再确定其进出口温差ΔT,则加热剂(或冷却剂)的用量为: w=Q2/cp?ΔT Q2=κA1?ΔT m
κ——传热系数,kJ/(m2?h.℃); Al——传热面积,m2;
ΔT m ——对数平均温差,℃。
ΔT m=(ΔT1—ΔT2)/ln(ΔTl/ΔT2)
从上式即可计算所需的传热面积。
对不需加热或冷却的设备可不必进行热量计算,此时水、汽等消耗量的确定可从同类型的生产车间取得。
热量衡算结束应列成动力消耗定额及消耗量表。
物料和热量恒算举例
物料恒算和热量恒算主要用于设计中的设备选型。
每个工艺段都应该进行核算。
