发酵液中还原糖含量测定
发酵液还原糖的测定方法

中间体化验操作法发酵液中糖含量的测定:1.原理:利用还原性糖类的自由配合基在碱性溶液中能将高价铜还原成为低价铜,过量的高价铜在酸性溶液中与碘化钾作用生成Cu2I2,同时析出碘,析出的碘以标准硫代硫酸钠(Na2S2O3)溶液滴定,同时做一空白对照,从两者之间求出糖的含量。
反应式如下:酸△(C6H10O6)n n(C6H10O6)水解CuSO4+2NaOHCu(OH)2+Na2SO4CHOH—COONa O—CH--COONaCu(OH)2+Cu +2H2OCHOH—COOK O—CH--COOKO-CHCOOK CHOCu +CHOHO4O-CHCOOK CHOHO--CHCOOK COONa HO--CHCOOK2Cu +NaOH+H2O (CHOH)4+Cu2O+O--CHCOOK CH2OH HO--CHCOONaO—CHCOOK CHOHOOK过量的Cu +2H2SO4O—CHCOOK CHOHOONa+CuSO4+Na++K++SO42-2CuSO4+4KI+2Cu↓2K2SO4+I2(在酸化条件下)I2+2Na2S2O32NaI+Na2S4O62.试剂:1)斐林试剂直接配制法:将酒石酸钾钠800g溶于水中,再溶入硫酸铜160g,加入1N的NaOH溶液1318ml (或固体氢氧化钠580g),最后加入KI400g溶后,加入纯化水至总体积为10000ml,摇匀即得。
2)斐林试剂贮备液的制备a.硫酸铜贮备液:称取硫酸铜(CuSO4·5H2O)800g加纯化水溶解(如浊可用玻璃棉过滤),使总体积成10000ml,摇匀即可。
b.酒石酸钾钠贮备液:称取酒石酸钾钠400g,加纯化水使总体积为1000ml摇匀即得。
c.斐林试剂混合液:取硫酸铜贮备液1000ml,加酒石酸钾钠贮备液1000ml,摇匀加11mol/L氢氧化钠(NaOH)659.5ml或固体NaOH290g,最后加入碘化钾(KI)200g,溶后加入水,使总体积为5000ml。
糖氮测定实验报告

一、实验目的1. 了解糖氮测定的原理和方法。
2. 掌握DNS法测定还原糖及总糖含量的操作步骤。
3. 通过实验,了解发酵液中糖氮含量的变化情况。
二、实验原理DNS法(3,5-二硝基水杨酸法)是一种常用的测定还原糖的方法。
该方法基于还原糖与DNS试剂发生反应,生成红色的复合物,根据颜色的深浅可以计算出还原糖的含量。
总糖含量可以通过还原糖含量与糖氮比进行换算得到。
三、实验材料1. 试剂:DNS试剂、NaOH溶液、硫酸铜溶液、硫酸溶液、标准葡萄糖溶液。
2. 仪器:分光光度计、移液器、容量瓶、试管、烧杯、酒精灯、试管架等。
四、实验步骤1. 标准曲线的绘制(1)取6支试管,分别加入0、0.5、1.0、1.5、2.0、2.5 mL标准葡萄糖溶液,加入2 mL DNS试剂,混匀,置于沸水中加热5分钟。
(2)取出试管,加入2 mL NaOH溶液,混匀,静置冷却。
(3)用分光光度计在540 nm波长下测定吸光度,以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 发酵液中还原糖含量的测定(1)取发酵液样品2 mL,加入2 mL DNS试剂,混匀,置于沸水中加热5分钟。
(2)取出试管,加入2 mL NaOH溶液,混匀,静置冷却。
(3)用分光光度计在540 nm波长下测定吸光度,从标准曲线上查出对应的葡萄糖浓度。
3. 发酵液中总糖含量的测定根据实验数据,计算出发酵液中还原糖含量,再根据糖氮比换算出总糖含量。
五、实验结果与分析1. 标准曲线的绘制根据实验数据,绘制标准曲线,得出线性回归方程为:y = 0.0589x - 0.0032,相关系数R² = 0.9981。
2. 发酵液中还原糖含量的测定发酵液中还原糖含量为0.925 g/L。
3. 发酵液中总糖含量的测定根据糖氮比(1:1),发酵液中总糖含量为0.925 g/L。
六、实验讨论1. 实验过程中,DNS试剂的浓度、加热时间、冷却时间等因素对实验结果有一定影响。
发酵液还原能力测定

发酵液还原能力测定
发酵液的还原能力是指其抗氧化能力,通常通过测定其对氧化
剂的还原作用来评估。
常见的测定方法包括抗坏血酸法、铁离子还
原法和DPPH自由基清除法等。
抗坏血酸法是一种常用的测定发酵液还原能力的方法。
该方法
通过将发酵液与含有氧化剂的试剂(如二碘化钾溶液)反应,然后
用碘液滴定未反应的氧化剂,从而计算发酵液中还原抗坏血酸的含量,间接反映其还原能力。
铁离子还原法是另一种常见的测定方法,利用发酵液中的还原
物质与铁离子生成的蓝色络合物的形成来测定还原能力。
还原能力
强的发酵液会生成更多的蓝色络合物,从而可以通过比色法或者光
度计来测定其还原能力。
DPPH自由基清除法是一种常用的体外抗氧化能力测定方法。
该
方法利用DPPH自由基的颜色变化来评估发酵液的抗氧化能力,还原
能力强的发酵液会导致DPPH自由基的减少,从紫色变为黄色或无色,通过测定吸光度的变化来评估其抗氧化能力。
除了上述方法,还有其他一些测定发酵液还原能力的方法,如Folin-Ciocalteu法、FRAP法等。
这些方法可以从不同角度全面地评估发酵液的抗氧化能力,为发酵液的质量评价提供了重要的参考依据。
总的来说,测定发酵液的还原能力是评估其抗氧化能力的重要手段,可以帮助我们了解发酵液的营养价值和保健功效。
酒石酸钾钠铜络合物

实验室安排
• • • • • 每组领一台显微镜,放在510 接种 502 灭菌 504 摇床 505 分光光度计 310
测定原理
• 水溶液中的氨基酸并不是以游离的羧基或 氨基形式存在,而是兼性离子,既是质子 供体(酸),也是质子受体(碱)。
COOH H3N+ C R H pK1 2左右 COOH3N+ C R H pK2 9左右 H 2N COOC R H
二、发酵过程主要生化指标的测定
氨基氮测定——甲醛滴定法
为什么要测定氨基氮?
• 氨基氮是微生物生长的主要氮源,菌体 代谢主要氮源是由蛋白分解形成的单体 氨基酸。 • 因此,氨基氮的含量是一项表明潜在的 菌体生长和发酵力的重要指标。
三、大肠杆菌发酵种子的制备
接种量1-2环
接种量1%
菌种
斜面
30℃,18h , 4℃长期保存
滴定注意事项
• • • • • • • • • 至少以1秒1滴的速度滴定 ; 滴定在1min内完成; 滴定消耗量葡萄糖量控制在1ml以内; 做平行测定,两次相差不得超过0.1mL。 沸腾后滴定。 滴定终点:一瞬间变成澄清的黄色溶液 样品是稀释10倍后的稀释液 快到终点时减速,摇晃三角瓶 中途不要更换试剂
5. 数据记录
预加体 积(ml)
空白 V0(ml) Vf(ml)
Vf-V0 (ml)
总体积 (ml)
A
预备
正式1 B1
行计算: (A -B) ×C 还原糖(g/100mL)=───────×样品稀释倍数 W 式中: A——空白滴定耗用0.1%葡萄糖标准液数,mL; B——正式滴定耗用0.1%葡萄糖标准液数, mL;(取两次平行实验的平均值) C——葡萄糖标准液浓度(0.1g/100ml) W——参加反应的稀释样液量,mL。
国内最准确的生产实用发酵液糖检测方法大公开
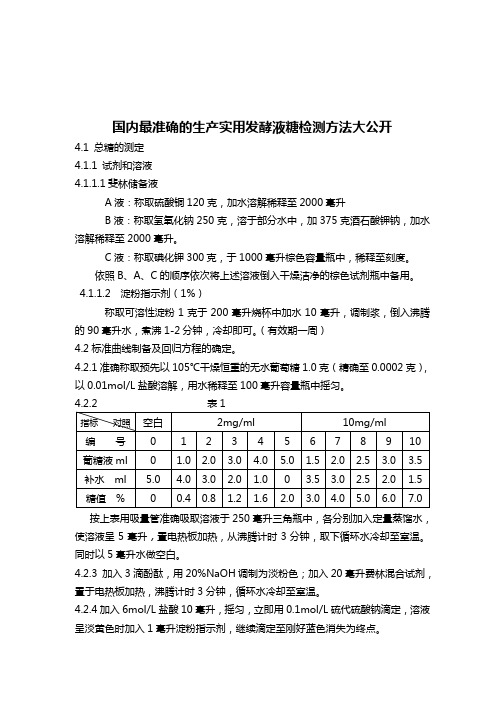
国内最准确的生产实用发酵液糖检测方法大公开4.1 总糖的测定4.1.1 试剂和溶液4.1.1.1斐林储备液A液:称取硫酸铜120克,加水溶解稀释至2000毫升B液:称取氢氧化钠250克,溶于部分水中,加375克酒石酸钾钠,加水溶解稀释至2000毫升。
C液:称取碘化钾300克,于1000毫升棕色容量瓶中,稀释至刻度。
依照B、A、C的顺序依次将上述溶液倒入干燥洁净的棕色试剂瓶中备用。
4.1.1.2 淀粉指示剂(1%)称取可溶性淀粉1克于200毫升烧杯中加水10毫升,调制浆,倒入沸腾的90毫升水,煮沸1-2分钟,冷却即可。
(有效期一周)4.2标准曲线制备及回归方程的确定。
4.2.1准确称取预先以105℃干燥恒重的无水葡萄糖1.0克(精确至0.0002克),以0.01mol/L盐酸溶解,用水稀释至100毫升容量瓶中摇匀。
按上表用吸量管准确吸取溶液于250毫升三角瓶中,各分别加入定量蒸馏水,使溶液呈5毫升,置电热板加热,从沸腾计时3分钟,取下循环水冷却至室温。
同时以5毫升水做空白。
4.2.3 加入3滴酚酞,用20%NaOH调制为淡粉色;加入20毫升费林混合试剂,置于电热板加热,沸腾计时3分钟,循环水冷却至室温。
4.2.4加入6mol/L盐酸10毫升,摇匀,立即用0.1mol/L硫代硫酸钠滴定,溶液呈淡黄色时加入1毫升淀粉指示剂,继续滴定至刚好蓝色消失为终点。
4.2.5 回归方程的确定。
4.3总糖测定4.3.1样品预处理4.3.2稀释液:准确吸取5毫升离心后发酵液于50毫升容量瓶中,用蒸馏水稀释至刻度。
精密吸取上述稀释液2.5毫升(根据发酵液含糖量可增减)于三角瓶中,加蒸馏水使溶液成5毫升,加入10毫升蒸馏水、5毫升6mol/L盐酸,置电热板加热至沸,煮沸3分钟,取下循环水冷却至室温,加入1%酚酞指示剂三滴,用20%氢氧化钠滴定中和至淡粉色。
准确加入混合液20毫升,置电热板加热至沸,从沸腾计时3分钟,取下自然冷却至室温。
发酵液还原糖的测定方法

中间体化验操作法发酵液中糖含量的测定:1.原理:利用还原性糖类的自由配合基在碱性溶液中能将高价铜还原成为低价铜,过量的高价铜在酸性溶液中与碘化钾作用生成Cu2I2,同时析出碘,析出的碘以标准硫代硫酸钠(Na2S2O3)溶液滴定,同时做一空白对照,从两者之间求出糖的含量。
反应式如下:酸△(C6H10O6)n n(C6H10O6)水解CuSO4+2NaOHCu(OH)2+Na2SO4CHOH—COONa O—CH--COONaCu(OH)2+Cu +2H2OCHOH—COOK O—CH--COOKO-CHCOOK CHOCu +CHOHO4O-CHCOOK CHOHO--CHCOOK COONa HO--CHCOOK2Cu +NaOH+H2O (CHOH)4+Cu2O+O--CHCOOK CH2OH HO--CHCOONaO—CHCOOK CHOHOOK过量的Cu +2H2SO4O—CHCOOK CHOHOONa+CuSO4+Na++K++SO42-2CuSO4+4KI+2Cu↓2K2SO4+I2(在酸化条件下)I2+2Na2S2O32NaI+Na2S4O62.试剂:1)斐林试剂直接配制法:将酒石酸钾钠800g溶于水中,再溶入硫酸铜160g,加入1N的NaOH溶液1318ml (或固体氢氧化钠580g),最后加入KI400g溶后,加入纯化水至总体积为10000ml,摇匀即得。
2)斐林试剂贮备液的制备a.硫酸铜贮备液:称取硫酸铜(CuSO4·5H2O)800g加纯化水溶解(如浊可用玻璃棉过滤),使总体积成10000ml,摇匀即可。
b.酒石酸钾钠贮备液:称取酒石酸钾钠400g,加纯化水使总体积为1000ml摇匀即得。
c.斐林试剂混合液:取硫酸铜贮备液1000ml,加酒石酸钾钠贮备液1000ml,摇匀加11mol/L氢氧化钠(NaOH)659.5ml或固体NaOH290g,最后加入碘化钾(KI)200g,溶后加入水,使总体积为5000ml。
DNS法测定发酵液中总糖含量

DNS法测定发酵液中总糖含量3,5-二硝基水杨酸与还原糖共热后被还原成棕红色的氨基化合物,在一定范围内,还原糖的量和反应液的颜色强度呈现比例关系,利用比色法可测知样品的含糖量。
DNS试剂的配方(3,5-二硝基水杨酸试剂):称取酒石酸钾钠18.2g,溶于50ml蒸馏水中,加热(不超过50℃),于热溶液中依次加入3,5-二硝基水杨酸0.63g,NaOH 2.1g(先配成溶液),苯酚0.5g,无水亚硫酸钠0.5 g, 搅拌至溶解完全,冷却后用蒸馏水定容至100ml,贮于棕色瓶中,室温保存。
0.1%葡萄糖标准液:准确称取100 mg分析纯的葡萄糖(预先在105℃干燥至恒重),用少量蒸馏水溶解后定容至100 ml,冰箱保存备用。
注意事项:1. 在配制的过程中,如果操作不合理,会出现溶液变黑,或者有鸡蛋花一样的絮状沉淀出现。
2.称取DNS(具体重量,按照你的配方来,下同),加水溶解,水浴45℃;3.逐步加入氢氧化钠溶液,同时不断搅拌,直到溶液清澈透明;(a.药品中的氢氧化钠要配制成溶液;直接加颗粒,可能产生鸡蛋花;b.加入氢氧化钠溶液时,溶液的温度会上升,所以要慢慢加,不停地搅拌,同时溶液的温度不能超过48度;温度高了,溶液颜色变黑。
)4. 逐步加入四水酒石酸钾钠、苯酚和无水亚硫酸钠;(顺序最好不要更改!)5.继续45度水浴,同时补水,不断搅拌,直到加入的物质完全溶解;(一定要有耐心地搅拌!)6. 停止加热,冷却至室温,用水定容。
7. 储存在棕色瓶中,避光保存。
室温下存放7天后使用。
有效期为6个月。
(时间不忙的话,最好按照时间来操作,时间紧迫了,时间提前个几天,推后几天,也可以用的)【操作方法】一、葡萄糖标准曲线的绘制取9支大试管,分别按下表顺序加入各种试剂:将上述各管溶液混匀后,用72型分光光度计(520nm)进行比色测定,用空白管溶液调零点,记录光密度值。
以葡萄糖浓度为横坐标,光密度值为纵坐标绘制出标准曲线。
发酵过程主要生化指标的测定氨基氮测定——甲醛滴定法

• 水溶液中的氨基酸并不是以游离的羧基或 氨基形式存在,而是兼性离子,既是质子 供体(酸),也是质子受体(碱)。
COOH
COO-
COO-
H3N+ C H
H3N+ C H
H2N C H
R
2p左K右1
R
9p左K右2
R
甲醛可与氨基酸上的NH3+结合,生成羟甲基衍生物,释放出H+ R-NH2+2HCHO→R-N(CH2OH)2
• 为何两种显色剂?
• 6-7.6 溴酚兰变色范围(黄 蓝)
• 7.4-10 酚酞变色范围(无色 粉红)
• 酚酞终点淡红,不易观察,现在变色范 围是从黄色变为紫色,终点为紫色,易 观察。
• 用标准碱液滴定羧基,按标准碱的消耗 量求出氨基酸的含量。碱完全中和羧基 时的pH值约为8.5~9.5。
滴定注意事项:
• 沙伦逊甲醛滴定法(Sorensenformaltitration) 一种测定氨基或氨基氮的方法。氨基酸 分子中含有碱性氨基和酸性羧基,在固 态或水溶液中以双性离子(内盐)存在, 因此不能直接用酸滴定氨基,也不能用 碱滴定羧基。
• 沙伦逊提出了将氨基酸(水溶液)用中 性甲醛水溶液处理,将氨基“隐蔽”后 滴定羧基的方法。
三、大肠杆菌发酵种子的制备
菌种
接种量1-2环
接种量1%
斜面 一级种子 二级种子
30℃,18h , 4℃长期保存
14h,32℃,
8h,32℃
按学号,4人一组,3组共用一支斜面种子 摇瓶装液量50ml 一级种子种龄在14h±2h内,二级种子7-8h内
时间安排
每一格必须由操作人签名!
一级种子
二级种子
• 甲醛有毒,滴定要快,必要时可戴口罩。 • 现配现滴,滴完盖紧瓶盖。 • 中性甲醛若长时间放置会变酸,滴定前要
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
发酵液中还原糖含量测定
(3,5-二硝基水杨酸比色法)
一、实验目的
1、掌握还原糖测定的基本原理
2、学习比色法测定还原糖的操作方法和分光光度计的使用
二、实验原理
还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类。
单糖都是还原糖,双糖和多糖不一定是还原糖,例如乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用各种糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来。
对非还原性的双糖和多糖,可用酸水解法使其降解成还原性单糖进行测定,再分别求出样品中还原糖和总糖的含量(常以葡萄糖含量计)。
还原糖在碱性条件下加热可被氧化成糖酸及其它产物,而氧化剂3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以系数0.9。
三、实验材料和试剂
1、实验材料发酵液
2、实验试剂
①1mg/ml葡萄糖标准液
准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100ml容量瓶中,用蒸馏水定容至100ml,混匀,4℃冰箱中保存备用。
②3,5-二硝基水杨酸(DNS)试剂
将6.3g DNS和262ml 2M NaOH溶液,加到500ml含有185g酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000ml,贮于棕色瓶中备用。
四、实验器材
具塞璃玻刻度试管:20ml×8
移液管:2ml×2;10ml×1 微量移液器:1000μL×1
容量瓶:100ml
恒温水浴锅沸水浴
可见光分光光度计
五、操作步骤
1、制作葡萄糖标准曲线
取7支具塞刻度试管编号,按表1分别加入浓度为1mg/ml的葡萄糖标准液、蒸馏水和DNS试剂,配成不同浓度的葡萄糖反应液。
表1 葡萄糖标准曲线制作
管号1mg/ml葡萄糖
标准液(ml)
蒸馏水
(ml)
DNS
(ml)
葡萄糖含量
(mg)
光密度值
(OD-540nm)
0 0 2 1.5 0
1 0.
2 1.8 1.5 0.2
2 0.4 1.6 1.5 0.4
3 0.6 1.
4 1.
5 0.6
4 0.8 1.2 1.
5 0.8
5 1.0 1.0 1.5 1.0
6 1.2 0.8 1.5 1.2
将各管摇匀,在沸水浴中准确加热5min取出,流水冷却至室温,用蒸馏水补足至10ml,加塞后颠倒混匀,在分光光度计上进行比色。
调波长540nm,用0号管调零点,分别测出1~6号管的光密度值。
以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标准曲线。
2、发酵液中还原糖的测定
取2支具塞刻度试管,编号,按表2所示分别加入待测液和显色剂,空白调零可使用制作标准曲线的0号管。
加热、定容和比色等其余操作与制作标准曲线相同。
表2 样品还原糖测定
管号发酵液待
测液
(mL)
总糖待测
液(mL)
蒸馏水
(mL)
DNS
(mL)
光密度值
(OD-540nm)
查曲线葡
萄糖量
(mg)
7 0.5 1.5 1.5
五、结果与计算
计算出7号管光密度值,在标准曲线上分别查出相应的还原糖毫克数,按下式计算出样品中还原糖和总糖的百分含量。
查曲线所得葡萄糖毫克数×提取液总体积/测定时取用体积
还原糖(%) =——————————————————————————×100
样品毫克数
六、注意
1. 标准曲线制作与样品测定应同时进行显色,并使用同一空白调零点比色
2. 若比色液颜色过深,其吸光度可能超出标准曲线浓度范围,可将样液适当稀
释后再显色测定。
