高中化学专题23 常见烃的衍生物
烃的衍生物课件

烃衍生物的应用
烃衍生物在燃料、医药和化妆品等领域有广泛的应 用,为我们的日常生活带来了便利。
醛类
醛是含有羰基的有机化合物,其结构具有一些独 特的特点。醛的命名方法也是特殊的。
烃的衍生物
酮类
酮是含有碳氧双键的有机化 合物。酮的特殊结构使其在 化学反应中发挥独特的作用。
羧酸类
羧酸是含有羧基的有机化合 物。它们的结构特点和命名 方法使其在化学和生物领域 中具有重要的作用。
酯类
酯是由醇和羧酸反应形成的 有机化合物。酯的结构及其 应用使其在人们的日常生活 中非常重要。
烷烃和烯烃的区别
烷烃是饱和烃,分子中只含有碳和氢单原子。烯烃是不饱和烃,分子中含有至少一个碳-碳化合物。卤素的存 在改变了烃的性质和用途。
酚类
酚和醇有相似的化学性质,但结构上有一些重要 的区别。酚也具有特定的命名方法。
醇类
醇是含有氢氧基的有机化合物。它们具有独特的 结构特点和命名方法。
烃衍生物的应用
1 燃料
烃衍生物作为燃料的广泛应用,如汽油、煤油和天然气,为我们的能源需求提供了重要 的来源。
2 医药
烃衍生物在医药领域中起着重要作用,包括合成药物、药物载体和生物燃料。
3 化妆品
烃衍生物被广泛用于化妆品制造中,如乳液、香水和护肤品。
总结
烃的衍生物的分类和命名方法
了解烃的衍生物的分类及其命名方法对于深入研究 和应用这些化合物至关重要。
烃的衍生物PPT课件
这份PPT课件将带您深入了解烃的衍生物。通过丰富的内容和精美的图片,让 您轻松愉快地学习这个话题。
烃的概念及分类
什么是烃?
烃是一类有机化合物,由碳和氢元素构成。它们通常是石油和天然气的主要成分。
高二化学烃的衍生物课件

3
分离和提取
烃衍生物在化学分离和提取技术中被广 泛应用,如蒸馏和萃取。
应用案例:石油化工
汽油 合成橡胶
塑料
石油提炼中的主要产品,广泛用于汽车燃料。
通过合成工艺,利用烃衍生物生产出耐磨橡胶材 料。
烃衍生物作为塑料的重要组成部分,被广泛应用 于包装和制造业。
总结
烃的衍生物提供了广泛的应用领域,从日常生活到化学实验室,都有其重要地位。深入了解烃衍生物的种类和 应用,将帮助我们更好地理解有机化学领域的奥秘。
高二化学烃的衍生物课件
欢迎来到本次课件,我们将探索烃及其衍生物的世界!从基本概念到日常应 用,带您一起探索不一样的化学领域。
烃的基本概念
烃是由碳和氢元素组成的有机化合物。它们以碳-碳键为主要结构,并分为饱和和不饱和烃两种类型。
衍生物的定义
烃的衍生物是通过将其他元素或基团与烃分子中的一个或多个氢原子替换而 形成的新化合物。
2 燃料和能源
烃衍生物如汽油和天然气 被广泛用作燃料和能源来 源。
3 化妆品和个人护理产
品
许多化妆品和个人护理产 品,如香水和洗发水,都 使用了烃衍生物。
化学实验室中的烃衍生物应用
1பைடு நூலகம்
溶剂
某些烃衍生物可用作溶剂,在化学实验
反应活性
2
室中起到重要作用。
烃衍生物是许多有机合成和催化反应的
重要反应活性体。
烃的衍生物种类
饱和烃的衍生物
通过取代烷烃中的一个或多个氢原子,形成如卤代烷和醇等衍生物。
不饱和烃的衍生物
通过替换烯烃或炔烃中的氢原子,形成如醛、酮和酯等衍生物。
环烷烃的衍生物
通过在环烷烃分子上引入不同的基团,形成如芳香化合物等衍生物。
烃的衍生物总结

液溴
催化剂 C6H5Br
液溴
催化剂 邻、间、对三 种一溴甲苯
溴水
无催化剂 三溴苯酚
苯酚与溴的取代反应比苯、甲苯易进行 酚羟基对苯环的影响使苯环上的氢原子变得活泼, 易被取代
几组有机物的类别异构
烯烃
环烷烃 醇 CnH2n+2O 醚 CnH2n
炔烃
二烯烃 醛 酮 CnH2nO 酯 CnH2n-2
酸 CnH2nO2
酚
各类物质间转化关系
酮
氧 化 水解 HX 还 原
烯烃
HX 消去
卤代烃
醇
脱 水
氧化 还原
醛
氧化
羧酸
酯化 水解
酯
醚、烯
典型代表物质转化关系
CH3CH3Leabharlann + H2CH2=CH2
消 去 H2O
+ H2
CH≡CH H2O
CH3COOC2H5
C2H5OH O2 水解
O2
脱氢
水解
C2H5Br
HBr
CH3CH2OH
烃的衍生物知识总结
烃的衍生物
卤代烃
醇类
醛类
羧酸
酯(油脂)
酚
通式
通式
通式
通式
通式
通式
代表物
代表物
代表物
代表物
代表物
代表物
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—X,一元饱和卤代烃为CnH2n+1X 卤代烃 代表物 CH3CH2Br 化性:①强碱溶液中发生水解生成醇(取代反应) ②在强碱的醇溶液里发生消去反应生成乙烯 制法:①乙烯加HBr ② CH3—CH3取代 ③C2H5OH、NaBr、H2SO4混合加热
高一化学烃的衍生物知识点讲解

高一化学烃的衍生物知识点讲解
高一化学烃的衍生物知识点讲解
以下是查字典化学网为大家整理的关于《高一化学烃的衍生物知识点讲解》的文章,供大家学习参考!
烃的衍生物
①乙醇:
a、物理性质:无色,有特殊气味,易挥发的液体,可和水以任意比互溶,良好的溶剂
b、分子结构:分子式C2H6O,结构简式CH3CH2OH或C2H5OH,官能团羟基,OH
c、化学性质:ⅰ、与活泼金属(Na)反应:
2CH3CH2OH+2Na 2CH3CH2ONa+H2
ⅱ、氧化反应:燃烧:C2H5OH+3O2 2CO2+3H2O
催化氧化:2CH3CH2OH+O2 2CH3CHO+2H2O
ⅲ、酯化反应:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
d、乙醇的用途:燃料,医用消毒(体积分数75%),有机溶剂,造酒
②乙酸:
a、物理性质:无色,,有强烈刺激性气味,液体,易溶于水和乙醇。
纯净的乙酸称为冰醋酸。
b、分子结构:分子式C2H4O2,结构简式CH3COOH,官能团羧基,COOH
c、化学性质:ⅰ、酸性(具备酸的通性):比碳酸酸性强。
高中化学烃和烃的衍生物知识点总结
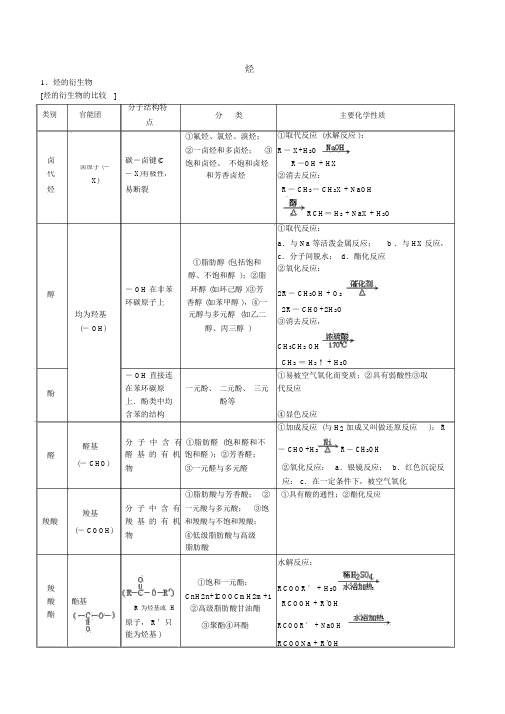
烃1.烃的衍生物[烃的衍生物的比较]分子结构特类别官能团点卤碳-卤键(C卤原子(-代- X)有极性,X)易断裂烃分类主要化学性质①氟烃、氯烃、溴烃;①取代反应 (水解反应 ):②一卤烃和多卤烃;③R- X+H2O饱和卤烃、不炮和卤烃R-OH + HX和芳香卤烃②消去反应:R- CH2- CH2X + NaOH醇均为羟基(- OH)酚RCH= H2 + NaX + H2O①取代反应:a.与 Na 等活泼金属反应; b .与 HX 反应,①脂肪醇 (包括饱和c.分子间脱水; d.酯化反应②氧化反应:醇、不饱和醇 );②脂- OH 在非苯环醇 (如环己醇 )③芳2R- CH2OH + O2环碳原子上香醇 (如苯甲醇 ),④一2R- CHO+2H2O元醇与多元醇 (如乙二③消去反应,醇、丙三醇 )CH3CH2 OHCH2= H2↑ + H2O- OH 直接连①易被空气氧化而变质;②具有弱酸性③取在苯环碳原一元酚、二元酚、三元代反应醛基醛(- CHO)上.酚类中均酚等含苯的结构分子中含有①脂肪醛(饱和醛和不醛基的有机饱和醛 );②芳香醛;物③一元醛与多元醛④显色反应①加成反应 (与 H2加成又叫做还原反应): R- CHO+H2R- CH2OH②氧化反应:a.银镜反应;b.红色沉淀反羧基羧酸(- COOH)应: c.在一定条件下,被空气氧化①脂肪酸与芳香酸;②①具有酸的通性;②酯化反应分子中含有一元酸与多元酸;③饱羧基的有机和羧酸与不饱和羧酸;物④低级脂肪酸与高级脂肪酸水解反应:羧酸酯基(R 为烃基或H 酯原子, R′只能为烃基 )①饱和一元酯:RCOOR′ + H2O CnH2n+lCOOCmH2m+1RCOOH + R'OH ②高级脂肪酸甘油酯③聚酯④环酯RCOOR′ + NaOHRCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例 (反应的化学方程式)有机物在一定条件下,从一个CH2= H2↑ + H2O 消去反应分子中脱去一个小分子(如C2H5OHH2O、 HBr 等 )而生成不饱和 (含双键或叁键 )化合物的反应苯酚的显色反应苯酚与含 Fe3+的溶液作用,使溶液呈现紫色的反应CH≡ CH + H2CH2= H2还原反应有机物分子得到氢原子或失去CH2=H2 + H2氧原子的反应CH3CH3R— CHO + H2R- CH2OH燃烧或被空2CH3CH2OH + O22CH3CHO + 2H2O 气中的 O2氧氧化有机物分子得到氧原子或失去2CH3CHO + O22CH3COOH化反氢原子的反应CH3CHO + 2Ag(NH3)2OH银镜反应CH3 COONH4+2Ag↓ + 3NH3↑ + H2O应红色沉淀反CH3 CHO + 2Cu(OH)2CH3COOH + Cu2 O↓ + 2H2O 应卤代烃的在 NaOH 水溶液的条件下,卤R- CH2X + H2O RCH2OH + HX 代烃与水作用,生成醇和卤化水解反应氢的反应取酸 (无机含氧酸或羧酸)与醇作代用,生成酯和水的反应RCOOH + R'CH2OH酯化反应反RCOOCH2R′ + H2O应在酸或碱存在的条件下,酯与酯的水解反RCOOR′ + H2O RCOOH + R'OH水作用生成醇与酸的反应应RCOOR′ + NaOH →RCOONa + R'OH3.同分异构体的有关知识[同分异构体的熔点、沸点高低的规律]①当为脂肪烃的同分异构体时,支链越多 (少 ),沸点越低 (高 );②当为含两个侧链的苯的同系物时,侧链相隔越远 (近 ),沸点越高 (低 ).[同分异构体的书写规律]①同分异构体的书写规律:要准确、完全地写出同分异构体,一般按以下顺序规律进行书写:类别异构+ 碳链异构一位置异构.②碳链异构 (烷烃的同分异构体)的书写技巧:a.先写出不含支链的最长碳链;b.然后写出少 1 个碳原子的主链,将余下的 1 个碳原子作支链加在主链上,并依次变动支链位置;c.再写出少 2 个碳原子的主链,将余下的 2 个碳原子作为一个乙基或两个甲基加在主链上,并依次变动其位置(注意不要重复);d.以此类推,最后分别在每个碳原子上加上氢原子,使每个碳原子有 4 个共价键.说明a.从上所述可归纳为:从头摘、挂中间,往端移、不到边,先甲基、后乙基,先集中、后分散,变换位、不能同. b .在书写烯烃或炔烃的同分异构体时,只要在碳链异构的基础上依次变动碳碳双键或碳碳叁键位置即可.[烃的同分异构体种数的确定方法]①等效氢法.烃分子中同一种类的氢原子称为等效氢原子.有机分子中有几种不等效氢原子,其氢原子被一种原子或原子团取代后的一取代物就有几种同分异构体.等效氢原子的一般判断原则:a.位于同一碳原子上的H 原子为等效H 原子.如CH4中的 4 个 H 原子为等效 H 原子. b.位于同一 C 原子上的甲基上的 H 原子为等效H 原子.如新戊烷 (CH3)4C 上的 12 个 H 原子为等效 H 原子. c.同一分子中处于对称位置或镜面对称位置上的H 原子为等效 H 原子.对于含苯环结构的分子中等效 H 原子的种数的判断,应首先考虑苯环所在平面上是否有对称轴,若没有,则还应考虑是否有垂直于苯环平面的对称轴存在,然后根据对称轴来确定等效H 原子的种数.②换元法.换元法是要找出隐含在题目中的等量关系,并将所求对象进行恰当地转换.例如,已知正丁烷的二氯代物有 6 种同分异构体,则其八氯代物的同分异构体有多少种正丁烷 C4 H10。
高三化学烃的衍生物详解演示文稿

2,3—二甲基—3—戊醇
第6页,共68页。
一、醇 1.醇的分类
1)根据羟基所连烃基的种类
第7页,共68页。
2) 根据醇分子结构中羟基的数目,醇可分为一元醇、 二元醇、三元醇……
饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇和丙三醇都是无色、黏稠、有甜味的液体, 都易溶于水和乙醇,是重要的化工原料。 乙二醇可用于汽车作防冻剂,丙三醇可用于配制化 妆品。
7、有何杂质气体?如何除去? 由于无水酒精和浓硫酸发生的氧化还原反应,反应制得
的乙烯中往往混有H2O、CO2、SO2等气体。可将气体 通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
第16页,共68页。
学与问
反应条件
化学键的断裂
化学键的生成
CH3CH2Br
CH3CH2OH
乙二醇的沸点高于乙醇,1,2,3—丙三醇的沸点高 于1,2—丙二醇, 1,2—丙二醇的沸点高于1—丙醇,其 原因是:由于羟基数目增多,使得分子间形成的氢键增 多增强。
思考与交流 处理反应釜中金属钠的最安全、合理的方法是第(3)
种方案,向反应釜中慢慢加入乙醇,由于乙醇与金属钠 的反应比水与钠的反应缓和,热效应小,因此是比较安 全,可行的处理方法。
上的氢原子。 3、乙醛的化学性质 (1)氧化反应
a、银镜反应
△
CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O
第33页,共68页。
资料卡片 银氨溶液的配制
AgNO3 + NH3·H2O=AgOH↓+NH4NO3 AgOAgH+++N2NHH3·H3·2HO2=OA=gAOgH(N↓+HN3H)24O+ H+2H2O
新教材人教版高中化学选择性必修3第3章烃的衍生物 知识点考点归纳总结

第3章烃的衍生物第一节卤代烃一、卤代烃1.定义烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。
官能团是碳卤键,可表示为R—X(X=F、Cl、Br、I)。
2.分类3.物理性质(1)状态:常温下,卤代烃中除个别为气体外,大多为液体或固体。
如一氯甲烷为气体。
(2)溶解性:卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是很好的有机溶剂,如CCl4、氯仿(CHCl3)等。
(3)密度与沸点:①卤代烃的密度和沸点都高于相应的烃;②卤代烃的密度一般随烃基中碳原子数目的增加而减小,如ρ(CH3Cl)>ρ(CH3CH2Cl);③卤代烃的沸点一般随碳原子数目的增加而升高,如沸点CH3Cl<CH3CH2Cl。
4.卤代烃的系统命名——类似于烃的命名方法二、溴乙烷的结构与性质1.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点是38.4 ℃,密度比水的大,难溶于水,可溶于多种有机溶剂(如乙醇、苯、汽油等)。
2.溴乙烷的分子结构3.溴乙烷的化学性质(1)取代反应——又称水解反应①条件:NaOH水溶液、加热。
②反应方程式:C 2H5—Br+NaOH――→水△C2H5—OH+NaBr。
③反应原理:(2)消去反应——又称为消除反应。
①条件:NaOH的乙醇溶液、加热。
②反应方程式:(以溴乙烷为例)CH3CH2Br+NaOH――→乙醇△CH2===CH2↑+NaBr+H2O。
③反应原理:④定义:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应叫做消去反应(消除反应)。
(3)加成和加聚反应含有不饱和键(如)的卤代烃也可以发生加成和加聚反应。
①氯乙烯加聚反应生成聚氯乙烯:。
②四氟乙烯加聚反应生成聚四氟乙烯:。
三、卤代烃破坏臭氧层原理(了解)氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。
以CCl3F为例,它破坏臭氧层的反应过程可表示为:CCl3F――→紫外线CCl2F·+Cl·卤代烃的主要性质及检验1.卤代烃的消去反应和取代反应的比较消去反应取代反应卤代烃的结构特点与卤素原子相连的碳原子的邻位碳原子上有氢原子一般是1个碳原子上只有1个—X反应实质脱去1个HX分子,形成不饱和键—X被—OH取代反应条件强碱的醇溶液、加热强碱的水溶液、加热化学键变化主要产物烯烃或炔烃醇2.卤代烃消去反应的规律(1)没有邻位碳原子的卤代烃不能发生消去反应。
烃的衍生物知识点归纳

烃的衍生物知识点归纳烃是由碳和氢元素组成的有机化合物家族,是天然气、煤油和石油的主要成分。
由于其分子结构简单,烃具有许多重要的应用领域,包括燃料、化学原料和制药等。
本文将整理烃的衍生物知识点,以帮助读者更好地了解烃化合物的特性和应用。
1. 烃的分类烃可以根据碳原子的结构和连接方式进行分类。
最简单的烃是烷烃,由单个碳-碳单键组成。
其他类别包括烯烃(含有碳-碳双键)和炔烃(含有碳-碳三键)。
2. 烃的命名烃的命名方法基于碳原子的数量和连接方式。
烷烃的命名使用前缀和后缀的组合,例如甲烷、乙烷、丙烷等。
烯烃和炔烃的命名使用前缀、中缀和后缀,例如乙烯、丙烯、乙炔等。
3. 烃的物理特性烃的物理特性与其分子结构和分子量有关。
通常,烃具有较低的沸点和熔点,是易燃的液体或气体。
随着分子量的增加,烃的密度和黏度也会增加。
4. 烃的化学性质烃的化学性质主要与有机反应有关。
对于烃基本上是非极性分子,它们通常不会发生直接的化学反应。
然而,通过在化学反应中引入适当的催化剂、温度和压力条件,烃可以被氧化、加成、取代等。
5. 烃的衍生物烃衍生物是通过对烃进行功能化改变而产生的化合物。
主要的烃衍生物包括醇、醚、酮、羧酸、醛、胺、卤代烃等。
6. 烯烃的衍生物烯烃衍生物是通过对烯烃进行不同的反应而形成的。
烯烃的衍生物包括环烯烃、烯烃醇、烯烃醛、烯烃酸等。
7. 炔烃的衍生物炔烃衍生物是通过对炔烃进行不同的反应而形成的。
炔烃的衍生物包括环炔烃、炔烃醇、炔烃醛、炔烃酸等。
8. 烷烃的衍生物烷烃衍生物是通过对烷烃进行不同的反应而形成的。
烷烃的衍生物包括醇、醚、酮、醛、胺、酸等。
9. 烃衍生物的应用烃衍生物广泛应用于多个领域。
醇是重要的溶剂和溶剂中间体,醚常用作溶剂、非极性溶剂和反应中间体,酮可以用作溶剂、溶剂中间体和有机合成中间体,羧酸常用于制备酯类化合物,胺是重要的有机合成试剂等。
10. 烃衍生物的制备方法烃衍生物的制备方法多种多样,包括催化加氢、氧化、取代、加成等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题23 常见烃的衍生物
【课前练习】
1.(09年广东化学·13)警察常从案发现场的人体气味来获取有用线索,人体气味的成分中含有以下化合
物:①辛酸;②壬酸;③环十二醇;④5,9一十一烷酸内酯;⑤十八烷⑥已醛;⑦庚醛。
下列说法正确的是
A.①、②、⑥分子中碳原子数小于10,③、④、⑤分子中碳原子数大于10
B.①、②是无机物,③、⑤、⑦是有机物
C.①、②是酸性化合物,③、⑤不是酸性化合物
D.②、③、④含氧元素,⑤、⑥、⑦不含氧元素
2.(09年广东文基·67)下列有关有机物的说法不正确的是
A.酒精中是否含有水,可用金属钠检验
B.有机酸和醇脱水合成的某些酯,可用作糖果、化妆品中的香料
C.蛋白质在一定条件下能发生水解反应,生成氨基酸
D.乙烯通过聚合反应可合成聚乙烯,聚乙烯塑料可用来制造多种包装材料
3.(08上海卷16)霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物。
下列关于MMF 的说法正确
的是( )
A.MMF能溶于水
B.MMF能发生取代反应和消去反应
C.1molMMF能与6mol氢气发生加成反应
D.1molMMF能与含3molNaOH溶液完全反应
4.(09年全国理综Ⅱ·12)1 mol
的NaOH的物质的量为
A.5 mol B.4 mol C.3 mol 与足量的NaOH溶液充分反应,消耗D.2 mol 【知识动脉】
知识框架
共21页第1页。
