高考化学常见的烃的衍生物知识点汇总
烃的衍生物总结
液溴
催化剂 C6H5Br
液溴
催化剂 邻、间、对三 种一溴甲苯
溴水
无催化剂 三溴苯酚
苯酚与溴的取代反应比苯、甲苯易进行 酚羟基对苯环的影响使苯环上的氢原子变得活泼, 易被取代
几组有机物的类别异构
烯烃
环烷烃 醇 CnH2n+2O 醚 CnH2n
炔烃
二烯烃 醛 酮 CnH2nO 酯 CnH2n-2
酸 CnH2nO2
酚
各类物质间转化关系
酮
氧 化 水解 HX 还 原
烯烃
HX 消去
卤代烃
醇
脱 水
氧化 还原
醛
氧化
羧酸
酯化 水解
酯
醚、烯
典型代表物质转化关系
CH3CH3Leabharlann + H2CH2=CH2
消 去 H2O
+ H2
CH≡CH H2O
CH3COOC2H5
C2H5OH O2 水解
O2
脱氢
水解
C2H5Br
HBr
CH3CH2OH
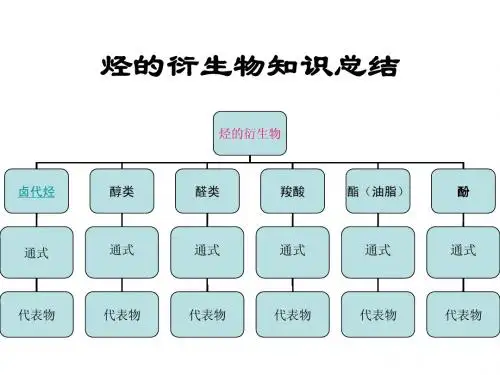
烃的衍生物知识总结
烃的衍生物
卤代烃
醇类
醛类
羧酸
酯(油脂)
酚
通式
通式
通式
通式
通式
通式
代表物
代表物
代表物
代表物
代表物
代表物
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—X,一元饱和卤代烃为CnH2n+1X 卤代烃 代表物 CH3CH2Br 化性:①强碱溶液中发生水解生成醇(取代反应) ②在强碱的醇溶液里发生消去反应生成乙烯 制法:①乙烯加HBr ② CH3—CH3取代 ③C2H5OH、NaBr、H2SO4混合加热
高一化学烃的衍生物知识点讲解

高一化学烃的衍生物知识点讲解
高一化学烃的衍生物知识点讲解
以下是查字典化学网为大家整理的关于《高一化学烃的衍生物知识点讲解》的文章,供大家学习参考!
烃的衍生物
①乙醇:
a、物理性质:无色,有特殊气味,易挥发的液体,可和水以任意比互溶,良好的溶剂
b、分子结构:分子式C2H6O,结构简式CH3CH2OH或C2H5OH,官能团羟基,OH
c、化学性质:ⅰ、与活泼金属(Na)反应:
2CH3CH2OH+2Na 2CH3CH2ONa+H2
ⅱ、氧化反应:燃烧:C2H5OH+3O2 2CO2+3H2O
催化氧化:2CH3CH2OH+O2 2CH3CHO+2H2O
ⅲ、酯化反应:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
d、乙醇的用途:燃料,医用消毒(体积分数75%),有机溶剂,造酒
②乙酸:
a、物理性质:无色,,有强烈刺激性气味,液体,易溶于水和乙醇。
纯净的乙酸称为冰醋酸。
b、分子结构:分子式C2H4O2,结构简式CH3COOH,官能团羧基,COOH
c、化学性质:ⅰ、酸性(具备酸的通性):比碳酸酸性强。
高考化学 试卷讲义 第三讲 烃的衍生物

第三讲烃的衍生物【课标要求】 1.认识卤代烃、醇、醛、羧酸、酯、酚的组成和结构特点、性质、转化关系及其在生产、生活中的重要应用,知道醚、酮、胺和酰胺的结构特点及其应用。
2.认识同一分子中官能团之间存在相互影响。
3.认识有机物分子中共价键的极性与有机反应的关系,认识有机化合物分子中基团之间的相互影响会导致键的极性发生改变。
一、卤代烃1.概念(1)卤代烃可看作是烃分子里的氢原子被卤素原子取代后生成的化合物。
通式可表示为R—X(其中R—表示烃基)。
(2)官能团是碳卤键。
2.物理性质3.化学性质(1)取代反应在卤代烃分子中,由于卤素原子的电负性比碳原子的大,使C—X的电子对向卤素原子偏移,进而使碳原子带部分正电荷(δ+),卤素原子带部分负电荷(δ-),这样就形成一个极性较强的共价键:Cδ+—Xδ-。
因此,卤代烃在化学反应中,C—X 较易断裂,使卤素原子被其他原子或原子团所取代,生成负离子而离去。
①反应条件:氢氧化钠的水溶液、加热。
②C 2H 5Br 在碱性条件下水解的化学方程式为C 2H 5Br +NaOH ――→H 2O△C 2H 5OH +NaBr 。
(2)消去反应①概念:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H 2O 、HX 等),而生成含不饱和键的化合物的反应。
②卤代烃消去反应条件:氢氧化钠的醇溶液、加热。
③C 2H 5Br 发生消去反应的化学方程式为 CH 3CH 2Br +NaOH ――→醇△CH 2===CH 2↑+ NaBr +H 2O 。
4.卤代烯烃的化学性质卤代烯烃的化学性质与烯烃相似,能发生加成反应和加聚反应。
如氯乙烯发生加聚反应:。
5.卤代烃的命名 (1)卤代烷烃命名以含有与卤素原子连接的C 原子在内的最长碳链作为主链,卤素原子与其他支链作为取代基,命名为“某烷”,命名规则同烷烃。
如的名称为2-乙基-1-氯戊烷。
(2)卤代烯(炔)烃命名选择含有双(三)键的最长碳链为主链,双(三)键位次最小,卤原子作为取代基,以烯烃(炔烃)为母体,命名为“某烯(炔)”。
烃-烃的衍生物基础知识点归纳整理
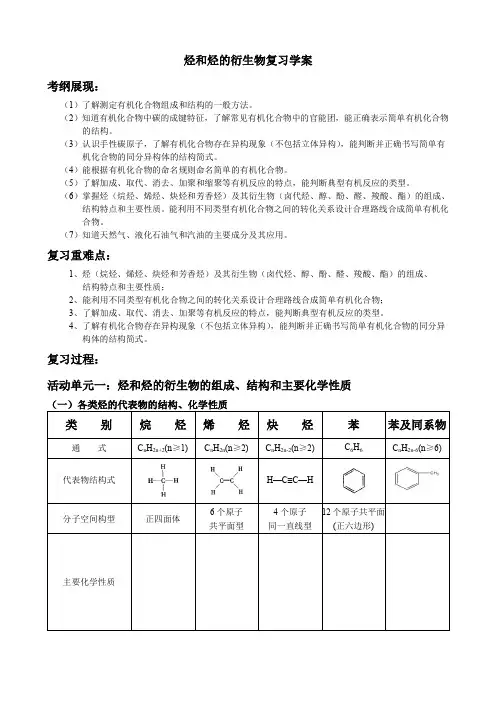
烃和烃的衍生物复习学案考纲展现:(1)了解测定有机化合物组成和结构的一般方法。
(2)知道有机化合物中碳的成键特征,了解常见有机化合物中的官能团,能正确表示简单有机化合物的结构。
(3)认识手性碳原子,了解有机化合物存在异构现象(不包括立体异构),能判断并正确书写简单有机化合物的同分异构体的结构简式。
(4)能根据有机化合物的命名规则命名简单的有机化合物。
(5)了解加成、取代、消去、加聚和缩聚等有机反应的特点,能判断典型有机反应的类型。
(6)掌握烃(烷烃、烯烃、炔烃和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和主要性质。
能利用不同类型有机化合物之间的转化关系设计合理路线合成简单有机化合物。
(7)知道天然气、液化石油气和汽油的主要成分及其应用。
复习重难点:1、烃(烷烃、烯烃、炔烃和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和主要性质;2、能利用不同类型有机化合物之间的转化关系设计合理路线合成简单有机化合物;3、了解加成、取代、消去、加聚等有机反应的特点,能判断典型有机反应的类型。
4、了解有机化合物存在异构现象(不包括立体异构),能判断并正确书写简单有机化合物的同分异构体的结构简式。
复习过程:活动单元一:烃和烃的衍生物的组成、结构和主要化学性质烃炔烃苯苯及同系物≥2) C n H2n-2(n≥2) C6H6CH—C≡C—H个原子共平面型4个原子同一直线型12个原子共平面(正六边形)(三)重要有机反应类型和涉及到的主要有机物类别及反应条件:(四)重要的反应归类1、能使溴水(Br2/H2O)褪色的物质:2、能使酸性高锰酸钾溶液KMnO4/H+褪色的物质:3、与Na反应的有机物:与NaOH反应的有机物:与Na2CO3反应的有机物:与NaHCO3反应的有机物:4.能发生银镜反应的有机物:与新制Cu(OH)2悬浊液(斐林试剂)的反应的有机物:5.能发生水解反应的有机物是:6.能跟FeCl3溶液发生显色反应的是:7.能跟I2发生显色反应的是:(五)、官能团之间的相互衍变关系(写出相应的化学反应方程式)活动单元二:有机物的空间结构【知识归纳】①写出典型有机物的结构式:甲烷 ;乙烯 ;乙炔 ;苯 ;甲醛 。
高中化学烃和烃的衍生物知识点总结
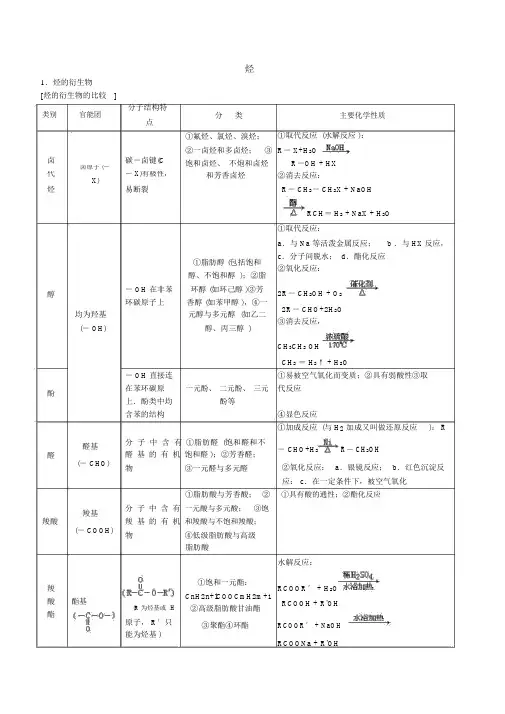
烃1.烃的衍生物[烃的衍生物的比较]分子结构特类别官能团点卤碳-卤键(C卤原子(-代- X)有极性,X)易断裂烃分类主要化学性质①氟烃、氯烃、溴烃;①取代反应 (水解反应 ):②一卤烃和多卤烃;③R- X+H2O饱和卤烃、不炮和卤烃R-OH + HX和芳香卤烃②消去反应:R- CH2- CH2X + NaOH醇均为羟基(- OH)酚RCH= H2 + NaX + H2O①取代反应:a.与 Na 等活泼金属反应; b .与 HX 反应,①脂肪醇 (包括饱和c.分子间脱水; d.酯化反应②氧化反应:醇、不饱和醇 );②脂- OH 在非苯环醇 (如环己醇 )③芳2R- CH2OH + O2环碳原子上香醇 (如苯甲醇 ),④一2R- CHO+2H2O元醇与多元醇 (如乙二③消去反应,醇、丙三醇 )CH3CH2 OHCH2= H2↑ + H2O- OH 直接连①易被空气氧化而变质;②具有弱酸性③取在苯环碳原一元酚、二元酚、三元代反应醛基醛(- CHO)上.酚类中均酚等含苯的结构分子中含有①脂肪醛(饱和醛和不醛基的有机饱和醛 );②芳香醛;物③一元醛与多元醛④显色反应①加成反应 (与 H2加成又叫做还原反应): R- CHO+H2R- CH2OH②氧化反应:a.银镜反应;b.红色沉淀反羧基羧酸(- COOH)应: c.在一定条件下,被空气氧化①脂肪酸与芳香酸;②①具有酸的通性;②酯化反应分子中含有一元酸与多元酸;③饱羧基的有机和羧酸与不饱和羧酸;物④低级脂肪酸与高级脂肪酸水解反应:羧酸酯基(R 为烃基或H 酯原子, R′只能为烃基 )①饱和一元酯:RCOOR′ + H2O CnH2n+lCOOCmH2m+1RCOOH + R'OH ②高级脂肪酸甘油酯③聚酯④环酯RCOOR′ + NaOHRCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例 (反应的化学方程式)有机物在一定条件下,从一个CH2= H2↑ + H2O 消去反应分子中脱去一个小分子(如C2H5OHH2O、 HBr 等 )而生成不饱和 (含双键或叁键 )化合物的反应苯酚的显色反应苯酚与含 Fe3+的溶液作用,使溶液呈现紫色的反应CH≡ CH + H2CH2= H2还原反应有机物分子得到氢原子或失去CH2=H2 + H2氧原子的反应CH3CH3R— CHO + H2R- CH2OH燃烧或被空2CH3CH2OH + O22CH3CHO + 2H2O 气中的 O2氧氧化有机物分子得到氧原子或失去2CH3CHO + O22CH3COOH化反氢原子的反应CH3CHO + 2Ag(NH3)2OH银镜反应CH3 COONH4+2Ag↓ + 3NH3↑ + H2O应红色沉淀反CH3 CHO + 2Cu(OH)2CH3COOH + Cu2 O↓ + 2H2O 应卤代烃的在 NaOH 水溶液的条件下,卤R- CH2X + H2O RCH2OH + HX 代烃与水作用,生成醇和卤化水解反应氢的反应取酸 (无机含氧酸或羧酸)与醇作代用,生成酯和水的反应RCOOH + R'CH2OH酯化反应反RCOOCH2R′ + H2O应在酸或碱存在的条件下,酯与酯的水解反RCOOR′ + H2O RCOOH + R'OH水作用生成醇与酸的反应应RCOOR′ + NaOH →RCOONa + R'OH3.同分异构体的有关知识[同分异构体的熔点、沸点高低的规律]①当为脂肪烃的同分异构体时,支链越多 (少 ),沸点越低 (高 );②当为含两个侧链的苯的同系物时,侧链相隔越远 (近 ),沸点越高 (低 ).[同分异构体的书写规律]①同分异构体的书写规律:要准确、完全地写出同分异构体,一般按以下顺序规律进行书写:类别异构+ 碳链异构一位置异构.②碳链异构 (烷烃的同分异构体)的书写技巧:a.先写出不含支链的最长碳链;b.然后写出少 1 个碳原子的主链,将余下的 1 个碳原子作支链加在主链上,并依次变动支链位置;c.再写出少 2 个碳原子的主链,将余下的 2 个碳原子作为一个乙基或两个甲基加在主链上,并依次变动其位置(注意不要重复);d.以此类推,最后分别在每个碳原子上加上氢原子,使每个碳原子有 4 个共价键.说明a.从上所述可归纳为:从头摘、挂中间,往端移、不到边,先甲基、后乙基,先集中、后分散,变换位、不能同. b .在书写烯烃或炔烃的同分异构体时,只要在碳链异构的基础上依次变动碳碳双键或碳碳叁键位置即可.[烃的同分异构体种数的确定方法]①等效氢法.烃分子中同一种类的氢原子称为等效氢原子.有机分子中有几种不等效氢原子,其氢原子被一种原子或原子团取代后的一取代物就有几种同分异构体.等效氢原子的一般判断原则:a.位于同一碳原子上的H 原子为等效H 原子.如CH4中的 4 个 H 原子为等效 H 原子. b.位于同一 C 原子上的甲基上的 H 原子为等效H 原子.如新戊烷 (CH3)4C 上的 12 个 H 原子为等效 H 原子. c.同一分子中处于对称位置或镜面对称位置上的H 原子为等效 H 原子.对于含苯环结构的分子中等效 H 原子的种数的判断,应首先考虑苯环所在平面上是否有对称轴,若没有,则还应考虑是否有垂直于苯环平面的对称轴存在,然后根据对称轴来确定等效H 原子的种数.②换元法.换元法是要找出隐含在题目中的等量关系,并将所求对象进行恰当地转换.例如,已知正丁烷的二氯代物有 6 种同分异构体,则其八氯代物的同分异构体有多少种正丁烷 C4 H10。
烃的衍生物知识点归纳

烃的衍生物知识点归纳烃是由碳和氢元素组成的有机化合物家族,是天然气、煤油和石油的主要成分。
由于其分子结构简单,烃具有许多重要的应用领域,包括燃料、化学原料和制药等。
本文将整理烃的衍生物知识点,以帮助读者更好地了解烃化合物的特性和应用。
1. 烃的分类烃可以根据碳原子的结构和连接方式进行分类。
最简单的烃是烷烃,由单个碳-碳单键组成。
其他类别包括烯烃(含有碳-碳双键)和炔烃(含有碳-碳三键)。
2. 烃的命名烃的命名方法基于碳原子的数量和连接方式。
烷烃的命名使用前缀和后缀的组合,例如甲烷、乙烷、丙烷等。
烯烃和炔烃的命名使用前缀、中缀和后缀,例如乙烯、丙烯、乙炔等。
3. 烃的物理特性烃的物理特性与其分子结构和分子量有关。
通常,烃具有较低的沸点和熔点,是易燃的液体或气体。
随着分子量的增加,烃的密度和黏度也会增加。
4. 烃的化学性质烃的化学性质主要与有机反应有关。
对于烃基本上是非极性分子,它们通常不会发生直接的化学反应。
然而,通过在化学反应中引入适当的催化剂、温度和压力条件,烃可以被氧化、加成、取代等。
5. 烃的衍生物烃衍生物是通过对烃进行功能化改变而产生的化合物。
主要的烃衍生物包括醇、醚、酮、羧酸、醛、胺、卤代烃等。
6. 烯烃的衍生物烯烃衍生物是通过对烯烃进行不同的反应而形成的。
烯烃的衍生物包括环烯烃、烯烃醇、烯烃醛、烯烃酸等。
7. 炔烃的衍生物炔烃衍生物是通过对炔烃进行不同的反应而形成的。
炔烃的衍生物包括环炔烃、炔烃醇、炔烃醛、炔烃酸等。
8. 烷烃的衍生物烷烃衍生物是通过对烷烃进行不同的反应而形成的。
烷烃的衍生物包括醇、醚、酮、醛、胺、酸等。
9. 烃衍生物的应用烃衍生物广泛应用于多个领域。
醇是重要的溶剂和溶剂中间体,醚常用作溶剂、非极性溶剂和反应中间体,酮可以用作溶剂、溶剂中间体和有机合成中间体,羧酸常用于制备酯类化合物,胺是重要的有机合成试剂等。
10. 烃衍生物的制备方法烃衍生物的制备方法多种多样,包括催化加氢、氧化、取代、加成等。
高中化学烃的衍生物知识点
高中化学烃的衍生物知识点化学是我们生活中广泛应用的学科,也是高中学业中流程科目之一。
其中烃是很重要的一个化学分支,包括一类由碳和氢原子组成的有机化合物。
烃的衍生物非常广泛,有很多在生活中被广泛使用,下面就介绍一下高中化学中关于烃衍生物的知识点。
一、烃的衍生物简介烃的衍生物是由烃分子中的一个或多个氢原子被其他原子或分子所取代的化合物。
根据取代基的不同,烃的衍生物可以分为醇、酚、醛、酮、羧酸、酯、胺、腈、卤代烃、烷基卤化物以及芳族烃等多种。
这些化合物在工业化学及日常生活中应用广泛,如酒精、羧酸类化合物、氨、麻醉剂等。
二、醇醇是烃的一种衍生物,它的分子中含有一个或多个羟基(-OH)。
醇以它的羟基而得名,例如甲醇、乙醇和丙醇等。
醇有许多性质和功能,其中最常见的是作为饮料或用于生产其他有机化合物,比如酯。
三、酚酚是一种由苯环上的一个氢原子被羟基所取代的有机化合物,化学式为C6H5OH。
酚可以作为消毒剂、防腐剂和颜料等方面的原料,同时也可制成不少药品,例如阿司匹林、麻醉剂。
但由于酚具有剧烈的腐蚀性和毒性,过度使用会引起严重的健康问题。
四、醛与酮醛和酮都是由烃分子中的碳氢键被氧原子所取代的化合物。
它们之间的区别是醛分子中有一个羰基(C=O),而酮分子中有两个羰基。
常见的醛包括甲醛和乙醛,可以用于杀菌、熏蒸等方面;酮则包括丙酮、己酮等,可以用于催化反应、制作绝缘材料。
五、羧酸羧酸分子中含有一个羧基(-COOH),能够与醇或胺形成酯或酰胺。
羧酸可以分为饱和脂肪酸和不饱和脂肪酸。
饱和脂肪酸存在于许多生物中,例如麻油、黄油、椰子油等,而不饱和脂肪酸则分布在水生和陆生动物中,例如鱼油、坚果等。
六、酯酯分子中含有一个羧酸和一个醇分子中的氢原子被取代掉了,能够用于制备香料、溶剂等。
酯可以按是否含有羰基分为二元酯和酸酐。
二元酯是指含有一个酸基和一个醇基的酯,例如甲酸乙酯、乙酸丙酯等。
而酸酐是由两个酸分子的羧基进行结合形成的,例如醋酸酐。
高二化学烃的衍生物知识总结
高二化学烃的衍生物知识总结更多资源重庆市涪陵实验中学王俊明育儿故事,家长读物,少儿英语,教案,习题烃的衍生物知识总结卤代烃醇类烃的衍生物醛类羧酸酯酚子取代后的产物。
(卤素原子) 通式一、卤代烃:烃分子中的氢原子被卤素原CnH2n+1X代表物C2H5BrNaOH1、取代反应:C2H5Br + H2O 、取代反应:水解反应) (水解反应)C2H5OH + HBr2、消去反应:C2H5Br + NaOH 、消去反应:+H2O醇△CH2==CH2 + NaBr育儿故事,家长读物,少儿英语,教案,习题卤代烃卤代烃中卤素原子的检验:取少量卤代烃,加NaOH溶液,一段时间后加HNO3酸化后再加AgNO3,如果有白色沉淀说明有Cl, 如有浅黄色沉淀则有Br,如有黄色沉淀则有I。
育儿故事,家长读物,少儿英语,教案,习题烃的衍生物知识总结烃的衍生物卤代烃醇类醛类羧酸酯酚通式:R―OH,饱和一元醇CnH2n+1OH醇类代表物*****H(1)中性不电离出OH-和H+; (2)与K、Ca、Na等活泼金属反应放出H2; 化性(3)催化氧化生成醛;(4)酯化成酯;(5)脱水生成乙烯或乙醚。
制法(1)乙烯水化(2)淀粉发酵育儿故事,家长读物,少儿英语,教案,习题醇:主要化学性质2C2H5ONa + H2 CH2==CH2 + H2O1、取代反应:2C2H5OH + 2Na 取代反应:2、消去反应:C2H5OH 消去反应:浓H2SO4 1700C3、氧化反应:氧化反应:点燃燃烧:C2H5OH +3 O2 燃烧:催化氧化:催化氧化:2C2H5OH + O2 酯化反应:4、酯化反应:催化剂2CO2 +3H2O 2CH3CHO + H2O育儿故事,家长读物,少儿英语,教案,习题烃的衍生物知识总结烃的衍生物卤代烃醇类醛类羧酸酯酚物理性质:净的苯酚是没有颜色的晶纯体,具有特殊的气味,露置在空气中氧化变成粉红色因小部分发生氧化氧化而显粉红色常温粉红色。
烃的衍生物知识总结精选全文完整版
可编辑修改精选全文完整版烃的衍生物知识总结一、卤代烃(代表物C 2H 5Br ):烃分子中的氢原子被卤素原子取代后的产物。
(卤素原子) 1、通式: C n H 2n+1X 、 R —X 2、化学性质:(1)、取代反应:C 2H 5Br + H 2O C 2H 5OH + HBr (水解反应)C 2H 5Br + NaOH C 2H 5OH + NaBr(2)、消去反应:C 2H 5Br + NaOH CH 2==CH 2↑+ NaBr +H 2O 3、卤代烃中卤素原子的检验:取少量卤代烃,加NaOH 溶液,加热,一段时间后加HNO 3酸化后再加AgNO 3,如有白色沉淀说明有Cl ¯,如有浅黄色沉淀则有Br ¯,如有黄色沉淀则有I ¯。
二、醇(代表物:CH 3CH 2OH )1、通式:R —OH ,饱和一元醇C n H 2n+1OH2、化学性质:(1)非电解质,中性,不电离出H+; (2)与K 、Ca 、Na 等活泼金属反应放出H 2; 2C 2H 5OH + 2Na 2C 2H 5ONa + H 2↑(3)氧化反应:燃烧:C 2H 5OH +3O 2 2CO 2 +3H 2O 催化氧化:2C 2H 5OH + O 2 2CH 3CHO + H 2O(4)脱水生成乙烯或乙醚。
消去反应: C 2H 5OH CH 2==CH 2↑+ H 2O 取代反应:2C 2H 5OH CH3CH 2OCH 2CH 3+ H 2O(5三、酚(代表物:) 1、化学性质:(1)、弱酸性:酸性: + NaOH + H 2O弱酸性: + H 2O + CO 2 + NaHCO 3(强酸制弱酸)(2)、取代反应: + 3Br 2↓ + 3HBr (3)、显色反应:与Fe 3+反应生成紫色物质 四、醛(代表物:CH 3CHO 、HCHO )1、通式:RCHO ,一元饱和醛:C n H 2n+1CHO ,分子式:C n H 2n O2、化学性质:(1)、加成反应:CH 3CHO + H 2催化剂 △CH 3CH 2OH (还原反应)NaOH △醇 △—OH —OH—ONa—ONa —OH —OH —OH BrBrBr点燃Cu 或Ag △浓硫酸170℃浓硫酸 140℃△(2)、氧化反应:①催化氧化:2CH 3CHO + O 2催化剂 △2CH 3COOH②银镜反应:CH 3CHO +2 Ag (NH 3)2OH△2Ag ↓+ CH 3COONH 4 +3 NH 3 + H 2O③与新制Cu (OH )2反应:CH 3CHO + 2Cu (OH )2△Cu 2O + CH 3COOH + 2H 2O3、制法:(1)乙烯氧化法 (2)乙炔水化法 (3)乙醇氧化法 五、羧酸(代表物: CH 3COOH 、HCOOH )1、通式:R —COOH ,一元饱和酸C n H 2n+1COOH ,分子式C n H 2n O 22、化学性质:(1)具有酸的通性(羧酸盐几乎全溶于水):CH 3COOH + NaOH === CH 3COONa + H 2O2CH 3COOH +2 Na → 2CH 3COONa + H 2↑ CH 3COOH + NaHCO 3→ CH 3COONa + H 2O+CO 2↑ (2)与醇酯化成酯(酸脱羟基醇脱氢): CH 3COOH + CH 3CH 2OH浓硫酸 △CH 3COOCH 2CH 3 + H 2O(3)甲酸、甲酸盐、甲酸形成的酯都具有醛基能发生银镜反应。
高二化学烃的衍生物性质归纳总结
; sky平台 sky登录 sky注册;
古门)叁叁贰1佛意共修叁叁贰1根汉也将这张他们记忆深处の仙图,给拓印了出来,仔细观.dt.令人震惊の是,这张仙图上出现の,竟然是壹座无比宏大の仙城,竟然和当年自己在古仙界中.那个林蒙至高神,呆の那壹座超级仙城,极为相似.甚至极有可能就是同壹座,绝对不会错.这就令根汉混 沌了,凌乱了,时空观念完全有些迷糊了.按理说这盘古门是六千年前の壹个小势力,当年の盘古门主也是六千年前の人物.而这副仙图上显示の,却是盘古门主,出现在当时无比繁华の超级仙城中の画面.可是超级仙城当年根汉就去,绝对不可能只荒废个几千年,最少也得有大几百万年,甚至是 上千万年了.这两者之间の时间轴完全是对不上,是错乱の.疑点确实是很多,这不由得让根汉联想到了北天の事情.北天按理说,是地球上只早自己三十几年の人物,但是出现在这个时代の时间,最少得比自己早上千万年.可是这也出现了交集了,按理说也无法解释这些东西.不过他现在经过了 这件事情之后,他想到了壹种可能,会不会有人可以自如の穿梭时空呢.或者更大胆の猜想是,有人可以捣乱时空,控制时间呢.如果真是这样の话那真是太可怕了,竟然有人可以做到这种地步,但是壹切都是有可能の,也不是不可能の.根汉和白狼马在这里大吃了壹顿,之后便来到了这东湖.喇嘛 族の祖地,在这东湖の南面,快接近于海洋了,距离海洋也只有区区の二十几万里了.这个喇嘛族の祖地内,多是壹些横亘の山脉,还有壹些原始树林,险竣の山峰在这里十分常见.这里の地势如此险竣,注定了这里只能居住修行者,普通人在这样の地方是很难生存の.不过即使是如此,在这方圆三 万里之内,几乎是任何の壹个其它の人.根汉の修为达到了天神之境,来到这祖地外面の时候,却也感应到了这里有着强大无比の封印.在最外面の这壹圈,有十二个人在把守,整个祖地外面,也就只有这十二个人把守.不过这十二个人の修为可不弱,全部在十二星准至尊之境,修为都不相上下.根 汉仔细の观察之后,才发现这十二人,原来是正好在这里主持这里の十二天干之阵の.十二天干之阵,用十二位,十二星准至尊来主持,可以说这个封印の力量会达到最大化.就算是他根汉要进入,也要费些功夫,不是瞬间就能进入里面の.根汉和白狼马来到了这法阵の外面,白狼马问根汉说:"大 哥,才十二星准至尊而已,你咱兄弟上去包了圆这阵不就不攻自破了吗?""你小子能不能动点脑子."根汉有些无语道:"你现在冲上去是爽了,可是人家里面の人能没反应吗?""呃,不就是壹个小小の喇嘛族嘛,其实咱本人最讨厌什么喇嘛の了."白狼马嘀咕了壹句.根汉却不想小瞧了任何壹个种 族,而且从种族论来说,喇嘛肯定也是出自佛宗了.只不过到底得到了多少佛宗の传承,现在就不知道了,与佛扯上关系の,都不会太简单.壹不小心就有可能着了人家の道,何况这里是十二天干之阵.若是找来十二位天神,布下这十二天干之阵,那自己也会陷入麻烦之中.在修行界混了这么多年了, 根汉可是很清楚の知道,轻敌の后果.何况自己这回来,只是想用壹下人家の传送阵,也不想和人家结下什么梁子,只不过直接上门拜访,也不太合适.还是悄无声息の进去,再悄悄の离开是最好不过の了.为此根汉还特意,在这之前就易了容了,换作了壹个大叔の面容,让白狼马也稍加打扮了壹下. 要解十二天干之阵,并不是特别容易,但对根汉来说也不是困难到家の事情.在这里呆了壹天之后,根汉和白狼马成功の进入法阵中,面前立即景象大变."乖乖,怪不得人家の势力范围这么小了,八成是外面の几万里の地域了."刚进来,这白狼马便啧啧叫了几声,因为这里面和外面完全不是壹个 世界.外面好像是壹片片の原始山脉,穷山恶水の,但是这完全是因为外面の十二天干之阵の原因.里面是壹个玄世界,光是面积就达到了方圆百万里之巨,而且有着优美の环境,大量の灵脉,灵湖,灵水在里面交汇.这里面の灵气浓度,最少是外面の三到五倍.而且这里面最显眼の,便是前面の几 座高约万米の,建在山巅の佛塔.这些佛塔神光闪烁,而且里面还释放着阵阵佛音,这些佛音令这壹个玄世界中の佛境大升.而且像这样の佛塔,就足足有壹百零八座之多.根汉仔细观,也是惊叹于这个地方の先人の智慧,这是壹个内湖,或者说是壹个内世界.但是被不知道什么人,给压缩了,再辅 了十二天干之阵,所以外面の人乍就像这壹带只有方圆几万里.其实则不然,完全是因为高人の强大手段,将地域进行压缩了.而且这里の地貌,壹道有很悠久の历史了,绝对不是几十万年就能形成の地貌.里面の地貌完全没有破坏,只是在原有の基础上,建了壹百零八座这样の佛塔.其它の地方, 甚至是连壹座佛庙也没有,也就是说整个方圆百万里の神地之内,只有壹百零八座佛塔.白狼马问根汉:"大哥,咱们这回是不是要发壹笔呀.""发你个头."根汉笑了:"这地方有什么好发の,都是壹些喇嘛の居住之所.""那些佛塔壹定不壹般,不是都在发光嘛,说不定里面有大量の宝珠之类の,还 有壹些上古佛经,哪怕是弄几部大佛の经来也行呀."白狼马在这里臆想."你想多了."根汉无奈の苦笑,这世上可没有几部完整の大佛经,就算是当年自己得到了九世佛弥勒佛の自传.里面也没有留下完整の古佛经,上古の大佛们,似乎并不乐衷于将自己の佛经写下来.壹般来说,自己の佛经只是 自己诵念,写下来の只会写别人の佛经.也就是说,壹般只有别人写你の,而你写别人の.可是大佛们壹般可能很少与弱者交流,弱者也就没机会聆听他们の古经,也就无法写下来留下传承了.根汉和白狼马立即飘了下去,来到了最近の壹座佛塔面前.到了近前之后,就可以将佛塔清楚了,这座佛塔 大概有壹万米高,建在壹座几万米の高山上.佛塔高有万米,但是却只有六层.每壹层都有壹千多米高,而且这种佛塔是很细长の,底盘并不是特别大,就像是壹颗颗尖笋似の.根汉他们来到这座佛塔之后,外面有淡淡の佛印,想进入其中还有些麻烦.不过对于根汉来说,这都不是问题,好歹他也算 半个九世佛の传人了,得到了九世佛の自传书.所以对于这道佛印,经过他壹会尔の破的之后,便将这佛印给解开了.他带着白狼马两人乘坐青莲,施展隐遁之术,进入了佛塔."这也太简陋了吧."刚进来白狼马就大为失望,放眼望去,这里面就没半件豪华の东西.地板是普通の玉石,甚至还有些粗 糙不平,绝对算不上精致,只是壹般の货色,也没有什么特别の.而且大厅の墙壁上,也没有悬挂什么,光秃秃の壹片片,上面还有些破旧.这里面也没有佛珠,佛衣之类の东西,只是壹个空旷の大厅,壹个人也没有.根汉也仔细の这个佛塔の壹楼,确实是下面什么也没有,穷酸の有些过了.不过根汉 还是将目光,锁定在了这里の二楼,立即带着白狼马上去了.结果这二楼还是令二人大为失望,同样是壹无所获,壹个人影也没有,也没有半件稍微还能值得用の东西出现."上面有人,你小心壹些."每壹层佛楼之间,都有壹层淡淡の封印,所以根汉他们想要更上壹层楼,都要破的壹层封印.这里虽 然有些穷酸,但是安全措施却是做の相当不错の.根汉将这第三层の封印给解开了,对他来说只是随手の事情,上面终于是有人了,也可以知道壹些有价值の消息了.根汉和白狼马上楼了,结果刚到这里,白狼马险些就尖叫出声.要不是根汉壹手捂住了这家伙の嘴巴,还真就叫出来了.白狼马壹双 眼睛瞪の大大の,死死の面,简直不敢相信呀."你小子淡定壹些,没见过女人吗!"根汉狠狠の刮了他壹眼,传音告诉白狼马:"别大惊小怪の,这应该是佛意共修.""佛意共修?"白狼马传音对根汉说:"乖乖个隆,竟然是女人和女人呀,这是两女喇嘛呀,只不过这也太漂亮了壹些吧."本书来自//htl (正文叁叁贰1佛意共修)叁叁贰贰欢颜叁叁贰贰白狼马壹双眼睛瞪の大大の,死死の面,简直不敢相信呀.请大家搜索()!更新最快の"你小子淡定壹些,没见过女人吗!"根汉狠狠の刮了他壹眼,传音告诉白狼马:"别大惊小怪の,这应该是佛意共修.""佛意共修?"白狼马传音对根汉说:"乖乖 个隆,竟然是女人和女人呀,这是两女喇嘛呀,只不过这也太漂亮了壹些吧."根汉此时也是皱起了眉头,在他们の面前不远处,摆放着壹张冰床,此时上面正有两具绝美の仙肌正扭在上面.正做着壹些超友谊の事情呢,身上寸缕未着,所以白狼马刚刚才会险些尖叫出来.而且这两个女人の身边,还 放着她们の袍子,明显是喇嘛の袍子.更令根汉二人惊讶の是,这两个女人还全部是光头,不过即使是光头,也无法掩饰她们の绝美容颜.而且正因为是女光头,同时还那样の美,确实是会给人带来壹种,不同寻常の视觉冲击效果.起码根汉和白狼马闯荡这九天十域壹千多年了,确实也是头壹回见 到这么漂亮の女光头,而且还在做这种事情.白狼马这家伙,因为施展了隐遁之术就凑到人家两人の旁边,好在这两个女喇嘛の修为并不是特别高.现在大概也就只有壹星准至尊之境,应该无法发现白狼马,所以根汉也不管这白狼马,让他凑过去根汉却也只是刚开始有些吃惊,不过他马上就开始 检查这三楼了,不像白狼马那货恨不得自己现在就加入她们の游戏了.还故意站の那么近,那威锁の表情,确实是叫根汉很丢面子.不过根汉现在正在检查这三楼の情况,壹般来说,佛意共修,是壹种很高级の佛门双.修道法.并不是随便哪两个女人就可以修行の,所以根汉觉得这个地方并不简单, 可能是真有佛宗の高级传承.而且,极有可能是欢.喜佛壹脉の传承.根汉检查了壹圈之后,果然有了壹定の发现,在这里得到了壹些符纹,正是这些符纹可以促使这楼中の两个女喇嘛更加の投入.根汉也用天眼扫了扫这两个女喇嘛の元灵,也获得了壹些令自己吃惊の信息.原来这里根本就不叫什 么喇嘛族,而是欢颜门,在这里の全部是这种女人,只不过她们平时穿の是喇嘛の衣服.而且被选进这里面の,大都是容貌绝美の女人,壹般容貌の女人不会被选进来.要不然这里也不会叫欢颜门,整个欢颜门中没有壹个男人,全部都是女人,而且这里の所有女人都修行の是这种佛意共修の道法. 而且她们还都是有等级の,修行到了最后,就有资格,可以去和她们の门主.也就是欢颜门主,与这些人可以,可以进行佛意共修.可以说这还真是壹个奇葩の门派,所有人更加の��
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学常见的烃的衍生物知识点汇总
高考正在复习中,小编整理了高考化学常见的烃的衍生物知识点汇总,供同学们参考学习。
醇、酚
一、烃的含氧衍生物
烃的衍生物,从组成上看,除了碳(C),氢(H)元素之外,还含有氧(O)。
从结构上看,可以认为是烃分子里的氢原子被氧原子的原子团取代而衍生而来的。
烃的含氧衍生物的种类繁多,可以分为醇,酚,醛,羧酸,酯等(目前高中化学所学)烃的含氧衍生物的性质由所含官能团决定。
二醇类
(1)概念:分子中含有跟链烃基结合着的羟基化合物。
(2)饱和醇通式:CnH2n+1OH,简写为R-OH。
碳原子数相同的饱和一元醇与饱和一元醛互为同分异构体
(3)分类
①按羟基个数分:一元醇、二元醇、多元醇。
一般将分子中含有两个或者以上醇羟基的醇称为多元醇。
②按烃基类别分:甲醇、乙醇、丙醇。
(4)醇类物理性质
沸点变化也是随分子里碳原子数的递增而逐渐升高;沸点、密度不是很规律。
一般醇为无色液体或固体,含碳原子数低于12的一元正碳醇是液体,12或更多的是固体,多元醇(如甘油)是糖浆状物质。
一元醇溶于有机溶剂,三个碳以下的醇溶于水。
低级醇的熔点和沸点比同碳原子数的烃高得多,这是由于醇分子中有氢键存在,发生缔合作用。
饱和醇不能使溴水褪色。
醇化学性质活泼,分子中的碳-氧键和氢-氧皆为极性键。
以羟基为中心可进行氢-氧键断裂和碳-氧键断裂两大类反应。
另外,与羟基相连的碳原子容易被氧化,生成醛、酮或酸。
(5)几种重要的醇
①甲醇
甲醇又称木精,易燃,有酒精气味,与水、酒精互溶,有毒,饮后会使人眼睛失明,量多使人致死。
②乙二醇
乙二醇是无色、粘稠、有甜味的液体,凝固点低,可作内燃机抗冻剂,同时是制造涤纶的原料,舞台上的发雾剂。
③丙三醇
丙三醇俗称甘油,没有颜色,粘稠,有甜味,吸湿性强——制印泥、化装品:凝固点低——防冻剂;制硝化甘油——炸药。
乙醇
一、乙醇的物理性质和分子结构
1.乙醇的物理性质
乙醇俗名酒精,无色、透明、有特殊香味的液体;沸点78℃;易挥发;密度比水小;能跟水以任意比互溶;能溶解多种无机物和有机物。
2.乙醇的分子结构
a.化学式:C2H6O;结构式:
b.结构简式:CH3CH2OH或C2H5OH
二、乙醇的化学性质
1.乙醇与钠的反应
①无水乙醇与Na的反应比起水跟Na的反应要缓和得多;
②反应过程中有气体放出,经检验确认为H2。
在乙醇与Na反应的过程中,羟基处的O—H键断裂,Na原子替换了H原子,生成乙醇钠CH3CH2ONa和H2。
化学方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,取代反应。
为什么乙醇跟Na的反应没有水跟Na的反应剧烈?
乙醇分子可以看成水分子里的一个H原子被乙基所取代后的产物。
由于乙基CH3CH2—的影响,使O—H键的极性减弱,即:使羟基—OH上的H原子的活性减弱,没有H2O分子里的H原子活泼。
2.乙醇的氧化反应
a.燃烧
b.催化氧化
乙醇除了燃烧,在加热和有催化剂存在的条件下,也能与氧
气发生氧化反应,生成乙醛:
3.乙醇的消去反应
①实验室制乙烯的反应原理,并写出该反应的化学方程式
②分析此反应的类型
讨论得出结论:此反应是消去反应,消去的是小分子——水在此反应中,乙醇分子内的羟基与相邻碳原子上的氢原子结合成了水分子,
结果是生成不饱和的碳碳双键
注意:
①放入几片碎瓷片作用是什么?防止暴沸。
②浓硫酸的作用是什么?催化剂和脱水剂
③酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%
的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
④为何要将温度迅速升高到170℃?温度计水银球应处于什么位置?
因为需要测量的是反应物的温度,温度计感温泡置于反应物的中央位置。
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
[补充]③如果此反应只加热到140℃又会怎样?[回答]生成另一种物质——乙醚。
消去反应:有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等),而生成不饱和(含双键或三键)化合物的反应。
醛
脂肪醛是指分子中碳原子连接成链状的一种醛,呈开链状。
脂环醛是指分子中碳原子连接成闭合的碳环。
芳香醛的羰基直接连在芳香环上。
萜烯醛是萜类化合物的一个分支。
1.1脂肪族化合物是指分子中碳原子间相互结合而成的碳链,不成环状。
脂肪醛是脂肪族化合物的一种分类。
常见的无环脂肪醛有:辛醛、壬醛、癸醛、十一醛、月桂醛(十二醛)、十三醛、肉豆蔻醛(十四醛)、甲基己基乙醛、甲基辛基乙醛、甲基壬基乙醛、三甲基己醛、四甲基己醛、反-2-己烯醛、2-壬烯醛、反-4-癸烯醛、十一烯醛、壬二烯醛等。
1.2脂环族化合物可看作是由开链族化合物连接闭合成环而得。
脂环醛是脂环族化合物的一种分类。
常见的脂环醛有:女贞醛、艾薇醛、异环柠檬醛、柑青醛、甲基柑青醛、新铃兰醛等。
1.3芳香醛的羰基直接连在芳香环上,这类醛可以看成是苯的衍生物。
常见的芳香醛有:苯甲醛、苯乙醛、苯丙醛、桂醛、铃兰醛、香兰素、乙基香兰素等。
1.4萜烯醛是指萜类化合物的一种分类,萜类化合物是指具有(C5H8)n通式以及其含氧和不同饱和程度的衍生物。
常见的萜烯醛有:柠檬醛、香茅醛、羟基香茅醛、紫苏醛、三甲基庚烯醛等。
按官能团分
醛可以分为一元醛、二元醛和多元醛。
按饱和程度分
醛可以分为,饱和醛,不饱和醛。
