专题1常见气体的制取
高中18种常见气体制备原理(只有方程式)

高中18种常见气体制备原理(只有方程式) 高中常见18种气体的制备方法一、氢气实验室制法:锌和稀硫酸反应,生成锌硫酸和氢气。
工业制法:碳和水蒸气反应,生成一氧化碳和氢气,或者一氧化碳和水蒸气反应,生成二氧化碳和氢气。
二、一氧化碳实验室制法:甲酸和浓硫酸反应,生成一氧化碳和水。
工业制法:碳和水蒸气反应,生成一氧化碳。
三、二氧化碳实验室制法:碳酸钙和稀盐酸反应,生成氯化钙、二氧化碳和水。
工业制法:碳酸钙分解,生成氧化钙和二氧化碳。
四、甲烷实验室制法:乙酸钠和氢氧化钠反应,生成碳酸钠和甲烷。
五、乙烯实验室制法:乙醇和浓硫酸反应,生成乙烯和水。
工业制法:石油裂解或烷基化反应,生成乙烯。
六、乙炔实验室制法:电石和水反应,生成氢氧化钙和乙炔。
七、氮气实验室制法:亚硝酸钠和氯化铵反应,生成氮气、氯化钠和水,或者氧化铜和氨水反应,生成铜和氮气。
工业制法:液化空气再蒸馏,先蒸出氮气。
八、氨气实验室制法:氢氧化钙和氯化铵反应,生成氯化钙、氨气和水,高温高压。
工业制法:氮气和氢气催化反应,生成氨气。
九、一氧化氮实验室制法:铜和稀硝酸反应,生成硝酸铜和一氧化氮。
工业制法:氨气和氧气反应,生成一氧化氮和水,催化剂存在。
十、二氧化氮实验室制法:铜和浓硝酸反应,生成硝酸铜、二氧化氮和水。
工业制法:一氧化氮和氧气反应,生成二氧化氮。
十一、氧气实验室制法:高锰酸钾分解,生成高锰酸钾、氧气和二氧化锰,或者二氧化锰和氯酸钾反应,生成氯化钾、氧气和水。
工业制法:液化空气再蒸馏,蒸出氧气。
十二、SO2的制法在实验室中,可以通过将Na2SO3和浓度不低于70%的H2SO4反应来制得SO2,反应产物为Na2SO4、SO2和H2O。
而在工业上,可以将4FeS2和11O2反应,得到2Fe2O3和8SO2.另外,还有一种点燃硫和氧气反应的方法,可以得到SO2.十三、H2S的制法在实验室中,可以通过将FeS和稀盐酸反应来制得H2S,反应产物为FeCl2和H2S。
常见的气体制取与净化

千里之行,始于足下。
常见的气体制取与净化
常见的气体制取与净化方法有:
1. 空气分离法:通过空气分离装置将空气中的氮气、氧气等组分分离出来,得到高纯度的氮气、氧气等气体。
2. 化学合成法:根据不同气体的物理性质和化学性质,通过化学反应生成目标气体。
例如,氢气可以通过水电解反应或碳一烯饱和蒸馏法制取。
3. 燃烧法:某些气体可以通过燃烧反应制取,如氢气可以通过金属与酸的反应或铝水与水的反应制取。
4. 吸附法:利用吸附剂(如活性炭)将气体分子吸附在表面上,从而实现气体的净化。
例如,对空气中的有害气体进行净化。
5. 洗涤法:将气体与液体接触,通过溶解、循环冲洗等方法,去除气体中的杂质。
例如,对氯气进行液体洗涤以去除其中的杂质。
6. 膜分离法:利用特殊材料的膜进行分离,根据气体分子的大小、形状和亲疏水性等特性来实现气体的分离和纯化。
例如,利用膜分离技术可以将二氧
化碳从天然气中分离出来。
7. 冷凝法:通过降低气体温度使其冷凝,从而分离出目标气体。
例如,液化空气工艺中通过降低空气温度来分离出液态氧气和液态氮气。
这些方法在工业生产和实验室研究中被广泛应用,以满足不同领域的气体
制取和净化需求。
第1页/共1页。
实验室制取气体方法

实验室制取气体方法
在实验室中,制取气体的方法可以根据气体的性质和制备要求不同而有所差异。
以下是一些常见的实验室制取气体的方法:
1. 蒸发法:某些易挥发的液体可通过加热使其蒸发,然后将气体冷凝收集。
2. 氢化物法:将适量的金属与酸性溶液反应,生成氢气。
例如,铍与硫酸反应生成硫酸铍,然后通过加热分解得到氢气。
3. 碱金属与水反应法:将碱金属(如钠、钾)与水反应,产生氢气。
4. 酸与金属反应法:将适量的酸性溶液与金属反应,生成相应的金属盐和氢气。
例如,用盐酸与锌反应可以制取氢气。
5. 高温分解法:一些化合物在高温下可以分解产生气体。
例如,高温下加热重铬酸钠可以产生氧气。
6. 导电式电解法:利用电解原理将水或者其他适合的溶液分解为氧气和氢气。
例如,用电解法可以制取氧气和氢气。
7. 吸附法:某些气体可以通过特定的材料吸附和分离出来。
例如,通过活性炭吸附可制取氯气。
以上只是一些常见的实验室制取气体的方法,还有其他更具体的制取方法根据不同气体的性质和要求而存在。
在操作中,要注意安全操作和防范有毒或易燃气体的泄漏。
常见气体的制取

常见气体的实验室制取【考纲要求】1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)2.与其它各部分知识、技能的综合应用。
【知识要点】一、课本中的气体制备二、气体的制取实验室气体制备的一般步骤有:制取→净化→收集→尾气吸收(一)气体的发生装置常见的气体制取装置有:或填写下表:32H2+4HCl MnClCaCl2)选择发生装置的根据是。
(二)气体的净化装置或欲除去下列气体中的杂质,写出选用的试剂和装置气体选择净化装置的根据是。
(三)气体的收集装置 或或或选择收集装置的根据是 。
(四)气体的尾气吸收选择尾气吸收装置的根据是 。
【典型例题】例1、(课本《必修1》P99页)下图是实验室制取氨气的常用装置,某同学欲用该装置制取、收集干燥纯净的氨气,试分析其是否严谨?若不严谨,应如何改进?试画出改进后的实验装置图。
例2、(课本《必修1》P50页)铁能与水蒸气反应,反应化学方程式为 。
常用反应装置如下图。
如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其他必要的仪器和物品,设计一套简单的实验装置,使还原铁粉与水蒸气反应(这套装置应包括水蒸气发生、水蒸气与铁粉反应、检验产生的气体等部分)。
画出你设计的装置简图。
例4、(课本《选修6》P22)回忆初中化学课程中制取二氧化碳的实验,思考下列问题:(1)能够通过化学反应产生二氧化碳气体的物质有哪些?(2)制取二氧化碳的实验中,以什么物质为反应物(原料)?为什么?(3)反应的装置是如何选择和安装的?(4)如果要制备干燥的气体产物,应如何设计装置?例3、(课本《必修1》P92页)现给你一试管二氧化氮,其他药品和仪器自选。
请你设计实验,要求尽可能多地使二氧化氮被水吸收。
画出你设计的装置简图,简述实验步骤、现象并进行解释。
例5、某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下。
[实验目的] 测量锌和稀硫酸反应的速率[实验用品] 锥形瓶、双孔塞、分液漏斗、直角导管、50mL注射器、铁架台、、量筒;锌粒、1mol·L-1的H2SO4、4mol·L-1的H2SO4。
实验室常见气体的制取精讲
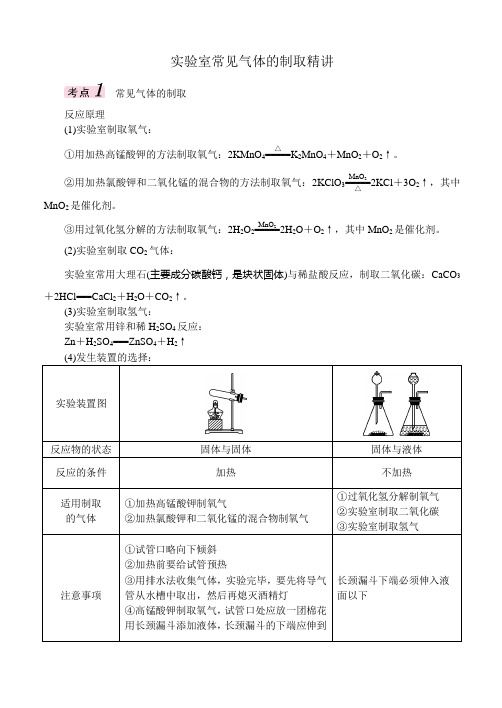
实验室常见气体的制取精讲常见气体的制取反应原理(1)实验室制取氧气:①用加热高锰酸钾的方法制取氧气:2KMnO 4=====△K 2MnO 4+MnO 2+O 2↑。
②用加热氯酸钾和二氧化锰的混合物的方法制取氧气:2KClO 3=====MnO 2△2KCl +3O 2↑,其中MnO 2是催化剂。
③用过氧化氢分解的方法制取氧气:2H 2O 2=====MnO 22H 2O +O 2↑,其中MnO 2是催化剂。
(2)实验室制取CO 2气体:实验室常用大理石(主要成分碳酸钙,是块状固体)与稀盐酸反应,制取二氧化碳:CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑。
(3)实验室制取氢气:实验室常用锌和稀H 2SO 4反应: Zn +H 2SO 4===ZnSO 4+H 2↑ 实验装置图反应物的状态 固体与固体 固体与液体 反应的条件 加热不加热适用制取 的气体①加热高锰酸钾制氧气②加热氯酸钾和二氧化锰的混合物制氧气①过氧化氢分解制氧气 ②实验室制取二氧化碳 ③实验室制取氢气注意事项①试管口略向下倾斜 ②加热前要给试管预热③用排水法收集气体,实验完毕,要先将导气管从水槽中取出,然后再熄灭酒精灯 ④高锰酸钾制取氧气,试管口处应放一团棉花 用长颈漏斗添加液体,长颈漏斗的下端应伸到长颈漏斗下端必须伸入液面以下常见气体最佳发生装置的选择:装置图A B C D装置特点安装简单便于添加液体可以控制反应速率可以控制反应的发生与停止适用范围用于制取少量气体制取较多气体用于剧烈反应时可平稳地获取气流用于持续时间很长的气体制取思考:B中从那个仪器添加液体药品?C装置控制反应速率的原因?还可用什么仪器代替分液漏斗?D是如何控制反应的发生和停止的?根据制取气体的实际需要和反应的具体情况,从上述装置中选择最佳适合需要的装置进行气体的制取。
(5)收集装置的选取:选择收集装置要考虑气体的溶解性、能否与水反应、密度、是否有毒性、能否与空气中的某成分发生化学反应等因素。
中考化学第2部分专题1常见气体的制取真题精练

第二部分 专题一1.(·威海)以下是实验室制取、收集、干燥、存放气体的装置图,有关说法错误的是( B )A .实验室用双氧水制取氧气,用石灰石和稀盐酸制取二氧化碳均可使用装置②B .实验室收集氧气和二氧化碳均可使用装置③,气体从导管b 端进入C .实验室干燥氯气和二氧化碳均可使用装置④,气体从导管a 端进入D .实验室收集的氯气和二氧化碳,均可用如图⑤临时存放2.下面是实验室常用制取气体的装置图,根据装置图回答下列问题:(1)写出标有①②序号的仪器的名称:①试管,②酒精灯。
(2)实验室在B 装置中用双氧水与二氧化锰混合制取氧气的化学方程式:2H 2O 2=====MnO 2 2H 2O +O 2↑。
(3)实验室制取二氧化碳的化学方程式:2HCl +CaCO 3 === CaCl 2+H 2O +CO 2↑,若用G 装置收集二氧化碳,空气会从b 管口排出。
(4)硫化氢(H 2S)在通常状况下是一种无色、有臭鸡蛋气味的气体,密度比空气大,极易溶于水,其水溶液称为氢硫酸。
实验室常用硫化亚铁和稀硫酸反应来制取硫化氢,其反应的化学方程式为FeS +H 2SO 4=== FeSO 4+H 2S↑,则实验室制取硫化氢的发生装置可选用B 装置,收集硫化氢可选用D 或G 装置,干燥硫化氢可选用A(填字母)。
A .浓硫酸B .碱石灰3.(·黔南州)下图是实验室制取气体时常用的装置,请回答下列问题。
(1)仪器①的名称是锥形瓶,仪器②的名称是漏斗。
(2)实验室用氯酸钾和二氧化锰为原料制取氧气的气体发生装置应选A(填编号),化学反应方程式为2KClO 3=====MnO 2△ 2KCl +3O 2↑;反应结束后,欲从剩余残渣中回收氯化钾,现有以下步骤:①蒸发结晶②过滤③洗涤、烘干④溶解,正确的操作顺序是④②①(填序号)。
(3)用盛满水的G 装置收集氧气时,气体应从b(填“a”或“b”)端通入。
(4)实验室制取并收集一瓶干燥的CO 2气体,选用的装置依次是BFC(填编号)。
初中化学常见气体的制取专题教案

初中化学常见气体的制取专题教案一、教学目标1、知识与技能目标(1)掌握氧气、二氧化碳、氢气三种常见气体的实验室制取方法,包括反应原理、实验装置、收集方法和检验方法。
(2)理解气体制取装置的选择依据,能够根据反应物状态和反应条件选择合适的发生装置,根据气体的密度和溶解性选择合适的收集装置。
2、过程与方法目标(1)通过实验探究,培养学生的实验操作能力、观察能力和分析解决问题的能力。
(2)通过小组合作,培养学生的团队协作精神和交流表达能力。
3、情感态度与价值观目标(1)通过实验探究,激发学生学习化学的兴趣,培养学生严谨的科学态度。
(2)通过对实验装置的改进和创新,培养学生的创新意识和环保意识。
二、教学重难点1、教学重点(1)氧气、二氧化碳、氢气的实验室制取方法。
(2)气体制取装置的选择依据。
2、教学难点(1)实验装置的选择和改进。
(2)气体制取的综合实验设计。
三、教学方法讲授法、实验探究法、讨论法四、教学过程(一)导入新课通过展示一些生活中与气体有关的图片,如氧气用于医疗急救、二氧化碳用于灭火、氢气用于填充气球等,引导学生思考这些气体是如何制取的,从而引出本节课的主题——初中化学常见气体的制取。
(二)知识讲解1、氧气的制取(1)反应原理加热高锰酸钾:2KMnO₄△ K₂MnO₄+ MnO₂+ O₂↑加热氯酸钾和二氧化锰的混合物:2KClO₃ 2KCl + 3O₂↑过氧化氢在二氧化锰的催化作用下分解:2H₂O₂ 2H₂O + O₂↑(2)实验装置发生装置:固体加热型(加热高锰酸钾或氯酸钾和二氧化锰的混合物)、固液不加热型(过氧化氢溶液和二氧化锰)收集装置:向上排空气法(氧气的密度比空气大)、排水法(氧气不易溶于水)(3)检验方法将带火星的木条伸入集气瓶中,如果木条复燃,证明是氧气。
2、二氧化碳的制取(1)反应原理碳酸钙与稀盐酸反应:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑(2)实验装置发生装置:固液不加热型收集装置:向上排空气法(二氧化碳的密度比空气大,能溶于水)(3)检验方法将产生的气体通入澄清石灰水中,如果石灰水变浑浊,证明是二氧化碳。
常见气体的制取考点归纳

常见气体的制取考点归纳
考点归纳 1.气体发生装置
2.气体收集方法
[注意]①若要收集干燥气体,则选择排空气法收集;若要收集较为纯净的气体,则选择排水法。
②用A装置收集气体时,要等气泡连续均匀冒出时开始收集;当集气瓶口有较大气泡冒出时,收集满了。
③用排水法测量反应放出的气体体积时,在长导管后连接量筒(量筒中收集到的水的体积就是生成的气体的体积)。
④用C装置收集气体验满时,燃着(或带火星)的木条要放在瓶口。
3.常见气体的检验
[注意]①H2、CO、CH4都具有可燃性,可根据它们燃烧后生成的产物不同来区别。
②混合气体检验时:先检验水蒸气,再检验其他气体。
4.气体的干燥
[注意]干燥剂只能吸收水分,不能与气体发生反应。
一般原则是:酸性干燥剂不能干燥碱性气体,碱性干燥剂不能干燥酸性气体。
5.气体的净化
[注意]①用洗气瓶除杂,一般除杂在前,干燥在后。
②有多种气体需要检验时,一般先检验水,同时,避免前步检验对后步检验的干扰。
③综合性气体实验装置的连接顺序:气体发生装置→气体净化装置→气体干燥装置→性质验证装置→尾气处理装置。
④尾气处理常用方法:
a .溶液吸收,如HCl 、SO 2可用NaOH 溶液吸收。
装置末端导管上接一气球或塑料袋等将尾气收集,如回收CO。
参考答案
考点归纳
3.木条复燃淡蓝尖锐的爆鸣声水珠红色白色蓝色变浑浊浅蓝色变浑浊红色变浑浊水珠浑浊熄灭不变浑浊变蓝白色沉淀白色蓝色。
