乳胶标记常见问题汇总
抗原胶体金法和乳胶法

抗原胶体金法和乳胶法抗原胶体金法和乳胶法是实验室中被广泛使用的两种标记技术。
由于其特殊的优点,它们在医学、分子生物学等领域有着重要的应用。
本文将重点介绍抗原胶体金法和乳胶法的原理、操作程序和应用前景。
什么是抗原胶体金法抗原胶体金法(AuEL)是一种用于检测抗原的实验室技术。
它采用抗原-抗体特异性结合,将抗体与抗原结合至胶体金表面,以形成特定的显色图案。
胶体金由金纳米粒子组成,具有很强的光学性质和优越的稳定性,能够记录下抗原物质的特定图案,从而鉴别抗原的存在与否。
主要步骤包括抗原抗体匹配,图像采集和分析。
图像采集过程是通过紫外-可见光谱表谱仪来实现的,能够将胶体金表面的抗原信号转换为可视化图案。
在这一步,抗原抗体结合发生在胶体金上,抗原物质形成色谱图案,从而可以用来判断抗原物质的存在或不存在。
什么是乳胶法乳胶法(Gelimmuno)是一种抗原检测的实验室技术,属于免疫学技术体系。
它采用了从抗体与抗原膜片上形成的蛋白质特定的电极信号,来确定抗原的存在与否。
主要步骤包括准备样品、抗原抗体结合、电偶制备以及分析。
电偶制备是乳胶法技术的核心步骤。
它分为两个部分:一是将抗原依赖性因子(包括抗原抗体结合)与检测蛋白质(抗原)结合,从而形成抗原信号;二是将抗原信号调节技术,将抗原抗体结合物信号转换成可视化图案,然后利用软件进行数据处理,最终获得结果。
抗原胶体金法和乳胶法的应用抗原胶体金法和乳胶法都主要应用于各种生物样品的抗原检测,如细胞培养、组织切片、血清血液样品、药物和抗原制剂等等。
特别是在医学研究、食品检测、环境监测等领域,抗原胶体金法和乳胶法均被广泛采用。
抗原胶体金法具有较高的灵敏度和特异性,能够快速准确地检测出抗原的存在,而且操作简便,操作时间短。
乳胶法具有高精度高灵敏度的优点,而且能够对多种抗原同时进行检测,从而有效节省时间和费用。
结论抗原胶体金法和乳胶法是常用的两种生物技术,它们都具有较高的灵敏度和特异性,因此常用于抗原检测。
胶体金和乳胶的区别

个人经验:
胶体金标记:
1.标记缓冲液的PH值与标记蛋白的等电点有关,一般略高于等电点比较合适。
2. 被标记蛋白的分子量是否太大或太小。
蛋白质保存的缓冲液中盐离子浓度要尽量低。
3.可以调整金标颗粒的大小,比如10nm,或60nm都可以试试。
乳胶标记:
1.根据你的乳胶颗粒上的活性基团不同标记原理也不同,所以买来的乳胶溶液要仔细看说明书
2.现在很多公司,只要购买他们的乳胶溶液,都可以指导你怎样成功标记。
就像做硝酸纤维素膜的公司一般都会制作体外诊断试剂一样,不然这些公司就不能做出好的膜来。
乳胶标记不难,多查查资料,多试试,应该没问题的。
乳胶标记蛋白一般都是使用羧基和氨基的偶联方法进行偶联的,乳胶表面有羧基,经过活化后和蛋白的氨基结合形成共价键!参考步骤如下:
1 乳胶上羧基的活化:加入EDC 和NHS对羧基进行活化
2 将蛋白进行合适的处理,主要是除去缓冲液中游离的氨基
3 调整乳胶和蛋白溶液的PH按一定比例进行混合,搅拌
4 离心纯化,保存在合适的溶液中或者冻干即可。
免疫层析标记物及其标记技术

原胶乳
免疫胶乳
荧光胶乳
荧光胶乳颗粒粒度均一、单分散性好,有较好的生物相容性;形成 微球后染料荧光猝灭大大减少,发射强而稳定。
荧光乳胶层析法比一般的胶体金等固相免疫灵敏10~100倍,可以 有效排除背景色的干扰,且能够对待测物进行定量测定。
荧光胶乳颗粒的缺点是荧光染料系物理掺杂,容易发生泄漏,同时 高分子胶乳颗粒的表面修饰不够灵活,且由于多数具有输水性质, 而易发生非特异性吸附。
QDs激发谱宽而发射谱窄,并且具有较大的Stokes位移,都在很大 程度上提高检测的准确性;
QDs荧光寿命长,即不易衰变,稳定性高,可重复检测。 QDs在制备、修饰及抗原抗体标记等环节受到技术要求制约,结合
物稳定性也有待提高,并且检测时需紫外光作为激发光,仪器设备 要求和成本都较高。
免疫磁珠
上转磷光颗粒
上转磷光材料( up-convertingphosphor,UCP) 是新近发展起来的 由 2 种稀土金属元素(分别作为光吸收子和发射子)掺杂于氧化硫 等惰性材料中构成的一类能上转发光产生磷光的纳米级示踪材料。
上转磷光颗粒
天然生物材料不具备上转发光的特性,其发光信号不受检测环境的影 响,故样品本底低而灵敏度高,非常适合定量检测。
免疫磁珠(immunomagnetic beads,IMB) 是包被有单克隆抗体的 磁性微球,可与含有相应抗原的靶物质特异性结合形成复合物,是 近年来发展起来的一项新的免疫学技术。磁性免疫层析技术利用超 顺磁性纳米微粒作为标记物,由高灵敏度磁性检测仪测量包被了免 疫复合物的磁性微粒所产生的局部磁场效应,而得出待测分析物的 um dots, QDs)又称荧光半导体纳米颗粒,用于生物 探针的量子点主要由第二副族和第六主族的元素组成,如硒化镉( CdSe)、硫化锌(ZnS)、碲化镉(CdTe)、硫化镉(CdS)等。 粒径多介于1~10 nm,极小的粒径,外观似点状,故得名为量子点。
人类免疫缺陷病毒抗体检测(乳胶法)
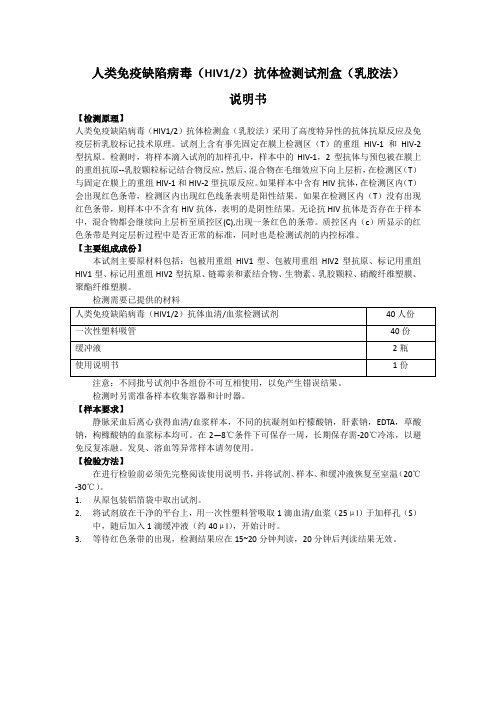
人类免疫缺陷病毒(HIV1/2)抗体检测试剂盒(乳胶法)说明书【检测原理】人类免疫缺陷病毒(HIV1/2)抗体检测盒(乳胶法)采用了高度特异性的抗体抗原反应及免疫层析乳胶标记技术原理。
试剂上含有事先固定在膜上检测区(T)的重组HIV-1和HIV-2型抗原。
检测时,将样本滴入试剂的加样孔中,样本中的HIV-1,2型抗体与预包被在膜上的重组抗原--乳胶颗粒标记结合物反应,然后,混合物在毛细效应下向上层析,在检测区(T)与固定在膜上的重组HIV-1和HIV-2型抗原反应。
如果样本中含有HIV抗体,在检测区内(T)会出现红色条带,检测区内出现红色线条表明是阳性结果。
如果在检测区内(T)没有出现红色条带,则样本中不含有HIV抗体,表明的是阴性结果。
无论抗HIV抗体是否存在于样本中,混合物都会继续向上层析至质控区(C),出现一条红色的条带。
质控区内(c)所显示的红色条带是判定层析过程中是否正常的标准,同时也是检测试剂的内控标准。
【主要组成成份】本试剂主要原材料包括:包被用重组HIV1型、包被用重组HIV2型抗原、标记用重组HIV1型、标记用重组HIV2型抗原、链霉亲和素结合物、生物素、乳胶颗粒、硝酸纤维塑膜、聚酯纤维塑膜。
检测需要已提供的材料注意:不同批号试剂中各组份不可互相使用,以免产生错误结果。
检测时另需准备样本收集容器和计时器。
【样本要求】静脉采血后离心获得血清/血浆样本,不同的抗凝剂如柠檬酸钠,肝素钠,EDTA,草酸钠,枸橼酸钠的血浆标本均可。
在2—8℃条件下可保存一周,长期保存需-20℃冷冻,以避免反复冻融。
发臭、溶血等异常样本请勿使用。
【检验方法】在进行检验前必须先完整阅读使用说明书,并将试剂、样本、和缓冲液恢复至室温(20℃-30℃)。
1.从原包装铝箔袋中取出试剂。
2.将试剂放在干净的平台上,用一次性塑料管吸取1滴血清/血浆(25μl)于加样孔(S)中,随后加入1滴缓冲液(约40μl),开始计时。
解决贴标过程常见质量问题的方法

解 决 措 施 :调 整标 站 与 瓶 子 的距 离 ( 进或退 ) 标 站位 置 ;调整 内外 侧 毛 刷 力 度 一致 ;调 整 胶 水
调整好标站和标板轴座之 间距离 ,使各个角均 厚度到合适值; 松开螺钉调整标板 到正确位置 。 能受 到相 同 的压 力 。 2 . 8起皱 或鼓 泡 2 . 5头标 不平 整 、不光 滑 。 原 因 :上胶量 太 大 ;胶水 的水 分含 量过 大 ;
不平 整 、 不光 滑 的原 因 : 头 标推绵 力 量不够 , 铝 箔标 推 到 瓶 子 上 时压 痕 出起 鼓 ,而 此 处 压 痕 在 随后 的刷 标 过 程 中经 常 刷 不 平 整 ;头 标 毛 刷 磨损 了 ;头标 毛刷 没有调 整好 。 解 决 措 施 :调 整 推 棉 力 度 ;更 换 磨 损 严 重 的 毛 刷 ;调 整 头标 毛刷 的位 置 ,保 证 刷 标 力 度
1 0 c m ),耕 刀速度 提升 1 0 %。
点 居 中 ;调 整推绵 压 力到合 适值 。 2 . 7头标 和 身标不 对 中
原 因 :标 站 与 瓶 子 之 间距 离 不 对 ;头标 和
虽然 影 响贴 标 质 量 的 因 素很 多 ,但 人 是 主 要 因素 。这 就需 要 我 们 在 工 作 中 遇 到 问题 ,认 真 对 待 ,分 析原 因 ,采 用最 佳 的解 决 方 法 ,这 样 才 能提高 我们 的贴标 质量 。
推 绵 压力 不 够 使 商 标 和瓶 子粘 结 不 牢 ,瓶 子 做 9 0度转 动 时商标 歪斜 。 解 决 措 施 :校 正标 盒 、标 钩 ,保 证 标 盒 水 施压 板 或施 压带 对标 签 施加 均匀 而 适合 的压 力 , 在 圆 周 方 向 配合 瓶 旋 转 ,调 整 毛刷 位 置 ;在 通 往 贴 标 机 的输 送 带 上 安装 吹风 机 以吹 除残 存 水
乳胶管生产过程常见问题及解决

乳胶管生产过程常见问题及解决
1. 乳胶管出现异味:可能是原料或添加剂质量不合格。
解决方法是检查原料和添加剂质量,并更换不合格的原料或添加剂。
2. 乳胶管外观不平整:可能是模具加工不精确或注塑工艺不正确。
解决方法是重新加工模具,调整注塑工艺。
3. 乳胶管容易破裂:可能是乳胶管原料质量不合格或加工工艺不正确。
解决方法是更换质量合格的原料,调整加工工艺。
4. 乳胶管硬度不合适:可能是原料配方不正确或加工工艺不当。
解决方法是重新调整原料配方,优化加工工艺。
5. 乳胶管黏性过大:可能是原料中胶粘剂含量过高或加工温度不合适。
解决方法是减少胶粘剂含量或调整加工温度。
6. 乳胶管表面粘连:可能是注塑模具表面存在油污或残留物。
解决方法是及时清洁模具表面,并保持干净。
7. 乳胶管尺寸偏差较大:可能是模具尺寸不准确或生产设备不稳定。
解决方法是检查模具尺寸是否准确,调整设备稳定性。
8. 乳胶管颜色不均匀:可能是原料颜色分散不均或加工温度不一致。
解决方法是优化原料分散性,调整加工温度均匀性。
9. 乳胶管强度不够:可能是原料中添加剂不足或加工工艺不当。
解决方法是增加加工中所需添加剂的用量,优化加工工艺。
10. 乳胶管易老化:可能是原料中抗老化剂含量不足或贮存条件不合适。
解决方法是增加抗老化剂用量,调整贮存条件。
乳胶漆产品不合格的原因

乳胶漆产品不合格的原因
乳胶漆产品不合格的原因可能有以下几种:
1. 原材料质量不佳:如果乳胶漆的原材料质量不佳,比如使用了劣质的乳液、颜料、增稠剂等,就会导致乳胶漆的品质下降。
2. 生产工艺不当:生产乳胶漆的工艺不当也会导致产品质量不合格。
例如,生产过程中控制不好温度、搅拌不均匀、过滤不彻底等都可能导致产品质量问题。
3. 存储条件不佳:乳胶漆的存储条件也会影响产品质量。
如果存放环境温度过高或过低,存放时间过长,或者包装不严密,都可能导致产品质量下降。
4. 检验不严格:如果检验不严格,就会导致不合格的乳胶漆产品流入市场,给消费者带来安全隐患。
5. 假冒伪劣产品:市场上也存在一些假冒伪劣的乳胶漆产品,这些产品可能没有经过严格的检验和质量控制,质量无法得到保障。
综上所述,乳胶漆产品不合格的原因可能有很多种,需要从原材料、生产工艺、存储条件、检验和假冒伪劣等方面进行全面的分析和控制。
荧光微球标记抗体制备的详细步骤及问题分析

荧光微球标记抗体方法及问题分析很多公司开展了荧光胶乳免疫层析做定量分析及胶乳增强免疫比浊分析项目,关注胶乳标记技术的技术人员越来越多。
本人总结了部分胶乳微球标记技术相关主题帖,并加以分类,以便朋友们查阅,希望朋友们继续完善或分享经验。
1. 胶乳大小选择【求助】免疫胶乳或免疫颗粒(聚苯乙烯)的粒径免疫胶乳或免疫颗粒(聚苯乙烯)的粒径- 丁香园论坛【求助】乳胶免疫比浊中的乳胶颗粒大小与抗体乳胶免疫比浊中的乳胶颗粒大小与抗体- 丁香园论坛2. 胶乳标记方法【交流】蛋白如何偶联到聚苯乙烯乳胶颗粒上蛋白如何偶联到聚苯乙烯乳胶颗粒上- 丁香园论坛(求助)胶乳标记(求助)胶乳标记- 丁香园论坛【求助】抗原或抗体致敏胶乳的缓冲液和pH值抗原或抗体致敏胶乳的缓冲液和pH值- 丁香园论坛3. 胶乳标记过程问题【求助】胶乳偶联出现絮凝胶乳增强免疫比浊试剂稳定性问题- 丁香园论坛【求助】胶乳增强免疫比浊中抗体交联的问题胶乳微球物理吸附反应微球带磺酸基、羧基、醛基表面的都是疏水微球,都可以用来设计被动吸附蛋白。
磺酸基微球表面含带有负电荷的磺酸基团,pka大约为2,因此在酸性pH保持稳定。
醛基微球表面也带有磺酸基团,但能和蛋白行程共价键。
羧基微球表面含带负电荷的羧基基团,在pH5.0以上时保持稳定。
带有疏水基团的蛋白的吸附和配位结合,是最简单和直接的标记方法。
这种方法中,微球溶液和含目标蛋白的溶液混合,反应后,未结合的游离蛋白通过清洗步骤除去,从而获得胶体蛋白复合物。
疏水吸附方法只能用于疏水微球(硫酸盐、羧基、醛基表面修饰的微球)。
醛基表面修饰微球是一个特例,其疏水吸附结果取决于后来的共价结合。
虽然物理吸附是不依赖pH的,但反应缓冲液的pH对蛋白的结构有非常大的影响,从而影响蛋白吸附到微球上的反应效率。
一般,在被吸附蛋白等电点附近pH时,物理吸附效率会很高。
反应步骤:1. 用反应缓冲液系数蛋白到10mg/ml;2. 用反应缓冲液系数胶乳微球到1%;3. 将蛋白溶液加入到胶乳微球溶液中,10ml胶乳中加入1ml蛋白溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胶乳标记过程中常见问题集
1)问题:蛋白无法吸附到微球上。
解决方法:加入更多的蛋白;去除微球中的表面活性剂,释放其占据的蛋白结合位点;引入中间物,将微球与蛋白相连;改变缓冲液。
2)问题:标记时加入了大量的蛋白,但是仍然无活性。
解决方法:改变蛋白加入量,从而改变蛋白与微球结合的空间构象;使用表位稀释物,占据微球上的部分蛋白结合位点,防止蛋白靠的太近。
3)问题:清洗去除未吸附蛋白后,微球聚集。
解决方法:增加蛋白标记量或封闭剂的用量,防止有空余位点;
4)问题:标记后开始活性很好,储存一段时间后,活性降低。
解决方法:降低储存温度到2~8度;降低储存液中的封闭剂浓度,防止抗体被替换;确认储存液中无能与抗体竞争的杂质,防止长时间取代抗体。
5)PS微球与蛋白(抗体)交联后,当时没发现有凝集,但隔夜后发现有凝集
是偶联效率低的原因。
当体系蛋白不足或是其它原因,使微球表面在交联后还空出许多反应基团时,由于这些基团又可以与相连微球上的蛋白反应,结果是把球又拉在一起了,所以有聚集。
可以加一些blocker agents 解决,常见的是BSA,另外,也可提高微球的交联率。
但为什么是过一段时间后才出现凝集呢,这是因为微球偶联上蛋白后,相互之间由于携带同种电荷的关系,比较稳定(所以能以胶体样存在),只有当偶尔相互碰撞,遇上彼此的反应基团时才能结合。
6)抗体偶联至羧基PS球,即时检测效果很好,但置于37度2天后,抗体活性似乎下降很大。
可能共价结合未成功,如果是这样,那么最主要的原因是EDAC质量差或过期了。
EDAC 长期放在空气中会吸潮,水汽会降低EDAC活性。
另一个可能原因是凝集。
观察胶乳是否有凝集产生。
还有,交联蛋白前有没有清洗?我们提供的胶乳缓冲液中含有表面活性剂,可能干扰抗体的结合。
如果未发生凝集,而且用前已经清洗,那么我们建议换新的EDAC。
7)EDC活化羧基乳胶微球后,加蛋白(抗体)即时有沉淀出现,是什么原因?
很多因素可以导致蛋白加入后,微球聚集成块。
通常,蛋白偶联前的聚集与缓冲液(电解质)有关。
可能是羧基没有活化好。
EDC质量出现问题了,请换质量好的再尝试。
如果没有好的EDC,可以适当调低活化缓冲液的pH值。
对非修饰微球,那么可以从以下方面着手解决:
绝大多的微球制备过程中,加有脂肪酸乳化剂。
在聚合时,它起乳化作用,在聚合后,它起稳定剂作用,使微球以胶体样分布。
在碱性pH下,微球表面的COOH,脂肪酸分子上的COOH以及聚苯乙烯多聚链末端的硫酸根(SO42-)使微球表面带负电荷,亲水性增强,从而能形成稳定的胶体。
由缓冲液导致的聚集可以通过加蛋白,阴离子乳化剂,非离子乳化剂(如Triton X-100和Tween-20)。
下列方法供参考:
a) 加入蛋白前,加少量的乳化剂。
具体量可以自己摸索掌握,太多的乳化剂可能会占据微球表面,影响蛋白偶联
b) 少数研究人员选择用含少量蛋白的缓冲液冲洗微球(可以降低体系中的离子强度)
c) 适当降低缓冲液的浓度,但不能使蛋白变性。
d) 稀释微球,使微球间距离加大,减少相互结合的机会
e) 如果有可能,加大偶联蛋白的浓度
f) 偶联时,将微球加入蛋白液中,而不是将蛋白加入微球中
g) 偶联时,振荡加快反应
总之,其原则是在微球与蛋白偶联前,减少其在高离子强度下与其它微球接触的机会。
在偶联结束后,由于微球表面接有的蛋白,会非常稳定。
