麦克斯韦速率分律与平动动能分布律关系
06-3麦克斯韦速率分布律

由定义式 f ( v)
dN
可看出 f (v)的意义是:
dv v 表示速率在 附近
因为 所以
v 0
dN
0
N, 即
v 0
dN N
1
f (v ) d v 1
这称为速率分布函数 的归一化条件。
二 、麦克斯韦速率分布函数
1859年麦克斯韦(Maxwell)导出了理气在 分子速率分布函数为: 无外场的平衡态(T)下,
数的比例为万分之2.58 。
五、三种统计平均值
最可几速率 v p
2kT m 2 RT RT 1.41 M mol M mol
8 RT RT 1.60 π M mol M mol
平均速率
8kT v πm
2
方均根速率
3kT v m
3RT RT 1.73 M mol M mol
另一种是用连续的分布函数来描述: 设:dN 为速率v v +dv 区间内的分子数,
N 为总分子数, 则: dN N d v, dN 即 dv N 由于dN / N 是速率v 附近dv 区间的分子数与 总分子数之比,所以它应与v 的大小有关, 可以 dN dN 写成: f (v) 即 f ( v) d v , N dv N
0
x (v ) Nf (v )dv N
0 x (v ) f (v )dv
例 T 300K时, v p 395m/s , v 取 v 790m/s,v 10m/s,则 u 2, vp v 10 u v p 395 N 4 u2 2 e u u N π 4 22 2 10 4 e 2 2.58 10 395 π 即:速率为790 — 800m/s的分子数占总分子
从玻尔兹曼分布推导麦克斯韦速度分布律和能量均分定理

从玻尔兹曼分布推导麦克斯韦速度分布律和能量均分定理玻尔兹曼分布是热力学中描述粒子分布的重要概念。
麦克斯韦速度分布律和能量均分定理则基于玻尔兹曼分布,对分子在气体中的速度和能量分布进行了详细研究。
本文将从玻尔兹曼分布开始,逐步推导出麦克斯韦速度分布律和能量均分定理,并解释其重要性和指导意义。
首先,我们来回顾一下玻尔兹曼分布的概念。
玻尔兹曼分布描述了在热平衡状态下,粒子的能级分布情况。
在一个封闭系统中,粒子的分布与其能量有关,服从玻尔兹曼分布的概率可以用以下公式表示:P(E) = (1/Z) * e^(-E/kT)其中,P(E)表示粒子能量为E的概率,Z是配分函数,k是玻尔兹曼常数,T是系统的温度。
通过玻尔兹曼分布,我们可以了解不同能量级别上粒子的分布情况。
基于玻尔兹曼分布,我们可以推导出麦克斯韦速度分布律。
麦克斯韦速度分布律描述了气体中粒子的速度分布情况。
根据分子动理论,气体分子的速度服从高斯分布。
在二维情况下,麦克斯韦速度分布律可以表示为:f(v) = (m/(2πkT))^0.5 * e^(-mv^2/(2kT))其中,f(v)表示速度为v的粒子的概率密度函数,m是粒子质量。
这个分布函数说明了粒子速度随温度和质量的变化。
接下来,我们来推导能量均分定理。
能量均分定理是基于麦克斯韦速度分布律的一项重要结果。
根据能量均分定理,系统中每个自由度的平均动能为kT/2。
自由度可以理解为能够存储和传递能量的独立振动模式或轨道数。
对于一个分子来说,自由度通常包括平动、转动和振动。
在热平衡情况下,每个自由度的平均动能相等。
能量均分定理在热学和统计物理中具有重要的指导意义。
它说明了在热平衡状态下,分子具有与温度相对应的能量。
通过平均动能,我们可以计算出系统的总能量。
这个定理的应用广泛,在材料科学、化学反应动力学以及热力学等领域都扮演着重要角色。
总结起来,玻尔兹曼分布为我们提供了粒子分布的重要理论基础。
基于玻尔兹曼分布,我们可以进一步推导出麦克斯韦速度分布律和能量均分定理,分别描述了气体粒子的速度和能量分布情况。
麦克斯韦气体分子速率分布定律
m i 5 E = ⋅ RT = 0.3× ×8.31× 273 =1.70×103 J M 2 2
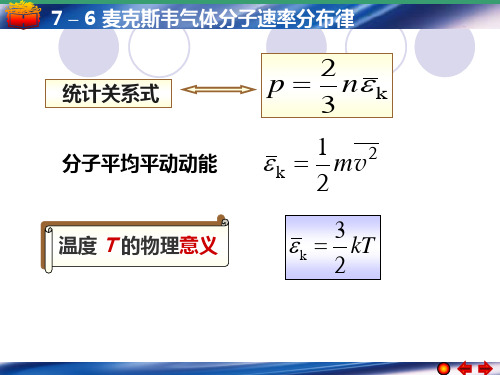
7 – 6 麦克斯韦气体分子速率分布律 速率分布律:不管分子运动速度的方向如何, 速率分布律:不管分子运动速度的方向如何,只 考虑分子按速度的大小的分布的规律. 考虑分子按速度的大小的分布的规律. 速率分布函数的意义:用统计的说明方法, 速率分布函数的意义:用统计的说明方法,指出 在总数为N 的分子中, 在总数为 的分子中,在各种速率区间的分子各有多 或它们各占分子总数的百分比多大, 少,或它们各占分子总数的百分比多大,这种说明方 法就给出分子按速率的分布. 法就给出分子按速率的分布. 区间的分子数. ∆N 为速率在 v → v + ∆v 区间的分子数.
非刚性分子平均能量 非刚性分子平均能量
1 1 2 2 ε v = µ vCx + kx 2 2
ε = ε kt + ε kr + ε v
分子能量中独立的速度和坐标的二次方 自由度 分子能量中独立的速度和坐标的二次方 数目叫做分子能量自由度的数目 简称自由度, 叫做分子能量自由度的数目, 项数目叫做分子能量自由度的数目, 简称自由度, 表示. 用符号 i 表示
o
M H = 0.002 kg ⋅ mol
−1
M O = 0.032 kg ⋅ mol
−1
R = 8.31 J ⋅ K ⋅ mol
−1
−1
T = 300 K
−1
vrms = 3RT M
氢气分子 氧气分子
vrms = 1.93 × 10 m ⋅ s −1 vrms = 483 m ⋅ s
3
i E = NAε = RT 2
m' m' i i mol 理想气体的内能 E = RT = ν RT M M 2 2
11.4-11.6 麦克斯韦速率分布规律 麦克斯韦-波尔兹曼分布律、分子平均碰撞次数和平均自由程

1)
v
vp
Nf
(v)dv
2)
vp
1 2
mv 2
Nf
(v)dv
例 如图示两条 f (v) ~ v 曲线分别表示氢气和
氧气在同一温度下的麦克斯韦速率分布曲线, 从图
上数据求出氢气和氧气的最可几速率 .
f (v) O2
H2
vp
2RT M mol
M mol (H2 ) M mol (O2 )
469.1m / s
由公式
v2 3RT M mol
v2
38.31 300 29 103
507.1m
/
s
例 已知分子数 N ,分子质量 m ,分布函数
f (v) 求 1) 速率在vp ~ v 间的分子数; 2)速率
在 vp ~ 间所有分子动能之和 .
解:速率在v v dv 间的分子数 dN Nf (v)dv
N
dN
0
dN
f ()d
N
0N 0
8kT 8RT 1.60 RT
m
M mol
M mol
3
2dN
0
2
f
(
)d
N
0
或由w 1 m2 3 kT
2
2
可得 2 3kT
v1~v2
v2 f ()d
v1
v2 f ()d
v1
v v1~v2
v2 vf (v)dv
v1
对于v的某个函数g(v),一般地,其平均值可以表示为
第四、五讲 麦克斯韦分布律 能均分定理

N 0 dvx dvy dvznvx f (vx , vy , vz )dt dA
n
0
vx
f
(vx
)dvxdAdt
kT
2 m
1/
2
dAdt
1 nv dAdt
4
单位时间内与单位面积相碰的分子数 为
N 1 nv dtdA 4
v 为平均速率
§4.7 能量按自由度均分定理
§4.5 麦克斯韦分布律
大量分子整体在一定的条件下,它们的速度的分布却遵 从一定的统计规律,这个规律叫麦克斯韦速度分布律。若不考 虑分子速度的方向,则叫麦克斯韦速率分布律。
一、麦克斯韦按速度分布律
设气体总分子数为N,处于温度为T的平衡态时,
速度介于 vx vx dvx , vy vy dvy , vz vz dvz
质量为M的理想气体的内能为
M1
U
(t r 2s)RT
M 2
温度改变,内能改变量为
U M 1 (t r 2s)RT M 2
对于理想气体,等体过程 đQ dU
摩尔等体热容量为
CV ,
(
đQ dT
)V
dU dT
1 (t r 2
2s)R
例如:对于双原子分子气体, t r 2s 7
7 CV , 2 R
在v1—v2区间
dN f (v)dv N
N v2 f (v)dv
N
v1
f (v)
在0—区间有
dS
dN N
=面积
N 面积 N
f (v)dv 1
v 0 ——归一化条件 O v v dv v1 v2
三种统计速率
(1)最概然速率 vp 与f(v)极大值对应的速率。
-麦克斯韦速率分布律

0
x x x
x
太原理工大学物理系
一、 速率分布函数
o
+
把速率分成很多相等的间隔
统计出每个间隔内的分子数N
N + 间隔内分子数与分子总数N之比 N
某 处单位速率间隔内分子数与总数之比 N 1 N v
N 1 N v 只与速率v有关,只是v 的函数。
vp
取 v v 2 ,并注意到
v2
3kT m
ቤተ መጻሕፍቲ ባይዱ
3 2
2kT m
3 2
v
2 p
太原理工大学物理系
f ( v2 )
概率之比为
4
3
1
3
e2
2 vp
f (vp )dv
f (vp )
2
e
1 2
1.10
f ( v2 )dv f ( v2 ) 3
太原理工大学物理系
四、分子速率的实验测定
速率分布函数 f(v)可写为
f (v) 4 (
m
)3
2
v2e
mv2 2kT
2 kT
4
1
3
2
v2 v3p
ev2
v
2 p
4
2
v v2
v
2 p
e 3
vp
太原理工大学物理系
f (v)
4
2
v ev2
v
2 p
v
3 p
在上式中取v=vp ,得
f (vp )
4 1 e1
mol用于讨论速率分布用于计算分子的平均平动动能三种速率的使用场合地球形成之初大气中应有大量的氢氦但很多分子和he原子的方均根速率超过了地球表面的逃逸速率112kms故现今地球大气中已没有氢和氦了
麦克斯韦气体分子速率分布律

5. 分子运动的自由度
自由度 分子能量中独立的速度和坐标 的二次方项数目叫做分子能量自由度的数目, 简称自由度,用符号 i 表示. 自由度数目
i t r v
平 动 转 动 振 动
单原子分子的能量自 由度 i=3 ;
刚性双原子分子的能量自由 度 i=5 ;
8
非刚性双原子分子的能量自由度 i=7 .
f( v ) 4 π ( 2 π kT
k 玻耳兹曼常数,若m、T
给定, 函数的形式可概括为
曲线
2 m v m 32 2 2 kT ) e v
速率分布曲线 有单峰,不对称
快减
快增
两者相乘
曲线
速率
恒取正
对分子质量为m 、热力学温度为T 、处于平衡态的气体 速率在 到 区间内的分子数 与总 分子数 之比
刚性分子能量自由度 自由度 分子 单原子分子 双原子分子 多原子分子
t 平动
3 3 3
r转动
0 2 3
i总
3 5 6
9
二
能量均分定理
理想气体,平衡态,分子平均平动动能 因 故
每个平动自由度的平均平动动能均为
将等概率假设推广到转动动能,每个转动自由度的转 动能量相等,而且亦均等于
(能量按自由度均分定理)
理想气体的内能
m 'i i m ' E RT RT ( 为气体的摩 ) M 2 2 M
理想气体内能变化
i dE RdT 2
12
第一节
麦克斯韦气体分子速率分布律 处于平衡态的气体,其分子沿各向运动的机会均 等,这并非意味着每个分子的运动速率完全相同, 而是大量不同运动速度(大小和方向)的分子,在 一定条件下所形成的一种热动平衡状态。 麦克斯韦速率分布律,是表示气体处于热平衡时, 气体的分子数按速度大小(速率)分布的规律。
第4节能量均分定理麦克斯韦分布律

df (v) 0 dv v vp
f (v)
f max
d [4π(
m
3
)2
e
mv2 2kT
v2
]
0
o
d 2πkT
vp
v
mv2
e 2kT
2Fra biblioteke2 mv2 2kT
(
2mv )
0
2kT
2 m 2 0
kT
根据分布函数求得 2 2kT
m
vp
2kT
m
2NAkT NAm
氧气的内能为____;温度升高2K时内能增加____。
解: i t r 3 2 5
t
3 2
kT
3 2
1.38 1023
273
5.65 1021 (J )
r
2 2
kT
2 1.381023 2
273
3.77 1021(J)
E
M
5 2
二、能量按自由度均分定理
2 x
2 y
2 z
12
3
1 2
m
2 x
1 2
m
2 y
1 2
m
2 z
1 3
(1 2
m
2)
1 ( 3 kT ) 1 kT
32
2
气体分子沿x,y,z三个方向运动的平均平动动能完全
相等,可以认为分子的平均平动动能均匀分配在
每个平动自由度上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
麦克斯韦速率分律与平动动能分布律关系
————————————————————————————————作者:————————————————————————————————日期:
麦克斯韦速率分布律与平动动能分布律关系
卜子明(1号)
摘要:麦克斯韦首先把统计学的方法引入分子动理论,首先从理论上导出了气体分子的速率分布率,现根据麦克斯韦速率分布函数,求出相应的气体分子平动动能分布律,并导出与麦克斯韦分布函数类似的一些性质,求出平动动能的最概然值及平均值。
并比较相似点和不同点。
引言:麦克斯韦把统计方法引入了分子动理论,首先从理论上导出了气体分子的速分分布律。
这是对于大量气体分子才有的统计规律。
现做进一步研究,根据其成果麦克斯韦速率分布函数,导出相应的平动动能分布律,并导出与麦克斯韦分布函数类似的一些性质并求出平动动能的最概然值及平均值,并且由此验证其正确性。
方法:采用类比的方法,用同样的思维,在麦克斯韦速率分布函数的基础上,作进一步研究,导出能反映平均动能在ε附近的单位动能区间内的分子数
与总分子数的比的函数
)(εf 的表达式。
并由此进一步推出与麦克斯韦分布函
数相对应的一些性质,并比较分析一些不同点。
麦克斯韦速率分布律
Ndv
dN v f =
)(这个函数称为气体分子的速率分布函
数麦克斯韦进一步指出,在平衡态下,分子速率分布函数可以具体地写为
222
32
24)(v e kT m Ndv dN v f kT mv πππ-⎪⎭
⎫ ⎝⎛==式中T 是气体系统的热力学温度,k 是玻耳兹曼常量,m 是单个分子的质量。
式(8-30)称为麦克斯韦速率分布律。
式子
dv v f v
v
⎰=∆2
1
)(N N 表示在平衡态下,理想气体分子速率在v 1到v 2
区间的分子数
占总分子数的比率。
而应用麦克斯韦速率分布函数可以求出气体分子三个重要的速率: (1)最概然速率
p
v
,f(v)的极大值所对应的速率
M
RT M RT m kT v p 41
.1220≈==其物理意义为:在平衡态的条件下,理
想气体分子速率分布在附近的单位速率的分布区间内的分子数占气体总分子的百分率最大。
(2) 平均速率
v ,用于研究分子碰撞M
RT 1.60M 8T 80___
≈==
ππRT m k v
(3) 方均根速率
2
v
,用于研究分子平均平动动能
M
RT
M RT m kT v 373
.13302
≈==反映的是大量分子无规则运动速率
的二次方的平均值的二次方根称为方均根速率。
推导及演绎:
由于分子的平动动能可表示为 22
1mv =ε
两边同时取微分有
εd m
vdv 2
2=
带入到麦克斯韦速率函数有212
3)(2)(επ
εεεkT e kT Nd dN f --==现定义为)(εf 为气体分子的平动动
能的分布函数。
平动动能在从
1
ε到2
ε
之间的分子数比率N /N ,等于曲线下从
1
ε到2
ε
之间的面积, 如图中阴影部分所示。
显然,因为所有N 个分子的速率必
然处于从0到 之间,也就是在速率间隔从0到
的范围内的分子数占分子总
数的比率为1,即
1)(0
=⎰+∞
εεd f 这说明和麦克斯韦分布率相似平动动能分布函
数
)(εf 同样必须满足归一化条件。
而 εεε
ε
d f ⎰=∆2
1
)(N N 表示在平衡态下,理想气体分子速率在
1
ε到2
ε
区间的分子数占总分子数的比率。
同样我们也可以
根据平动动能分布函数求出最概然平动动能
p
ε
以及平均平动动能
ε
(1)粒子的最概然平动动能p
ε
同样地,最概然平动动能
p
ε
也是对应着
)
(εf 的极值。
由
0==P
d df εεε
化简
0)]1(21[2
2
1212
3
=-+=---p
kT e e kT kT kT εεεεεεπ)(解出 kT 2
1P =ε
而其所对应的速率M
RT
m kT v pp
==
由此我们看到,最概然平动动能所对应的速率并不是麦克斯韦速率所求得的最概然速率。
初看起来似乎很奇怪,可仔细想想,最概然速率代表的是速率分布在附近的单位速率的分布区间内的分子数占气体总分子的百分率最大时的速率。
而最平动动能的概然值代表的是平动动能分布在附近的单位动能的分布区间内的分子数占气体总分子的百分率最大时的动能,其对应的速率却不是最该然速率。
而计算发现这是其实是由于两个方程求极大值时对应的导函数不同。
很显然求的的极大值也不同。
(2)粒子的平均平动动能
ε
同样的,
εεπεεεεεd e k d f N
vdN
kT -∞
∞
∞
⎰⎰⎰===
2
32
300
)T (2)(其中因为
2
50
23
43a dx e x ax
π=-∞
⎰所以kT kT
kT 2
3)1(43
225
23===ππε)( 这个结果是显然的:有麦克斯韦分布律已经得到,这也证明了上面的推导的正确性。
总结:通过以上的讨论和分析,我们不仅进一步了解了麦克斯韦速率分布函数,及其结论,还能挖掘出衍生出来的气体平动动能的分布情况,这样我们会对气体动理论的本质有跟家深刻的理解。
引文:要善于在前人已有的基础之上做进一步试探性的研究,才能衍生出新的知识点,也能有助于深刻的理解原有的知识。
参考文献:《大学物理基础知识》,《物理热力学基础》。
