2021年主动脉夹层的最新诊治进展(全文)
2021急性主动脉夹层合并冠心病的诊断与治疗策略中国专家共识(全文)

2021急性主动脉夹层合并冠心病的诊断与治疗策略中国专家共识(全文)主动脉疾病患者通常合并冠心病、慢性肾功能不全、糖尿病、血脂异常以及高血压等疾病,其中约4%~8%的急性主动脉夹层(acute aortic dissection,AAD)患者发生急性ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)[1],即使接受了手术治疗,Stanford A型夹层(type A aortic dissection,TAAD)合并冠状动脉低灌注或合并严重冠状动脉病变患者的院内死亡率仍超过50%[2?3]。
在日常临床实践中,胸痛患者因为辅助检查异常而导致AAD诊断与治疗延迟的情况也时有发生,有的患者甚至接受了溶栓治疗[4]。
为了进一步提高诊断准确率、减少延误并及时采取正确的治疗策略,中华医学会心血管病学分会大血管学组联合中华心血管病杂志编辑委员会,组织全国心血管内科、外科以及血管外科等相关领域的专家撰写了此共识,以指导临床实践。
一、AAD合并冠心病的机制AAD合并冠心病发病机制可能基于以下几个方面:(1)两种疾病具有共同的危险因素,包括高血压、血脂异常、不良生活习惯如吸烟、饮酒等,这些危险因素单独或协同发挥作用,促进包括主动脉在内的血管发生粥样硬化[5];(2)炎症反应在主动脉与冠状动脉发生粥样硬化的病理生理机制中扮演了重要角色[6];(3)部分遗传性疾病如马方综合征可同时累及主动脉与冠状动脉,在应激情况下可能导致两种疾病同时发生[7]。
AAD累及冠状动脉系统时,患者临床表现类似急性冠状动脉综合征(acute coronary syndrome,ACS),但机制上与传统的冠状动脉粥样硬化导致ACS有所不同,主要与AAD对冠状动脉系统造成不同形式、不同程度的机械性阻塞有关[1,8]。
图1所示为TAAD导致冠状动脉灌注异常的可能机制。
二、AAD合并冠心病患者的诊断与鉴别诊断1.现病史及既往病史:10%~15%的AAD患者可能发生心肌缺血或心肌梗死[9-10],AAD可同时合并或并发ACS,仔细询问疼痛性质以及疼痛发生的先后顺序对诊断有一定的帮助。
中国主动脉夹层诊疗现状与展望

中国主动脉夹层诊疗现状与展望主动脉夹层是一种罕见但极为危险的疾病,近年来在中国发病率呈上升趋势。
本文将围绕中国主动脉夹层诊疗现状与未来展望进行探讨。
主动脉夹层是指主动脉内膜撕裂,血液进入内膜与外膜之间形成血肿,导致血管壁分层。
主动脉夹层可引起剧烈疼痛、休克、器官缺血等一系列严重并发症,甚至危及生命。
主动脉夹层的诊断主要依靠医学影像学检查,包括胸片、超声心动图和计算机断层扫描等。
目前,中国医疗机构普遍采用多排螺旋CT(MSCT)进行诊断,其具有较高敏感性和特异性。
但是,由于MSCT设备昂贵、技术要求高,部分地区医疗机构仍难以普及。
主动脉夹层的治疗主要包括药物治疗、介入治疗和外科手术治疗。
药物治疗主要通过控制疼痛、降低血压和心率等手段减轻症状,但难以根治疾病。
介入治疗主要采用覆膜支架修复血管壁,具有创伤小、恢复快等优点,但需严格掌握适应症。
外科手术治疗包括传统开胸手术和微创腔内修复术,虽然疗效确切,但手术风险较高。
目前,中国主动脉夹层诊疗技术已经取得了一定成果。
药物治疗方面,国内临床医生根据患者病情,严格选用镇痛、降压、抗凝等药物,有效控制了患者症状。
介入治疗方面,国内医疗机构正在逐步推广应用,并取得了一定疗效。
外科手术治疗方面,国内部分大型医院已经具备了成熟的手术技术和经验,并成功完成了数千例手术。
随着科技的不断进步,中国主动脉夹层诊疗将迎来更多创新机遇。
新型影像学技术的研发将为诊断提供更多选择,如高分辨率MRI和功能成像技术等,可进一步提高诊断准确性和敏感性。
新型治疗手段的探索也将为患者带来更多福音,如药物涂层球囊、可降解支架等新型介入治疗技术,以及更加精细化和个性化的外科手术方法。
未来,中国主动脉夹层诊疗将更加注重规范化治疗。
国家和地方政府将加大对医疗机构诊疗能力的培训和评估力度,确保患者能够得到高质量的诊疗服务。
医疗机构之间将加强合作与交流,推动诊疗技术的普及和优化。
为了提高中国主动脉夹层诊疗整体水平,学术交流将变得更加活跃。
主动脉夹层的治疗研究进展

主动脉夹层的治疗研究进展主动脉夹层是一种严重的心血管疾病,通常需要立即进行治疗。
近年来,随着医学技术的不断发展和进步,主动脉夹层的治疗研究取得了一系列重大进展。
本文将就主动脉夹层的治疗研究进展进行详细介绍。
主动脉夹层是指由于主动脉壁的内膜破裂,使得血液在主动脉内膜与外膜之间形成夹层,导致主动脉壁的破裂和扩张。
主动脉夹层通常是一种急性疾病,如果不及时治疗,患者可能会面临生命危险。
准确诊断和采取有效的治疗措施对于主动脉夹层患者来说至关重要。
近年来,主动脉夹层的诊断技术得到了显著提升,特别是影像学诊断技术的进步。
高分辨率CT成像技术可以清晰地显示主动脉夹层的位置、大小和形态,有助于医生准确判断病情并制定治疗方案。
磁共振成像技术也具有较高的诊断准确性,可以提供更为全面的主动脉夹层影像信息。
这些先进的影像学技术为主动脉夹层的早期诊断提供了重要的帮助,有助于医生及时采取有效的治疗措施。
在主动脉夹层的治疗方面,外科手术是目前最常用的治疗方法之一。
随着微创手术技术的日益成熟,许多患者可以通过经皮主动脉瓣置换术(TAVI)等微创手术获得良好的治疗效果。
相比传统的开放性手术,微创手术创伤更小,恢复期更短,术后并发症的发生率也更低。
微创手术成为了越来越多主动脉夹层患者的首选治疗方法。
除了外科手术,内科治疗也在主动脉夹层的治疗中扮演着重要的角色。
药物治疗是主动脉夹层患者长期治疗的重要手段。
通过使用β受体阻滞剂、血管紧张素转换酶抑制剂等药物,可以有效降低血压,减轻主动脉壁的压力,有助于减少夹层的扩张和撕裂。
抗凝治疗也被广泛应用于主动脉夹层的治疗中,有助于预防血栓形成和减少血栓栓塞的风险。
近年来,介入治疗在主动脉夹层的治疗中也得到了广泛的关注和应用。
主动脉内膜修复术是一种新型的介入治疗方法,通过在夹层处植入支架,可以有效地将夹层处的血流恢复到正常状态,防止夹层扩张和撕裂。
这种介入治疗方法具有创伤小、恢复快的特点,逐渐成为主动脉夹层治疗的新选择。
主动脉夹层39例临床分析

油 、 拉 地 尔等 静脉 滴 注 ( 滴 ) 乌 静 积极 诊率 最高 , 可作为 诊 断 急性 AD的重
降压 ,口服 B 体 阻滞 剂 、 受 血管 紧 张素 要 手段 。
作 者简介 : 令辉 (90 ) 男 ( 薛 1 7 一 , 汉族 ) 山东省人 , 主治医师。
危重病急救 医学,0 02 2 12 2 1,2( ): 2 . ( 收稿 日期: 0 1 0 — 9 2 1— 6 2 ) ( 文编辑 : 本 李银平 )
常把并发症 视为 压者 l 例。 7 合并 心肌梗 死 2 主动脉 积极治 5%的患者可于 4 内死亡 重 并发症 和伴 随症 状 , 例, 0 8h 瓣杂 音 1 , 围大血管 出现异常杂音 本组 病 死 率 2 .%,因此 , 期 诊 断 对 首发 症状 而受先 人为主 的影 响 , 4例 周 56 早 忽视 了 2 0例, 彩色多普勒超 声心动图检查主动 降低病死 率有 重要意义。彩色多普勒 超 A D的原 发病。 AD病变 累及临近器官时 脉瓣反流者 1 例 。 8
【 关键词 】 主动脉夹层;诊断 ;治疗
中图分类号 :R 4 .;R 6 5 31 3 2 文献标识码 :B IOI 0 3 6 /.sn 10 - 6 12 1 . 10 8 ) :1 . 9 9 ji .0 8 9 9 . 0 2 0 . 1 s
对 D临床 表 现 的多 对本 院收治的 3 9例 主 动 脉 夹 层 转换 酶 抑制 剂 ( c I 、 离子拮 抗 剂 生 常缺 乏警 惕 性 , A A E) 钙 A ( ) 者的l AD 患 临床资 料进行 回顾性 分析, 等,严格 控制血 压和心 率 ,同时加强 对 样 性 和不 典 型性 认识 不足 。 D急性 期 报 告 如 下o 症、 持治 疗。最终 经 内科 保守 治疗 好 病例多表现 为疼痛与心电图症状与体征、 支 1 临床 资料
2021年度冠心病领域临床研究进展(全文)

不良心脑血筐事件(major adverse cardiovascular and cerebrovascular events , MACCE)发生率均未见显著差异。
EROSION E的研究结果提示, OCT 用于指导制订和优化 STEMI 患 者的个体化再灌注治疗决策是安全可行的,首次证实了 OCT 指导下的基 于病理圭理机制和病变特征的再灌注策略可安全菁效地减少旱期罪犯血 管开通后的 STEMI 意者的支架置入率;且对于需要支架置入的意者,OCT 可进一步评估支架置入术后的即刻效果,减少支架相关并发症的发生。 但 该研究样本量相对较少,导致研究的安全性终点尚不具备统计学效力。 因 此,未来需要更大规模的前瞻性||面床研究进行验证及优化,从而使得研究 结果更具说服力。
该研究是自TUXEDO研究以来,头个在大规模糖尿病患者中对第二代DES 进行比较的强效研究,并获得了可观的结果。 相较于既往研究,该研究纳 入及排除标准宽松,不限制复杂病变、 新型抗血小板药物和降糖药物等情 况,因此更能反映真实世界人群,更具有代表性,为糖尿病患者PCI 提供 了更加高效的潜在选择。
础的佐他滔莫司DES(真厚度较Cre8 EVO支架更大)。 该t鹉金共纳入
1175例患糖尿病并需要行PCI的患者,随机分至接受Cre8 EVO支架治 疗组和Resolute Onyx支架治疗组。 主要终点为TLF(包括心原性死亡、
in 靶血管心肌梗死、 临床驱动的靶病变血运重建的复合事件)。随 1年后,
值得一握的是,新一代Firesorb BRS薄壁的设计更利于血管内皮修
复 , 支架璧厚度只高100 ~120 µm,远低于 第→'"t BRS的150 ~180 µ m , 在保证充分支撑力的同时 , 薄壁的设计有利于支架置入后血管内膜的
主动脉夹层的治疗研究进展

主动脉夹层的治疗研究进展主动脉夹层是一种危险的血管疾病,由于主动脉壁内层的撕裂,血液可以进入主动脉壁中的缝隙,导致血管内层和外层之间形成假腔,从而增加主动脉破裂的风险。
主动脉夹层的治疗一直是心血管领域的研究热点之一,近年来,针对主动脉夹层的治疗手段有了很大的进展,为患者提供了更多的治疗选择和希望。
本文将重点介绍主动脉夹层治疗的最新研究进展。
1. 传统手术治疗:传统的主动脉夹层手术治疗主要包括开胸手术和主动脉置换术。
通过开胸手术剔除主动脉夹层部分,然后用人工血管或主动脉瓣膜替代受损的主动脉,这是一种比较传统的治疗手段。
传统手术治疗风险较大,手术创伤大,而且术后康复时间长,对患者的身体和心理都会造成较大的影响。
2. 内膜修复技术:内膜修复技术是近年来新兴的治疗手段,通过内膜修复器件修复主动脉夹层,既可以保留患者的自身主动脉,又能减少手术创伤和术后并发症。
内膜修复器件可以通过导管经血管插入体内,利用膨胀器件将夹层内壁压迫,形成新的真腔,从而达到修复的效果。
内膜修复技术适用范围广泛,适合于各种类型的主动脉夹层患者,并且手术创伤小,恢复快,成为目前治疗主动脉夹层的重要手段之一。
3. 药物治疗:药物治疗在主动脉夹层的治疗中也起着重要的作用。
目前主要采用β受体阻滞剂、血管紧张素转化酶抑制剂、钙通道阻滞剂等药物来控制血压,减少主动脉的压力,从而减缓主动脉夹层的扩张速度,预防夹层的进一步发展。
抗凝药物和抗栓剂也常用于预防血栓形成,减少并发症的发生。
4. 介入治疗:介入治疗是一种微创手术治疗方法,常常用于治疗主动脉夹层的急性期,通过经皮血管插管技术将支架或血管腔内修复器件置入主动脉内,从而实现对主动脉夹层的修复。
介入治疗具有创伤小、恢复快、并发症少等优点,特别适合于高龄患者和有手术禁忌症的患者。
5. 综合治疗:综合治疗是目前治疗主动脉夹层的趋势,即将药物治疗、内膜修复技术、介入治疗和传统手术治疗相结合,根据患者的具体情况制定个性化的治疗方案,从而取得更好的治疗效果。
2024急性主动脉夹层机制及治疗要点(全文)
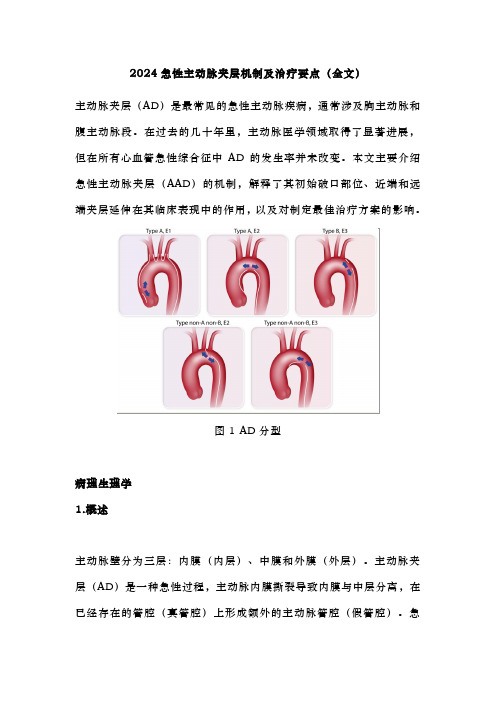
2024急性主动脉夹层机制及治疗要点(全文)主动脉夹层(AD)是最常见的急性主动脉疾病,通常涉及胸主动脉和腹主动脉段。
在过去的几十年里,主动脉医学领域取得了显著进展,但在所有心血管急性综合征中AD的发生率并未改变。
本文主要介绍急性主动脉夹层(AAD)的机制,解释了其初始破口部位、近端和远端夹层延伸在其临床表现中的作用,以及对制定最佳治疗方案的影响。
图1 AD分型病理生理学1.概述主动脉壁分为三层:内膜(内层)、中膜和外膜(外层)。
主动脉夹层(AD)是一种急性过程,主动脉内膜撕裂导致内膜与中层分离,在已经存在的管腔(真管腔)上形成额外的主动脉管腔(假管腔)。
急性主动脉夹层(AAD)患者通常会突然出现严重“撕裂”性和放射性胸痛。
2.分型(1)根据Stanford分类:①累及升主动脉(无论是否累及主动脉弓和降主动脉)的AD为A型;②如果夹层累及主动脉弓而不累及升主动脉,则称为非A非B型;③只累及降主动脉的夹层为B型。
(2)根据DeBakey分类:①夹层累及升主动脉和降主动脉为1型;②夹层仅仅累及升主动脉为2型;③夹层累及胸降主动脉为3a型,夹层累及胸降主动脉和腹降主动脉为3b型。
A型AD不管是逆行还是顺行延伸,开放手术都是首选的治疗方法。
逆行延伸常累及非冠状窦,常导致右冠状窦与非冠状窦之间的主动脉瓣结合部脱垂,导致主动脉瓣反流。
夹层向冠状动脉开口延伸可导致冠状动脉阻塞。
右冠状动脉受累较常见。
经常观察到因液体穿过相邻假腔的薄壁渗入心包腔而导致心包积液。
三分之一的患者被诊断为无血流动力学意义的心包积液。
有证据表明,8%-31%的患者会发生由假腔破裂或广泛渗出引起的心包填塞。
AAD的侵入性治疗通常包括消除真假腔之间最近端的连通口,这通常是最初的撕裂口,包括三种策略(图2):①切除各自的主动脉段,并用涤纶假体替代;②可以通过胸主动脉腔内修复术(TEVAR)和支架移植物植入来实现。
③可以通过植入混合假体,即冷冻大象鼻(FET)假体,来消除连通。
主动脉夹层的诊疗现状

主动脉夹层的诊疗现状主动脉夹层(Aorticdissection,AD)是心血管系统的疑难杂症之一,其发病急,预后凶险,病死率高。
近年来,随着影像学诊断技术的发展,分子生物学研究的深入,及腔内治疗的迅猛发展,不仅使AD的诊疗理念发生了许多变革,也极大地提高了AD的治疗效果及预后。
一、主动脉夹层的流行病学及临床特征国际上大注册中心的数据表明,AD的年发病率为(3~6)/10万。
其中男性多发,占到总发病率的2/3。
女性发病率低,但预后较差。
与国外相比,国人AD的发病年龄比国外明显年轻,有数据表明,国人的发病年龄平均为52岁左右,而国外平均为63岁。
AD最常见的危险因素为高血压和结缔组织疾病史。
最典型的临床表现为突发的剧烈胸背部撕裂样疼痛,许多患者自诉为前所未有的剧痛。
疼痛可以从胸部向下背部转移,且在疼痛发作前常有剧烈运动史或服用了一些特殊药物,如可卡因和安非他命。
AD的发病时间具有节律性,一年当中在冬季凌晨高发。
除疼痛以外,偶可合并包括晕厥、下肢瘫痪等在内的神经系统症状。
若AD破口位于主动脉近端,还可伴发主动脉瓣关闭不全、心包积液和心肌缺血等异常。
二、主动脉夹层的分类主动脉夹层可依据发病时间及解剖学特征进行分类。
传统的时间分类将发病时间小于2周的定义为急性主动脉夹层,而发病时间大于2周的归为慢性主动脉夹层。
但随着治疗的发展,越来越多的证据表明,许多主动脉夹层患者在2周后仍会出现各种并发症,如主动脉直径快速增大等,因此Booher等分析主动脉夹层国际登记处(InternationalRegistryofAcuteAorticDissections,IRAD)的数据显示,依据生存率的差异将AD分为了4个时期:超急性期(<24h),急性期(2~7d),亚急性期(8~30d),慢性期(>30d)。
而伴随着腔内技术的发展,人们发现在3个月以内夹层血管壁均可保持较好的重塑性,胸主动脉腔内修复术(Thoracicendovascularaorticrepair,TEVAR)的远期效果更佳,因此有学者提议将AD分为3期:急性期(<14d),亚急性期(15~90d),慢性期(>90d)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021年主动脉夹层的最新诊治进展(全文)主动脉夹层(Aortic Dissection,AD)是由于各种原因导致的主动脉内膜、中膜撕裂和分离,致使动脉管腔被分隔为真腔和假腔,属心血管系统的危急重症。
当病变累及主动脉及重要分支时,会出现器官供血障碍所致的临床表现[1]。
近年来,随着诊断水平日益提高和多学科技术的飞速进步,AD的诊出率不断提高,围手术期死亡率得到了明显下降。
欧洲心脏病协会最早于2001年发布了“主动脉疾病诊疗指南”,并于2014年对该指南作出修订。
中国医师协会心血管外科分会大血管外科专业委员会也于2017年发布了最新的《主动脉夹层诊断与治疗规范中国专家共识》,近年来也有不少相关的临床研究发布,因此本文拟对AD的最新诊治进展作一总结。
一、AD分型和分期为了更好指导临床治疗和评估预后,根据内膜破口位置及夹层累及的范围,目前国际上以DeBakey分型和Stanford分型应用最为广泛(图1)[2]。
DeBakey分型:I型:原发破口位于升主动脉或主动脉弓,夹层累及大部或全部胸升主动脉、主动脉弓、胸降主动脉、腹主动脉;Ⅱ型:原发破口位于升主动脉,夹层累及升主动脉,少数可累及主动脉弓;Ⅲ型:原发破口位于左锁骨下动脉以远,夹层范围局限于胸降主动脉为Ⅲa型,向下同时累及腹主动脉为Ⅲb型。
Stanford分型则根据升主动脉受累程度来区分,而升主动脉受累程度是确定适当管理策略的关键。
大约三分之二的主动脉夹层发生在升主动脉(TAAD),其余主要发生在左锁骨下动脉远端降主动脉(TBAD)[3]。
凡夹层累及升主动脉为Stanford A型(Type A AD,TAAD),相当于DeBakeyⅠ型和Ⅱ型;夹层仅累及胸降主动脉及其远端为Stanford B型(Type B AD,TBAD),相当于DeBakeyⅢ型[2]。
图1 AD Stanford分型及DeBakey分型上述两种分型主要反映夹层累及范围以及破口的位置,但是难以准确反映AD的病变程度和预后。
因此,为了便于制定个性化治疗方案和选择最佳手术时机和手术方式,孙立忠[4]团队在Stanford分型基础上提出AD 细分分型(孙氏分型)和相关的治疗策略。
目前,国内广泛应用的孙氏分型如下:TAAD根据主动脉根部受累情况细分为3个亚型:A1型,窦管交界和其近端正常,无主动脉瓣关闭不全;A2型,主动脉窦部直径小于3.5cm,夹层累及右冠状动脉,致其开口处内膜部分剥离或全部撕脱,轻至中度主动脉瓣关闭不全;A3型根部重度受累型,窦部直径大于5.0cm,或直径为3.5~5.0cm但窦管交界结构破坏,有严重主动脉瓣关闭不全。
根据病因及弓部病变情况分为C型(复杂型)和S型(简单型):符合以下任意一项者为C型:①原发内膜破口在弓部或其远端,夹层逆行剥离至升主动脉或近端主动脉弓;②弓部或其远端有动脉瘤形成(直径>5.0cm);③头臂动脉有夹层或动脉瘤形成;④TEVAR术后逆撕A型AD;⑤套筒样内膜剥脱和广泛壁内血肿:⑥主动脉根部或升主动脉术后残余夹层或新发夹层;⑦病因为遗传性结缔组织病,如Marfan综合征。
S型:原发内膜破口位于升主动脉且不合并上述任何一种C型病变。
临床诊断时根据实际情况组合分型,如A1C型。
TBAD 根降主动脉的扩张部位分为3个亚型:B1型,降主动脉无扩张或仅近端扩张,中、远端直径接近正常;B2型,全胸降主动脉扩张,腹主动脉直径接近正常;B3型,全胸降主动脉、腹主动脉均扩张。
根据病因及弓部有无夹层累及亦分为C型和S型:符合以下任意一项者为C型,①夹层累及左锁骨下动脉开口或远端主动脉弓;②合并心脏疾病,如瓣膜病、冠心病等;③合并近端主动脉病变,如主动脉根部瘤、升主动脉或主动脉弓部瘤等;④病因为遗传性结缔组织疾病,如Marfan综合征。
S型,不合并上述任何一种情况者。
AD通常根据发病时间进行分期。
即发病时间≤14天为急性期,15-90天为亚急性期,>90天为慢性期[1]。
二、诊断(一)临床判断由于主动脉夹层是一种致死性疾病,准确及时的诊断是非常关键的。
目前认为AD的危险因素主要包括:(1)增加主动脉管壁张力的临床情况,如高血压、主动脉缩窄、外伤等[5];(2)导致主动脉管壁结构异常的因素,如动脉粥样硬化、遗传性结缔组织病、家族性遗传性AD或主动脉瘤等[6];(3)其他:如妊娠、医源性AD等。
AD的临床症状根据病变发病部位及累及范围不同多种多样。
其中疼痛是AD患者最为普遍的主诉。
AD导致的疼痛常被描述为“撕裂样”或“刀割样”的持续性难以忍受的锐痛。
疼痛的部位和性质可提示AD破口的部位及进展情况。
TAAD常表现为前胸痛或背痛,TBAD常表现为后背痛或腹痛。
如果疼痛消退或稍后复发,应怀疑即将发生主动脉破裂。
大约15%的患者存在神经并发症,包括晕厥、神经功能障碍、瘫痪或截瘫。
需要注意的是,AD可伴发中风、心脏病(如累及冠状动脉,引起心肌梗死)、急性肠系膜缺血、急性肾功能衰竭以及肢体缺血等多种脏器灌注不良表现,因此当AD以不典型症状起病时需特别引起警惕。
除上述症状外,疑似AD的患者出现以下体征有助于临床诊断:(1)血压异常:AD常可引起远端肢体血流减少,导致四肢血压差别较大。
若测量的肢体是夹层受累一侧,将会误诊为低血压,从而导致误诊和漏诊。
因此对于AD患者,应常规测量四肢血压;(2)主动脉瓣区舒张期杂音:如患者既往无心脏病史,而本次突然出现主动脉瓣区舒张期杂音,则提示夹层所致急性主动脉瓣反流可能;(3)胸部体征:AD如出现大量渗出或者引起破裂出血时,可出现气管向右侧偏移,左胸叩诊呈浊音,左侧呼吸音减弱;(4)腹部体征:AD导致腹腔脏器供血障碍时,可造成肠麻痹甚至坏死的体征;(5)神经系统体征:AD引起脑供血障碍时可出现淡漠嗜睡、昏迷或偏瘫;AD引起脊髓供血障碍时,可有下肢肌力减弱甚至截瘫[2]。
因此,临床上对于剧烈胸背痛且伴高危病史及体征者应高度警惕AD 的可能。
(二)实验室检查典型胸痛症状且高度怀疑急性AD的患者,应完善常规检查如血常规及血型、肝肾功能、血气分析、心肌损伤标志物、血凝常规(应包括D-二聚体)和血脂系列(包括总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇等)等检查。
这将有助于明确诊断以及评估主要脏器功能和手术风险,缩短术前准备时间。
其中D-二聚体(D-dimer,D -D)是交联纤维蛋白经纤溶酶水解产生的一种特异性降解产物,主要反映纤维蛋白溶解功能,其在临床大多数用于深静脉血栓形成、肺动脉血栓栓塞症的诊断和排查。
研究发现[7],以500ng/ml为参考值时,D-二聚体对AD的诊断敏感性达100%,特异性达67%,可作为急性AD诊断的排除指标。
而且,有研究显示D-二聚体与夹层撕裂范围和不良预后风险呈正相关[8]。
鉴于D-二聚体具有易检测、结果回报快等特点,因此目前在AD诊断中应用较为广泛,对AD早期识别、诊断起到了积极作用。
目前除了D-二聚体外,也有不少被发现的潜在的AD生物学标志物[9-12]:(1)反映内皮或平滑肌细胞受损的特异性标记蛋白,如平滑肌肌球蛋白重链和弹性蛋白降解产物。
平滑肌存在于主动脉壁中层,当发生夹层或夹层持续进展时,受损的平滑肌细胞使细胞蛋白释放入血,肌球蛋白重链及相关产物在血液循环中含量明显增加;Suzuki[13]等发现AD患者在发病后3小时内滑肌肌球蛋白重链升高,与健康人相比,敏感性为90.9%,特异性为98.0%。
可见其具有良好的鉴别和诊断准确性,但因升高时间窗短,下降较快,可用于症状发生早期的诊断;(2)反映血管间质受损的钙调蛋白和基质金属蛋白酶。
基质金属蛋白酶为锌依赖性金属内肽酶家族,可由成纤维细胞、血管平滑肌细胞及白细胞分泌。
任何原因增加主动脉内皮细胞、平滑肌细胞和浸润性炎症细胞的活性,都会使循环血液中基质金属蛋白酶释放增加。
Li[12]等发现,与对照组相比,MMP-1和MMP-9的组织表达在AD患者中有所增加;(3)反映炎症活动的C-反应蛋白等。
(三)影像学检查AD的诊断目前主要依赖于影像学检查。
临床上常用的筛查、诊断手段有超声心动图(Echocardiography)、计算机断层扫描(Computed Tomography,CT)、核磁共振成像(Magnetic Resonance Imaging,MRI)和血管造影术(Angiography)[1]。
影像学检查的目的是对全主动脉进行综合评价,包括病变范围、形态、主动脉直径、主动脉瓣及各分支受累情况、与周围组织的关系以及了解AD对其他脏器的影响情况如心包积液、胸腔积液等。
超声心动图包括经胸(Transthoracic Echocardiography,TTE)和经食管(Transoesophageal Echocardiography,TOE)两种,其对AD 的早期急诊诊断有很大的优越性。
对于怀疑急性AD的患者而言,TTE因其无创、操作方便可作为急诊初步筛查首选的影像学检查。
TTE诊断Stanford B型AD的灵敏度较低,但TEE可明显提高其诊断的准确性。
当TTE受患者体型、胸壁、肺部疾病等因素影响时,TEE则可提高AD诊断的准确性。
但作为一种侵入性操作,TEE对急性AD患者具有一定的风险,一般非全麻状态下不建议常规实施。
TTE诊断Stanford A型AD的灵敏度可达88%-98%,特异度可达90%-95%。
对于Stanford A型AD,TEE可便捷、快速评价患者心功能、主动脉瓣膜功能及主动脉窦受累情况,从而为制订手术方案提供帮助。
主动脉CT增强和核磁血管造影都是目前诊断AD重要的影像学诊断方法(图2)。
主动脉增强CT可清晰显示内膜片将主动脉管腔分为真腔和假腔,对夹层类型、范围、破口位置及主要分支血管或腹腔器官的受累情况等进行全面评价,为临床治疗方案的选择以及患者预后的评价提供帮助,是现阶段诊断AD的金标准[14]。
图2 A 增强CTA;B、C 主动脉MRAMRI对AD的诊断效率与主动脉增强CT相似,但由于检查耗时长、费用高,对于不稳定患者难以配合,故MRI仅作为CTA存在禁忌症的替代检查手段[15]。
主动脉血管造影曾被认为是AD诊断的“金标准”。
由于它是一种侵入性有创操作,依靠血管造影明确诊断存在巨大临床风险。
因此,最新国内外指南不再推荐血管造影作为AD的常规诊断检查手段,仅作为AD腔内治疗的手段[1,2]。
(图3)图3 主动脉血管造影三、治疗原则目前AD治疗方法及原则仍在不断研究中不断更新。
针对TAAD,目前公认的经典治疗方法为开放手术,但开放手术创伤较大,高龄、内科合并症较多的患者难以耐受,因此杂交手术及全腔内技术的出现在一定程度上解决了这些难题。
而针对TBAD的治疗争论的焦点在于保守治疗和外科治疗之间的权衡。
