第四章 缩合反应
合集下载
第四章 缩合反应(简单版)

Cannizzaro 反应
CH2OH
有机金属化合物的α−羟烷基化反应
(1) Reformatsky reaction: 醛、酮与α−卤代酸酯在锌粉的 存在下缩合而得β−羟基酸酯或脱水得α,β−不饱和酸酯。
O R1 R2 + X H C CO2R H R
1 2
1) Zn 2) H3O+ R
1 2
OH H C C CO2R H -H2O
+
C6H5 C6H5COCH2CHCH2CO2H
O CO2Et + CH CCOCH3
K2CO3/Acetone
O CO2Et COCH3
KOH/EtOH CHCN Et + CH2 CHCN
CN C CH2CH2CN Et
O CO2Et + Yb(OTf)3 CH2 CHCOCH3
O CO2Et COCH3 (95%)
O O HO NH2 CN HO O NH CN Cl OCH3 HO O N
O OCH3 CN
化合物Ⅰ
化合物Ⅱ
O O Ni/H2 HO N OCH3 NH2 NaOH/ref HO O N O NH
化合物Ⅲ(VAM水溶液)
化合物Ⅳ(Wing-B)
2.有机金属化合物的β−羰烷基化反应
有机金属化合物对α,β−不饱和羰基化合物的1,4− 加成−β−位引入烷基。
O R C CH3 + 3NH3 + 3HCHO
O R C C(CH2NH2)3
NH3
+
HCHO
CH2
NH2
Imine (亚胺)
2.Streck反应- a-氨基酸的制备
醛、酮类化合物与ΗCΝ和氨(胺类化合物)反应生成 α−氨基腈,再经酸或碱水解得到α−氨基酸的反应。
第四章 缩合反应 总结

药物合成基础
第四章 缩合反应
总结
主要涉及多种类型的缩合反应, 第四章 主要涉及多种类型的缩合反应,要求掌握如 下内容: 下内容:
1. 了解什么是缩合反应? 了解什么是缩合反应? 2 . 掌握α-羟烷基化、卤烷基化、氨烷基化反应 掌握α 羟烷基化、卤烷基化、氨烷基化反应 反应; 〔1〕重点掌握醛醇缩合及其机理、实例;Prins反应; 〕重点掌握醛醇缩合及其机理、实例; 反应 Reformatsky反应;Blanc反应;Mannich反应;及其相应 反应; 反应; 反应; 反应 反应 反应 的实例。 试剂、 试剂和Normat试 的实例。 Reformatsky试剂、Grignard试剂和 试剂 试剂和 试 剂有何区别? 剂有何区别? 〔2〕知道 〕知道Strecker反应的应用 反应的应用 3 . 掌握β-羟烷基化、 β-碳基羟烷基化反应 掌握β 羟烷基化、 碳基羟烷基化反应 〔1〕重点掌握 〕重点掌握Michael反应及相应的实例 反应及相应的实例 〔2〕知道环氧化合物的反应及有机金属化合物与不饱和 〕 醛酮的加成反应
4 .掌握亚甲基化反应 掌握亚甲基化 掌握亚甲基 〔1〕重点掌握 〕重点掌握Wittig及Horner反应及相应的实例 及 反应及相应的实例 反应、 反应、 〔2〕知道 〕知道Knoevenagel反应、Stobbe反应、 反应 反应 Perkin反应、Erlenmeyer-Plochl反应及有机金属 反应、 反应 反应及有机金属 化合物的亚甲基化 5 .掌握 掌握Darzens缩合反应及实例 掌握 缩合反应及实例 6 .掌握环加成反应 掌握环加成反应 重点掌握diels-alder反应的应用及碳烯和氮烯的加 反应的应用及碳烯和氮烯的加 重点掌握 成
第四章 缩合反应

催化剂:酸如HCl, H2SO4, BF3, 对甲苯磺酸等, 但不及碱催化应用广泛。
4
1.自身羟醛缩合
两分子相同的醛或酮在碱的催化下,相互缩合生 成β-羟基醛(酮),或进一步脱水生成α,β-不饱和 醛(酮)。
R
CH2
O
O
O
C
RH(RC'H) 2+
C
R
H(R')
CH2
+R
C
HC(RH'2)
O OCH- Ho(rR. ')H+ OH- or. H+
OO
((动动(动力力力学学学控控控制制制)))
(((热热热力力力学学学控控控制制制)))
OOO
12
(2)羟甲基化反应--Tollens缩合
在碱催化下,甲醛与含α-氢的醛、酮进行交叉羟 醛缩合,在醛、酮的α-碳原子上引入羟甲基,其 产物是β-羟基醛酮或α,β-不饱和醛酮。
HHHCCCHHHOOO +++ CCCHHH333CCCOOOCCCHHH333
2
O O
(65%) (65%)
8
2.A-B型羟醛缩合
(1)Claisen-Schimidt缩合
无α-H的芳醛与含有α-H的醛、酮,在碱或酸的催化 下,脱水缩合成α,β-不饱和醛(酮)的反应。
OO
ArACrHCOHO++RRCCHH2C2C HH((RR')') OOHH--
RR
AArr
HH(R(R')')
一、α-羟烷基化反应 羟醛缩合反应: 含有α-氢的醛或酮,在酸或碱的催化下发生自身 缩合,或与另一分子的醛或酮发生缩合,生成β羟基醛(酮),或进一步脱水生成α,β-不饱和醛 (酮)的反应。
4
1.自身羟醛缩合
两分子相同的醛或酮在碱的催化下,相互缩合生 成β-羟基醛(酮),或进一步脱水生成α,β-不饱和 醛(酮)。
R
CH2
O
O
O
C
RH(RC'H) 2+
C
R
H(R')
CH2
+R
C
HC(RH'2)
O OCH- Ho(rR. ')H+ OH- or. H+
OO
((动动(动力力力学学学控控控制制制)))
(((热热热力力力学学学控控控制制制)))
OOO
12
(2)羟甲基化反应--Tollens缩合
在碱催化下,甲醛与含α-氢的醛、酮进行交叉羟 醛缩合,在醛、酮的α-碳原子上引入羟甲基,其 产物是β-羟基醛酮或α,β-不饱和醛酮。
HHHCCCHHHOOO +++ CCCHHH333CCCOOOCCCHHH333
2
O O
(65%) (65%)
8
2.A-B型羟醛缩合
(1)Claisen-Schimidt缩合
无α-H的芳醛与含有α-H的醛、酮,在碱或酸的催化 下,脱水缩合成α,β-不饱和醛(酮)的反应。
OO
ArACrHCOHO++RRCCHH2C2C HH((RR')') OOHH--
RR
AArr
HH(R(R')')
一、α-羟烷基化反应 羟醛缩合反应: 含有α-氢的醛或酮,在酸或碱的催化下发生自身 缩合,或与另一分子的醛或酮发生缩合,生成β羟基醛(酮),或进一步脱水生成α,β-不饱和醛 (酮)的反应。
第四章:缩合反应(2,3节)-1
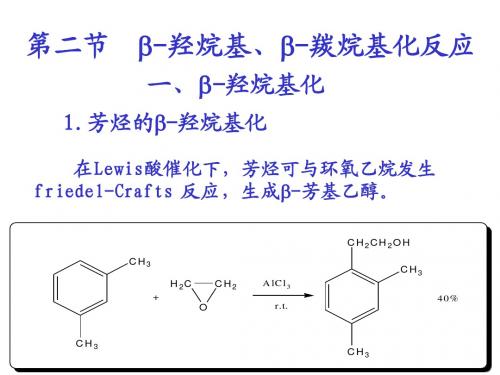
2 2 5
H3CO
CH2CH2COOC2H5
H3CO
2. Perkin 反应
芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合, 芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成 芳基丙烯酸类化合物的反应。 β-芳基丙烯酸类化合物的反应。
O H3C C6H5CHO + H3C C O C O CH3COO C6H5 H C H COOH
O R C O R C C R2 R2 O R C R1 C R2 H2 C C X + BH R O C R1 C R2 H2 C X CH + B CH R2 R1 + C C X R O C O R1 + B R C C R2 R1 C H2 C C X R1 + BH
供电体: 供电体的酸度越大, Michael 供电体: 供电体的酸度越大,越容易 形成碳负离子,活性越大。 形成碳负离子,活性越大。 受电体: Michael 受电体: α,β-不饱和键上所连接的官 能团的吸电子能力越强, 能团的吸电子能力越强,使β-碳原子的电子云密度 降低的越多,其活性亦越大。 降低的越多,其活性亦越大。
R3 C R4 O
+
R1 (C6H5)3P C R2
R3 C R4 C
R1
+ (C6H 5)3P
O
R2
R1 R1 (C6H5)3P C R2
+
R1 (C6H5) 3P C R2 R4 R3
R3 C R4 O
(C6H5) 3P O
C
R2 R4
CR2 C
+ (C6H5)3P
O
R4
R3
硫和磷与碳结合时,碳带负电荷,硫或磷带正电荷彼此相邻,这种结构的化 合物称为Ylide(叶立德)。由磷形成的Ylide称为磷Ylide,又称为Wittig试剂, 其结构可表示如下:
H3CO
CH2CH2COOC2H5
H3CO
2. Perkin 反应
芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合, 芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成 芳基丙烯酸类化合物的反应。 β-芳基丙烯酸类化合物的反应。
O H3C C6H5CHO + H3C C O C O CH3COO C6H5 H C H COOH
O R C O R C C R2 R2 O R C R1 C R2 H2 C C X + BH R O C R1 C R2 H2 C X CH + B CH R2 R1 + C C X R O C O R1 + B R C C R2 R1 C H2 C C X R1 + BH
供电体: 供电体的酸度越大, Michael 供电体: 供电体的酸度越大,越容易 形成碳负离子,活性越大。 形成碳负离子,活性越大。 受电体: Michael 受电体: α,β-不饱和键上所连接的官 能团的吸电子能力越强, 能团的吸电子能力越强,使β-碳原子的电子云密度 降低的越多,其活性亦越大。 降低的越多,其活性亦越大。
R3 C R4 O
+
R1 (C6H5)3P C R2
R3 C R4 C
R1
+ (C6H 5)3P
O
R2
R1 R1 (C6H5)3P C R2
+
R1 (C6H5) 3P C R2 R4 R3
R3 C R4 O
(C6H5) 3P O
C
R2 R4
CR2 C
+ (C6H5)3P
O
R4
R3
硫和磷与碳结合时,碳带负电荷,硫或磷带正电荷彼此相邻,这种结构的化 合物称为Ylide(叶立德)。由磷形成的Ylide称为磷Ylide,又称为Wittig试剂, 其结构可表示如下:
第四章缩合反应详解演示文稿

CH2N
OCH3 中等极性供电基
第三十六页,共68页。
酸性条件下反应
O CH3 H2O + (CH2O)3 +(CH3)2NH.HCl 回流
O CH3
O
+ (H3C)2NH2C
CH3
CH2N(CH3)2
70%
30%
抗疟疾药常洛林
比较定位强度
NH
OH
NH
HCHO
N H
第三十七页,共68页。
CH2 N OH
RCH2OH + RCOO-
O
Ca(OH)2
CH3CH + 3HCHO
HOH2C
CH2OH C CHO CH2OH
HCHO
HOH2C
Ca(OH)2
CH2OH C CH2OH + (HCOO)2Ca CH2OH
季戊四醇
第九页,共68页。
b 苯甲醛与含α-H醛酮的反应(Claisen-Schimidt)
含有 -活泼氢的醛、酮与甲醛及胺(伯胺、仲胺或氨)反应,结果一
个 -活泼氢被胺甲基取代,此反应又称为胺甲基化反应,所得产物
称为Mannich(曼尼奇)碱
通式:
R EtOH
R'H
+
HCHO + HN HCl R
or苯
R R' H2CN
R
活性氢化合物: 醛、酮、羧酸、腈、硝基烷、含活泼氢的炔、 活化的芳环。应用最广的是甲基酮和环酮。
H CC
H
O C CH2CH3
O
H C C C CH3
CH3
第十一页,共68页。
酸性条件下将形成烯醇,而不是烯醇负离子
药物合成反应(第三版_闻韧)第四章 缩合反应总结

R
CH C OH
R'
R
-H
R' R R CH2 C OH
O R'
Hale Waihona Puke CH C- H2O
R'
O C C CR'
CH2R R
Organic Reactions for Drug Synthesis
1)自身缩合 (一般用碱性催化剂)
NaOH 25℃ 2CH3CH2CH2CHO NaOH 80℃ CH3CH2CH2CH OH CH3CH2CH2CH CH CHO CH2CH3 C CHO
试解释上述反应中为什么使用镁?
Organic Reactions for Drug Synthesis
1)
-卤代酸酯的活性顺序为:
R1 R1
ICH2COOC2H5>BrCH2COOC2H5 >ClCH2COOC2H5
X CCOOC2H5 > X CHCOOC H > X CH2COOC2H5 2 5 R2
2) 无水操作:Et2O、THF等。Zn需活化(用20%HCl 处理)
Organic Reactions for Drug Synthesis
Reformatsky反应的应用:
•合成-羟基羧酸酯 •合成-羟基羧酸
•醛、酮增长碳链的方法之一
Organic Reactions for Drug Synthesis
C O Y
Nu
C O Nu
+ Y
Organic Reactions for Drug Synthesis
羰基化合物的结构与反应特征
羰基化合物的结构特征之二: ——羰基C=O的吸电子作用使得a-H具有明显 的酸性,在碱性条件下可以离解,生成烯醇 负离子,从而成为亲核试剂,进攻羰基碳或 卤代烃,发生亲核加成反应、亲核取代反应。
第四章:缩合反应(2,3节)-1
NH2
C (C O O C 2 H 5 ) 2
30%
O R
C
R R1
+
C H 2 (C O O C 2 H 5 ) 2
T iC l 4 / P y C
R1
C (C O O C 2 H 5 ) 2
73~100%
2. Stobbe 反应
丁二酸酯或烃基取代的丁二酸酯在碱性试剂存 在下,与羰基化合物进行缩合生成-烃基亚甲基丁 二酸单酯的反应。
O
C H C O O C 2H 5 + (H 3 C ) 3 C OH
CH CO OC2H5
C 6H 5 C
O H2 C
C CH
O C 2H 5
- O C 2H 5
C O O C 2H 5
C O
O
C
O
(H 3 C ) 3 C
(C 6 H 5 ) 2
OK
(C 6 H 5 ) 2 C CH2
C O O C 2H 5
醚水解
CHO
+ P h3P = C H O C H 3 金 刚
利 用 此 结 构 可 制 醛
O O
+
P h3P
C H
COEt
位 阻 大 ,不 反 应
维生素A的合成-
X
C H 2O H C H
(C 6 H 5 ) 3 P . H X
C H 2 P ( C 6 H 5 )3 C H
C - P H ( C 6 H 5 )3
A ld o le
O OH
H 2O O
2.有机金属化合物的-羰烷基化反应反应
有机金属化合物与,-不饱和羰基化合物加成时, 既可进攻1,2-加成产物,又可与共扼体系反应生成1, 4-加成产物。若生成1,4-加成产物,既在连有金属部 分的碳原子上引入一个-烷基,又称-羰烷基化反应。
第四章 缩合反应-shi
第四章
缩合反应
Chapter 4 Condensation Reaction
定义:两个或多个有机化合物分子通过反应形成一个新的 较大分子的反应,或同一个分子发生分子内的反应 形成新分子都可称为缩合反应。
1
本章主要内容
-羟烷基、卤烷基、氨烷基化反应 -羟烷基、 -羰烷基化反应 亚甲基化反应 ,-环氧烷基化(Darzens)反应 环加成反应
第一节 -羟烷基、卤烷基、氨烷基化反应
一、-羟烷基化反应
羰基位碳原子的-羟烷基化反应(Aldol缩合) 不饱和烃的-羟烷基化反应(Prins反应) 芳醛的-羟烷基化反应(安息香缩合) 有机金属化合物的-羟烷基化反应
3
1. 醛醇缩合(Aldol Condensation)
定义:含有-活性氢的醛或酮在酸或碱的催化下发生自 身缩合,或与另一分子的醛或酮发生缩合,生成-羟基 醛或酮类化合物的反应,该类化合物不稳定,易脱水生成 ,-不饱和醛或酮。 (1) 含有 -活泼氢的醛或酮的自身缩合
机 理 a: 碱催化
NaOH, Na2CO3 , EtONa, NaH
机 理 b: 酸催化
CH3CONHC(COOC2H5)2
CH2 C (COOC2H5)2 水解 NHCOCH3 N H
脱羧 N H
H CH2 C COOH NH2
CH2N(CH3)2 NaCN/H2O/EtOH N H HCl/H2O N H CH2COOH N
CH2CN
H3CO
HCHO COCH3 Me2NH. HCl
NC OH NC O Proton Ar C C Ar' Ar C C Ar' transfer O H HO H
2 CH3O
缩合反应
Chapter 4 Condensation Reaction
定义:两个或多个有机化合物分子通过反应形成一个新的 较大分子的反应,或同一个分子发生分子内的反应 形成新分子都可称为缩合反应。
1
本章主要内容
-羟烷基、卤烷基、氨烷基化反应 -羟烷基、 -羰烷基化反应 亚甲基化反应 ,-环氧烷基化(Darzens)反应 环加成反应
第一节 -羟烷基、卤烷基、氨烷基化反应
一、-羟烷基化反应
羰基位碳原子的-羟烷基化反应(Aldol缩合) 不饱和烃的-羟烷基化反应(Prins反应) 芳醛的-羟烷基化反应(安息香缩合) 有机金属化合物的-羟烷基化反应
3
1. 醛醇缩合(Aldol Condensation)
定义:含有-活性氢的醛或酮在酸或碱的催化下发生自 身缩合,或与另一分子的醛或酮发生缩合,生成-羟基 醛或酮类化合物的反应,该类化合物不稳定,易脱水生成 ,-不饱和醛或酮。 (1) 含有 -活泼氢的醛或酮的自身缩合
机 理 a: 碱催化
NaOH, Na2CO3 , EtONa, NaH
机 理 b: 酸催化
CH3CONHC(COOC2H5)2
CH2 C (COOC2H5)2 水解 NHCOCH3 N H
脱羧 N H
H CH2 C COOH NH2
CH2N(CH3)2 NaCN/H2O/EtOH N H HCl/H2O N H CH2COOH N
CH2CN
H3CO
HCHO COCH3 Me2NH. HCl
NC OH NC O Proton Ar C C Ar' Ar C C Ar' transfer O H HO H
2 CH3O
第四章 碱催化缩合反应和烃基化反应(6)-1
8
4.1.2 酯缩合反应
1. Claisen酯缩合反应 Claisen酯缩合反应:酯和含活泼甲基或亚甲基的羰基化合物在强
碱作用下缩合,生成β-羰基化合物的反应称之。
◆ 机理:
H CH2COOC2H5
乙酸乙酯
O
NaOC 2H5
O
-
O-
CH2-C-OC2H5
O-
CH2=C-OC2H5
CH3-C-O-C 2H5 + -CH COOC H 2 2 5
◆ 讨论:
① 羰基使α-H的酸性大增,在强碱(碱性大于OH-)作用下,发 生亲核加成-消除反应,最终得到β-二羰基化合物。
② 酮的酸性一般大于酯,所以在乙醇钠的作用下,酮更易生 成碳负离子。例如:
O CH3-C-CH3 O CH3-C-CH2
O OCH3-C-CH2-C-CH3 OCH2CH3
O-
第四章 碱催化缩合反应和烃基化反应
4.1.4 Stobbe 反应 丁二酸酯或α-烃基取代的丁二酸酯在碱作用下,与羰基化合物 (常用酮)进行缩合而得α-烷烃(或芳烃)亚甲基丁二酸酯的反
应称为Stobbe 反应。
CH2COOC2H5 (C6H5)2C O H+ + CH2COOC2H5 C COOC2H5 CH2COOH (CH3)3C OK (CH3)3C OH, (C6H5)2C C COOC2H5 CH2COO
C O
R'
R
C H
C O
R'
醛的缩合反应,生成碳负离子为决速步骤;酮的缩合反应,碳 负离子对酮羰基的加成是决速步骤。
第四章 碱催化缩合反应和烃基化反应 2
R
H2 C
《药物合成》第四章缩合反应
讨论内容:
具有活性H的化合物与羰基化合物(醛、酮、酯等) 之间的缩合反应。主要包括: α -羟烷基、卤烷基、 氨烷基化反应;β-羟烷基, β-羰烷基化反应
第一节: α-羟烷基、卤烷基、氨烷基化反应
一、α-羟烷基化反应
主要包括 1.羰基α-位碳原子的α-羟烷基化(aldol 缩合) 2. 不饱和烃的α-羟烷基化反应(Prins 反应) 3.芳醛的α-羟烷基化反应(安息香缩合) 4.有机金属化合物的α-羟烷基化
缩合反应
Condensation Reaction
本节主要内容
α-羟烷基化反应 α-卤烷基化反应 α-氨烷基化反应 β-羟烷基化反应 β-羰烷基化反应
前言
缩合:两个或多个有机化合物分子通过反应形成一个 新的较大分子或同一分子内两个官能团重新连接 而生成新的分子的过程,即称为缩合。
反应特点: 有小分子的水或醇等脱去,从而建立新的C—C键 或 C—Y(碳—杂)键。
1、羰基α位碳原子的α羟烷基化(Aldol缩合)
定义:含有α-活性氢原子的醛或酮,在碱或 酸的催化下发生自身缩合,或与另一分子的醛或 酮发生缩合,生成β-羟基醛或酮类化合物的反应, 称α-羟烷基化反应。
但该类反应不稳定,易消除脱水生成α,β-不 饱和醛酮。故此反应又称醛醇缩合(Aldol缩合)反 应。
缩合而生成新的C—C键的一种缩合方法;主要有烯醇 盐法、烯醇硅醚法、亚胺法。
机理①烯醇盐法
②烯醇硅醚法
③亚胺法:将醛与胺类反应生成亚胺,再与LDA作用转变为亚胺锂盐,然
后与另一醛、酮分子发生醛醇缩合而得α,β-不饱和醛。机理如下:
对羰基进行加成
例 (4)甲醛与含有α-活性氢的醛酮之间的缩合(Tollens缩合)
CH3OCH2Cl /ZnCl2、CH3OCH Cl2/lewis酸
具有活性H的化合物与羰基化合物(醛、酮、酯等) 之间的缩合反应。主要包括: α -羟烷基、卤烷基、 氨烷基化反应;β-羟烷基, β-羰烷基化反应
第一节: α-羟烷基、卤烷基、氨烷基化反应
一、α-羟烷基化反应
主要包括 1.羰基α-位碳原子的α-羟烷基化(aldol 缩合) 2. 不饱和烃的α-羟烷基化反应(Prins 反应) 3.芳醛的α-羟烷基化反应(安息香缩合) 4.有机金属化合物的α-羟烷基化
缩合反应
Condensation Reaction
本节主要内容
α-羟烷基化反应 α-卤烷基化反应 α-氨烷基化反应 β-羟烷基化反应 β-羰烷基化反应
前言
缩合:两个或多个有机化合物分子通过反应形成一个 新的较大分子或同一分子内两个官能团重新连接 而生成新的分子的过程,即称为缩合。
反应特点: 有小分子的水或醇等脱去,从而建立新的C—C键 或 C—Y(碳—杂)键。
1、羰基α位碳原子的α羟烷基化(Aldol缩合)
定义:含有α-活性氢原子的醛或酮,在碱或 酸的催化下发生自身缩合,或与另一分子的醛或 酮发生缩合,生成β-羟基醛或酮类化合物的反应, 称α-羟烷基化反应。
但该类反应不稳定,易消除脱水生成α,β-不 饱和醛酮。故此反应又称醛醇缩合(Aldol缩合)反 应。
缩合而生成新的C—C键的一种缩合方法;主要有烯醇 盐法、烯醇硅醚法、亚胺法。
机理①烯醇盐法
②烯醇硅醚法
③亚胺法:将醛与胺类反应生成亚胺,再与LDA作用转变为亚胺锂盐,然
后与另一醛、酮分子发生醛醇缩合而得α,β-不饱和醛。机理如下:
对羰基进行加成
例 (4)甲醛与含有α-活性氢的醛酮之间的缩合(Tollens缩合)
CH3OCH2Cl /ZnCl2、CH3OCH Cl2/lewis酸
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH
H2COH
ArH
ArCH2OH
HCl
ArCH2Cl
19
二、环加成反应机理
环加成反应可以看成是两种或两种以上的不饱和化合物通 过π键的断裂,相互以σ键结合成环状化合物的反应。在成 环过程中,既不发生消除,也不发生σ键的断裂,而σ键的 数目有所增加(一般形成两个新的σ键),加成物的组成是 反应物的总和。如果分子中含有合适基团,则可进行分子 内的环加成反应。
(C2H5)2O
RMgX
Grignard试剂
R1 R2
R3 C C X + Mg
THF R1 40~50℃ R2
R3 C C MgX
12
③Wittig试剂对醛、酮的加成-消除反应
Wittig羰基成烯反应:醛或酮与烃代亚甲基三苯膦反应,醛、
酮分子中羰基的氧原子被烃代亚甲基所取代,生成相应的 烯类化合物及氧化三苯膦的反应称Wittig羰基成烯反应,其
O PhC CH3 TMSCl
OTMS PhC CH2 (CH3)2C=O/TiCl4
O
OH
PhC CH2C(CH3)2
( 想让哪个醛、酮的α-H活化就让它与转变成烯醇硅醚)
35
c 亚胺法:醛类化合物一般较难形成相应的碳负离子,因而可先将 醛与胺类反应形成亚胺,亚胺再与LDA形成亚胺锂盐,然后与另一 分子醛、酮发生醛酮缩合
Ph3P +
R3 CH X R4 Ph3P CH
R3 X R4
n-BuLi
R3 Ph3P C R4 Ph3P C
R3 R4
14
反应机理 :
R3 R4 R1 R2
Ph3P
C
+
C
O
①
Ph3P O
C C
R3 R4 R1
R2
②
Ph3P O
C C
R3 R4 R1 R2
C C
R3 R4 R1 R2
+ Ph3P=O
中烃代亚甲基三苯膦称为Wittig试剂。
R1 R2
R3 C O + C R4
PPh3
R1 C R2
C
R3 R4
Witting试剂
13
Wittig试剂:
硫和磷与碳结合时,碳带负电荷,硫或磷带正电荷彼此相邻, 这种结构的化合物称为Ylide(叶立德)。 由磷形成的Ylide称为磷Ylide,又称为Wittig试剂,其结构可表示如下:
10
机理
C O + X C COOR5 2) H3O R2 R4 R3 OHR3 R1 H2O R1 C C COOR5 C C COOR5(若R =H) 4 R2 R2 R
4
11
R1
R3
1) Zn
Grignard反应: Grignard试剂与羰基化合物(醛、酮)反应, 生成相应的醇类化合物。
R X + Mg
活性亚甲基的位氢有一定酸性,在碱性条件下容易失去质子,形 成碳负离子。然后与醛、酮缩合,脱水得产物。(类似羟醛缩合)
H2C
X Y
R1 + R2
C
O
B:
R1 R2
C
C
X Y
+ H2O
醛、酮与伯胺、仲胺反应,生成亚胺过渡态,然后活性亚甲基的 碳负离子向亚胺过渡态发生亲核加成,再经脱氨得产物。
R' CH H CH O + R2'NH CH H CH OH N R' C CH R' N R'
C HO
R' +
R
HC
Cቤተ መጻሕፍቲ ባይዱOH
R'
R
H
R
H2 C C
R' R C H
O C R'
- H2O -H
R'
OH2
RH2C
28
③影响因素
醛、酮结构的影响
活性:酮<醛
O
O
CH3 C + H2C C CH3 CH3 H CH3 O
Ba(OH)2
H3C C CH2 C CH3 OH CH3
I2或 3PO4 H O
2
羰基化合物的结构与反应特征
羰基C=O,可以接受亲核试剂的进攻,发生亲核加成反 应、亲核取代反应。
C O
Nu E
C OE Nu
C O
H2NY
Y C N
R1 R2
C O
Ph3P CR1R2
C C
C O Y
Nu
C O Nu
+ Y
3
羰基化合物的结构与反应特征
羰基C=O的吸电子作用使得α-H具有明显的酸性,在碱性条 件下可以离解,生成烯醇负离子,从而成为亲核试剂,进 攻羰基碳或卤代烃,发生亲核加成反应、亲核取代反应。
CH2 CH2 CH2 CH2 HC HC CH2 CH2 CH2
+ [4+2]环加成反应 HC 1,3-偶极环加成反应 CH
2
HC
20
1. [4+2]环加成反应 共轭二烯烃与烯烃、炔烃进行环加成,生成环己 烯衍生物的反应属[4+2]环加成反应,该反应称为 Diels-Alder反应,也称“双烯加成”。 最简单的[4+2]环化加成是1,3-丁二烯与乙烯加 成反应,假定丁二烯分子与乙烯分子面对面互相 接近,丁二烯的最高占有轨道与乙烯的最低空轨 道或丁二烯的最低空轨道与乙烯的最高占有轨道 都可以重叠成键,因此,[4+2]环加成是对称允许 反应。
15
④活性亚甲基化合物对醛、酮的加成-消除反应
【含活泼亚甲基的化合物】+【醛或酮】+在【弱碱性催 化剂(氨、伯胺、仲胺等有机碱)】存在下→缩合得到【 α, β-不饱和化合物】。
H2C
X Y
R1 + R2
C
O
B:
R1 R2
C
C
X Y
+ H2O
16
活性亚甲基化合物对醛、酮的加成-消除反应的机理主要有两种:
B: + OH
-
R
-H2O
H2 C C
R' R C
O
C R'
产物不稳定
27
OH H
△
机 理 b: 酸催化 H2SO4
R CH2 C R' O H+ R
HCl
CH2 C OH
TsOH
R' R CH2 C R' HO ' H2 R R C C C H OH O C C R CR' O C R'
R
CH2
O O C3H7 C CH3 -78℃ LDA OLi H3CH2CH2C C CH2 RC R HO R O R C CH2 C CH2CH2CH3 65%
H+
( 想让哪个醛、酮的α-H活化就让它与有位阻的碱反应)
34
b.烯醇硅醚法 将醛、酮中的某一组分转变成烯醇硅醚,然后在在四 氯化钛等路易斯酸的催化下,与另一分子醛、酮分子发生醛醇缩合。
C
C 烯醇负离子
C R
O C
烷基化反应
OH O C C C
Aldol-反应 羟醛反应
X-X
亲电取代
-羟基酮
O C C X
卤代反应
5
第一节 缩合反应机理
亲核反应机理 电子反应机理
亲电反应机理
环加成反应机理
6
一、电子反应机理
1. 亲核反应
(1)亲核加成-消除反应
含有α-活性氢的醛或酮间的加成-消除反应 α-卤代酸酯对醛、酮的加成-消除反应
H C
CHO
CH2CH3 C CHO
CH3CH2CH2CH
CH2CH3
31
催化剂的影响 醛或酮的自身缩合反应常用碱作催化剂,酸催化剂应用较少。
32
④应用特点
制备长链醛(醇)
例:2-乙基己醇(异辛醇)的生产 2 CH3CH2CH2CHO
CH3CH2CH2CH2-CHCHO OH CH2CH3
CH3CH2CH2CH2=CCHO CH2CH3
慢
R
H2 C
R' C O
+R
H C
快
C O R' R
H2 C C
R' R C H
O
C R'
O
H2O
R
H2 C C
R' R O C C
R ' + OH
B:
-H2O
R
H2 C C
R' R C
O
C R'
产物不稳定
8
OH H
△
机 理 b: 酸催化 H2SO4
R CH2 C R' O H+ R
HCl
CH2 C OH
C6H5N(CH3)MgBr/PhH/Et2O
CH3CH2COCH2C OH
CH2CH3
60%~67%
30
反应温度的影响 活性醛发生反应,如反应温度较高或催化剂的碱性较强,有利于消 除脱水得α,β -不饱和醛。
NaOH 25℃ 2CH3CH2CH2CHO NaOH 80℃
CH3 CH2CH2CH OH
Wittig试剂对醛、酮的加成-消除反应
活性亚甲基化合物对醛、酮的加成-消除反应
7
①含有α -活性氢的醛或酮间的亲核加成-消除反应
机 理 a: 碱催化(无机碱NaOH, Na2CO3 ;有机碱EtONa, NaH )
R H2 C B: C O R' R H C C O R' R C H C O R'
