第八章 缩合反应
第8章羰基缩合反应

O H3C C OH
+
CX3
O H3 C C O
如果是CHI3,则出现黄色沉淀
二、a – 卤代反应
(1)Aldehyde and ketone
O H3C C CI3 O H3C C CI3 OH O H3C C O + O H3C C OH
OH
+ CI3
CHI3 (yellow)
碘仿反应:用于鉴别甲基酮和能氧化为甲基酮的醇
二、a – 卤代反应
(1)Aldehyde and ketone 酸催化机理:
H H H C C C C OH O Ⅰ 质子化相对容易 X C C OH H
慢
C C OH X C C O Ⅱ
ห้องสมุดไป่ตู้
X X 快
比较I和II,由于卤素的吸电子作用,II中羰基氧上的电 子云密度降低,因此质子化能力降低,反应多停留在 一卤代阶段
二、a – 卤代反应
(1)Aldehyde and ketone
O H OH H3C C CH2X Ⅱ O H3C C CHX2 Ⅲ O H3C C CX3 Ⅳ
OH OH
O H3C C CH2X
O H3C C CH2
X-X -X
O H3C C CX2
O H3C C CX2
X-X -X
O H3C C CX3 OH + CHX3
五、a, - 不饱和羰基的亲核加成
1. Michael addition
• It is the addition of a a, -unsaturated carbonyl compound with an enolate as a nucleophile • ——1, 4 – addition • ——to form 1, 5-dicarbonyl compounds
药物合成反应四、缩合反应

苯妥英的合成始于苯甲醛的制备,通常通过苯甲醇氧化得到。然后,苯甲醛与尿素发生 缩合反应,生成苯妥英钠。最后,通过酸化得到苯妥英,经过分离纯化后得到最终产物。
阿司匹林的合成
总结词
阿司匹林的合成涉及酯化反应和缩合反 应,关键步骤是醋酐与水杨酸的酯化反 应。
VS
详细描述
阿司匹林的合成始于水杨酸与醋酐的酯化 反应,生成水杨酸醋酐酯。然后,通过与 乙酸酐发生缩合反应,生成阿司匹林。经 过分离纯化后得到最终产物。
详细描述
酯缩合反应通常在碱催化下进行,涉及两个酯分子的反应。该反应通过酯基的转 化,形成新的碳-碳键,将两个分子连接在一起。酯缩合反应在药物合成中具有 广泛应用,可以用于构建具有特定结构的有机分子。
烯胺缩合反应
总结词
烯胺缩合反应是一种通过碳-氮键的形成将烯胺和另一个分子连接在一起的反应。
详细描述
烯胺缩合反应通常在酸或碱催化下进行,涉及一个烯胺和一个其他分子的反应。该反应通过形成新的 碳-氮键,将两个分子连接在一起。烯胺缩合反应在药物合成中具有重要意义,可以用于构建具有特定 结构的有机分子。
要点二
解决方法
研究反应机理,寻找更有效的催化剂或试剂,以及通过实 验条件的优化,如增加反应时间、提高温度等,提高反应 收率。
如何实现绿色合成
绿色化学
随着环保意识的增强,药物合成过程需要更加绿色和 可持续。
解决方法
研究和发展更环保的合成方法,如使用无毒或低毒性 的溶剂、催化剂和试剂,减少废物产生,以及通过反 应条件的优化实现高效、低能耗的合成过程。
详细描述
羟醛缩合反应通常在碱催化下进行,涉及一个醛和一个醇分子的反应。该反应首先形成醇的烯醇式,然后与另一 个分子进行加成反应,形成新的碳-碳键。羟醛缩合反应在药物合成中具有重要意义,可以用于构建具有特定结 构的有机分子。
缩合反应实例
RC R'
O C C OEt
CH2 C O
O
O H C OEt
C C
CH2 O
C O
EtO R
EtOH
R'
O
O
H O
C
C OEt
CH2 C OEt O
EtOH EtO
O C C C OEt
O CH2 C OH
从形式上看,该反应的特点是:醛(酮)的羰基碳与丁二酸 酯的一个酯基的α-C形成C=C,同时另一个酯基被水解成酸。
RCH2COOK
R ArCH C COO
+ RCH2COOH
反应历程:
O
RCH2 C OH
O
RCH 2
O C
O
O C
C
OO RCH C O C CH2R
O Ar C H
OHO O Ar C C C O C CH2R
HR
RCH 2COOH
OH H O O Ar C C C O C CH2R
(1) 碱 (2) H
R CC R'
O C OEt
CH2 C OH O
反应历程:
CH2 CH2
R C
R' O
O
C OEt
EtOH CH
EtO
O C OEt
R
O
R'
R C R'
C
C OEt O
R R'
O C OEt C CH2 C
CH2 C OEt
O O H C OEt
C
R
C
CH2
R'
OC
O OEt
2.官能团转化
O Ph C CH2CH2NR2
第八章缩合反应

第八章缩合反应
四、酯—酮缩合
➢ 1mol酮与1mol酯进行混合缩合,就得 到β—二酮类化合物。因为酮旳α—活泼 氢一般比酯旳α—活泼氢活泼,故在碱性 催化剂作用下,因应首先形成负碳离子, 然后与酯旳羰基进行亲核加成,缩合反应 旳成果是酮旳α—碳原子酰基化。例如
第八章缩合反应
➢若用酮与不含α—活泼氢旳能进行混合 缩合,能得到纯度较高旳产物。例如
第八章缩合反应
三、分子内旳酯—酯缩合
二元酸酯能够发生分子内旳和分子间旳酯缩合 反应。假如分子中旳两个酯基被三个以上旳碳 原子隔开时,就会发生分子内旳缩合反应,形 成五员环或六员环旳酯。这种环化酯缩合反应 又称为狄克曼(Dieckmann)反应。例如
第八章缩合反应
假如两个酯基之间只被三个或三个下列旳碳原子隔开 时,就不能发生闭环酯缩合反应因为这么就要形成四 员环或不大于四员环旳体系。但能够利用这种二元酸 酯与不合α—活泼氢旳二元酸进行分子间缩合,一样也 可得到环状羰基酯。例如在合成樟脑时,其中有一步 反应就是用β—二甲基戊二酸酯与草酸酯缩合,得到五 员环旳二β—羰基酯。例如
Michael反应常用旳碱能够是较强旳碱,如叔丁 醇钾、乙醇钠(钾)、氢化钠、氨基钠、金属钠等, 也能够用吡啶、六氢吡啶、三乙胺等较弱旳碱。 碱旳选择一般取决于反应物旳活性大小及反应条 件。对于高活性反应物,常用六氢吡啶作催化剂, 它具有副反应少旳优点,但反应速度较慢;对于 低活性物质,则需选择更强旳碱。
第八章缩合反应
三、羰基合成反应 在铁、钴、镍等过渡金属羰基化合物旳催化下,烯烃
和一氧化碳在氢气存在下反应生成醛,或在水(或醇) 存在下生成羧酸(或羧酸酯)旳反应,被统称为羰基合 成反应。
➢烯烃旳反应活性与其本身旳构造有关,一般地 说,直链末端烯烃>直链非末端烯烃>支链末端 烯烃;环烯旳反应速度为C5>C6>C7>C8,即甲 酰基优先导入位阻小旳一边,叔碳原子处不发生 甲酰化。例如
缩合反应

应用:合成稠环,如甾类,萜类化合物
27
2. 不饱和烃的-羟烷基化反应(Prins反应)
28
Mechanism
29
30
应用: A: 制备1,3二醇
HCOOH + HCHO
OCHO OCHO H2O
OH OH
B: 制备1,3二氧六环
酸性树脂 + HCHO
O
31
3. 安息香缩合(Benzoin Condensation)
2
第一节 -羟烷基、卤烷基、氨烷基化反应
一、-羟烷基化反应
➢ 羰基位碳原子的-羟烷基化反应(羟醛缩合) ➢ 不饱和烃的-羟烷基化反应(Prins反应) ➢ 芳醛的-羟烷基化反应(安息香缩合) ➢ 有机金属化合物的-羟烷基化反应
3
1. 羟醛缩合(Aldol Condensation)
65
1.芳烃的β-羟烷基化 在Lewis酸催化下,芳烃与环氧乙烷发生Friedel-Crafts反应, 生成-芳基乙醇的反应。
66
2.活性亚甲基化合物的-羟烷基化
H2C(COOC2H5)2 EtONa CH(COOC2H5)2
CH2 CH2
COOC2H5
O /EtOH HC COOC2H5
CH2CH2OH
Michael 受电体:,-不饱和羰基化合物及其衍生物,如 ,-烯醛类、,-烯酮类、,-炔酮类、 ,-烯腈类、,-烯酯类、,-烯酰胺 类、杂环,-烯烃、,-不饱和硝基化 合物等。
70
Mechanism:
O
O
Base
RCH2EWG
RCHEWG
OH
R EWG
O
R EWG
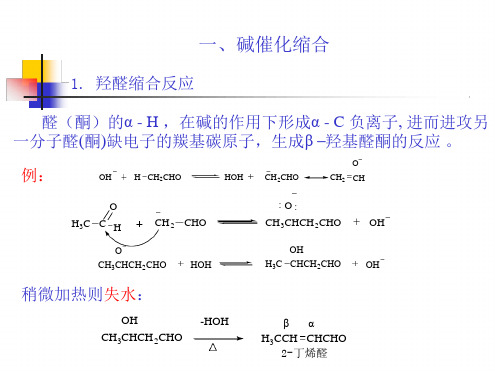
定义:含有-活泼氢的醛或酮在酸或碱的催化下发生自 身缩合,或与另一分子的醛或酮发生缩合,生成-羟基 醛或酮类化合物的反应。
缩合反应

6 缩合反应缩合反应一般指两个或多个有机化合物分子形成较大的分子的反应,此外缩合反应也可以发生在分子内。
缩合过程常伴有小分子消除。
通过缩合反应可以形成碳碳键、碳杂键,进而达到增碳、引入官能团以及成环等目的,在药物合成中占有重要地位。
本章内容主要为含活泼氢化合物(醛、酮和酯)之间的缩合反应。
6.1alpha-羟烷化、alpha-卤烷化和alpha-氨(胺)烷化反应指在底物分子的某位置引入alpha-羟烷基、alpha-卤烷基和alpha-氨烷基的反应。
alpha是指羟基(卤素和氨(胺)基)直接与引入的烷基的碳相连。
6.1.1alpha-羟烷化(1)羰基alpha碳的alpha-羟烷化(羟醛缩合)具活泼氢的醛(酮)在碱(或酸)的催化下,自身或交叉缩合,生成beta-羟基醛或酮的反应。
最初是因为烯醇负离子对一个醛(aldehyde)加成得到醇(alcohol)而得名(aldol)。
反应机理为烯醇(负离子)对羰基的亲核加成。
①具活泼氢的醛或酮的自身缩合反应可以是碱催化的。
根据反应条件的不同,生成的beta-羟基醛或酮可以发生消除而生成烯,如丁醛的羟醛缩合反应。
也可以用酸催化,比如硫酸、盐酸以及离子交换树脂等。
碱能催化的原因在于碱可以夺取底物的质子,使其形成烯醇负离子;酸能催化的原因在于酸既能质子化羰基,使之更容易被亲核试剂进攻,也能帮助烯醇式的形成,又能催化脱水。
对称酮缩合产物单一。
对于不对称酮,不论碱催化或酸催化,反应主要发生在含氢较多的alpha碳原子上,得到beta羟基酮或其脱水物。
②芳醛与具活泼氢的醛或酮的缩合芳醛与具活泼氢的醛或酮的缩合可生成b羟基芳丙醛(酮),并进一步消除生成更稳定的芳丙烯醛(酮),即Claisen-Schmidt反应。
消除产物以反式构型为主,如苯甲醛与苯乙酮的缩合。
这与过渡态的稳定性有关(反式共平面消除)。
芳醛与两个alpha位都含活泼氢的酮反应时,酸催化倾向于在含氢较少的位置缩合,碱催化与此相反。
人大附中化学竞赛讲义-缩合反应
CHO +
CHO
受体(给体)
给体(受体)
CH3 N CH3
OH C C H O
CH3 + N CH3
OH C C O H
β-羟基醛酮碱性条件失水机理 羟醛缩合中的立体化学问题 羟醛缩合中的反应竞争问题 酸催化与碱催化的区域选择性问题 复杂羟醛缩合机理推断 酮在碱性条件自身缩合产率低,酸性条件产率较高
分子间或分子内不相连接的两个碳原子连接起来形 成新的碳碳键,成为新的化合物,同时往往有比较 简单的无机或有机小分子化合物生成。这样的反应 统称为缩合反应。
通常情况下,缩合反应的实质是碳负离子作为亲核 试剂进攻羰基,生成新的碳碳键的反应。
定义:
1.具有α-H的醛、酮、酸、酯、 硝基化合物、腈、末端炔烃、含 有活泼氢的芳香环系化合物。 2. 二级胺。
通式:
反应所需的碱性催化剂一般为酸酐对应的羧酸盐
反应机理
应用实例:
定义:
在弱碱的催化作用下,醛、酮与含有活泼亚甲基的 化合物发生的失水缩合反应为Knoevenagel反应。
通式:
O Z: CHO, CR, COOR, CN, NO2 等
弱碱: N , N H , RCH2NH2, R2NH 等
N H 苯, 分水
(CH3)2CHCH = C(CO2Et) 2
90 %
定义:
醛、酮与α-卤代酸酯在强碱催化作用下互相作用, 生成α,β-环氧酸酯的反应称为Darzen反应。
通式:
* C=O + BrCH2CO2Et
NaNH 2 or RO-
第八章 缩合反应
O H H O +
O
稀NaOH
40-42 oC
O
(COOH)2 -H2O OH OH
O R R
1
O + R
2
OH or H R
3
R2 3 R
OH O R R
1
R2 -H2O R3 R
O R1
一、反应机理
在碱或酸条件下的亲核加成-消除反应,亲核加成是一个可逆过程,脱 水过程不可逆。其中亲核加成过程随酸、碱条件的不同而不同。
1. 碱催化机理
醛或酮羰基π键与α-C-H σ键之间存在的σ-π超共轭作用,使其易于烯醇 化而导致α-氢具有弱酸性。
2. 酸催化机理
含有活性α-氢的醛或酮的羰基在酸性条件下质子化后,极易转化为烯醇 式,烯醇作为亲核试剂进攻另一个被质子化的羰基碳原子发生亲核加成, 随后脱去羰基氧上的质子获得β-羟基醛或酮。在酸性条件下,β-羟基被 质子化后脱去一分子水,最后生成α,β-不饱醛或酮。
二、影响反应主要的因素
1. 酸碱催化剂的影响 a) Aldol缩合反应可在酸性和碱性条件下进行,并且以碱性条件下进行的居多。 b) 常用的碱包括乙酸钠、碳酸钠(钾)、醇钠、叔丁醇铝、氢化钠和氨 基钠等。常用的酸包括盐酸、硫酸、对甲苯磺酸以及BF3等路易斯酸。 2. 醛或酮结构的影响 进行Aldol缩合时,通常醛的活性高于酮,空间位阻小的醛或酮活性高 于空间位阻大的醛或酮。催化剂的选择通常依赖与反应物的活性、立体 位阻等因素。 3. 反应温度的影响 反应温度对缩合反应的速率及产物类型均有一定影响。一般,反应温度 高有利于消除脱水。
d) 含有活性α-氢的酮的自身缩合比醛慢很多,反应平衡强烈地偏向左边。 为使平衡向生成产物的方向移动,通常需用强碱或弱酸性阳离子交换树 脂催化,或在Soxhlet提取器中进行。 e) 对称酮的自身缩合产物较单纯,若为不对称酮时,反应产物依赖与催 化剂,但大多数情况下得到的是混合物。
缩合 聚合反应
缩合聚合反应2010-01-13 18:15:43| 分类:默认分类| 标签:无|字号大中小订阅缩合反应概述缩合反应condensation (reaction)两个或多个有机分子相互作用后以共价键结合成一个大分子,同时失去水或其他比较简单的无机或有机小分子的反应。
其中的小分子物质通常是水、氯化氢、甲醇或乙酸等。
缩合反应可以是分子间的,也可以是分子内的。
在多官能团化合物的分子内部发生的类似反应则称为分子内缩合反应。
缩合反应可以通过取代、加成、消除等反应途径来完成。
多数缩合反应是在缩合剂的催化作用下进行的,常用的缩合剂是碱、醇钠、无机酸等。
缩合作用是非常重要的一类有机反应,在有机合成中应用很广,是由较小分子合成较大分子有机化合物的重要方法。
有时两个有机化合物分子互相作用成一个较大的分子而并不放出简单分子,也称缩合。
常见的缩合反应类型①羟醛缩合反应为醛、酮或羧酸衍生物等羰基化合物在羰基旁形成新的碳-碳键,从而把两个分子结合起来的反应。
这些反应通常在酸或碱的催化作用下进行。
一个羰基化合物在反应中生成烯醇或烯醇负离子后进攻另一个羰基的碳原子,从而生成新的碳-碳键。
最简单的例子是乙醛的羟醛缩合反应:②克莱森缩合反应含有α-活泼氢的酯类在醇钠、三苯甲基钠等碱性试剂的作用下,发生缩合反应形成β-酮酸酯类化合物,称为克莱森缩合反应,反应可在不同的酯之间进行,称为交叉酯缩合;也可将本反应用于二元羧酸酯的分子内环化反应,这时反应又称为迪克曼反应(Dieckmann reaction)。
例如,乙酸乙酯在乙醇钠作用下生成乙酰乙酸乙酯:③苯偶姻缩合反应芳香族醛在氰化钾作用下发生两分子缩合,生成苯偶姻类化合物:④偶姻缩合反应羧酸酯与钠发生双分子还原,生成偶姻类化合物。
如以适当的链状二元羧酸酯为原料,通过这个反应,使发生分子内偶姻缩合,能制得中环化合物:⑤曼尼希反应醛或酮与甲醛和二级胺或一级胺在弱酸性条件下发生氨甲基化反应。
缩合反应
( 90%)
克 脑 (ⅲ) 氰乙酸酯 文 O 格 NCCH2COOC2H5 反 C2H5CCH3 应
(ⅳ) 硝基烷烃
醛及酮均能顺利反应
H2NCH2CH2COOH 苯带水
C 2H 5 CH3 C CH
CN COOC2H5
( 81~87.5%)
醛及酮
CH3
CHO OCH3
CH3CH2NO2
n-C4H9NH2 甲苯带水
以醛(或酮)为羰基供给者的有关缩合反应----反应组分
α-H化合物
醛酮
产物
(I)或(II) Aldol缩合
活泼亚甲基化合物 (II)
Knowvenagel反应 其它反应(IV) Stobbe反应 其它反应(IV) Perkin反应 Mannich反应
醛酮
丁二酸酯 (琥珀酸酯) 羧酸酐 醛+胺
(II) (II)
CN
+ H2O
CN
O
+ NCCH2CO2Et
RNH3OACH3 C
CN
+ H2O
CO2Et
CHO
+
CH2(COOH)2
吡啶
Δ
COOH
+
H2O
Doebner反应 醛酮与丙二酸或氰基乙酸在吡啶或吡啶-哌啶 催化下缩合,生成β-丙烯酸并伴随脱羧
III. Perkin反应(类似Aldol缩合)
1. Perkin 反应的一般形式
Ar CHO + RCH2COONa (RCH2CO)2O H Ar R COOH
Δ
芳香醛与脂肪酸酐在相应羧酸盐作用下生成不饱和酸 最简单的 Perkin 反应
O Ph CHO + H3C O O CH3 CH3COONa COOH Ph
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O CH3(CH2)2CO2Et + N CO2C2H5 NaH N C CHCO2Et CH2CH3
三 分子内的酯-酯缩合
Dickmann 缩合:六碳或七碳的二元酸酯在分子内进行缩合反应形成一个五元 或六元的环状β-酮酯的反应
例如:己二酸酯在甲苯中与金属钠作用
OEt CO2Et CH2 CH2 CH2 CH2 OEt C CH2 CH2 CH CH2 CO2Et -EtOO CO2Et O C CO2Et Na,苯 CH2 CH2 O CH CH2 CO2Et
3 酯
四
Michael(迈克尔)加成反应
在碱性催化剂的作用下,活泼亚甲基与α,β-不饱和醛、
酮、酯或羧酸衍生物的碳碳双键发生亲核加成,生成1,5-二羰
基化合物 的反应,称为 Michael反应,这也是活泼亚甲基化合物
进行烷基化的另一种途径。
醚
R
X
+
Mg
RMgX
羰基碳有亲电性
-
O MgX R
H2C O
OMgX R C H2O R
OH C
C
+
亲核加成
醇
H 2O R CH2 OH
伯醇
提示:合成上用 于制备比卤代烷 多 R`+1 个碳原 子的醇类化合物。
R'CH R MgX
O
H 2O R
R' CH OH
仲醇
O
R'
R'
C
R"
H 2O R C R" OH
(Mannich碱)
Mannich反应机理
O R C H CHR' H
H H H
HO R C CHR' H R
OH C CHR'
酮的烯醇化
O H C OH C H R" H OH2 H2C N R" R" N R" H2O H2C N R" R" OH H H2C N R" R"
醛与胺生成亚胺正离子
烯醇与亚胺正离子结合
R" OH R C CHR' H2C N R" R OH C CH R' O H R C CH R' CH2 N R" R" CH2 N R" R"
Mannich反应举例
O Ph C CH3 + CH2O + (CH3)2NH2 Cl
O Ph C CH2 CH2
H N CH3 Cl
R3 R1 R2 C=O + H-C-COOC2H5 X
R1 R2
R3 C-C- C-COOC2H5 O- X
-X-
R1 R2
R3 C C-COOC2H5 O
R' + X CHCO2Et R
O R
EtONa R R
O R' CO2Et
机理
R' X C H EtO R O R R R' CO2Et O COEt X R O R' C O COEt R O C R R' C X O COEt
CH3
CH2O + HN(CH3)2
O KH
OK H2C N(CH3)2
O CH2 N(CH3)2
• 二 醛酮与羧酸缩合
• 1 Perkin反应:发生在酸酐与芳香醛之间的缩合反应
RCH2COONa Ar CHO + (RCH2CO)2O H Ar R COOH
芳香醛与酸酐在相应羧酸盐作用下生成不饱和酸。
取代环氧乙烷
OH H 2O CH2 R CH2 CH2
三元环较 活泼,易 开环。
伯醇
亲核取代 烷氧基卤化镁
O
OH H 2C R M gX CH R' H 2O R CH2 C H R'
仲醇
提示:合成上用于制备比卤代烷多2个碳的醇类化合物
R
5. 与卤代烷的亲核取代
+ R' X R R' + MgX2
OH H C C
O C or C CH2 C
C
醛 或 对称酮
分子内的羟醛缩合
二羰基化合物分子内的羟醛缩合,生成五,六元环的α,β-不饱和环状的醛 O 酮。
O
N aO H
O
二 交叉羟醛缩合(两种不同醛酮之间的羟醛缩合)
O R1 R
2
O + R
3
OH R
4
多种产物
OH R3 R
4
O R R1
2
R4 R3
O Ph CHO + H3C O CH3 O CH3COONa COOH Ph
Perkin反应的应用
肉桂 酸
CHO OH
(CH3CO)2O CH3COONa O O
• 2
Knoevenagel(克脑文格)反应:
• 含有活泼亚甲基化合物在氨或胺及它们的羧酸盐等弱碱性催化剂催化 下,与醛或酮进行缩合反应,最终生成不饱和羰基化合物的反应
(75%~80%)
CO2Et CO2Et
NaOEt
H+
CO2Et O
CO2Et CO2Et CO2Et NaOEt H+ O
CH2CH2CO2C2H5 H3C N CH2CH2CO2C2H5
NaOEt
HCl H3C H
CO2C2H5 N O Cl
四 酯与酮缩合反应
醛酮形成的碳负离子与没有α-氢的甲酸酯、苯甲酸酯或草酸酯缩合在有 机合成上是制备β-酮酸酯或β-二酮的重要方法。 如草酸酯与酮反应可得β-酮酯:
+
R1 R2
Ph3P-CH X-
碱,溶剂
+
R1 R2
R1 Ph3P=CR2
Ph3P-C-
季鏻盐
用途:
Wittig试剂与含羰基的醛、酮反应,反应产物为含有 双键的烯烃化合物,这是在合成反应中制备烯烃的方 法之一。 O
Ph3P CH3 I O CH2 Ph3PCH3 I NaCH2SCH3 Ph3P CH2
-
C H 2O H HCHO HOCH2 C CHO 浓 OH
-
C H 2O H
C H 2O H HOCH2 C C H 2O H + H C O O
-
C H 2O H
季戊四醇
歧化反应 不含α-H的醛,如HCHO,R3CCHO,C6H5CHO等,在浓碱的作用 下,能发生自身的氧化还原作用,即一分子醛氧化成酸,另 一分子醛还原成醇,这种作用叫歧化作用。
第八章 缩合反应
由两个或两个以上的化合物通过反应,失去一个小 分子化合物(如水、醇、盐等)而形成一个新的较大 分子化合物(新的C-C,C-X等键)的反应称为缩合反应。 缩合反应能提供由简单有机物合成复杂有机物的 许多合成方法,在芳香族,脂肪族和杂环化合物,在 香料,医药等许多精细化工生产中得到应用。
MgX
偶联反应
苄基、烯丙基、3o烷基
1o 和 2o 烷基卤代烷 不发生偶联
例:
RCH CHCH2 RCH MgX CHCH2 + RCH CHCH2 + X MgX2
CH2CH
CHR
提示: 制备活泼卤代烷的Grignard试剂时,应采用低温和稀溶液反
应,以防自身偶联发生。
三 羰基合成反应
1醛:
2 羧酸
CHO 浓 OH
-
C H 2O H + HCHO H
+
+
HCOOH
OCH3
OCH3
8.2 类羟醛缩合反应
• 一 胺甲基化(Mannich)反应
O R C CH2 R' + CH2O + H N
R" H R" R
O C CH R' CH2 N
R"
R"
有活泼 氢的酮
甲醛或 其它醛
仲胺或 伯胺
b -氨基酮衍生物
(弱亲核性强碱)
O 2 H3C C OC2H5 (1)Na / C2H5OH (2) 50% HOAc O O
H3C C CH2 C OCH2CHC CH3 CH3 C CO2C2H5 CH2CH3
2 CH3CH2CHCO2C2H5 CH3
Ph3C Na
二 交叉酯缩合(两个不同酯之间的缩合)
本章内容
羟醛缩合反应
类羟醛缩合反应
酯缩合反应 其他类型的缩合
8.1 羟醛缩合反应
含有α-氢的醛或酮,在碱或酸的催化下,与另一分子醛或 酮进行缩合,生成β-羟基醛或酮类化合物的反应称为羟醛或醇 醛缩合反应。β-羟基醛或酮经消除便生成α,β-不饱和醛酮。 这类缩合反应常需有碱(苛性钾、醇钠、叔丁醇铝等)催化, 有时也可用酸(如盐酸、硫酸等)催化。
O CH3O Ph3P CH2
O CH2 CH3O O
CCH2CH2COCH3
CCH2CH2COCH3
(1) Ph3P Br CH2CO2Et (2) NaOH Ph3P CHCO2Et
PhCHO
H C Ph C
H
CO2E t Z-isomer
8.3 酯缩合反应
在碱性催化剂存在下,具有α-氢的酯和另一个分子 相同或不相同的酯反应,脱去一分子醇,生成 β-酮
(ROOCCOOR)等。
CH2COOEt + CO(OEt)2 NaOEt CH(COOEt)2 (86%)
CH2COOEt +
COOEt NaOEt COOEt
CHCOOEt COCOOEt
-CO,加热
CH(COOEt)2 (85%)
