无机框图题专项训练
无机框图题解法[下学期]
![无机框图题解法[下学期]](https://img.taocdn.com/s3/m/4302b422b207e87101f69e3143323968011cf4db.png)
③在空气中由无色迅速变为红棕色的气 体是___N__O____
④使品红溶液褪色的往往是 ___S_O_2_____
⑤能使淀粉变蓝的是 ____I_2_____
常见的特征反应现象及对应物质
⑥与碱溶液反应生成白色沉淀且放置空气中变 灰绿色最终变红褐色的离子是___F_e_2+____ ⑦滴入_S_C_N__—溶液显血红色以及遇苯酚显紫色 的离子是 __F__e3_+__
⑧投入水中生成气体和难溶物或微溶物的物质 是_C_a_C__2__A_l_2_S_3 Mg3N2
A XB YC Y D Z E
当当本XX题是是“强强题酸 碱时 时眼, ,”AA有、、三BB:、、CC、、DD、、EE均均含含另同一一元元素素。; 回(答1下)列A既问题可(和用盐化酸学又式能)与NaOH反应; (1、2)A是C_的(_N_相H_4_)对_2S 分,子Y是质_量_O_比_2_D_ 少,1Z是6且_H_含_2O__有_ 元 素2、相当同X;是强酸时, E是 __H_2S_O__4
无色溶液I
AgNO3 稀HNO3
焰色反应:紫色
..
1、写出B、D形成化合物电子式__K_+_[∶ .S.∶] 2— K +
2、写出下列有关物质化学式:E __A_lC__l3_ J _N_a_A_l_O_2
3、写出C单质与H水溶液反应的离子方程式:
Cl2+H2S=S↓+2H++2Cl-
常见的特征反应现象及对应物质
经氧化反应两次转化的有
P Cl2 PCl3 Cl2 PCl5 H2O H3PO4 N2 O2 NO O2 NO2 H2O HNO3 NH3 H2S O2 SO2 O2 SO3 H2O H2SO4 S FeS C O2 CO O2 CO2 H2O H2CO3 Na O2 Na2O O2 Na2O2 H2O
12、“无机框图题”题眼归类专题

“无机框图题”专题复习一、特征反应1.与碱反应产生气体(1)⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质(2)铵盐:O H NH NH 234+↑−→−+碱 2.与酸反应产生气体(1)⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 (2)()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体(1)单质⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na (2)化合物()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na5.强烈双水解()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H 与 6.既能酸反应,又能与碱反应(1)单质:Al(2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
高一化学专项无机框图练习题1

高一化学无机框图练习题11.A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。
而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。
D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:(1)写出A、C、F的化学式:A________;C________;F________。
(2)写出F和H反应的化学方程式_____________________________________________________。
(3)写出下列反应的离子方程式:①D+盐酸__________________________________________________;②B+水______________________________________________________________。
2.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
填写下列空白:(1)写出化学式:A______________,B______________,D______________。
(2)以上反应中属于氧化还原反应的有______________(填序号)。
(3)写出反应⑤的离子方程式:__________________________________________________。
写出反应⑥的化学方程式:______________________________________________。
3.如图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;(2)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
高二化学无机框图专题训练1

高二化学无机框图专题训练(一)1.下图表示常见物质的相互转化关系(图中反应条件及部分反应物或生成物略去)。
X是黄绿色气体;M、N为金属单质,其中M是地壳中含量最多的金属元素;E为红褐色固体;反应③常用于冶炼金属。
试回答下列问题:(1)物质E的化学式为。
M在周期表中的位置是(2)画出X的组成元素原子结构示意图。
(3)写出反应②的离子方程式,并用单线桥法标明该反应电子转移的方向和数目:。
(4)检验D中金属阳离子的常用试剂是,现象是。
(5)分别写出下列反应:①的化学方程式:、③的化学方程式:、④的离子方程式:。
(6)F的俗名2.下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
请回答下列问题:(1)C物质中所包含的化学键类型____________。
(2)写出反应①的离子方程式:_______________ ________________。
(3)写出反应②的离子方程式且标出电子转移的方向和数目:_________________ _____________。
(4)写出B→E的化学方程式:。
(5)写出L→M化学方程式:。
3.现有常见金属A、B,它们之间存在如下的转化关系(图中有些反应的产物和反应的条件没有全部标出),其中G、H为白色沉淀。
请回答下列问题:(1)写出HCl的电子式:;F中阳离子的结构示意图:。
(2)写出E转化为G的离子方程式;(3)写出H放在空气中的现象:。
(4)A→B的化学方程式:;A→E的离子方程式:;A→D的离子方程式:;G→D的离子方程式:。
4.A 是一种红棕色金属氧化物,C 是当今用量最大的金属单质,D 常温常压下为无色液体 化合物,H 通常状况下为黄绿色的气体单质。
(1)A 化学式: ,1 mol I 在空气中完全反应生成J 时,失去电子 mol 。
(2)按要求写方程式:C 与D 反应生成K 和B 的化学方程式:C 可以在H 中燃烧,发出棕黄色的烟。
高中化学期末复习无机框图题专项训练一

煌敦市安放阳光实验学校期末复习(5)——无机框图题专项训练1.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反均为黄色。
填写下列空白:(1)写出化学式:A ,B 。
(2)写出反⑤的离子方程式:。
(3)写出反⑥的化学反方程式:。
2.下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。
气体B与气体C相遇产生大量的白烟,D是海水中浓度最高的盐(反物和生成物及溶剂水已略去)。
请回答下列问题:(1)甲的化学式是,C的化学式为;(2)写出A溶液和丁反生成D的离子方程式:;(3)写出A和E反的化学方程式:。
3.物质间的三角转化关系是化学常见关系,如图,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化。
(1)若A是常见金属的氢氧化物,且A+OH-→B,A+H+→C,写出:①B→C的离子方程式,②由C制备A的离子方程式。
(2)若A是酸性氧化物,是正常雨水pH=5.6的原因,B、C的焰色反为黄色,相同条件下B的溶解度小于C的溶解度。
则A的化学式是,B的俗名是。
写出C在溶液中转化为B的化学方程式。
4.A、B、C是中学化学常见的三种物质,它们之间相互转化关系如下(反条件及产物略去)。
(1)若A是一种黄色单质固体,则B→C的化学方程式为。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为,试用化学方程式表示C物质在宇宙飞船上的一个重要用。
(3)若C是红棕色气体,则A的化学式可能为,试写出C与水反的化学方程式。
5.已知A是黑色固体,C和F是无色气体,D是红棕色气体。
(1)写出C和D的化学式、。
(2)写出A和B反的化学方程式:。
甲A 丙乙丁BCEDA加热高温、高压点燃(3)F与O2反生成D的现象是。
(4)写出B与Cu反生成D的离子方程式。
6.下图所涉及的物质均为中学化的常见物质,其中C 为O2、D为C12、E为Fe 单质,其余为化合物。
它们存在如下转化关系,反中生成的水及次要产物均已略去。
高三化学复习专题训练无机框图题
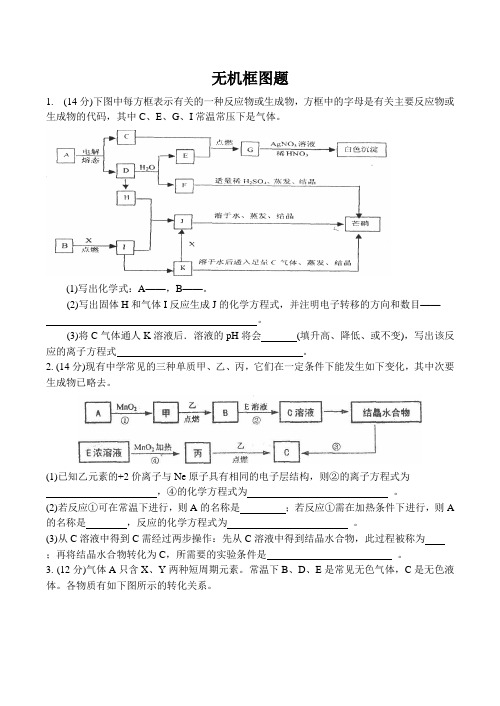
无机框图题1. (14分)下图中每方框表示有关的一种反应物或生成物,方框中的字母是有关主要反应物或生成物的代码,其中C、E、G、I常温常压下是气体。
(1)写出化学式:A——,B——。
(2)写出固体H和气体I反应生成J的化学方程式,并注明电子转移的方向和数目——。
(3)将C气体通人K溶液后.溶液的pH将会(填升高、降低、或不变),写出该反应的离子方程式。
2. (14分)现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则②的离子方程式为,④的化学方程式为。
(2)若反应①可在常温下进行,则A的名称是;若反应①需在加热条件下进行,则A 的名称是,反应的化学方程式为。
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到结晶水合物,此过程被称为;再将结晶水合物转化为C,所需要的实验条件是。
3. (12分)气体A只含X、Y两种短周期元素。
常温下B、D、E是常见无色气体,C是无色液体。
各物质有如下图所示的转化关系。
试回答下列问题:(1)若气体A是纯净物,且A分子的空间构型为直线型,则A的电子式为;(2)若气体A是混合物,且X与Y的质量比小于3,则气体A中肯定有(写化学式)。
(3)若D与固体乙反应过程中,观察到固体乙由黑色变为红色,则乙为(写化学式)。
(4)C与固体甲在高温下反应的化学方程式为:。
(5)写出气体A的实验室制法的化学方程式:。
4. (16分,每空2分)下列图17所示反应有直接进行的.也有在溶液中进行的,其中部分产物已略去。
已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
图17(1)化学式:B为,F为。
(2)用电子式表示D的形成过程为。
(3)A是一种非常重要的工业产品。
据统计。
地球上每年由于腐蚀而消耗的A约占A年产量的10%。
A发生腐蚀的主要原因是(填写下面的选项序号)a.直接与氧气发生化学腐蚀;b.通过原电池反应发生腐蚀;c.因溶于水而消耗掉;若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:。
无机框图训练题
无机推断训练题1、(2006全国理综Ⅱ28)以下一些氧化物和单质之间可发生如右图所示的反应:其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是 。
氧化物(Ⅱ)的化学式(分子式)是 。
(2)反应①的化学方程式是。
反应②的化学方程式是 。
反应③的化学方程式是 。
2、下图是部分短周期...元素的单质及其化合物的转化关系图(有关反应的条件及生成的...........H .2.O .已略去...),已知:(a)A 、B 、C 、D 是非金属单质,其中B 、C 、D 在常温常压下是气体。
(b)反应①②是化工生产中的重要反应。
(c)化合物E 是形成酸雨的污染物之一,化合物K 是常用的氮肥。
(d)化合物L 具有漂白性,可由Cl 2与NaOH 溶液反应而制得。
(e)化合物J 由两种元素组成,其相对分子质量为32。
请按要求填空:⑴反应③的化学方程式______________。
⑵C 的结构式______________;H 的化学式______________。
⑶L 的溶液与化合物E 反应的离子方程式______________。
⑷化合物J 的化学式______________。
3、根据下列反应框图填空,已知反应①是工业上生产化合物D 的反应,反应⑤是实验室鉴定化合物E 的反应。
G A B ② 电解 LM H④ J K ③(1)单质L是。
(2)化合物B是。
(3)图中除反应①以外,还有两个用于工业生产的反应,是和(填代号)。
它们的化学反应方程式分别是和。
4、下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:⑴写出B的化学式_______________,G的电子式_________________。
无机框图题
大题冲关滚动练之四——无机框图题1.从物质A的水溶液出发,有如图所示的一系列变化(参加反应或反应生成的H2O没有表示出来)。
试完成下列问题:(1)写出下列物质的化学式:A,E,X,Y。
(2)写出步骤①②发生反应的离子方程式:①________________________________________________________________________;②________________________________________________________________________。
2.甲、乙、丙为常见单质。
A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。
在一定条件下,各物质相互转化关系如图所示。
请回答下列问题:(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为_____________________________________________________________。
(3)电解E的水溶液时,E起到的作用是__________________________________________。
(4)写出B+C―→D的化学方程式:_____________________________________________;写出E+G―→F的离子方程式:_________________________________________________。
3.A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去)。
(1)若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种有毒气体。
①C的电子式为______________。
②写出反应Ⅰ的化学方程式____________________________________________________。
无机框图专题复习与练习
《无机框图题》专题复习(预备知识)预备知识一:根据“特征颜色”进行推断1.常见的有颜色的物质:2.焰色反应焰色呈黄色的物质含元素,透过蓝色的钴玻璃观察焰色呈紫色的的物质含元素。
预备知识二:根据“特征描述”进行推断1.密度最小的气体是。
2.造成温室效应的气体是,引起酸雨的气体是。
3.能使澄清石灰水变浑浊的气体是,相遇产生大量白烟的两种气体是。
4.能使品红溶液褪色,加热后又恢复为原来颜色的气体是。
5.能使品红溶液褪色,加热后不恢复原来颜色的弱酸是。
6.通常情况是无色、无味的液体,该液体是。
7.常温下能被浓硫酸或浓硝酸钝化的金属有。
8.地壳中含量最多的金属元素是,非金属元素是。
9.用量最大、应用最广泛的金属是,可用作红色油漆的物质,具有磁性的黑色固体是,漂白粉的有效成分是。
10.向某溶液中滴加NaOH溶液后产生能使湿润的红色石蕊试纸变蓝的气体,则该溶液中含有离子;向某溶液中加入KSCN溶液后溶液呈血红色,则该溶液中含有的离子是;向某溶液中滴加BaCl2溶液和稀HNO3能产生白色沉淀,则该溶液中可能含有的离子是。
11.在中燃烧发出苍白色火焰。
12.白色沉淀迅速变成灰绿色最终变成红褐色:→。
13.某气体遇空气由无色变成红棕色:→。
预备知识三:根据“特征转化关系”进行推断1.既能与酸又能与碱反应的物质有。
2.与碱反应产生气体的物质有。
3.高温条件下,金属之间的置换反应。
4.电解法冶炼金属的反应等。
5.连续与同一物质发生反应:(反应条件略去)(1)连续氧化:则A物质可能是。
(2)连续与H+反应:则A物质可能是。
(3)连续与OH—反应:则A物质可能是。
(4)连续与CO2反应:则A物质可能是。
附:(必修1)无机推断题中重要的方程式1.2Na + 2H2O=2NaOH + H2↑2.2Al+2NaOH+2H2O=2NaAlO2+3H2↑3.3Fe+4H2O(g)Fe3O4+4H24.2Na2O2+2H2O=4NaOH+O2↑5.2Na2O2 + 2CO2=2Na2CO3 + O26.2NaHCO3Na2CO3 + H2O +CO2↑7.NaHCO3+NaOH=Na2CO3+H2O8.Na2CO3+CO2+H2O=2NaHCO39.Al2O3+6HCl =2AlCl3+3H2O10.Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH—=2AlO2—+H2O11.2Al2O3 (熔融) 电解4Al + 3O2↑12.Al3++3NH3·H2O= Al(OH)3↓+3NH4+13.Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O14.Al(OH)3+ NaOH=NaAlO2+2H2O Al(OH)3+ OH—=AlO2—+2H2O 15.2NaAlO2+CO2(少量)+3H2O = 2Al(OH)3↓+Na2CO3NaAlO2+CO2(过量)+2H2O = Al(OH)3↓+NaHCO316.Fe3O4+8HCl=FeCl2+2FeCl3+4H2O17.Fe2O3+2Al Al2O3+2Fe18.Fe2O3+3CO2Fe+3CO219.FeCl3+3NH3·H2O =Fe(OH)3↓+3 NH4Cl Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+ 20.FeCl2+2NH3·H2O =Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O =Fe(OH)2↓+2NH4+ 21.4Fe(OH)2+O2+2H2O=4Fe(OH)322.2FeCl2+Cl2=2FeCl32Fe2++Cl2=2Fe3++2Cl—23.2Fe2++H2O2+2H+ =2Fe3++2H2O24.2FeCl3+Fe=3FeCl2 2Fe3++ Fe= 3Fe2+25.2Fe+3Cl2点燃2FeCl326.MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O27.Cl2+2NaOH=NaCl+NaClO+H2O28.4NH3+5O2催化剂△4NO+6H2O29.Ca(OH)2+2NH4Cl △CaCl2+2NH3↑+2H2O30.2Cl2+2Ca(OH)2= CaCl2 +Ca(ClO)2+2H2O31.2SO2+O2催化剂加热2SO332.2NO+O2=2NO233.3NO2+H2O=2HNO3+NO34.NH4Cl+NaOH=NaCl+ NH3↑+H2O35.Cu+2H2SO4(浓)△4+SO2↑+2H2O36.C+2H2SO4(浓)△2↑+2SO2↑+2H2O37.3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4 H2O 38.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O《无机框图题》专题复习1.下列框图所示的转化关系中,A、C为日常生活中常见的金属单质,F能使品红溶液褪色,X常温下为无色无味的液体。
高中化学无机推断框图题精选(附答案)
1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理)已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。
(1) A的化学式是;乙的化学式是。
(2) X是一种纯净物,X的化学式是;C中含有、。
(填化学式)(3)能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由。
2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。
B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:(1) X的电子式是,G的化学式是。
(2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是。
(3)反应“D+丙”的化学方程式是。
(4)写出X与D在稀硫酸中反应的离子方程式。
3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件下的相互转化关系如下:请填写以下空白:(1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是。
(2)在X、Z两种化合物的正价元素的化合价中,是。
A.前者高B.后者高C.不一定原因是。
(3)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
(4)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。
它们之间的反应关系如下图所示:请填写下列空白:(1)据此推断X、Y、Z的化学式:X 、Y 、Z 。
(2) X是常见的单质,它是主族元素,还是副族元素,其理由是:。
(3)写出C+Y → A的离子方程式:。
5.根据以下反应关系图,回答下列问题:(1) A溶液所含溶质是:________________________;(2) A溶液跟B溶液反应的化学方程式是:_______________________________;(3) G转变为E的离子方程式是:__________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2007届第二学期宿迁青华中学周练5(无机框图题专项训练)
1.(10分)(2007南通一模)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。
②、③、⑤均为工业生产中的重要反应。
各物质间的相互转化关系如下图:(其中某些反应的部分生成物被略去)
⑴工业生产中,实现反应⑤的设备是。
⑵由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的(填“字母”)。
⑶反应①的离子方程式为
;
将J滴入沸水中的离子方程式为。
⑷若反应④表示为“F+H2O=2G+H”,则可推知F的化学式___ __。
1.⑴沸腾炉
⑵G
⑶Mg+2NH4+=Mg2++H2↑+2NH3↑Fe3++3H2O(沸)=Fe(OH)3(胶体)+3H+
⑷SOCl2(每空2分,共10分)
2.(扬州07一模)(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。
A~H之间相互转化关系如下图所示:
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。
阴离子中各元素的质量分数与C相同且式量是C的2倍。
C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式。
(2)A的化学式。
(3)D+E→C+G的方程式。
(4)H+H2O2→I的离子反应方程式。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。
产生上述现象的主要原因是。
2 、(10分)(1)
C O
O
(2分)
(2)K3Fe(C2O4)3(2分)
(3)3CO+Fe2O3===2Fe+3CO2(2分)
(4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(5)因为溶液中的草酸根被高锰酸钾氧化,溶液中的Fe3+与SCN—离子反应。
(2分)
3.(2007年上海调研卷)
高锰酸钾是锰的重要化合物和常用的氧化剂。
以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。
其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液)
b. 双氧水
c. 苯酚
d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸
b. 硝酸银
c. 氯水
d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(5)该生产中需要纯净的CO2气体。
若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石
b. 稀HCl
c. 稀H2SO4
d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO 4和K 2CO 3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO 4粗晶体的。
3.(12分)
(1)ab (2分);(2)d (1分);(3)MnO 2;KOH (2分);(4)3
2
(1分); (5)cd (2分);A (1分);
(6)过滤(1分);溶解度(1分);浓缩结晶(只填“结晶”不给分)(1分)
4.(8分)(盐城市07二模)江苏省东部沿海有954 km 的海岸线,合理开发和利用海洋资源对江苏经济发展意义重大。
下图是部分元素的单质及其化合物的转化关系图(有关反应条件及部分反应物
或生成物已略去)。
已知:A 是海水中的重要资源;C 、D 、F 是单质,其中C 、D 在常温常压下是气体;反应②是化工生产中的重要反应,生成物E 是84消毒液的有效成份;J 、K 均为不溶于水的物质,其中J 为红褐色。
请按要求填空:
(1)反应①的离子方程式(请注明反应条件) 。
(2)B 的电子式____;E 的化学式____。
(3)③的化学方程式 。
(4)D 被誉为很有发展前途的未来燃料。
你所了解的实现该目标尚存在的实际问题有 (列举一条)。
5.(8分) (常州市2006—2007学年高三第一学期期末调研). 已知A 是由两种中学常见元素组成的化合物,H 、D 为白色沉淀,E 的焰色反应为黄色。
A~H 各物质之间的关系如图(反应中部分产物已略去,除气体
间的反应外,其余反应均在溶液中进行...........
)。
⑴X 的化学式为________________; ⑵写出反应①、②的离子方程式:
① 。
② 。
⑶用电子式表示G 的形成过程:
_________________________________________ 。
5.(8分)⑴NaOH (每空2分,方程式不配平不给分,条件不写扣1分)
⑵①2Al 3++6Cl -
+6H 2O 3H 2↑+3Cl 2↑+2Al(OH)3↓
②Al 3++3AlO 2-
+6H 2O =4Al(OH)3↓ ⑶H +Cl
H Cl
6.(10分)(2006~2007学年第一学期期末调研考试高三化学试题)由短周期元素组成的10种物质A ~J 间有下图所示的转化关系。
已知A 、B 为同周期相邻元素的单质,其余均为化合物;通常状况下A 为固体,B 、D 为气体,F 为液体;A 和G 的浓溶液加热时反应生成D 和F ;J 在光照时有I 生成。
试回答:
⑴工业生产中实现“D+O 2 → E ”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G 的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g 液态F 吸收49gE 气体生成液态G 时放出热量65.15kJ ,则表示该反应的热化学方程式为 。
⑸C 是一种重要的化工产品,为易挥发樱桃红色液体。
若反应②中G 和A 的物质的量之比为1∶2,则C 的电子式为 。
6.⑴接触室 ⑵HClO + SO 2 + H 2O = 3H + + SO 42—
+ Cl
—
⑶SO 2和H 2 ⑷SO 3(g)+ H 2O(l)=H 2SO 4(l);△H =-130.3kJ/mol ⑸ (每空2分,共10分)
7.(10分)(07南通市九校联考)已知下图所示各物质的转化关系中,某些反应部分产物已被省去。
其中反
应②用于常见金属I 的冶炼,B 为淡黄色固体, D 、G 、H 均为气体且D 、H 无色。
试回答下列问题:
⑴溶液A 为 (写名称),B 的电子式 。
⑵反应①的离子方程式 ; 反应③的离子方程式 。
⑶有同学认为M 也可由溶液J 、溶液K 各自加热灼烧获得,试判断这种说法是否正确? (填“是”或“否”),理由是 。
7.(10分)盐酸(1分)
(2分)
2Cl ―+2H 2O
Cl 2↑+H 2↑+2OH -(2分)
2Al +2H 2O +2OH -=2AlO 2-+3H 2↑(2分) 否(1分)
AlCl 3、NaAlO 2溶液加热蒸干、灼烧,前者获得Al 2O 3、后者得到的仍是NaAlO 2(2分)
8.(10分)物质A ~K 的转化关系如下图所示,已知A 是由两种元素组成的化合物;B 是非金属单质;J 是金属单质。
H 的相对分子质量比D 大16(部分反应物、生成物未列出)。
依据上述信息,回答下列问题:
Ⅰ.若A 为固体,F 是盐,反应①是工业上制取K 的重要反应,反应②为化合反应。
⑴ G 的电子式是__________。
⑵ 工业上反应①在 (填工业设备名称)中进行。
⑶ 反应①的化学方程式为 。
Ⅱ. 若A 为气体,E 为活泼金属单质,且K 与“Ⅰ”中的K 不同。
⑷ 物质A 的分子式是____________。
⑸ 反应②的离子方程式为____________________________________________。
8.(1) (2) 沸腾炉
(3)4FeS 2+11O 2
2Fe 2O 3+8SO 2
(4) NH 3 (5) 2Al +2OH -
+2H 2O =2AlO 2-
+3H 2↑ (本题共10分,每空2分)。
