杜仲组织培养的研究
杜仲细胞悬浮培养及主要次生代谢物积累的研究的开题报告

杜仲细胞悬浮培养及主要次生代谢物积累的研究的开题报告第一部分:研究背景杜仲是一种重要的中药材,其干皮和根皮富含多种生物活性物质,包括三萜皂苷、多酚、黄酮等次生代谢物。
这些次生代谢物不仅具有极高的药用价值,在食品、化妆品等领域也有广泛的应用。
然而,由于杜仲树的生长速度非常缓慢,其资源受到了很大的限制。
为了解决杜仲资源短缺的问题,以及提高杜仲药用价值,研究人员采用细胞培养技术,通过培养杜仲细胞来获得大量杜仲次生代谢物。
目前,已有一些研究表明,通过细胞培养技术可以促进杜仲次生代谢物的积累。
然而,对于杜仲细胞的悬浮培养以及次生代谢物的积累机制还存在一定的不清楚之处。
第二部分:研究内容本研究的主要内容为,通过杜仲细胞的悬浮培养,探究不同培养条件对杜仲细胞的生长和次生代谢物积累的影响,进而分析杜仲细胞次生代谢物积累的机理。
本研究将从以下几个方面进行探究:1. 杜仲细胞悬浮培养条件的优化。
本研究将通过优化培养基成分、培养温度、培养pH值等因素,探究对杜仲细胞的生长状况和次生代谢物积累的影响,进而确定最佳培养条件。
2. 杜仲细胞次生代谢物的定量分析。
本研究将通过高效液相色谱技术(HPLC)及紫外光谱分析技术,对杜仲细胞培养产生的主要次生代谢物进行定量分析,从而确定最佳次生代谢物积累条件。
3. 杜仲细胞次生代谢物的积累机制探究。
本研究将通过细胞内酶活性测定、代谢组学分析等手段,探究不同培养条件下杜仲细胞次生代谢物积累的机制和途径。
第三部分:研究意义本研究旨在通过杜仲细胞的悬浮培养,探究不同培养条件对杜仲细胞次生代谢物的积累机制,从而为杜仲资源的有效利用和开发提供科学依据。
同时,本研究还有望推动植物细胞培养技术的发展,为其他中药材的研究提供参考。
第四部分:研究方法1. 培养杜仲细胞悬浮培养,并通过细胞计数仪定期监测其生长情况。
2. 通过高效液相色谱技术(HPLC)及紫外光谱分析技术,对杜仲细胞次生代谢物进行定量分析。
杜仲的研究进展报告

西南交大生命学院杜仲的研究进展报告班级:生工一班学号:20114677姓名:王亮2012/12/9对于杜仲我不是很陌生因为我家周围还种有几颗,所以就简单叙述一下杜仲近来的研究进展。
先介绍一下杜仲的一些基本知识,杜仲属杜仲科落叶乔木,高可达20米,小枝光滑,黄褐色或较浅,具有片状髓,皮,枝及叶均具有胶质,撕开可见白色丝状物,单叶互生,椭圆形或卵形,7~15厘米,宽3.5~6.5厘米,先端渐尖,基部广楔形,边缘有锯齿,幼叶上面疏被柔毛,下面毛较密,老叶上面光滑,下面叶脉处疏被毛;叶柄长1~2厘米。
花单性,雌雄异株,与叶同时开放,或先叶开放,生于一年生枝基部苞片的腋内,有花柄;无花被;雄花有雄蕊6~10枚;雌花有一裸露而延长的子房,子房1室,顶端有2叉状花柱。
翅果卵状长椭圆形而扁,先端下凹,内有种子1粒。
花期4~5月。
果期9月。
生长于山野林间或人工栽培,分布在长江中游和南部各省,如河南,陕西,甘肃等省,要求喜阳光,气候温和湿润,对土壤要求不高比较耐寒,丘陵平原皆可栽种。
接下来是杜仲的药用价值,杜仲最先出现在《神龙本草经》里名为思仙,在后来又有其他的叫法,比如木绵、思仲(《别录》),檰(《本草图经》),石思仙(《本草衍义补遗》),丝连皮、丝楝树皮(《中药志》),扯丝皮(《湖南药物志》),丝棉皮(苏医《中草药手册》),玉丝皮,扯丝片。
先看看各位名家对它药理看法:1.《神农本草经》:主腰脊痛,补中益精气,坚筋骨,强志,除阴下痒湿,小便余沥。
2.《名医别录》主脚中酸痛,不欲践地。
3.《药性论》:主肾冷JI腰痛,腰病人虚而身强直,风也。
腰不利加而用之。
4.《日华子本草》:治肾劳,腰脊挛。
入药炙用。
5.王好古:润肝燥,补肝经风虚。
6.《本草正》:止小水梦遗,暖子宫,安胎气。
7.《玉楸药解》:益肝肾,养筋骨,去关节湿淫,治腰膝酸痛,腿足拘挛。
8.《本草再新》:充筋力,强阳道。
9.《本草纲目》:杜仲,古方只知滋肾,惟王好古言是肝经气分药,润肝燥,补肝虚,发昔人所未发也。
杜仲组培
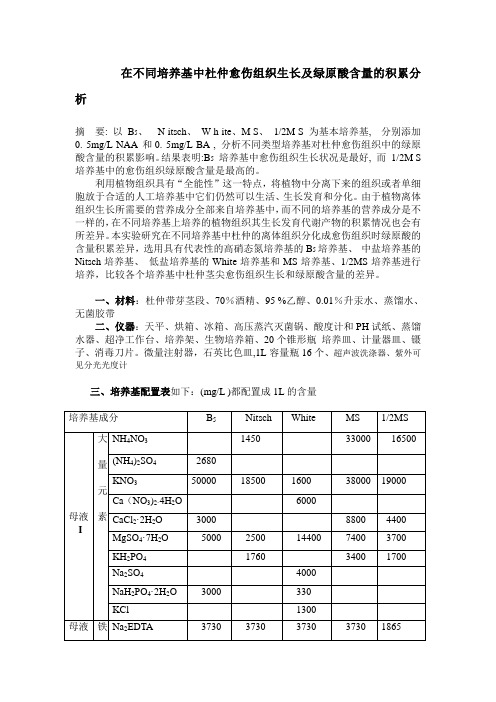
在不同培养基中杜仲愈伤组织生长及绿原酸含量的积累分析摘要: 以B5、N itsch、W h ite、M S、1/2M S 为基本培养基, 分别添加0. 5mg/L NAA 和0. 5mg/L BA , 分析不同类型培养基对杜仲愈伤组织中的绿原酸含量的积累影响。
结果表明:B5培养基中愈伤组织生长状况是最好, 而1/2M S 培养基中的愈伤组织绿原酸含量是最高的。
利用植物组织具有“全能性”这一特点,将植物中分离下来的组织或者单细胞放于合适的人工培养基中它们仍然可以生活、生长发育和分化。
由于植物离体组织生长所需要的营养成分全部来自培养基中,而不同的培养基的营养成分是不一样的,在不同培养基上培养的植物组织其生长发育代谢产物的积累情况也会有所差异。
本实验研究在不同培养基中杜仲的离体组织分化成愈伤组织时绿原酸的含量积累差异,选用具有代表性的高硝态氮培养基的B5培养基、中盐培养基的Nitsch培养基、低盐培养基的White培养基和MS培养基、1/2MS培养基进行培养,比较各个培养基中杜仲茎尖愈伤组织生长和绿原酸含量的差异。
一、材料:杜仲带芽茎段、70%酒精、95 %乙醇、0.01%升汞水、蒸馏水、无菌胶带二、仪器:天平、烘箱、冰箱、高压蒸汽灭菌锅、酸度计和PH试纸、蒸馏水器、超净工作台、培养架、生物培养箱、20个锥形瓶培养皿、计量器皿、镊子、消毒刀片。
微量注射器,石英比色皿,1L容量瓶16个、超声波洗涤器、紫外可见分光光度计三、培养基配置表如下:(mg/L )都配置成1L的含量培养基成分B5Nitsch White MS 1/2MS母液I 大量元素NH4NO31450 33000 16500 (NH4)2SO42680KNO350000 18500 1600 38000 19000 Ca(NO3)2·4H2O 6000CaCl2·2H2O 3000 8800 4400 MgSO4·7H2O 5000 2500 14400 7400 3700 KH2PO41760 3400 1700 Na2SO44000NaH2PO4·2H2O 3000 330KCl 1300母液铁Na2EDTA 3730 3730 3730 3730 1865II盐FeSO4·7H2O 2780 2780 2780 2780 1390母液III 微量元素KI 75 75 83 41.5 H3BO3300 1000 150 620 310 MnSO4·4H2O 1320 2500 700 2230 1115 ZnSO4·7H2O 200 1000 300 860 430 Na2MoO4·2H2O 25 25 MoO30.1 25 12.5 CuSO4·5H2O 2.5 2.5 0.1 2.5 1.25 CoCl2·6H2O 2.5 2.5 1.25母液IV 有机成分甘氨酸750 300 200 100 盐酸硫胺素1000 25 10 40 20 盐酸吡哆醇100 25 10 50 25 菸酸100 125 30 50 25 肌醇10000 10000 10000 5000二、基本培养基母液的配置:(1)大量元素为无机盐,在培养基中含量是比较大,浓度太高,容易影响准确性,所以我将母液浓度配置为20倍。
杜仲药理作用探讨

杜仲药理作用探讨本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载按钮下载本文档(有偿下载),另外祝您生活愉快,工作顺利,万事如意!1、杜仲的繁殖与保护无性繁殖和其他所有栽培林木一样,良种选育是杜仲资源开发中极其重要的基础性工作,但杜仲树体高大,生长周期长,生长环境较难控制, 采用常规方法进行育种很难实施。
赵树泉通过实践研究提出了插根育苗、树蔸育苗、休眠枝扦插育苗等无性繁殖的方法[4]。
马小峰等通过对不同生长素种类、不同浓度二因素随机区组设计,得出杜仲扦插育苗以ABT1号生根粉,浓度为/L,采穗母树为1年,扦插时间以6月中旬为最好[5]。
孟宪民等也提出利用杜仲的萌枝力极强这一特性进行无性繁殖,以获得新的植株。
其方法为在冬季结合施肥,松动根际周围的土壤,损伤其部分侧根,促使其产生根蘖条,第2年将萌蘖产生的小苗移走定植。
也可将老龄杜仲伐后,加强水肥管理,促使其萌生蘖条,在蘖条基部进行刻伤并培土,待第2年蘖条产生新根后分离定植[2]。
组织培养研究杜仲繁殖主要采用播种育苗方法,但其是雌雄异株,定植10年以上才能开花结果,种子结实有限,靠种子繁殖难以满足发展需要。
据报道,采用组培的方法繁殖杜仲,生产周期短,繁殖系数高,成本低,经济效益高。
另外,组培快速繁殖可以保证种苗形状一致,克服种子繁殖苗木观赏形状不一致的缺点,提高苗木的商品规格,有利于进行工厂化生产。
李俊红等通过实验得出,杜仲组织培养的不同培养阶段优化的最适培养基分别为:诱导愈伤组织的最适培养基为MS + /L NAA + /L BA,诱导率为95%;愈伤组织继代增殖最适培养基为MS +/L NAA + /L BA,成活率为%; 不定芽分化的最适培养基为MS +/L NAA + mg/L BA,分化率为40%;最适生根培养基为1/2MS +/L IBA,生根率为%[6]。
杜仲内生真菌的研究近年来随着人们对内生真菌研究的深入,发现通过人工发酵方法生产与其宿主植物相同的特有药用活性成分是可能的。
杜仲组织培养的研究

杜 仲( uo mi um i sOi.属杜 仲科 植 物 , E cr a lo e l ) n d v 其
1 材料 与方 法
11 材 . 料
药用 价值 和经 济价 值 均 高 , 是 名 贵 药 用 植 物 , 是 既 又 重要经 济树 种 … 。杜 仲 皮 是 传 统 中药 , 有 补 肝 肾 、 1 具 强 筋骨 、 胎 、 安 降压 、 久服 轻身 耐 老等功 效 _ 。其 全 株 2 J ( 除木 质部 外 ) 含有 的杜仲胶 以其独 有 的“ ( ) 都 橡 胶 一 塑 ( ) 重性 ” 料 二 的特 点 , 在航 空 航 天 以及 医疗 器 械 等 许 多高科 技 领域 具 有 巨大 的应 用 价 值 _ 。 杜 仲 的 主 】 ]
的增 殖
关 键 词 : 仲 ; 伤 组 织 ; 导 ; 殖 杜 愈 诱 增
A td nl s ec l r fEu o aumod s EP ,H N Y n QNJn ̄eD N nb Su yo su ut eo c mmi l iu ∥H o S a , I - , O Gwe.i J u E u n
h i u t no E cm i m i s a u a eB du 0 8 g r % U rS u p m n n wh . g LN A t d c o uo m a u od e c l , dt 5 ei ( . % a a +3 SCO )sp l e t t 1 0m / A en i f l u l n h s m m e e i i g
+1 5 / - A u d rt ec n t n o H 5 a d 1 h d iu n t n W p i z d frte p l e t n o al s . mg L 6 B n e o d i fp 6. 2 / l mia i a o t e r i r i fc l . h i o n l o s mi o h o fa o u Ke r s E c m a u n i e C l ;n u t n P ol r t n y wo d : u o mi h o dus; a u I d c o ; r le ai l s i f o F rta t o ’ l r : o l e o i c e c d E gn ei , S a n iUnv ri fS in e& T c n lg ,7 2 8 ,Xi is u h r S a l e C l g fLf S i e a n i e r d e e n n g n h a x ies y o e c t c e h oo y 10 1 —
杜仲愈伤组织继代培养及抑制褐化的研究

杜仲愈伤组织继代培养及抑制褐化的研究邱晓芳;朱笃;张志斌;涂艺声;游海;王曼莹【期刊名称】《食品科学》【年(卷),期】2007(028)008【摘要】对杜仲愈伤组织的继代培养及其褐化现象的抑制进行了研究,结果表明:B5培养基+0.5mg/LNAA+1.0mg/L 6-BA是杜仲愈伤组织继代培养和褐化控制的适合培养基;培养基中添加0.5%活性炭(AC)能有效的抑制杜仲愈伤组织的褐化;与中强光和红光相比,蓝光和黑暗能减轻组织的褐化.【总页数】3页(P307-309)【作者】邱晓芳;朱笃;张志斌;涂艺声;游海;王曼莹【作者单位】江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西,南昌,330022;江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西,南昌,330022;江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西,南昌,330022;江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西,南昌,330022;江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西,南昌,330022;江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西,南昌,330022【正文语种】中文【中图分类】R932【相关文献】1.杜仲愈伤组织诱导与继代培养研究 [J], 罗丽;赵德刚2.珙桐愈伤组织诱导和继代培养中的褐化研究 [J], 余阿梅;苏智先;胡进耀;邹利娟;王箫3.曼地亚红豆杉愈伤组织诱导和继代培养中抑制褐化的研究 [J], 胡凯;祝顺琴;谈锋;唐克轩4.苦豆子愈伤组织的诱导与继代培养的去褐化研究 [J], 王立强;杨军;王光碧;邓锷5.3种豆科牧草愈伤组织继代培养抗褐化的研究 [J], 陈爱萍;冯维卫;刘允康因版权原因,仅展示原文概要,查看原文内容请购买。
论杜仲组织的培养技术研究

论杜仲组织的培养技术研究作者:张海波等来源:《农家科技下旬刊》2014年第10期摘要:本文为了探讨杜仲组织的有效培养技术,通过把杜仲种子无菌发芽后的胚轴作为外植体予以不定芽诱导。
分别对植物激素的类型与浓度、谷氨酰胺对不定芽诱导的影响情况进行分析,同时还探讨了根的诱导情况。
希望对杜仲组织的培养技术提供一定参考价值。
关键词:杜仲组织;培养技术;基本培养基;植物激素杜仲属于杜仲科植物之一,同时也属于我国特殊的一种珍贵树种,整个植株除去木质部,其余均具有杜仲胶成分,能将其用于制作海底电缆,是海底电缆制作中不可或缺的原料之一。
其中杜仲皮是一种非常重要的中药材,杜仲木材是相当高级的用材。
目前由于对杜仲价值的不断探索,使得杜仲价格剧增,人们开始乱砍滥伐,导致种子产量剧减,原有稀缺的杜仲资源也明显遭到破坏。
杜仲通常是应用伐桩形成萌蘖或是通过种子繁殖,但其发芽率较低,怎样有效提高杜仲组织的发芽率,探索出有效的培养技术是需要进一步探讨的问题。
一、杜仲组织培养外植体的选择以及分化方式1. 选择杜仲组织培养外植体杜仲组织的培养不可或缺的是选取有效的外植体,植物组织培养能否成功与外植体发育时期、生长条件、取样时间以及取样部位等因素有非常重要的关系。
应当选取饱满具有活性的杜仲种子,将种子置于清水内浸泡24小时,剥去种皮后,用清水反复清洗,使用70%的酒精将种子消毒1分钟后,再用0.1%的氯化汞溶液将种子表皮消毒约为10分钟;再应用无菌水反复清洗,不能低于三次;于消毒后的蛭石接入种子,将其置于恒温室且没有光照的条件下培养。
等待2周时间后,种子会逐渐萌芽,要选择在胚芽子叶全部张开而真叶未全部张开的时期,选择胚轴切断当成外植体,以此种方式选择的外植体其效果更佳。
2. 杜仲组织培养的分化方式获得杜仲组织培养的再生植株的方式通常有两种,一种为器官发生方式,另一种为体细胞胚胎培养。
器官发生方式又能分为两种情况,其一为外植体无需通过脱分化产生愈伤组织再分化成器官的直接器官发生方式;其二为外植体先脱分化产生愈伤组织,再由愈伤组织分化产生器官的间接器官发生方式。
杜仲组织培养的研究进展

杜仲组织培养的研究进展唐亮;金晓玲【摘要】为了解杜仲组织培养的研究现状,对杜仲组织培养的研究进行了综述.杜仲是通过器官发生途径获得再生植株的,所用的外植体有叶片、叶柄、腋芽、胚轴、带芽茎段、茎尖和子叶等7种,除子叶外都成功组培获得了小植株.基本培养基、激素和附加营养成分等是影响组织培养的重要因素,其中,基本培养基以MS使用最多,初代培养中占83.3%,继代培养也有66.7%,而66.7%的生根培养基采用的是1/2 MS;芽的诱导中使用的激素有BA、NAA、IBA、BAP、IAA、KT、TDZ等7种,其中MS+0.1 mg/L 6-BA效果最好,诱导率达到96.7%;BA、NAA、IAA、BAP、GA3等5种激素对芽的增殖起作用,其中以MS+2.0 mg/L BA+0.05 mg/L NAA 效果最好,增殖系数达3.69;而生根所需激素主要有NAA、IBA、GA,其中以IBA 1.5 mg/L或2.0 mg/L效果最好,生根率达到92.5%;杜仲组织培养中常用的附加营养成分有酵母浸提物和谷氨酰胺等.【期刊名称】《贵州农业科学》【年(卷),期】2010(038)003【总页数】4页(P15-18)【关键词】杜仲;组织培养;器官发生;植株再生【作者】唐亮;金晓玲【作者单位】中南林业科技大学,环境艺术设计学院,湖南,长沙,410004;中南林业科技大学,环境艺术设计学院,湖南,长沙,410004【正文语种】中文【中图分类】S567.23+9杜仲是我国名贵的中药资源,为国家二级保护植物。
杜仲为杜仲科(Eucom-miaceae)杜仲属(Eucommia ulmoides Oliv.),为上新世遗留下来的单科单属单种的活化石植物[1]。
杜仲为落叶乔木[2],雌雄异株,其皮是我国传统的名贵中药,杜仲的花、果实和叶片等都具有很高的药用价值[3]。
杜仲的野生资源相当匮乏,被列为国家二级保护植物[4]。
目前杜仲生产上以种子繁殖为主[5]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
杜仲组织培养的研究作者:袁云香来源:《湖北农业科学》2012年第02期摘要:为了筛选出杜仲(Eucommiaulmoides)组织培养的最优培养条件,主要从外植体的选择、基本培养基、植物激素、光照条件、其他理化条件等方面对杜仲愈伤组织的诱导、增殖及分化培养的影响进行了综述,分析了杜仲组织培养过程中常见的问题并提出了解决方案,以期为杜仲快繁体系的建立提供理论依据。
关键词:杜仲(Eucommiaulmoides);组织培养;诱导;增殖;再分化中图分类号:S567.1+9文献标识码:A文章编号:0439-8114(2012)02-0228-04Research onTissueCultureofEucommia ulmoidesYUANYun-xiang(CollegeofChemistryandLifeScience,WeinanTeachersUniversity,Weinan714000,Shaanxi,China)Abstract:InordertoselecttheoptimalcultureconditionofEucommia ulmoidestissueculture,induction,proliferationanddifferentiation conditions for E. ulmoidescalluswerescreenedfromthe the aspects of choiceofexplants,basicmedium,planthormones,lightconditionsandotherphysicalandchemicalconditions.ThesolutionsofthecommonproblemsduringtheprocedureofE. ulmoidesOlivetissueculturewereanalyzed.ThisarticleprovidedatheoreticalbasisonE. ulmoidesrapidpropagationsystem.Keywords:Eucommiaulmoides;tissueculture;induction;multiplication;regeneration杜仲(Eucommiaulmoides)系杜仲科杜仲属(Eucommia)植物,为我国特有的经济树种,是一种名贵的药用植物,特别是对血压有双向调节作用,被认为是世界上高效天然降压药物[1]。
杜仲还是一种胶源植物,杜仲胶具有良好的绝缘性、抗酸碱性、热塑性和形状记忆等特点,受到世人的普遍重视[2]。
因此,杜仲作为用材、水土保持、绿化的经济树种,集“一林、一胶、两材、三效益”于一体,应用前景广阔[3]。
由于杜仲是雌雄异株植物,授粉较为困难,种子产量有限,加之自然环境的破坏和长期无计划的采挖,以及扦插繁殖的技术问题还未得到完全解决,使得杜仲的供应十分困难,生产中种苗的数量缺口很大。
组织培养是解决种苗快繁的有效方法之一[4]。
杜仲是组织培养较为困难的一种木本植物。
目前对杜仲愈伤组织的诱导、增殖方面的研究已有一些报道[5]。
本研究在前人工作的基础上,综述了在不同时间采集,以杜仲幼叶、嫩茎及种子无菌苗的下胚轴、子叶、真叶、根为外植体愈伤组织的诱导、增殖、分化及生根的培养基、激素、光照等理化条件,目的在于找出杜仲的愈伤组织诱导、增殖继代、分化及生根的最优培养条件[6],以期为大规模培养生产杜仲及次生代谢产物奠定基础。
1外植体的选择高等植物几乎所有的器官和组织都可以作为外植体,在合适的时间,选择适宜的苗龄、合适部位的外植体是有效诱导愈伤组织的关键[6]。
同类型的外植体对于诱导产生愈伤组织的难易程度不同,主要是不同的外植体其内源激素是有差别的[7]。
杜仲组织培养多采用植株的幼叶、嫩茎及种子无菌苗的下胚轴、子叶、真叶、根为外植体。
其中,使用频率最高的为茎尖[8]。
1.1外植体的种类据罗丽等[7]的报道,杜仲各种外植体的诱导出愈能力比为下胚轴>子叶>幼叶,只要培养基中激素配比适宜,杜仲各类外植体均能诱导产生愈伤组织。
另据李琰等[9]报道,以杜仲无菌苗作为外植体不仅出愈率高,愈伤组织生长旺盛,且不受季节影响,其中以下胚轴作外植体时,诱导率和生长状况最佳;以幼叶作为外植体时,污染小,便于消毒,出愈率也高;而对于茎,虽然诱导率高,但诱导出的愈伤组织不利于继代,且污染率高,诱导率有下降趋势。
此外,邱晓芳等[10]用杜仲无菌苗不同组织作为外植体,得出与上胚轴相比子叶更不易产生褐化,较容易进行稳定的继代;子叶和上胚轴均有利于诱导出疏松的愈伤组织,而上胚轴所诱导的愈伤组织质地非常疏松似乎更有利于作细胞悬浮培养。
可见,以胚轴作为外植体不仅诱导率高且不易褐化,愈伤组织生长茂盛稳定,是最优选择。
1.2外植体大小、接种方式及采样时期在杜仲组织培养过程中,不同接种方式的出愈率明显不同。
李琰等[9]的研究表明,对不同外植体:将真叶、子叶切成0.5cm×0.5cm方块,下胚轴和根切成0.7cm长的段进行接种;将幼茎切成0.7cm长段,幼叶切成0.5cm×0.5cm的方块接种方式为佳。
其中以幼茎为外植体,茎段的大小和接种方式以0.7cm长度横放方式诱导效果最好。
外植体的采用时期:田间材料幼叶取样时间以3月中旬为好,幼茎的取材时间以4月中旬前为最佳。
2培养基的选择培养基是植物组织培养的物质基础,也是愈伤组织能否成功的重要因素之一,愈伤组织能否形成,一方面取决于培养基材料本身的性质,另一方面也取决于培养基的种类和成分,因此要根据不同的外植体以及不同的培养目的选择合适的培养基[6]。
杜仲组织培养常用的培养基有MS、B5、LS、White、1/2MS、N6等,其中以MS使用最多,初代培养中占83.3%,继代培养也有66.7%,而66.7%的生根培养基采用的是1/2MS[8]。
2.1诱导培养基研究表明,B5培养基更有利于松散愈伤组织的形成,更适合作继代或悬浮培养;而MS培养基对子叶及上胚轴愈伤组织的诱导率均为最强,且不易于褐化;相比之下1/2MS培养基诱导的愈伤组织结构致密、生长缓慢、褐化严重,不利于诱导出疏松的愈伤组织[10]。
2.2增殖培养基关于继代培养的研究,何泼等[11]在MS、B5、LS、White、1/2MS、N6培养基上进行继代培养,结果表明,MS培养基虽然在诱导时效果很好,但它不适于愈伤组织的继代培养,愈伤在接种到该培养基上后生长缓慢,增长率较低,有的接种后不久会褐化死亡;而B5培养基最适合于愈伤组织的继代培养,继代后愈伤组织生长旺盛,增长率最高;此外N6培养基的效果也较好。
但据黄勇等[12]报道,MS培养基更适合于杜仲愈伤组织的继代培养,这可能是由于培养基上所加生长调节物质有所不同,或者与外植体种类也有一定的关系。
另有李琰等[1]以MS、LS、B5、N6、H、Nitsch、White、WPM为基本培养基,进行不同培养基对杜仲嫩茎及幼叶愈伤组织诱导的研究;以MS、LS、B5、N6、H、Nitsch、White、1/2MS为基本培养基,进行不同培养基对杜仲嫩茎及幼叶愈伤组织继代培养的研究。
结果表明,MS培养基有利于杜仲幼茎愈伤组织的诱导,而B5培养基不仅对叶的愈伤组织诱导有利,对茎和叶愈伤组织的继代培养也是最理想的。
3激素的选择3.1愈伤组织的诱导和增殖试验表明,没有添加植物激素的培养基上,杜仲愈伤组织继代生长很差,单独使用NAA的生长速度不如NAA与BA配合使用。
BA的最优使用量范围为1.0~3.0mg/L,NAA的最优使用量范围为0.5~4.0mg/L。
比较可见,在以MS培养基(0.8%琼脂+3%蔗糖)上附加2.0mg/LNAA+0.5mg/L6-BA有利于杜仲愈伤组织的诱导;以B5培养基(0.8%琼脂+3%蔗糖)上附加1.0mg/LNAA+1.5mg/L6-BA,有利于愈伤组织的增殖[11]。
据黄勇等[12]的报道,以杜仲幼茎为外植体,接种于附加NAA、2,4-D、KT、6-BA及其组合的MS培养基上,均能产生愈伤组织,但附加2,4-D的培养基上愈伤组织容易褐化,其他均可正常生长,附加0.5mg/LNAA+0.5mg/L6-BA+1.0mg/LKT的培养基适合愈伤组织的增殖培养。
3.2芽的诱导和增殖芽的诱导形成使用的激素有BA、NAA、IBA、BAP、IAA、KT等,BA和NAA 2种激素在从愈伤上诱导芽时通常需要混合使用,BA的最优使用量范围为0.50~2.25mg/L,NAA的最优使用量范围为0.05~0.50 mg/L[8]。
根据李岩等[5]的报道,在含有0.1mg/LNAA+0.8mg/L6-BA的MS培养基中,杜仲胚轴可直接诱导产生不定芽,诱导率达到47%,为较优培养方案。
李琰等[2]以MS为基本培养基,在添加0.05mg/LNAA+0.5mg/LBA或者0.1mg/LIBA+0.5mg/LBA的培养基中,腋芽的诱导和生长较好;继代增殖培养以0.5mg/LBA+0.01mg/LNAA的MS培养基丛芽数量最多,增殖系数最高。
可见,不同浓度的BA和NAA混合使用对芽的诱导与增殖有显著促进作用。
3.3根的诱导杜仲生根培养所需激素有NAA、IBA、GA等3种激素,以IBA的效果最好,其适合浓度为1.5~2.0mg/L[8]。
据报道,只用White培养基,不添加激素也可以生根[8]。
李岩等[5]研究表明,在生根培养中,附加1.5mg/LIBA+20g/L蔗糖的1/2MS培养基效果最好,生根率达到91.7%。
另有王东良等[4]报道,以1/3MS附加0.1mg/LKT+0.5mg/LNAA也有生根现象,生根率18%。
比较可知,采用1/2MS培养基材料的生根率明显高于采用1/3MS培养基材料的生根率,且较低浓度的盐离子有利于根的分化。
4光照条件光对愈伤组织的生长既有促进作用也有抑制作用,杜仲的愈伤组织培养中,光照条件以12h光照12h暗培养最好。
黑暗中和12h光照条件下愈伤组织的增长量相似,但颜色差异较大。
在生理生化特征和分化能力上这些形态不同的愈伤组织也有很大的差异,其在次生代谢产物的含量方面是否有差异尚需进一步研究[13]。
何泼等[11]分别采取黑暗24h/d、光照12h/d、自然光3种不同光照方法进行光照对愈伤组织增长影响的试验,结果表明,3种不同光照方式下愈伤组织的增长率并无太大差异,但光照12h/d条件下培养的愈伤组织更易做进一步的继代培养,而连续黑暗培养24h/d时的增长率略低。
另外光照对杜仲愈伤中次生代谢物的积累有明显影响,杨振堂等[14]报道,光照有利于愈伤中杜仲胶的积累,与自然光下相比,杜仲胶的总生产率较高。
