电导法测定酶活力
酶活性的测定原理

酶活性的测定原理
酶活性是指单位时间内酶所催化的底物转化的速率。
测定酶活性的原理主要基于酶和底物之间的反应,通常采用比色法、发光法、电化学法等不同技术来测量产物的生成量。
一种常用的测定酶活性的方法是比色法,该方法主要通过测量底物转化后所产生的色素的强度或吸收率来反映酶活性的大小。
具体操作步骤如下:
1. 首先,准备好所需的实验试剂和设备,包括底物、酶溶液、缓冲液、比色剂等。
2. 将酶溶液加入适当的量的缓冲液中,以调节pH值和酶的浓度。
此步骤有助于提供适宜的反应环境,以发挥酶的最佳催化效果。
3. 在试管中加入适量的底物溶液。
4. 立即加入酶溶液,并立即开始计时。
为了确保测量的准确性和可比性,要确保每个实验条件下反应时间一致。
5. 在一定时间内(通常为几分钟或数十分钟),停止反应。
这可以通过加入酶活性停止剂、改变反应条件或其他合适的方法来实现。
6. 加入比色剂,使产物产生明显的颜色。
比色剂的选择要根据具体试剂和底物的特性来进行,以保证在所使用的检测设备
(如分光光度计)的波长范围内有明显的差异。
7. 使用合适的仪器(如分光光度计)测量产生的色素的吸光度或强度。
根据吸光度或强度的变化,可以通过对比标准曲线或对照组的结果,计算出酶活性的数据。
需要注意的是,在测定酶活性时,实验条件的控制非常重要。
包括温度、pH值、底物浓度和酶浓度等因素的选择和控制,都会对测定结果产生影响。
因此,在进行酶活性测定时,应该对这些因素进行合理的控制和调节,以提高实验结果的准确性和可比性。
抗氧化酶(SOD、POD、CAT)活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)14.5mM甲硫氨酸溶液:取2.1637g Met用磷酸缓冲液(pH7.8)定容至1000ml。
(3)30μM EDTA-Na2溶液:取0.001gEDTA-Na2用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取0.0023g核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)2.25mM 氮蓝四唑(NBT)溶液:取0.1840g NBT用PBS定容至100ml,避光保存。
酶液制备:取0.2g(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入1.6ml 50mmol/L预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液0.6ml,磷酸缓冲液5.4ml,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
纤维素酶酶活测定可编辑全文

纤维素酶酶活测定纤维素酶活测定方法一、原理纤维素酶能将纤维素降解成纤维二糖和葡萄糖,具有还原性末端的纤维二糖糖和有还原基团的单糖在沸水浴条件下可与DNS试剂发生显色反应。
反应颜色强度与酶解产生的还原糖量成正比,而还原糖量又与反应液中的纤维素酶的活力成正比。
酶活定义纤维素酶活力单位是指55℃、pH5.0的条件下,以每分钟催化羧甲基纤维素钠水解生成1μmol还原糖所需的酶量定义为一个酶活力单位U。
二、实验试剂羧甲基纤维素钠(聚合度1700-2000),内切纤维素酶(苏柯汉)50mmol NaAC-HAC、DNS试剂三、实验仪器容量瓶(1000ml ×2、500 ml×3、100 ml ×4、50ml×4 ml)、移液器、烧杯(500ml×3、50ml×3)、具塞试管、电热套、水浴锅、分光光度计、pH计、电子天平四、标准曲线的绘制五、酶活测定由于苏柯汉给定的pH范围为4.8-5.2,故选用pH 5.0的50mmol NaAC-HAC缓冲液测定纤维素酶酶活。
1、样品的制备CMC-Na溶液的制备:用pH 5.0的50mmol NaAC-HAC缓冲液配置0.5%的CMC-Na (羧甲基纤维素钠)溶液,准确称量CMC-Na0.05g,精确至0.001g,溶于蒸馏水中,45℃水浴锅中搅拌溶解,冷却后定容至100ml。
纤维素酶液的制备:准确称取纤维素酶,精确到0.001g。
用50mmol NaAC-HAC pH5.0的缓冲液配置成适当的浓度10000倍,保证吸光度在0.2-0.6之间。
2、DNS法测酶活:取1.8ml 0.5% CMC-Na的溶液于25ml 具塞刻度试管中,55℃预热10min左右,加入0.2ml 适当稀释的酶液,于55℃水浴锅中保温30min后,然后加2ml DNS,混匀,沸水浴5min,冷却至室温,定容到25ml。
混匀测OD540nm。
三种常用检测种子生活力方法比较(1)

三种常用检测种子生活力方法比较(1)随着种子在种植中所占的重要地位,各种检测种子生活力的方法也应运而生。
常用的检测种子生活力的方法有三种,分别是发芽率法、荧光法和电导率法。
本文将对这三种方法进行详细介绍,并进行比较。
一、发芽率法发芽率法是最常用的检测种子生活力的方法之一。
其主要原理是把一定数量的种子在一定的条件下进行发芽,然后通过计算发芽率来推断种子的生活力。
条件包括温度、湿度、光照和通风等,不同的作物和品种有不同的最适条件。
发芽率法检测种子主要有以下几个优点:一是操作简单;二是可大批量检测;三是检测结果真实可靠。
但是同时也存在着一些缺点,如检测时间长、结果受环境因素的影响等。
二、荧光法荧光法是一种新兴的检测种子生活力的方法。
荧光法主要利用了种子的细胞色素氧化酶体系在氧化还原体系下发生反应而使荧光物质荧光素产生荧光。
通过测定产生的荧光的强度来判断种子的生活力。
三、电导率法电导率法是一种利用种子中质量和导电能力的变化来测定种子生活力的方法。
其主要原理是将一定数量的种子放入导电液中,通过测定电导率的变化来判断种子的生活力。
导电液可以是盐水、糖水、电导液等。
三种方法比较从上述的介绍可以看出,每种方法都有其优点和缺点,没有一种方法是完美的。
所以在实际应用中,需要根据具体情况选择合适的方法。
一般来说,发芽率法适用于大批量检测,荧光法适用于单个种子检测,电导率法适用于不同品种间的比较。
除此之外,也可以选择不同的方法相互协作,如发芽率法和荧光法或者电导率法和发芽率法组合使用。
酶活力测定方法

空白和对照试验: 空白试验:是指杂质反应和自发反应引起
的变化量,它提供的是未知因素的影响。空 白值可以通过不加酶,或不加底物,或二者 都加(酶预先经过失效处理)。
对照试验:是指用纯酶或标准酶制剂测得 的结果,主要作为比较或标定的标准。
3)测定方法:
取样测定法:
酶变性剂:5% 三氯醋酸 3% 高氯酸 其它酸、碱、醇类
A1 - A2
0.003 : 1 =
:X
T
A1 - A2 0.003T
每mg供试品中含胰蛋白酶单位数为
A1 - A2
0.003TW
A1—A 2 P=
0.003 T W
重组人白细胞介素 11的胰蛋白酶切肽 图分析
肽图分析是评价重组产品蛋白质结构及其 生产工艺稳定性的重要方法,目前常用的方 法有CNBr裂解SDS-PAGE微量肽 图法和胰蛋白酶切RP HPLC肽图法。返回练习与思考
1.何谓:生化药物、生物技术药物、 基因工程药物和生物制品? 2.生化药物和基因工程药物各分哪 几种? 3.与化学合成药物的分析相比,生 物药物的分析有何特点?
返回
加热:使酶失效
酶反应
不同的时间取样
终止反应
测定
连续测定法:在反应过程中对反应系统进 行直接连续检测。
检测方法: 紫外-可见分光光度法 旋光法 荧光分光光度法 电化学测定法 酶偶联测定法 离子选择性电极测定法等。
示例:胰蛋白酶效价测定 胰蛋白酶 肽键、酰氨键、酯键(碱性氨基酸) 水解速率:酯键﹥酰氨键﹥肽键 供试品溶液:50~60单位/ml 底物溶液:N-苯甲酰-L-精氨酸乙酯
2.酶活力测定法
1)基本原理: 酶活力是指酶催化一定化学反应的能力。酶
活力测定实质上是测定一个被酶所催化的化学 反应速度。酶反应速度越快所表示的酶活力越 高。
电导率测定
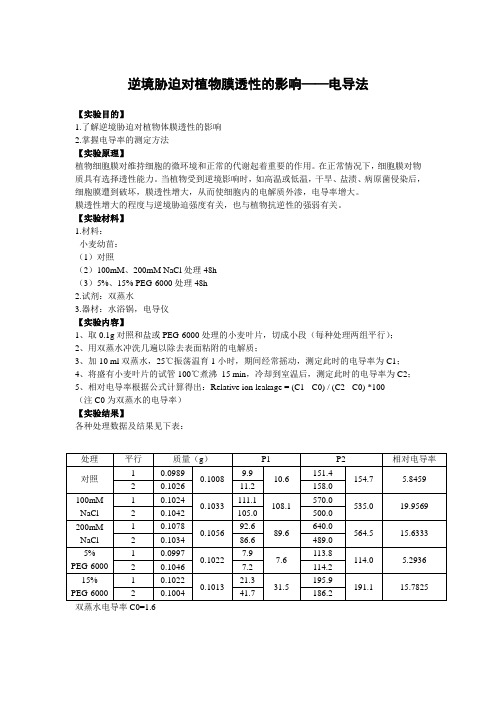
逆境胁迫对植物膜透性的影响——电导法【实验目的】1.了解逆境胁迫对植物体膜透性的影响2.掌握电导率的测定方法【实验原理】植物细胞膜对维持细胞的微环境和正常的代谢起着重要的作用。
在正常情况下,细胞膜对物质具有选择透性能力。
当植物受到逆境影响时,如高温或低温,干旱、盐渍、病原菌侵染后,细胞膜遭到破坏,膜透性增大,从而使细胞内的电解质外渗,电导率增大。
膜透性增大的程度与逆境胁迫强度有关,也与植物抗逆性的强弱有关。
【实验材料】 1.材料: 小麦幼苗: (1)对照(2)100mM 、200mM NaCl 处理48h (3)5%、15% PEG-6000处理48h 2.试剂:双蒸水3.器材:水浴锅,电导仪【实验内容】1、取0.1g 对照和盐或PEG-6000处理的小麦叶片,切成小段(每种处理两组平行);2、用双蒸水冲洗几遍以除去表面粘附的电解质;3、加10 ml 双蒸水,25℃振荡温育1小时,期间经常摇动,测定此时的电导率为C1;4、将盛有小麦叶片的试管100℃煮沸 15 min ,冷却到室温后,测定此时的电导率为C2;5、相对电导率根据公式计算得出:Relative ion leakage = (C1 - C0) / (C2 - C0) *100 (注C0为双蒸水的电导率) 【实验结果】各种处理数据及结果见下表: 双蒸水电导率C0=1.6处理 平行 质量(g ) P1 P2相对电导率 对照 1 0.0989 0.1008 9.9 10.6 151.4 154.7 5.8459 2 0.1026 11.2 158.0 100mM NaCl 1 0.1024 0.1033 111.1 108.1 570.0 535.0 19.9569 2 0.1042 105.0 500.0 200mM NaCl 1 0.1078 0.1056 92.6 89.6 640.0 564.5 15.6333 2 0.1034 86.6 489.0 5% PEG-6000 1 0.0997 0.1022 7.9 7.6 113.8 114.0 5.2936 2 0.1046 7.2 114.2 15%PEG-6000 10.10220.101321.3 31.5195.9 191.115.78252 0.1004 41.7186.2【实验讨论】1.从结果中可以看出,逆境胁迫会导致小麦叶片的膜透性增加,且胁迫程度越大,溶液电导率越大。
测定方法——精选推荐

测定⽅法指标测定⽅法1.相对电导率(REC) 参见郝再彬主编《植物⽣理实验》材料与⽤品电导仪、真空泵、恒温⽔浴锅、平⼝试管(或⼩烧杯)、打孔器、移液管(10ml)、去离⼦⽔、滤纸、搪瓷盘实验步骤1)将处理组叶⽚和对照组叶⽚⽤⾃来⽔轻轻冲洗叶⽚,除去表⾯玷污物,⽤去离⼦⽔冲洗2次,然后⽤洁净滤纸吸净表⾯⽔分。
⽤6-8mm的打孔器避开主脉打取圆⽚(或切割成⼤⼩⼀致的叶块),每试管10⽚(或1g),三次重复。
2)在装有叶⽚的试管中各加⼊10ml去离⼦⽔,放⼊真空⼲燥箱中⽤真空泵抽⽓10min以抽取细胞间隙的空⽓,当缓缓放⼊空⽓时,⽔即渗⼊细胞间隙,叶⽚变成半透明状,沉⼊⽔下。
3)将以上试管置室温保持1h,期间要多次摇动,或者将其放在震荡器上震荡1h4)1h后将各试管充分摇匀,⽤电导仪测其初电导值(S1)5)测毕,将各试管置⽔浴中10min,以杀死植物组织。
取出试管后⽤⾃来⽔冷却⾄室温,并在室温下平衡10min,摇匀,测其终电导值(S2).计算相对电导率计算式为L=S1/S2 (L值的⼤⼩表⽰细胞膜受伤害的程度)如果⽤普通蒸馏⽔,需要设置蒸馏⽔空⽩试管,测值S0,则L=(S1- S0)/(S2- S0)注意事项测电导率时防⽌CO2⽓源和⼝中呼出的CO2进⼊试管,也要避免⽤⼿直接接触叶⽚。
2.丙⼆醛(MDA)硫代巴⽐妥酸法,参见李合⽣《植物⽣理⽣化实验原理和技术》材料与⽤品研钵,试管,恒温⽔浴锅,冷冻离⼼机,分光光度计;5%三氯⼄酸(TCA)[称取5g⽤蒸馏⽔定容⾄100ml],0.67%硫代巴⽐妥酸(TBA)[称取0.67g⽤5%TCA定容⾄100ml,若难溶在磁⼒器上微热]实验步骤1)取不同处理的植物样品0.5g,加5%TCA5ml(总共),研磨后所得匀浆在3000r/min下离⼼10min。
2)取上清液2ml,加0.67%TBA2ml,混合后在100℃⽔浴上煮沸30min,冷却后再离⼼⼀次(据实际情况⽽定)。
酶活测定基本方法

前处理:称取叶片0.5克,加5ml(1+4)提取液PH7.8 Pbs,冰浴研磨,12000g,4℃,20min,上清液即为粗酶提取液。
注:粗酶提取液要全部转移;加入石英砂后离心需配平1.SOD测量取透明度好的指形管,按下表加入各溶液:试剂(酶)用量(ml)0.05M磷酸缓冲液 1.565mM Met溶液0.3500uM NBT溶液0.3100uM EDTA-Na20.3200uM核黄素0.3酶液0.1(对照管加缓冲液)蒸馏水0.5总体积 3.3混匀后将一支对照管置暗处作空白对照,其余各管于4000lx光下反应20-30min,反应结束后,以不照光的对照管为空白,560nm测定OD值。
按下式计算SOD活性。
SOD总活性=[(ACK —AE)×V]/[ ACK×1/2×W×a]SOD比活力=SOD总活性/蛋白质浓度SOD总活性以每克鲜重每单位表示:比活力单位以酶单位/mg蛋白表示ACK—照光对照管的消光度值AE—样品管的消光度值V—样液总体积(ml)a—测定时样品用量(ml)W—样重(g)蛋白质浓度单位为:mg蛋白/g样重。
【试剂配制】磷酸缓冲液配制:母液:A:Na2HPO4•12H2O 36g,稀释至500mlB:NaH2PO4•2H2O 15.92g,稀释至500ml提取液配制:取0.0186gEDTA(0.1mM),5g PVP (1%(g/ml)),用磷酸缓冲液(PH7.8)稀释至500ml。
PH7.8 Pbs配制:A 114.35ml + B 10.625ml,定容至500ml。
PH7.0 Pbs配制:A 152.5ml(76.25ml)+ B 97.5ml(48.75ml)稀释至1000ml (500ml)。
65 mmol/L Met: 取0.97g Met 用磷酸缓冲液(PH 7.8)定容至100ml;500 umol/L NBT:取0.0409g NBT用磷酸缓冲液(PH 7.8)定容至100ml(避光保存);100 umol/L EDTA-Na2: 0.03721g(0.0186g)EDTA-Na2磷酸缓冲液(PH 7.8)定容至1000ml(500ml);200 umol/L 核黄素:0.0753(0.03765)g核黄素磷酸缓冲液(PH 7.8)定容至1000ml(500ml);(现用现配)注:若要抑制Cu-Zn/SOD的活性,可加入30mM的KCN0.3ml;若要抑制Cu-Zn/SODFe-SOD的活性,可加入50mM的H2O2(0.52ml 30%的H2O2稀释至100ml) 0.3ml;2.CAT酶提取液:取材料0.5g,置研钵中,加入5ml 4℃下预冷的提取液和少量石英砂研磨,12000g,4℃,20min,上清液即为过氧化氢酶粗提液,4℃下保存备用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电导法测定酶活力
摘要
我们已经测定了脲酶,脂肪酶,葡萄糖苷酶水解过程中的电导率的变化,这些变化严格地与前两个体系中碳酸铵的释放和第三个体系中氨基的数目成正比。
电导率的方法运用在酶和各种生理液浓度的测定中。
引言
Sjoquist,Oker-Blom,Henri,des Bancels 和Bayliss 证实了用电导法测定酶活性的可能性。
最近,Northrop在他的课程中也用了这种方法研究胃蛋白酶,测定了卵蛋白盐酸盐的的水解,解释了水解底物的依赖性电离,并研究有关机制的胰蛋白酶消化的动力学。
Euler 欧拉一直采用这种方法研究甘肽的水解。
Bayliss通过研究脲酶,脂肪酶,葡萄糖苷酶的行为证实了电导率的可能性,但没有报道过任何与这些系统相关的研究。
以电导判断为目的,酶反应可以归类为:(1)那些释放强烈电子的,(2)释放那些弱离的电解质,(3)那些传统被认为非电解质的。
脲脲酶,sinigrin- myrosin,和丙酮醛-乙二醛是属于第一类,而蛋白质水解系统,会有氨基酸的产生,属于第二类。
第三组的代表是碳水化合物和大多数的葡萄糖苷酶,作用于他们各自的底物,释放糖类。
该反应属于第一组,显然最适合电导研究。
第二组反应有一定的局限性和一定的困难,但是随后能使用一个敏感的设备。
第三组反应,就目前来说,超过了其研究的范围,在他们的使用范围内,有一定的优势,在硼酸盐,硫酸盐,和钼酸存在条件下,多元醇像糖一样表现出导电性增强。
最强烈的反对意见,提出了该方法不能研究缓冲系统。
反应过程中不仅有因为反应的变化,而且有水解产物的累积,为了确定酶的活性,我们必须关注最初阶段的反应过程,使干扰因素控制在最小值。
在这段阶段,电导率的方法也许是唯一一个有任何的优势且可以应用方法。
因为它能够给人们提供早期反应阶段的大量数值。
由于在这些反应中介质的pH值很少有变化,Northrop在pH值6.2至6.4胰蛋白酶明胶的水解不伴pH值的改变而改变。
在低浓度电解质中杂质的存在不影响测量,因为可以选择适当的电导率细胞给出须需要的精度。
与其他物理方法相比,电导率测量有着在反应过程中不受干扰和能适用于极小批量底物中的优势。
实验部分
用目前的方法对脲-脲酶,精氨酸-精氨酸酶-脲酶,蛋白胨-胰蛋白酶-激酶和杨素- 苦杏仁酶进行了研究。
通常采用Kohlrausch电桥法测量电导率。
一个校准Kohlrausch滑线,4号电阻箱和一个Arrhenius-Ostwald细胞组成了电路的元件。
一个5毫升整数倍的底物溶液对工作是必要的。
采用铂电极,提供的细胞是在水中浸泡,恒温维持在30.0 ℃±0.1 ℃。
当高频电流源和一个电话的听筒用于零点检测时,提供1000 Hz的音频振荡器被使用。
该导电细胞的电容通过一个与电阻箱并联的的空气冷凝器平衡。
在反应开始,在很短的时间间隔内读数,后来时间间隔较长。
利用相对应的酶底物浓度,大量的实验同时在单一的反应容器进行时。
对在一定的时间间隔内从反应容器中倒出的等份反应混合物进行分析。
因此该反应过程可由一个完全独立的化学方法而知。
脲-脲酶。
利用丙酮使一个百分之一的尿素溶液(Kahlbaum)和大豆脲酶的水溶液沉淀。
由Sastri 1935年提出的方法有碳酸铵的释放,包括在丙酮中用标准酒精盐酸溶液(0.1 N)滴定等份反应混合物。
精氨酸-精氨酸酶-脲酶。
精氨酸碳酸盐是在5%的d-精氨酸中通入二氧化碳至饱和制备而成的。
过量的二氧化碳是通过电解溶液中的氢冒泡而赶出的。
因此获得的精氨酸碳酸盐溶液呈稳定电导率值。
水溶性萃取液丙酮使公羊肝中的提取物沉淀,因此可作为精氨酸酶的来源。
因为脲酶几乎瞬间水解、随着精氨酸分解逐步释放,我们需要使用过多的脲酶以确保反
应混合物任何一个时间里都只有鸟氨酸和碳酸铵。
在反应混合物中碳酸铵量在不同的时间间隔上面所提及的滴定法确定。
蛋白胨-胰蛋白酶-激酶。
利用了1%的Witte蛋白胨(BDH)和1%的Pfanstiehl胰蛋白酶-激酶。
底物和酶的比例为10比1。
通过Linderstrgm Lang’s的滴定方法确定水解过程中氨基数的释放。
杨素-苦杏仁酶。
利用了1%的水杨苷和水溶性提取物苦杏仁酶。
使用Bertrand方法测定糖的释放量。
讨论
电导和化学性的测量,至少要进行两个酶的浓度。
一组实验的结果如图1(电导)和图2(化学)所示。
这两个相应曲的总体形状表明,这些酶反应动力学可通过电导研究。
物理和化学方法之间的密切关系能通过由前面描述的方法绘制的相关图表(图3)清楚体现。
在这两个体系中脲-脲酶和精氨酸-精氨酸酶-脲酶,在电导率变化主要是由于碳酸氨的释放,这就带来了显着的图表了。
相关图(图3)脲-脲酶和精氨酸-精氨酸酶-脲酶实际上是相同的。
每毫摩尔氨基酸的释放引起的电导率的变化,可在蛋白胨-胰蛋白酶体系中计算,因为电导率和氨基数成线性关系。
在杨素- 苦杏仁酶体系的研究中,而化学法是目前较为准确,虽然电导率容易测
量,重复性好,但是电导率的变化幅度很小。
通过加入硼酸盐使释放糖的电导性增强正在研究中。
现行的电导法,和糖释放体系一样被关注,据糖释放的有关系统,没有提供任何
优于化学法的优势。
结论
在题为“采样与分析的蛋”的文章中,作者通过说”这里没有A. 0. A. C.方法应用”总结了甘油和盐的方法。
它让我们注意到这暗示着没有A. 0. A. C.方法可用于分析。
情况不是这样的。
氯的A. 0. A. C.方法在该协会的“分析方法”第三版249页可能修订为盐的测定,像盐蛋黄中的盐含量。
然而用这种方法进行一系列的测定需要长达12 h,我们报道的方法只需要10 min。
已报道和初步通过的甘油方法需要6 h进行6次测定,而我们的方法只要1.5 h进行相同数量的测定。
我们的目的,像本文第三段所说一样,是为了提供重复性好的快速测定方法。
我们省略了不适合工厂控制的A. 0. A. C.方法的参考文献,我们相信不会因为这一省略不会有任何歧义。
