硼氢化钠的还原及相关机理
硼氢化钠还原羧酸机理.
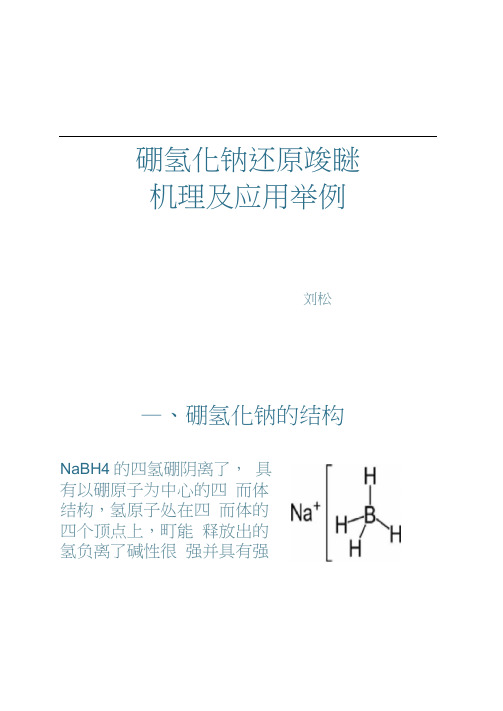
硼氢化钠还原竣瞇机理及应用举例刘松—、硼氢化钠的结构NaBH4的四氢硼阴离了,具有以硼原子为中心的四而体结构,氢原子处在四而体的四个顶点上,町能释放出的氢负离了碱性很强并具有强亲核性。
硼氢化钠应用背景在现代有机合成中#金属氢化物是一类重要的试剂*其中最常用的就是硼氢化钠(NaBH4 ) . NaBH4用于有机物的还原,反应条件温和#可以很容易的将醛或酮还原为醇* 在质子溶剂中将亚胺或亚胺盐还原为胺,经过修饰的硼氢化钠还可以还原竣酸、竣酸酯. 基化合物和睛等*硼氢化钠还原法成本适中*用途十分广泛-三、硼氢化钠还原竣酸机理o oR-C—OH + NaBH- ------------ A 4R-C —CP B^Na®+ 出Xo©B 焉+ 2NaBH4—RCHQ J严B'® N® + 2NaBO分4RCH2OH + NaBO.总反应4RCO2H + 3NaBH4 ^lUO4RII2OH +3N3BO2 + 4H22008年,Yasumitsu Suzuki 等利用计算机建立反 歸恤翹飜化呻瀏懈•个OCH&R2HCO-B 二 OCHF^OCH$klgtire 10. n'rarifrition Mate Mruviurv of NaHI l| reduciiiwi of accttxie wiih three meUuAol molecules oocfxlinatifig Na' (B3LYP/b-31 +C(d)K机理:R-q ;^+ NaJ^ —R- IoOBH2O-C-H n R-C-ROBHa N 才4 R-C-Ro II R-C-RR-C-R I H O II R-C-ROCH 冷AR2HCO-B 二OCHFfeOCHFfeHQOHR-C-R + B(OHb + NaOH H2亠i H.近年报道的各种硼氢化钠体系能增强硼氢化钠的还原性或rv而选择性,基本上都是因为加入的新基团使BH4 ■的负氢亲核性增强,或使锲基双键电子拉向氧增强拨基C的缺电子性。
硼氢化钠还原羰基机理

硼氢化钠还原羰基机理
1 硼氢化钠还原羰基机理
硼氢化钠还原羰基(简称BHNRC)是一种用于降低烷基芳烃羰基(例如:醚、酮、腈和羧酸)氧化性能的重要机理。
它通常由硼氢化
钠作为还原剂而存在。
该机理首先以此钠化产物与烷基芳烃羰基发生
氢键形成裹氢羰基,随后传统的硼氢化反应开始,在该反应的起作用
的即为硼氢化钠所提供的氢原子。
当反应结束后,原本的羰基就被硼
氢化反应形成的氢化物代替,从而起到原本的烷基芳烃的了羰基的效果。
由于硼氢化钠还原羰基可以有效地降低物质的氧化性而被视为一
种十分有效的还原机理,经常被用于各种反应体系中,特别是对芳烃
反应体系。
例如,用于合成甲烷、芳香烃以及烃基烷基醇等碳氢化合物,实际上就是基于硼氢化钠还原羰基这一机理而进行的反应。
在实际应用中,由于这一机理具有一定的不确定性,反应较为复杂,所以硼氢化钠还原羰基的应用还处在探索阶段,还有大量有待深
入研究的内容。
未来,希望可以继续加强对这一研究的深入研究,以
进一步提高硼氢化钠还原羰基机理应用在各种反应体系中的操作水平。
硼氢化钠还原反应机理

硼氢化钠还原反应机理硼氢化钠(NaBH4)是一种常用的还原试剂,广泛应用于有机合成和无机化学领域。
它以其高效、温和、选择性的特点而受到了广泛的关注和应用。
硼氢化钠的还原反应机理如下:硼氢化钠在水溶液中可以存在两种形式:NaBH4和NaBH4·2H2O。
在碱性条件下,NaBH4会被氢氧根(OH-)和水分解为BH4-离子和H2气体:NaBH4 + 2OH- → BH4- + H2O + Na+NaBH4·2H2O + 2OH- → BH4- + 2H2O + Na+在有机合成中,硼氢化钠通常用作还原醛、酮、酸和酯等官能团。
还原过程中,硼氢化钠的BH4-离子被氧化为B(OH)3和H2气体。
具体的反应机理如下:1. 醛和酮的还原:硼氢化钠的BH4-离子中的氢原子被醛或酮的羰基氧原子攻击,生成一个新的C-O 键,同时形成醇。
然后,BH3-OH 或BH2(OH)2作为中间体与H2O反应,再次生成BH4-离子和产物。
2. 酸的还原:硼氢化钠的BH4-离子首先通过与酸中的负电荷氧原子结合,形成一个中间体(加合物),然后该中间体与H2O反应,释放出产物和BH4-离子。
3. 酯的还原:硼氢化钠中的BH4-离子与酯的羰基氧原子发生亲核加成反应,生成醇和一个氧负离子(炔醇中间体)。
然后,炔醇中间体再次与BH4-离子发生反应,生成一个新的C-O 键,并形成产物和BH4-离子。
硼氢化钠的还原反应机理可以归结为BH4-离子的氢原子直接与官能团的氧原子发生反应,然后通过中间体的生成和再反应,最终得到还原产物。
这种还原反应机理的特点是它是一个亲核加成反应,并且显示出较高的选择性和反应活性,因此在有机合成中具有广泛的应用前景。
硼氢化钠还原氰基

硼氢化钠还原氰基
硼氢化钠是一种常用的还原剂,在有机合成中广泛应用。
其中一种重要的应用就是还原氰基。
氰基是一个类似于羰基的官能团,但是它比羰基更容易被还原。
硼氢化钠还原氰基的机理是:氰基中的C-N键会被硼氢化钠还原为C-H键和N-H键。
具体来说,硼氢化钠会先与氰基中的C=O键反应,在缩合的过程中,C-N键被还原为C-H键和N-H键。
硼氢化钠还原氰基的反应条件比较温和,通常在室温下或略高温度下(30-40℃)进行。
反应的产物通常是相应的胺类化合物。
这种还原反应在有机合成中经常被使用,例如在合成氨基酸、含氮杂环化合物等方面。
- 1 -。
硼氢化钠的还原及相关机理

Vinicius De Souza . Tetrahedron Letters 2004, 45, 6021-6022 ; [4] R .Shundo,Y.Matsubara,K.Nishiguchi,T.Hirashima, Bull.Chem.
Soc.Jpn. 65 (1992)530;
本次您浏览到是第六页,共十一页。
De Souza . Tetrahedron Letters 2004, 45, 6021-6022 ; (b)R.P.McGeary, Tetrahedron Lett. 39 (1998) 3319;
8
本次您浏览到是第八页,共十一页。
二、文献查阅: NaBH4参与的还原反应
(四)氰基的还原
Ph CH2CN
THF , 70 ℃, 2.0 -4.0 h 88-97﹪
OH
R4
R1
R2 R3
R1, R2,R3,R4 : H, Cl, Br, F, OMe
[1]
OH CO2R
NaBH4 / ZnCl2
tertiary amine, THF
X
△, 2h
X
R = Me, Et
X = 2-Br, 2-SCH2Ph ,4- NO2, 4-OH 52- 98℅
[2]
Reference: [1] Nubia Boechat, Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and Marcus Vinicius De Souza . Tetrahedron Letters 2004, 45, 6021-6022; [2] R.E. Ten-Brintk, . Chem. 1987,52, 418 ;
硼氢化钠还原双键

硼氢化钠和氢化锂铝都不能还原双键。
硼氢化钠是比较温和的试剂,试用于二级。
三级卤代烷还原,而一级卤代烷不宜用此试剂还原。
硼氢化钠能够将羰基、醛基选择还原成羟基,也可以将羧基还原为醛基,但是与碳碳双键、叁键都不发生反应。
氢化铝锂具有很强的氢转移能力,能够将醛、酮、酯、内酯、羧酸、酸酐和环氧化物还原为醇,或者将酰胺、亚胺离子、腈和脂肪族硝基化合物转换为对应的胺。
此外,氢化铝锂超强的还原能力使得可以作用于其它官能团,如将卤代烷烃还原为烷烃。
扩展资料
硼氢化钠和氢化锂铝的还原反应机理:
硼氢化钠还原的反应机理与氢化铝锂相同。
反应时,BH4-也是唯一的进攻试剂,但它的反应活性不如氢化铝锂,通常只还原酰卤和醛。
酮,不还原酯基及其他易还原的化合物。
另一个不同是反应必须在质子溶剂中或有机锂离子存在下进行,它在水及醇中有一定的稳定性,特别在碱性条件下比较稳定,很多反应经常在醇溶液中进行。
硼氢化钠还原金属离子
硼氢化钠还原金属离子硼氢化钠是一种常见的还原剂,它可以将金属离子还原为相应的金属。
本文将介绍硼氢化钠还原金属离子的反应机理、用途及注意事项。
1. 反应机理硼氢化钠可以与金属离子发生还原反应,生成对应的金属。
以还原铜离子为例,反应方程式如下:Cu2+ + 2BH4- + 6H2O → Cu + 2B(OH)3 + 8H2在反应中,硼氢化钠分子中的氢离子(H)会被金属离子还原成氢气(H2),而硼氢化钠分子中的硼氢离子(BH4-)则会被金属离子还原成相应的金属原子。
在这个过程中,硼氢离子的氢原子(H-)被供电子给金属离子,从而形成对应的金属原子。
反应中,硼氢化钠起到的是还原剂的作用,即向金属离子提供氢电子,从而还原金属离子为金属原子。
同时,水在反应中扮演了催化剂的角色,能够促进反应的进行。
2. 用途硼氢化钠还原金属离子在实际应用中有广泛的用途。
它可以用于制备纯度较高的金属原子,去除金属表面的氧化物和污染物,改善金属性能等。
以下是其中一些具体的应用:(1) 制备纯金属元素:硼氢化钠可以将金属离子还原成相应的金属元素。
根据需要,可以选择不同的金属离子,从而制备出不同的金属元素。
(2) 除去污染物:金属材料表面可能附着有氧化物、化合物和杂质等,这些物质会影响材料的性能和质量。
硼氢化钠还原反应可以快速去除这些污染物,有效提高金属材料的质量和性能。
(3) 改善金属性能:部分金属材料中存在一些不良组织结构或者气孔等缺陷,这些都会影响金属的使用效果。
硼氢化钠还原反应可以缩小这些缺陷,从而改善金属材料的性能。
3. 注意事项在使用硼氢化钠还原金属离子时,需要注意以下几个方面:(1) 操作时应注意安全:硼氢化钠在潮湿的环境下会释放出剧毒的氢气,对人体有很强的毒性。
操作时需要佩戴防护口罩、手套、护目镜等个人防护装置。
(2) 控制反应过程:硼氢化钠溶液需要慢慢滴加到金属离子溶液中,以控制反应速度。
反应过程中需要注意温度变化,避免过高或过低的温度。
硼氢化钠还原二硫键
硼氢化钠还原二硫键硼氢化钠是一种常用的还原剂,可以用来还原含有二硫键的化合物。
二硫键是指两个硫原子之间共享两对电子形成的化学键,常见于含有硫的有机化合物中。
硼氢化钠的还原作用可以有效地将二硫键断裂,并将硫原子还原为硫化物。
硼氢化钠是一种无色结晶固体,化学式为NaBH4。
在水中可以迅速溶解,并产生氢气。
它是一种强还原剂,能够与许多含氧化合物发生反应,将其还原为相应的较低氧化态。
在还原二硫键的过程中,硼氢化钠的还原能力可以将硫原子的氧化态由正四价还原为负二价,使得二硫键得以断裂。
在进行硼氢化钠还原二硫键的实验中,一般会将硫化物溶解在适当的溶剂中,然后加入适量的硼氢化钠。
随着反应的进行,可以观察到溶液逐渐变为浑浊的混合物,这是由于硫化物的生成。
通过适当的实验条件控制,可以将二硫键高效地还原为硫化物。
硼氢化钠还原二硫键的反应机理是通过硼氢化物离子(BH4-)的还原能力来实现的。
硼氢化物离子具有四对孤立电子,可以供给电子给其他物质。
在反应中,硼氢化钠会失去一个氢离子,形成硼氢化物离子。
硫化物中的二硫键与硼氢化物离子发生反应,硼氢化物离子提供电子,将硫原子的氧化态还原为负二价。
同时,硼氢化物离子中的硼原子也会发生氧化,形成硼酸。
硼氢化钠还原二硫键的反应是一种具有广泛应用的化学反应。
它可以用于有机合成中的还原反应,常用于将酮、醛等化合物还原为相应的醇。
此外,硼氢化钠还可以用于还原其他含有硫键的化合物,如硫醇、二硫化物等。
需要注意的是,在进行硼氢化钠还原二硫键的实验中,应该注意控制反应条件,避免产生不必要的副反应。
同时,硼氢化钠是一种具有较强还原性的化合物,使用时应注意安全操作,避免与氧化剂等物质接触,以免引发危险。
硼氢化钠是一种常用的还原剂,可以用来还原含有二硫键的化合物。
通过提供电子,硼氢化钠可以将硫原子的氧化态还原为负二价,从而断裂二硫键。
硼氢化钠还原二硫键的反应机理是通过硼氢化物离子的还原能力实现的。
这种反应具有广泛的应用价值,在有机合成等领域发挥着重要作用。
硼氢化钠还原ni
硼氢化钠还原ni
硼氢化钠还原Ni
硼氢化钠是一种非常重要的还原剂,在化学反应中扮演着十分关键的角色。
它是无色固体,易溶于水,同时也具有强力还原性。
硼氢化钠被广泛应用于有机合成、金属还原、制备纯金属粉末等领域。
其中,硼氢化钠还原Ni也是一种常见的反应。
硼氢化钠还原Ni的反应方程式为:
Ni2+ + 2BH4- + 4H2O → Ni + 2B(OH)3 + 8H+
可以看出,硼氢化钠对Ni2+进行了还原,生成了纯净的金属Ni。
硼氢化钠在这个反应中起到了还原剂的作用,将Ni2+还原成了Ni。
同时,在这个反应中,硼氢化钠的氢离子和羟基离子结合,生成了
B(OH)3。
所以,这个反应也是一种水解反应。
硼氢化钠还原Ni的反应条件主要有两个方面:一是反应需要在无氧环境下进行,因为氧气具有氧化能力,容易将还原剂硼氢化钠氧化成较弱的还原剂;二是反应需要在弱酸性环境下进行,这能够促进反应进行。
同时,反应时需要注意控制温度,确保反应平稳进行。
硼氢化钠还原Ni的反应在制备金属Ni粉末方面具有重要意义。
金属Ni粉末是一种广泛应用于各个领域中的材料,如电子器件、催化剂、合成材料、航空航天材料等等。
硼氢化钠还原Ni反应的产物是纯净的金属Ni,这种方法可以制备出高纯度的Ni粉末,并且具有较高的成本效益。
总之,硼氢化钠还原Ni的反应在化学反应中是一种常见的还原反应。
通过该反应,我们可以制备出高纯度的金属Ni粉末,具有广泛应用前景。
同时,这个反应也为我们深入研究化学反应机理提供了参考。
硼氢化钠反应
硼氢化钠反应硼氢化钠反应是一种常见的还原反应,在有机合成中具有广泛的应用。
本文将从反应机理、反应条件、反应特点和实验操作等方面进行详细介绍。
一、反应机理硼氢化钠(NaBH4)是一种弱还原剂,可以与醛、酮、羰基酸酯等亲电性较强的化合物发生还原反应。
其还原机理为:NaBH4 + H2O → NaOH + BH3BH3 + H2O → B(OH)3B(OH)3 + 4H → BH4- + 3H2在上述过程中,NaBH4先与水发生水解生成BH3和NaOH,然后BH3再与水发生缩合生成B(OH)3,最后B(OH)3和四个质子结合形成BH4-离子。
在实际的还原反应中,BH4-离子可以直接给予亲电性较强的化合物一个氢离子(H-),从而完成还原。
二、反应条件1. 溶剂选择:常用溶剂有乙醇、甲醇、乙二醇等极性溶剂。
2. 反应温度:通常在室温下进行,但对于某些难以还原的化合物,需要在加热条件下进行。
3. 反应时间:反应时间根据具体反应物而定,一般在几分钟到数小时之间。
4. 反应物质量比:NaBH4与亲电性较强的化合物的摩尔比为1:1或2:1。
三、反应特点1. 选择性高:对于醛、酮等亲电性较强的化合物,硼氢化钠还原具有很高的选择性,不会对其他官能团发生还原反应。
2. 温和条件:硼氢化钠还原反应在室温下进行,不需要使用高温或高压条件,操作简单方便。
3. 还原效率高:硼氢化钠是一种弱还原剂,但其还原效率却很高,在实验中可以达到90%以上的收率。
四、实验操作1. 实验材料:NaBH4、溶剂(如乙醇)、待还原化合物等。
2. 实验步骤:(1)称取适量NaBH4并加入少量溶剂中搅拌至完全溶解;(2)将待还原化合物加入溶液中,并继续搅拌;(3)观察反应过程中产生的气体或颜色变化等;(4)反应结束后将溶液过滤或蒸馏得到产物。
3. 实验注意事项:(1)NaBH4具有强还原性,需要避免与空气中的水分接触,存放时应密封保存;(2)实验过程中应注意安全,避免NaBH4与皮肤或眼睛接触;(3)在实验过程中应仔细掌握反应条件和反应时间,以保证反应效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、文献查阅: NaBH4参与的还原反应
(五)酰氯的还原
NaBH 4- ZnCl2 R COCl TMEDA R CH2 OH R= alkyl / aryl 86-98 ℅
Reference: [11]Nubia Boechat,Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and MarcusVinicius De Souza. Tetrahedron Letters 2004,45, 6021-6022;
R OH
[9]
80-98℅
[8] [9] (a) Nubia Boechat,Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and MarcusVinicius De Souza . Tetrahedron Letters 2004, 45, 6021-6022 ; (b)R.P.McGeary, Tetrahedron Lett. 39 (1998) 3319; 7
参考文献:[1] 闻韧 主编 药物合成反应 北京 :化学工业出版社 ,2002. 363 2
还原试剂(金属氢化物)的选择:
LiAlH4 R CO2Et
R
OH
结论: 反应迅速, 但后处理操作复杂。
NaBH4
3
二、文献查阅: NaBH4参与的还原反应
(一)、酯的还原
OH R4 CO 2Et R1 R2 R3 NaBH 4(6.0 eq) ,MeOH(8mL) THF , 70 ℃, 2.0 -4.0 h 88-97﹪ R3 R4 R1 R2
4 R C R + B(OH)3 + N11
二、文献查阅: NaBH4参与的还原反应
(四)氰基的还原
NaBH 4- ZrCl4 Ph CH2CN THF , rt
Ph CH2CH 2NH 2 91℅
[10]
NaBH 4- I2 PhCN THF
NaOH PhCH 2NH 2 72℅
Reference:[10] (a) Nubia Boechat,Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and MarcusVin Souza. Tetrahedron Letters 2004,45, 6021-6022; (b) T.Yamakawa, M Masaki, H. Nohira, Bull. Chem. Soc. Jpn. 64 (1991) 2730; (c) ne, Chem. Rev. 76 (1976) 773 ; 8
Reference:[5](a) S.Baskaran, V.Gupta, N. Chidambaram, S. Chandrasekaran, J. Chem.Soc. Commun.(1989)903; (b) [6] Nubia Boechat, Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and MarcusVinicius De Souza . 6 Tetrahedron Letters 2004, 45, 6021-6022 ;
二、文献查阅: NaBH4参与的还原反应
(一)、酯的还原
CO 2Et NaBH 4- I2 THF , 70 ℃, 0.5 h H2O 85℅ OH
[3]
(二)羧酸的还原
NaBH 4 -ZnCl2 R-COOH THF ,△ R OH R= alkyl / aryl 70-95℅
[4]
Reference: [3]Nubia Boechat, Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and Marcus Vinicius De Souza . Tetrahedron Letters 2004, 45, 6021-6022 ; [4] R .Shundo,Y.Matsubara,K.Nishiguchi,T.Hirashima, Bull.Chem. 5 Soc.Jpn. 65 (1992)530;
金属氢化物的还原及 机理 ----NaBH4
制作:小鱼爱大海
1
一:金属氢化物还原
两种主要金属氢化物的还原特性[1] 反应官能团 酮 醛 生成官能团 仲醇 伯醇 LiAlH4 √ √ NaBH4 √ √
酯
羧酸 酰氯
伯醇
伯醇 醛
√
√ √
×
× √
注: √表示官能团能被还原;
×表示官能团不能被还原或反应很慢
[1]
R1, R2,R3,R4 : H, Cl, Br, F, OMe
OH CO2 R NaBH 4 / ZnCl2 X tertiary amine, THF △, 2h X
[2]
R = Me, Et X = 2-Br, 2-SCH 2Ph ,4- NO2 , 4-OH 52- 98℅
Reference: [1] Nubia Boechat, Jorge Carlos da Costa ,Jorge de Souza Mendonca, Pedro Santos Mello de Oliveira and Marcus Vinicius De Souza . Tetrahedron Letters 2004, 45, 6021-6022; [2] R.E. Ten-Brintk, . Chem. 1987,52, 418 ; 4
9
四、氢负离子还原机理
机理1、
H H B H H R +O R` R` CHOBH3 R R` CHOH R
机理2、
O 机理: R C R + Na BH3 H R OBH2O C H R C R H H2O H OH R O R C R R O C R OCHR2 R2HCO B OCHR2 Na OCHR2 OBH3 Na R C R H O R C R
二、文献查阅: NaBH4参与的反应
(二)羧酸的还原
COOH NaBH 4 -ZrCl4 THF ,rt, 5h 85℅ OH
[5]
COOH CO 2Et
NaBH 4 -I2 THF ,0-25℃ 82℅
OH CO2Et
[6]
NaBH 4 -I2 CH 3(CH 2) 8COOH CH 3(CH 2 )8CH 2OH THF ,0-25℃ 95℅
二、文献查阅: NaBH4参与的还原反应
(三)氨基酸及其衍生物的还原
R R H2 N COOH NaBH 4 -I2, THF reflux KOH MeOH H 2N 45-94℅ OH
[8]
R = alkyl or aryl
R H 2N COOH
NaBH 4 / H2 SO4, THF MeOH , NaOH H2N
