共轭效应 PPT课件
合集下载
共轭效应
4
04-06 共轭效应
三. 共轭效应在有机化学中的应用
判断或解释有机反应活性中间体的稳定性
碳正离子、碳负离子、自由基、不同取代的烯烃
例如:比较下列烯烃的稳定性
>
12个σ-π 超共轭 9个σ-π 超共轭
>
6个σ-π 超共轭Βιβλιοθήκη 504-06 共轭效应
例如:比较下列碳正离子的稳定性
>
p-π共轭
>
σ-p超共轭 6个C-H
04-06 共轭效应
二. 超共轭效应
1. 含义及分类
含义:一种特殊的共轭(-、-p) -超共轭效应: 键与C-H 键共轭产生的电子离域效应。
-p超共轭效应:C-H 键与p轨道共轭产生的电子离域效应。
-超共轭效应
-p超共轭效应
04-06 共轭效应
2. 产生的原因 原因:H原子体积小,C—H键电子云的形状及大小与碳原子的p轨 道相差不大,且近似平行,易与邻位的或p电子发生相互作用,形 成-、-p共轭体系。 3. 超共轭效应的特征 超共轭效应比共轭效应弱得多; 在超共轭效应中, 键一般是给电子的, C-H键越多超共轭效应越大。 -CH3 > -CH2R > - CHR2 > -CR3
>
σ-p超共轭 3个C-H
>
无共轭
σ-p超共轭 9个C-H
6
04-06 共轭效应
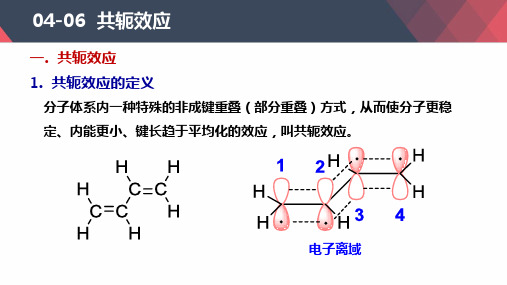
一. 共轭效应
1. 共轭效应的定义
分子体系内一种特殊的非成键重叠(部分重叠)方式,从而使分子更稳
定、内能更小、键长趋于平均化的效应,叫共轭效应。
电子离域
04-06 共轭效应
2. 共轭效应的分类 π- π p- π
共轭效应

原理介绍
正常共轭效应
共轭效应又称π-π共轭。是指两个以上双键(或叁键)以单键相联结时所发生的π电子的离位作用。C.K. 英戈尔德称这种效应为中介效应,并且认为,共轭体系中这种电子的位移是由有关各原子的电负性和p轨道的大小 (或主量子数)决定的。Y原子的电负性和它的p轨道半径愈大,则它吸引π电子的能力也愈大,愈有利于基团X=Y从基准双键A=B-吸引π电子的共轭效应(如同右边的箭头所示)。与此相反,如果A原子的电负性和它的p轨 道半径愈大,则它释放π电子使其向Y原子移动的能力愈小,愈不利于向-X=Y基团方向给电子的共轭效应。中间 原子B和X的特性也与共轭效应直接相关。多电子共轭效应又称p-π共轭。在简单的多电子共轭体系中,Z为一个 带有p电子对(或称n电子)的原子或基团。这样的共轭体系中,除Z能形成d-π共轭情况外,都有向基准双键 A=B-方向给电子的共轭效应。Z原子的一对p电子的作用,类似正常共轭体系中的-X=Y基团。
共轭效应
有机化学概念
01 离域现象
03 介绍 05 相关扩展
目录
02 特点 04 原理介绍
共轭效应 (conjugated effect),又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π 电子(或p电子)分布发生变化的一种电子效应。凡共轭体系上的取代基能降低体系的π电子云密度,则这些基团 有吸电子共轭效应,用-C表示,如-COOH,-CHO,-COR;凡共轭体系上的取代基能增高共轭体系的π电子云密度, 则这些基团有给电子共轭效应,用+C表示,如-NH2,-R、-OH。
超共轭效应
共轭效应其中一种为σ-π共轭。它是由一个烷基的C-H键的σ键电子与相邻的半满或全空的p轨道互相重叠 而产生的一种共轭现象。依照多电子共轭的理论,一个C-H键或整个CH3基团可作为一个假原子来看待。超共轭效 应存在于烷基连接在不饱和键上的化合物中,超共轭效应的大小由烷基中α-H原子的数目多少而定,甲基最强, 第三丁基最弱。超共轭效应比一般正常共轭效应和多电子共轭效应弱得多。
结构化学课件:离域p键和共轭效应

在SO32–, SO42–中,硫原子采用sp3杂化,与氧原 子形成s键,氧原子还把两个p轨道的孤对电子反 馈到硫原子的空d轨道中,但是这两个反馈电子的 键很弱,从键长和键能看,S-O键介于单键和双键 之间,由一个s键和两个p-d p键构成,总效果近似 于一个双键。 SO32–不可能由S和O的p轨道构成共 轭大p键,因为p电子数正好为p轨道的2倍。
O¯
羧酸在电离出氢离子后,由碳和
R
C
氧的一个p轨道可以形成3中心4电 子的共轭大p键Hale Waihona Puke 因此羧酸具有酸性。O
酚酞
OH
OH
NaOH
C
OH
C
O
CO
无色
O
形成三个不相连的
共轭p键。
COO¯ 红色
三个苯环和中心碳原子、
羧酸根、氧原子形成 Π2243
共轭p键。
共轭p键范围越大,那么基态和第一激发态之间能隙越小,从 而显示出的颜色的波长也越长。水溶液中的酚酞在紫外区, 所以无色,加碱后,波长变长,显示红色。
注: 2p轨道内层只有s电子,两个p轨道可以充分 接近形成p-p p键,因此p-p p键一般只限于2p-2p 之间,间或存在于2p-3p之间,比如CS2和SO2。
氮的化合物 NO2分子中氮以sp2杂化,两个杂化轨道与氧原子 形成两个s键,关于分子结构有三种观点: 1 另外一个杂化轨道是单电子,未杂化的孤对电 子与每个氧原子的一个p轨道(单电子)形成共轭p 键(3中心4电子),分子为V形。 2 另外一个杂化轨道是孤对电子,未杂化的单电 子与每个氧原子的一个p轨道(单电子)形成共轭p 键(3中心3电子),分子为V形。 3 在1和2两种结构间共振。
H
H C C CH2
《电子效应》PPT课件

δC+H2
δ+
CH CH
Oδ -
δ-
δ+
δ - δ - OH
2. 共轭效应是一种“远程”效应。即当共轭效应沿着共轭体系传递时, 不管距离多远,强度几乎无衰减,覆盖共轭链全部。其原因是因为共轭 效应是沿着共轭链传递的,而共轭体系中的π电子或P电子容易离域, “屏蔽效应”非常小。
3.共轭效应的方向性。不像诱导效应,只要发生,其电子云的必然朝着 某一方向偏移。如1所述,共轭效应电子云的变化有两种情况,只有发
甲基均为吸电基团
CD3 CH2
CD3 μ =0.073
ⅱ 烷基在诱导效应中的类型主要决定于其所处的环境。如烷基和 吸电基团(如羧基、硝基、醛基、羰基、羟基、氨基、苯环、烯键、炔 键等)相连则为供电基团;如烷基和烷基相连,则为吸电基团。
3.2.1.5 静态诱导效应对分子理、化性质的影响
一、通过影响分子的极性而影响物质的熔点、沸点及溶解度 静态诱导效应固定地影响分子中电子云的密度和分布,因而也
CH3 CH2 CH2CH2 Cl 极性分子
OH 非极性分子 极性分子
原因:
δδδ +
CH3 CH2
δδ +
CH2
H
Cδ +
δCl
H
δδδ + δδ + δ+
δO
δ+
H
δδδ + δδ +
在上式中:“→”表示诱导效应(inductive effects I)电子云变化
的方向δ;+ δ -
“ ”或“ ”表示由于电子云变化而导致
分子内 原子种类 部环境 原子之间连接顺序和方式
分子外 所处体系的类型 部环境 共存物质的类型及浓度
共轭效应PPT课件

第3页/共16页
电子效应
• 电子效应,理论有机化学基本概念之一。细分为两大类:一类是涉及π键的共轭效应;一类是涉及σ键的诱 导效应和超共轭效应。 电子效应本质上来讲就是由于不同原子之间存在电负性的差别,这个差别导致了化 学键的极化。这种极化的结果可以沿着化学键传导,从而对分子本身的物理性质和化学性质产生了影响。
共轭效应的产生 共轭效应的类型
第1页/共16页
共轭效应的产生
•共轭效应(conjugative effect ): 由于电子离域而产生的分子中原子间相互影 响的电子效应。 •特点:是沿共轭体系传递不受距离的限制。 • 结果:使分子能量降低,稳定性增加,缩短 键长。
第2页/共16页
电子离域
• 如1,3-丁二烯,四个∏ 电子不是两两分别固定 在两个双键碳原子之间, 而是扩展到了四个碳原 子之间,象这种现象称 为电子离域。它体现了 分子内原子之间的相互 影响。
0.133
0.154
H
H
? ? : nm
双键与乙烯相比,变长了;单键与乙烷相比,变短了。总的说 来,是键长趋于平均化了。
第9页/共16页
氢化热
孤立和共轭体系的氢化热:
CH2 CH CH2 CH CH2 + 2 H2 CH3CH CH CH CH2 + 2 H2 所以1,3-戊二烯的共轭能是28KJ/mol
第4页/共16页
共轭效应大致分为三类:
• ∏-∏共轭 • P-∏共轭 • 超共轭
第5页/共16页
∏-∏共轭( ∏-∏ conjugative )
• 非饱和键(双键或三键)与单键交
替分布,形成∏键的P轨道在同一
平面上相互重叠而成共轭体系,称
之为∏-∏共轭( ∏-∏
电子效应
• 电子效应,理论有机化学基本概念之一。细分为两大类:一类是涉及π键的共轭效应;一类是涉及σ键的诱 导效应和超共轭效应。 电子效应本质上来讲就是由于不同原子之间存在电负性的差别,这个差别导致了化 学键的极化。这种极化的结果可以沿着化学键传导,从而对分子本身的物理性质和化学性质产生了影响。
共轭效应的产生 共轭效应的类型
第1页/共16页
共轭效应的产生
•共轭效应(conjugative effect ): 由于电子离域而产生的分子中原子间相互影 响的电子效应。 •特点:是沿共轭体系传递不受距离的限制。 • 结果:使分子能量降低,稳定性增加,缩短 键长。
第2页/共16页
电子离域
• 如1,3-丁二烯,四个∏ 电子不是两两分别固定 在两个双键碳原子之间, 而是扩展到了四个碳原 子之间,象这种现象称 为电子离域。它体现了 分子内原子之间的相互 影响。
0.133
0.154
H
H
? ? : nm
双键与乙烯相比,变长了;单键与乙烷相比,变短了。总的说 来,是键长趋于平均化了。
第9页/共16页
氢化热
孤立和共轭体系的氢化热:
CH2 CH CH2 CH CH2 + 2 H2 CH3CH CH CH CH2 + 2 H2 所以1,3-戊二烯的共轭能是28KJ/mol
第4页/共16页
共轭效应大致分为三类:
• ∏-∏共轭 • P-∏共轭 • 超共轭
第5页/共16页
∏-∏共轭( ∏-∏ conjugative )
• 非饱和键(双键或三键)与单键交
替分布,形成∏键的P轨道在同一
平面上相互重叠而成共轭体系,称
之为∏-∏共轭( ∏-∏
烯烃共轭体系PPT课件

说明:有取代基的烯烃和共轭二烯烃更稳定。
(2) 产生原因:双键的电子云和相邻的α位C-H键的σ电子云相 互交盖而引起的离域效应。
1.50 Å
CH3
1.54 Å normal
p
p
C C
H
σ电子云
C
σ-超共轭效应:轨道和碳氢轨道的交盖,使原本定域的电
子云发生离域而扩展到更多原子的周围,从而降低了分子的能量
H C C CH2
H 0.108nm0.131nm
H
H
CCC
H
H
4.2 二烯烃的结构
4.2.2 1, 3-丁二烯的结构
电子是“离域”的
4.3 电子离域与共轭体系
4.3.1 - 共轭
- 共轭体系共轭体系的特性
1、几何特性:共平面性(参与共轭的原子处于同一平面) 键长的平均化 2、电子特性:影响分子偶极矩----------极化度高 3、能量特性:体系能量减低 4、化学特性:会发生共轭加成
共振论主要内容
1. 许多分子的实际状态往往不是一个单独的经典价键结构式所能 正确表示的,它介于几个不同的价键结构之间,分子的真实结 构是一系列共振结构式的杂化体;
2. 当共振结构式有差不多相同稳定性时共振式是重要的,每个共 振结构对杂化体的参与的程度取决于共振结构式的相对稳定性 ,结构越稳定参与程度越大;
2
+ 2 H2
+ 2 H2
28 kJ
+ 2 H2
△ Ho
250 kJ
254 kJ
226 kJ
离域能——共轭体系分子中电子的离域而导致分子更 稳定的能量。
4.3 电子离域与共轭体系
4.3.2 p- 共轭
4.3.2 p- 共轭
(2) 产生原因:双键的电子云和相邻的α位C-H键的σ电子云相 互交盖而引起的离域效应。
1.50 Å
CH3
1.54 Å normal
p
p
C C
H
σ电子云
C
σ-超共轭效应:轨道和碳氢轨道的交盖,使原本定域的电
子云发生离域而扩展到更多原子的周围,从而降低了分子的能量
H C C CH2
H 0.108nm0.131nm
H
H
CCC
H
H
4.2 二烯烃的结构
4.2.2 1, 3-丁二烯的结构
电子是“离域”的
4.3 电子离域与共轭体系
4.3.1 - 共轭
- 共轭体系共轭体系的特性
1、几何特性:共平面性(参与共轭的原子处于同一平面) 键长的平均化 2、电子特性:影响分子偶极矩----------极化度高 3、能量特性:体系能量减低 4、化学特性:会发生共轭加成
共振论主要内容
1. 许多分子的实际状态往往不是一个单独的经典价键结构式所能 正确表示的,它介于几个不同的价键结构之间,分子的真实结 构是一系列共振结构式的杂化体;
2. 当共振结构式有差不多相同稳定性时共振式是重要的,每个共 振结构对杂化体的参与的程度取决于共振结构式的相对稳定性 ,结构越稳定参与程度越大;
2
+ 2 H2
+ 2 H2
28 kJ
+ 2 H2
△ Ho
250 kJ
254 kJ
226 kJ
离域能——共轭体系分子中电子的离域而导致分子更 稳定的能量。
4.3 电子离域与共轭体系
4.3.2 p- 共轭
4.3.2 p- 共轭
092共轭效应PPT

CH2-CH-CH-CH2
2、P-∏共轭效应 定义:单键的一侧有一∏键,另一侧有未共用电子 对的原子,或有一平行的p轨道,称之为p-∏共 轭。 如: H2C=CH-Cl
H2C-CH-Cl
3、超共轭效应 定义:∏键与C-Hσ键共轭则称为σ-∏共轭,若 C-Hσ键与p轨道共轭则称为σ-p共轭。 如: σ-∏共轭: CH2=CH-CH3
CH 2
四*、静态p-∏共轭效应和静态∏-∏共轭效应的相对强度 1、p-∏共轭p电子朝着双键方向转移,呈推电子效应(+C)。
X C C
其共轭的强度次序对同族元素来说,随着原子序数的增加原子 半径增长,形成p-∏共轭的能力变弱:
OR>
SR>
SeR>
TeR
对于同周期的元素,p轨道的大小相接近,但由于元素的负 电性变大,使电子对不易参加共轭:
H
CH2-CH-CH2
σ-p共轭:
CH 3 -CH-CH 3
H H
CH 2 -CH-CH 2
CH3-CH=C=CH-CH3 (2,3-戊二烯 ) 是否具有共轭结构?
二 、共轭效应的特征 1)键长趋于平均化 2)共轭体系的内能低,分子 较稳定(CH2=CH-CH=CH2 ) 3)折射率较高
三、共轭效应的传递 共轭效应通过共轭键传递。当共轭 体系一端受电场的影响时,就能沿着 共轭链传递得很远,同时在共轭链上 的原子将依次出现电子云密度正、负 交替变化现象(与诱导效应不同)。
F>
Cl>
Br>
I
2、∏-∏共轭 ∏键电子云转移的方向偏向电负 性强的元素,呈拉电子效应(-C)。
C C C O
对于同族元 素来说,原 子序数越大, -C效应越小
共轭体系、共轭效应、共振论_图文

参与共轭的C-H键越多,体系稳定性越大。
应用2: 结合“稳定性原理”可解释反应现象。
例1:解释下列反应产物
(为什么不是
?)
解题思路:比较中间体自由基的稳定性。 具有p-π共轭而稳定! 没有p-π共轭,稳定性小!
例2:
phCH=CH-CH=CH2 +HBr
?
phCH-CH2-CH=CH2 phCH=CH-CH-CH3
CH2=CH-Cl
电子向共轭体系中电子 云密度低的方向转移!
由未共用电子对指向单键
例:
-O- -NH- -CH2-F -Cl -Br -I -OH -OR -NH2
具有+C效应
常见基团共轭效应的大小:
-F>-Cl>-Br>-I (同主族) -NH2 > -OR > -F (同周期) -O- > -OR
ΔH=137.2KJ/mol
CH2=CH-CH=CH2 + 2H2 CH3-CH2-CH2-CH3 + Q
ΔH=238.9KJ/mol
假定CH2=CH-CH=CH2分子不共轭,与 H2 反应时所放出的能量为:
137.2×2 = 274 . 4 KJ/mol
两者之差 —— 共轭能:
274.4 - 238.9 = 35.5 KJ/mol
例: CH2=CH-Cl
-
+
CH2-CH=Cl
d、负电荷处于电负性较大的原子上,稳定。
e、两异号电荷相距越近,同号电荷相距越远, 越稳定。
4、共振结构对杂化体的贡献
a、越稳定的共振式,对杂化体的贡献越大。
b、等价的共振式杂化出来的杂化体,稳定性 最大。
c、参与共振的共振式越多,杂化体越稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H = - 254 KJ/mol H = - 226 KJ/mol
从能量图可以看出,共轭 二烯烃比孤立二烯烃能量 低了254-226=28KJ/mol 这部分低出来的能量叫共轭 能或离域能。1,3-丁二烯 的共轭能为15kJ/mol。
E ?? 254KJ/mol ? ? 226KJ/mol
C5H12
P-π共轭
未成对电子的P轨道 与双键轨道在侧面相 互交盖,同样也能构 成共轭体系,称为P∏共轭。
超共轭效应
超共轭效应是指两根化学键的电子云部分重叠,电子可以在共轭 体系中流通,不是肩并肩地去杂化,而是以一定角度部分重叠
电子云重叠越多,那么它形成的键就越牢固,但是由于重叠很少 则叫做”超共轭“,这里的“超”是指很小,很少,一点点的意 思~ 可以说在分子中形成的超共轭键数量越多,那么分子越稳定,因 为重合的越多,键越不容易被打断
0.133
0.154
H
H
? ? : nm
双键与乙烯相比,变长了;单键与乙烷相比,变短了。总的说 来,是键长趋于平均化了。
氢化热
孤立和共轭体系的氢化热:
CH2 CH CH2 CH CH2 + 2 H2 CH3CH CH CH CH2 + 2 H2 所以1,3-戊二烯的共轭能是28KJ/molCH12 C5H12共轭效应
(conjugative effect )
共轭效应的产生 共轭效应的类型
共轭效应的产生
共轭效应(conjugative effect ): 由于电子离域而产生的分子中原子 间相互影响的电子效应。
特点:是沿共轭体系传递不受距离 的限制。
结果:使分子能量降低,稳定性 增加,缩短键长。
电子离域
这是因为它们分子中4个π电子处于离域的π 轨道中,共轭的结果,使共轭体系具有较低的 内能,分子稳定。
键长
以1,3-丁二烯为例:
现代物理方法测定,1,3-丁二烯的结构为一平面型分子,它的 键参数如下:
H
H
0.108 122.4度
H 0.134 0.148
119.8度 H
CH2 CH2 CH3 CH3
1,3-丁二烯特点
ⁿ ⑴碳碳单键键长相对缩短,单双键产生了平均化 ⁿ 随构造式CH2=CH-CH=CH2,但单双键的键长已相当
接近,同样体现在环状共轭体系中。如,苯环C-C键 长是完全相等的。 ⑵化合物的能量显著降低,稳定性明显增加。决定内 能大小方法之一就是测量氢化热,氢化热越低,分子 内能越低。
共轭效应大致分为三类:
∏-∏共轭 P-∏共轭 超共轭
∏-∏共轭( ∏-∏ conjugative )
非饱和键(双键或三键)与单键交 替分布,形成∏键的P轨道在同一平 面上相互重叠而成共轭体系,称之 为∏-∏共轭( ∏-∏ conjugative )
如:1,3-丁二烯
1,3-丁二烯
分子中,每个碳原子都以sp2轨 道相互重叠或与氢原子的1s轨 道重叠,形成三个C-Cσ键和六 个C-Hσ键。这些σ键都处在同 一个平面上,它们之间的夹角 都接近120°,此外每个碳原子 还剩下一个来参加杂化的与这 个平面垂直的p轨道。四个p轨 道的对称轴互相平行侧面互相 重叠,形成了包含四个碳原子 的四个电子的共轭体系。 更多…..
如1,3-丁二烯,四个∏ 电子不是两两分别固定在 两个双键碳原子之间,而 是扩展到了四个碳原子之 间,象这种现象称为电子 离域。它体现了分子内原 子之间的相互影响。
电子效应
电子效应,理论有机化学基本概念之一。细分 为两大类:一类是涉及π键的共轭效应;一类 是涉及σ键的诱导效应和超共轭效应。 电子效 应本质上来讲就是由于不同原子之间存在电负 性的差别,这个差别导致了化学键的极化。这 种极化的结果可以沿着化学键传导,从而对分 子本身的物理性质和化学性质产生了影响。
• 由干σ电子的离域,上式中C— C单键之间电子云密度增加,反 映在丙烯C—C 单键的键长缩短 为 0.150 nm(一般烷烃的 C—C单键键长为 0.154 nm)。
