KLA的测定
水中氧传递系数KLa的测定

环境学科实验教学中心
水环境实验室
环境学科实验教学中心
微孔曝气池
水环境实验室
环境学科实验教学中心
水环境实验室
曝气系统的组成
环境学科实验教学中心
水环境实验室
氧从空气向水中转移的机理பைடு நூலகம்用双膜理论来解释。当气、液两相作相对运
动时,其接触界面两侧分别存在着气膜和液膜。氧的转移就在气、液双膜进行 分子扩散和膜外进行对流扩散的过程。
环境学科实验教学中心
水环境实验室
五、溶解氧的测定
➢ 化学法 ➢ 离子选择性电极法
环境学科实验教学中心
水环境实验室
六、实验结果与分析
1、实验数据的统计
2、利用做图法和最小二乘法求解KLa。
3、确定废水α和β值。
4、试论述KLa与各变量(如搅拌速度、空气流量、温 度)之间的关系。
环境学科实验教学中心
水环境实验室
四、实验步骤
1、测定在非稳态条件下时间对氧转移系数的影响:实验水样、 水量不变,搅拌机转速、气体流量不变,改变曝气时间,分别 测DO的变化。
2、测定搅拌对氧转移系数的影响:实验水样、水量不变、气体 流量、曝气时间不变,改变搅拌机转速,分别测DO的变化。
3、测定气体流量对氧转移系数的影响:实验水样、水量不变、 搅拌机转速、曝气时间不变,改变气体流量,分别测DO的变化。
水环境实验室
环境学科实验教学中心
水环境实验室
氧的转移速率可表示为:
dc dt
K La (CS
C)
将上式积分得:
K La
2.3 1 t2 t1
log (CS C1) (CS -C2 )
式中:KLa——氧的总转移系数(时-1); Cs——水中氧的饱和浓度(毫克/升); C——水中氧的实际浓度(毫克/升);
动态法体积溶氧系数

实验三a 动态法测体积溶氧系数kL基本原理a可称为“通单位体积发酵的氧传递系数kL气效率”,可以用来表征发酵罐的通气情况。
由于各发酵罐设备情况不同以及整个a不是常发酵过程中培养液物性的变化,kL数,通过ka的测定,就可以了解发酵过程L中氧的传递效果的好坏,对提高氧的利用率和增产节能都有着重要意义。
实验方法(1)根据电极显示值求C值:如果温度为T时,水被空气所饱和,可得到氧分压式:•Po2= (P –P H2O)Y o2空气•P――总压P H2O――水蒸气压=f(T)•Y o2 空气――空气中氧的分子分数=0.21•当总压为1atm,温度为20℃时•P o2= (1 –2.34×10-2)×0.21= 0.205(atm)•相应的浓度可根据Henry定律计算:•H = P o2/X o2*•X o2 *――液相中氧的分子分数≈水的克分子浓度= 1000/18= 55.55•温度T = 30℃时水中的亨利常数:H (T = 30℃)= 4.81×104atm•C* = 0.21×55.55/4.81×104•空气氧饱和浓度值C* = 2.42×10-4Mol/L•将电极显示值E(%饱和)换算成氧浓度为:• C = E/100×C* = E/100×2.42×10-4Mol/L•发酵液中氧的饱和浓度一般取0.21mmol.L-1•C=E/100 ×C*×P(罐绝压,atm)=EP/100×0.21mmol/L•C=E/100 ×C*×P(罐绝压,atm)=E.P/100×0.21mmol/L•C-发酵液中溶氧浓度,mmol/L•E-发酵液的相对溶氧浓度,%•P-发酵罐压力(绝压),atm•注:罐绝压=表压+大气压KLa的获得•可以运用动态测定法获得K L a值,此法就是在非稳定时用下列衡算式:•dc/dt=k L a (C*-C)-r o2•当关气时,有kLa (C*-C)=0•则,dc/dt= -r o2,转换为dc=-r o2*dt•符合y=kx方程,先通过观察暂停通气后C值值。
实验三__氧转移系数KLa的测定

实验三 氧转移系数K La 的测定一、实验目的1、掌握曝气装置的充氧机理2、学会测定曝气装置的氧总转移数K La3、掌握影响氧总转移数K La 的主要因素 二、实验原理曝气的作用是向液相供给溶解氧。
氧由气相转入液相的机理常用双膜理论来解释。
双膜理论是基于在气液两相界面存在着两层膜(气膜和液膜)的物理模型。
气膜和液膜对气体分子的转移产生阻力。
氧在膜内总是以分子扩散方式转移的,其速度总是慢于在混合液内发生的对流扩散方式的转移。
所以只要液体内氧未饱和,则氧分子总会从气相转移到液相的。
单位体积内氧转速度率为:)(C C a K dt dcs L -= (公式1)dc/dt ——单位体积内氧转速率(公斤/米3·时) K La ——液相中以浓度差为动力的总转移系数(时-1) Cs ——液相氧的饱和浓度(公斤/米3) C ——液相内氧的实际浓度(公斤/米3) 对公式1进行积分得21121log31.2t t C C C C a K s s L -⨯--=C 1、C 2为在t 1、t 2时所测得的溶解氧浓度(公斤/米3) 本实验既是对清水进行曝气充氧,从而得到K La 和Cs 。
清水(在现场用自来水或曝气池出流的清液)一般含有溶解氧,通过加入无水亚硫酸钠(或氮气)在氯化钴的催化作用下,能够把水体中的溶解氧消耗掉,使水中溶解氧降到零,其反应式为:42232221SO Na O SO Na CL C o −−→−+通过使用空气压缩机或充氧泵把空气中的氧气打入水体,使水体系的溶解氧逐渐提高,直至溶解氧升高到接近饱和水平。
三、实验设备和试剂1、氧传递系数K La 测定实验装置1套;2、空气压缩机或充氧泵1台;3、秒表1只;4、1升量筒、长玻棒、虹吸管、洗耳球各1只;5、无水亚硫酸钠1瓶;6、氯化钴1瓶;7、溶解氧测定装置(DO 测定仪)1台或碘量法测定溶解氧装置一套(含相关试剂); 8、台式天平(0.1g )1个。
KLA的测定
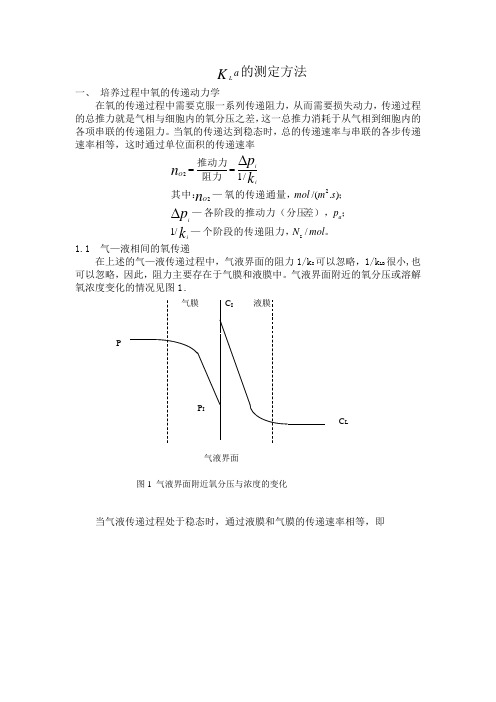
a K L的测定方法一、 培养过程中氧的传递动力学在氧的传递过程中需要克服一系列传递阻力,从而需要损失动力,传递过程的总推力就是气相与细胞内的氧分压之差,这一总推力消耗于从气相到细胞内的各项串联的传递阻力。
当氧的传递达到稳态时,总的传递速率与串联的各步传递速率相等,这时通过单位面积的传递速率。
个阶段的传递阻力,—;差),各阶段的推动力(分压—;氧的传递通量,—其中:阻力推动力mol N p s m mol k p n k p n iaiO iiO //1)./(/1s222∆∆==1.1 气—液相间的氧传递在上述的气—液传递过程中,气液界面的阻力1/k I 可以忽略,1/k LB 很小,也可以忽略,因此,阻力主要存在于气膜和液膜中。
气液界面附近的氧分压或溶解1。
当气液传递过程处于稳态时,通过液膜和气膜的传递速率相等,即;/);../(;/);../(/;/;/;;;/1/1/1/1223**33I**2C s m s m mol s m s m mol m mol m mol m mol k p k K p K p C p C P C p p p p p p K C C k C C K Pp k p p n LaG LaG aLLaia i aLLL L I GG iO 液膜传质系数,—气膜传质系数,—传质系数,以氧浓度为推动力的总—总传质系数,以氧分压为推动力的的—;平衡的液相氧浓度与—平衡的氧分压与—;液相主体氧浓度—气液界面氧浓度—气液界面氧分压,—气液界面氧分压,—气相主体氧分压,—其中:-=-=-=-= 根据亨利定律HC p =其中H 是亨利常数。
对于难容气体(如氧),气膜传递阻力与液膜传递阻力之比忽略不计,即1/Hk G <<1/k L ,因此k L ≈K L 。
在单位体积培养液中,氧的传递速率为()。
比表面积,—传递速率,单位体积培养液中的氧—其中:323*/);./(OTR OTR m m a s m mol a C C K LL -=通常将K L 与a 合并在一起,作为一个参数处理,称为容量传递系数(S -1)。
动态法测Kla的原理

动态法测Kla的原理
动态法测Kla(Kinetic Laser Absorptiometry)是一种用于测量骨密度的方法,其原理基于骨骼对激光的吸收能力。
该方法使用一束激光照射在人体的骨骼表面上,然后通过测量激光在骨骼中传播时的强度变化,进而计算出骨骼的密度。
激光束在骨骼中传播时会遇到两个主要的过程,即散射和吸收。
散射是指激光在骨骼组织中反射和散射的现象,而吸收是指激光在骨骼组织中被吸收的现象。
基于这两个过程,动态法测Kla通过测量被吸收的激光强度,可以推算出骨骼中的吸收系数,从而得到骨骼的密度。
动态法测Kla的优势在于它可以在短时间内对全身进行扫描,不需要使用射线,并且能够提供高分辨率的骨密度测量结果。
然而,它也有一些限制,例如对肌肉和软组织的影响较大,对于不同部位骨骼的测量结果可能存在一定的误差。
总的来说,动态法测Kla是一种有效的骨密度测量方法,可以用于评估骨质疏松症等骨骼相关的疾病。
Kla测定发

注意事项:将Na2SO3溶液用移液管放入碘液时,靠近碘液面操作,以防 氧化。
Na2S4O6(连四硫酸钠 )+2NaI
空白样滴定消耗的Na2S2O3体积ml 样液滴定消耗的Na2S2O3体积ml
V2之所以大于V1,空白样没有第一步反应。
⊿V即样液滴定多消耗的那部分的Na2S2O3实际上对应的是第一步与氧 反应的所消耗的Na2SO3 样液滴定比空白滴定多消耗1mol Na2S2O3 样液第二步多剩余1/2mol I2,
如果加入过量的Na2SO3以Cu2+为催化剂:
2Na2SO3+O2
Na2SO3+I2+H2O
2Na2SO4
Na2SO4+2HI
反应剩余的Na2SO3与过量的碘作用: 再用标准的Na2S2O3 溶液滴定剩余的碘以淀粉作指示剂:
2Na2S2O3+I2
⊿V=V2-V1 V1 V2
KLa —— 体积溶氧系数,1/s、1/h ; C* —— 相应温度、压强条件下饱和溶氧浓度, mol/m3; 浓度差
由式(1):体积溶氧速率取决于
Kla系 数
罐的条件 操作参数
单位体积发酵液的氧的传递系数kL a可称为“通气效 率”,可以用来表征发酵罐的通气情况。 kL a受 通气量——Vg、 通气速率——vs、
搅拌轴功率——Pg等设备条件影响。
通过kL a的测定: 了解发酵罐氧的传递效果,为保证发酵过程正常进行 提供依据。
实验原理:详细见《生物工程设备》第二章通气发酵设备 第一节 二、机械搅拌发酵设备的通气与溶氧传质 3.体积溶氧系数的测定 新版p36
在以Cu2+为催化剂时,SO32-的氧化反应非常快,远大于氧的溶解速度。氧一旦溶 解于液相中,立即与SO32-反应。反应液中的氧浓度为零。此时氧的传递速率最大。
实验三__氧转移系数KLa的测定说课讲解

实验三__氧转移系数K L a的测定实验三 氧转移系数K La 的测定一、实验目的1、掌握曝气装置的充氧机理2、学会测定曝气装置的氧总转移数K La3、掌握影响氧总转移数K La 的主要因素 二、实验原理曝气的作用是向液相供给溶解氧。
氧由气相转入液相的机理常用双膜理论来解释。
双膜理论是基于在气液两相界面存在着两层膜(气膜和液膜)的物理模型。
气膜和液膜对气体分子的转移产生阻力。
氧在膜内总是以分子扩散方式转移的,其速度总是慢于在混合液内发生的对流扩散方式的转移。
所以只要液体内氧未饱和,则氧分子总会从气相转移到液相的。
单位体积内氧转速度率为:)(C C a K dt dcs L -= (公式1) dc/dt ——单位体积内氧转速率(公斤/米3·时) K La ——液相中以浓度差为动力的总转移系数(时-1) Cs ——液相氧的饱和浓度(公斤/米3) C ——液相内氧的实际浓度(公斤/米3) 对公式1进行积分得21121log31.2t t C C C C a K s s L -⨯--=C 1、C 2为在t 1、t 2时所测得的溶解氧浓度(公斤/米3) 本实验既是对清水进行曝气充氧,从而得到K La 和Cs 。
清水(在现场用自来水或曝气池出流的清液)一般含有溶解氧,通过加入无水亚硫酸钠(或氮气)在氯化钴的催化作用下,能够把水体中的溶解氧消耗掉,使水中溶解氧降到零,其反应式为:42232221SO Na O SO Na CL C o −−→−+通过使用空气压缩机或充氧泵把空气中的氧气打入水体,使水体系的溶解氧逐渐提高,直至溶解氧升高到接近饱和水平。
三、实验设备和试剂1、氧传递系数K La 测定实验装置1套;2、空气压缩机或充氧泵1台;3、秒表1只;4、1升量筒、长玻棒、虹吸管、洗耳球各1只;5、无水亚硫酸钠1瓶;6、氯化钴1瓶;7、溶解氧测定装置(DO 测定仪)1台或碘量法测定溶解氧装置一套(含相关试剂);8、台式天平(0.1g )1个。
水中氧传递系数KLa的测定

环境学科实验教学中心
水环境实验室
环境学科实验教学中心
微孔曝气池
水环境实验室
环境学科实验教学中心
水环境实验室
曝气系统的组成
环境学科实验教学中心
四、实验步骤
1、测定在非稳态条件下时间对氧转移系数的影响:实验水样、 水量不变,搅拌机转速、气体流量不变,改变曝气时间,分别 测DO的变化。
2、测定搅拌对氧转移系数的影响:实验水样、水量不变、气体 流量、曝气时间不变,改变搅拌机转速,分别测DO的变化。
3、测定气体流量对氧转移系数的影响:实验水样、水量不变、 搅拌机转速、曝气时间不变,改变气体流量,分别测DO的变化。
水环境实验室
氧从空气向水中转移的机理可用双膜理论来解释。当气、液两相作相对运
动时,其接触界面两侧分别存在着气膜和液膜。氧的转移就在气、液双膜进行 分子扩散和膜外进行对流扩散的过程。
氧的转移速率可表示为:
dc dt
K La (CS
C)
将上式积分得:
K La
2.3 t2
1 t1
log (CS C1) (CS 教学中心
水环境实验室
水样:无氧水; 配置:自来水加亚硫酸钠
配制而成。
水环境实验室
实验装置工艺流程 环境学科实验教学中心
1、高位水槽 2、自控调温加热器 3、气泵 4、电动机 5、调速控制器 6、混合反应器 7、微孔曝气头 8、取样口 9、气体流量计 10、空气管 11、进水管 12、进水阀门 13、排水阀门
水环境实验室
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a K L
的测定方法
一、 培养过程中氧的传递动力学
在氧的传递过程中需要克服一系列传递阻力,从而需要损失动力,传递过程的总推力就是气相与细胞内的氧分压之差,这一总推力消耗于从气相到细胞内的各项串联的传递阻力。
当氧的传递达到稳态时,总的传递速率与串联的各步传递速率相等,这时通过单位面积的传递速率。
个阶段的传递阻力,—;差),各阶段的推动力(分压—;氧的传递通量,—其中:阻力推动力mol N p s m mol k p n k p n i
a
i
O i
i
O //1)./(/
1s
2
2
2∆∆== 气—液相间的氧传递
在上述的气—液传递过程中,气液界面的阻力1/k I 可以忽略,1/k LB 很小,也可以忽略,因此,阻力主要存在于气膜和液膜中。
气液界面附近的氧分压或溶解氧浓度变化的情况见图1。
当气液传递过程处于稳态时,通过液膜和气膜的传递速率相等,即
;
/);../(;/);../(/;
/;/;;;/1/1/1/12
2
3
*
*
3
3
I
*
*
2
C s m s m mol s m s m mol m mol m mol m mol k p k K p K p C p C P C p p p p p p K C C k C C K P
p k p p n L
a
G L
a
G a
L
L
a
i
a i a
L
L
L L I G
G i
O 液膜传质系数,—气膜传质系数,—传质系数,以氧浓度为推动力的总—总传质系数,以氧分压为推动力的的—;
平衡的液相氧浓度与—平衡的氧分压与—;液相主体氧浓度—气液界面氧浓度—气液界面氧分压,—气液界面氧分压,—气相主体氧分压,—其中:-=-=-=-
= 根据亨利定律
HC p =
其中H 是亨利常数。
对于难容气体(如氧),气膜传递阻力与液膜传递阻力之比忽略不计,即1/Hk G <<1/k L ,因此k L ≈K L 。
在单位体积培养液中,氧的传递速率为
(
)。
比表面积,—传递速率,单位体积培养液中的氧—其中:323*
/);./(OTR OTR m m a s m mol a C C K L
L -= 通常将K L 与a 合并在一起,作为一个参数处理,称为容量传递系数(S -1)。
二、 影响a K L 的因素
气液比表面积的测定比较困难,通常将K L 与a 合并在一起,作为一个参数处理。
操作条件的影响
对于带有机械搅拌的通气培养装置,搅拌器对物质的传递有几个方面的作用:(1)将通入培养液的空气分散成细小的细胞,防止小气泡的凝并,从而增大
气液相的接触面积;(2)搅拌作用是培养液产生涡流,延长气泡在培养液中的停留时间;(3)搅拌造成液体的湍动,减小气泡外滞留液膜的厚度,从而减小传递过程的阻力;(4)搅拌作用是培养液的成分均匀分布,使细胞均匀地悬浮在培养液中,有利于营养物质的吸收和代谢物的分散。
液体性质的影响
液体的性质,诸如密度、粘度、表面张力、扩散系数等等的变化,都会对K L a带来影响。
在同样的发酵罐中和同样的操作条件下,进行通气搅拌,如果液体的性质有较大的不同,则K L a也不同。
液体的粘度对K L a影响也很大。
液体的粘度增大时,由于滞留液膜的厚度增加,传质阻力也增加。
同时粘度也影响扩散系数。
其他因素
(1) 表面活性剂培养液中,消沫用的油脂等是具有亲水端和疏水端的表面活性物质,他们分散在气液界面,增大传递阻力,是K L下降。
(2)离子强度在电解质溶液中生成的气泡比水中的小得多,因而有较大的比表面积。
在同一气—液接触反应器中,在同样的操作条件下,电解质溶液的K L a比水大,而且随电解质浓度的增加,K L a也有较大的增加。
(3)细胞培养液中细胞浓度的增加,会使K L a变小。
三K L a的测定
亚硫酸氧化法
(1)适用情况本方法存在着亚硫酸与氧气的反应,并且反应速率很快,因此本方法只适用于非培养情况下测定反应器的氧传递速率。
(2)原理在反应器中加入含有铜离子或钴离子为催化剂的亚硫酸溶液,进行通气搅拌,亚硫酸钠与溶解氧生成硫酸钠。
由于反应进行得很快,反应速率由气液相的氧传递速度控制,而与亚硫酸钠浓度无关(在—m3)。
用碘量法测定亚硫酸消耗的速率,即可求得氧传递速率OTR。
因为氧化反应速度很快,液相氧浓度C L=0,所以
P K C K a a L G *
OTR ==
从而可以求出K L a 或K G a 。
(3)缺点及改进方法
自1944年首先采用亚硫酸氧化法研究通气搅拌罐的氧传递特性以来,这种方法得到了广泛应用,但是亚硫酸钠溶液与实际的培养液往往在物理性质上有很大的区别,不能很好的模拟培养液的情况。
并且,在计算K L a 是有一个问题,就是亚硫酸钠溶液的C*无法测定,许多文献就以K G a 或K D 表示传递系数。
Zlokarnik 指出氧气在m 3的亚硫酸钠中和m 3硫酸钠溶液中溶解度相同,建议在亚硫酸钠溶液中的溶解度可用在同样的硫酸钠溶液中的溶解度代替。
物料衡算(稳态法)
对培养液中的物料进行衡算,有
(
)
r a C C K dt
dC
L L --=*
L
*
处于稳态时,0L =dt
dC ,于是
(
)
C C K L L r a -=*
/
摄氧率可以有进气排气氧分压变化求出。
对于理想混合的反应器,C*为与排气氧中氧分压平衡的的氧浓度。
如果已知培养液中氧的溶解特性,测定了排气氧分压和液相氧浓度,即可求出K L a 。
在大型发酵罐中一般不能获得理想混合,这时可用平均推动力(C*—C L )m 代替(C*—C L ):
()
()()度。
氧分压平衡的液相氧浓分别代表与进气及排气
和其中:C C C C C C C C C C L
L
L
L
m
*
o *
i *
o *
i
*
o
*i
ln L *C C -----=
-
动态法
停止向培养基通气,根据培养液中溶氧浓度变化速率可以求出摄氧率。
当液
体的溶氧浓度下降到一定程度时(不应低于临界溶氧浓度),恢复通气,则培养液中溶氧浓度逐渐升高,最后恢复到原先的水平(图2)。
则*式可以改写为
C dt dC K r a L *L L 1
C +⎪⎪⎭⎫ ⎝⎛+⎪⎪⎭⎫ ⎝
⎛
-=
根据恢复通气后溶解氧变化的曲线,用图解法求出与一定溶解氧浓度对应的dt
dC L
(即曲线的斜率)
,将C L 对r
dt dC L
+作图可以得到一直线,其斜率为-1/ K L a ,
在C L 轴上的截距为C*.
动态法测定K L a 时,只需测定一个变量——溶解氧浓度CL 随时间的变化,因此对于安装有快速响应复膜氧电极的发酵罐,可以从记录仪描绘的溶解氧变化曲线,非常方便的求出K L a 。
对于非培养系统,可以用氮气赶去培养液中的溶解氧,然后通入空气,记录溶解氧随时间的变化,这时因r=0,*式就可以简写成
(
)
C C K dt
dC
L L a -=*
L
当t=0时C L =0上式积分后得到
at K C
C C
L L
-=-*
*
ln
将(C*-C L )/C*对时间t 在半对数坐标上作图,可得一直线,它的斜率为-1/ K L a 。
由于不用图解求dt
dC L ,所以更加方便。
