第八章 饱和碳原子上的亲核取代反应
亲核取代

R C C X R C C X
R C C R+ C C C+ C
+
R C+ C
R
R 为H, alkyl, aryl时,易发生重排,并可能 形成非经典碳正离子。 当R为R2N、Ph、R、CO2-、Br等基团时, 易发生邻基参与反应。
A Unified Theory of Aliphatic Nucleophilic Substitution
C…X
C…Y
C+ Y+Reaction coordinate
SN2反应为bimolecular反应,表现为二级 动力学方程,动力学方程为: rate=k[Nu][RX] 但是,观察不到二级动力学并不意味着反应不 按双分子基元反应进行,如溶剂解反应。 SN1反应为非基元反应,通常碳正离子的 形成为rate-determining:
Rate = k[HO-][R3N+R']
CH3 HOH3C N+ CH3 CHPh2 Ph2CHOH + N(CH3)3
Rate = k[Ph2CHN(CH3)3+]
SN2(Substitution Nucleophilic Bimolecular) SN1(Unimolecular)
[Y…C…X]
k1k2 [RX][Nuc-] k-1
虽然为二级动力学反应,但不是SN2反应。例如 Ph3CHCl在苯中与甲醇的反应。不过这种情况 很少。
在上述历程中,关键的问题是离去基团的离去 和亲核试剂的进攻的时机(timing)。在溶剂解反 应中,这一问题由于溶剂的亲核参与而变得更 为复杂。为了评价溶剂的电离能力,Grunwald & Winstein 用t-BuCl的溶剂解反应为基准,建立 了溶剂电离能力的线性自由能关系。
亲核取代

CH 3 CH 3 C CH 2Br CH 3
C2H5O SN1
-
CH 3 CH 3 C CH 2 CH 3 1° C
+
重排
CH 3 CH 3 C CH 2 CH 3 C 3°
+
OC2H5 CH 3 CH 3 C CH CH 3
-H
小结SN1的特点: ①分步进行 ②决速步骤为C-X解离,单分子反应,有 v=k[RX] ③有C+中间体,构型保持与构型转化机率相同 ④常伴有C+的重排
相对速度 150
1
0.01
0.001
因而,按SN2历程进行反应时,卤烷活性次序一般为: CH3X > 伯卤烷 > 仲卤烷 > 叔卤烷.
2015年12月9日 15
SN2反应中的空间效应
立体效应:碳原子上的甲基能阻碍亲核试剂的 接近,提高了反应的活化能而使反应速度降低. 电子效应:碳原子上的氢被烷基取代后, 碳原 子上的电子云密度将增加 ,也不利于亲核试剂对反 应中心的接近. 一般认为:立体效应的影响大于电子效应.
R1 R1 C R2 R3 Br
a
C R2 R3 HO
b
R1 HO C R2 R3
a 构型转化
+
R1 C OH R2 R3
b 构型保持 外消旋体
2015年12月9日
7
(2)特点二:反应有重排。
C2H5OH
CH 3 CH 3 C CH 2OC2H5 CH 3 CH 3
C2H5OH CH C CH 2 CH 3 3
>
RCH2
>
CH3
SN1反应的速度是:
R3C-X R CH-X CH2=CHCH2-X > 2
脂肪族饱和碳原子上的亲核取代反应、消除反应

根据反应机理和产物的不同,可以将亲核取代反应和消除反应分为多种类型,如 SN1、SN2、E1、E2等。
反应机理概述
亲核取代反应机理
亲核取代反应可以按照SN1或SN2机理进行。在SN1机理中 ,碳正离子首先形成,然后亲核试剂进攻碳正离子,形成产 物。在SN2机理中,亲核试剂直接从背面进攻碳原子,同时 发生取代反应。
要点二
不同点
亲核取代反应是进攻一个亲核试剂到碳原子上,而消除反 应是进攻一个水分子到碳正离子中间体上;亲核取代反应 的产物是稳定的,而消除反应的产物是不稳定的;亲核取 代反应的反应机理是形成中间体,而消除反应的反应机理 是形成碳正离子中间体。
THANKS
感谢观看
详细描述
E2反应需要离去基团具有较弱的酸性,如醇和酯等。在反应过程中,离去基团与碳原子上的两个氢原 子结合形成不饱和键,同时释放一个氢分子。由于是双分子反应,E2反应的速率主要取决于底物浓度 和催化剂的存在。
E1cb反应
总结词
E1cb反应是一种特殊的单分子消除反应,其中离去基团和碳原子上的一个非邻近氢原 子结合形成不饱和键。
详细描述
E1cb反应需要离去基团具有较强的酸性,如羧酸和酯等。在反应过程中,离去基团与 碳原子上的一个非邻近氢原子结合形成不饱和键,同时释放一个氢离子。由于是单分子
反应,E1cb反应的速率主要取决于底物浓度。
04
CATALOGUE
脂肪族饱和碳原子上的亲核取代反应与消 除反应的比较
反应机理比较
亲核取代反应
应用领域比较
亲核取代反应
在有机合成中广泛应用于碳-碳键的 形成,如酯化、水解等反应。
消除反应
在有机合成中常用于制备不饱和键, 如醇的脱水、卤代烃的脱卤素等反应 。
取代反应机理及应用

从而使产物具有不同程度的旋光性,而某些情况下还能得到构型保持的产物,例如:
5
以上几种情况到底发生哪一种?它与反应底物的结构、 试剂的种类与浓度以及反应环 境等因素有关。如果生成的碳正离子十分稳定,则生成外消旋化的产物,如果生成的碳正 离子不稳定,在离去基团(L)还未完全离开之前,亲核试剂(Nu)就开始进攻中心碳原子,由 于 L 的屏蔽效应,妨碍了 Nu 从 L 离去方向进攻中心碳原子,Nu 只能从 L 的背面进攻中 心碳原子,所以得到的产物往往是外消旋化的同时,还得到部分构型转化的产物。外消旋 化产物与构型转化产物二者的比例取决于碳正离子的稳定性和亲核试剂的浓度, 如果碳正 离子较稳定,亲核试剂的浓度较低,则产物外消旋化所占比例就高,反之,则外消旋化所 占比例就低。例如 Ph-CHClCH3 在不同条件下的水解反应,有如下数据: 虽然在实际的 SN1 反应中,往往只发生部分外消旋化,但这并不影响外消旋化作为 SN1 反应机理的证据, 至于在 SN1 反应中得到构型保持的产物, 则是由于邻基参与的结果。
6
该反应显然是通过 SN1 反应机理先离解成一级碳正离子,但一级碳正离子很不稳定, 立即发生重排,得到比较稳定的三级碳正离子,然后3)3C++Br-
如果外加一些与离解的离子相同的离子,例如 Br-离子,就会使平衡向左移动,这样对叔 丁基溴的离解起到了抑制作用,使反应速度减慢,这种作用叫做同离子效应,同离子效应 是反应的一个特征。 1.3 桥头碳上的 SN1 反应 对桥头碳上带有潜离去基团的化合物进行动力学研究,也能为 SN1 机理提供证据[3]。 例如, 将 1-氯代阿朴莰烷在 80%乙醇和 30%KOH 溶液中煮沸 2h 或者在硝酸银的乙醇水溶 液中煮沸 48h,都不发生反应,而类似的开链体系化合物则很容易反应。这是因为在 SN1 反应中反应底物首先离解成碳正离子,碳正离子为平面 (或近乎平面)结构,而桥头碳原子 上因空间效应的阻碍,它不能或很难伸展成平面结构,因此桥头碳正离子很难形成,以致 使该化合物在条件下不能发生反应,这就从反面为 SN1 反应机理提供了证据,见图 2:
有机化学基础知识点碳原子的亲核取代反应

有机化学基础知识点碳原子的亲核取代反应亲核取代反应是有机化学中重要的反应类型之一。
在这篇文章里,我将介绍碳原子的亲核取代反应的基础知识点。
亲核取代反应是一种化学反应,涉及到一个亲核试剂攻击一个电子云密度较低的碳原子,并将其取代。
这种反应可以发生在饱和碳原子上,也可以在环上的碳原子上发生。
1. 亲核试剂的选择亲核试剂是亲核取代反应中至关重要的一部分。
常见的亲核试剂包括卤代烷、醇、胺等。
选择适当的亲核试剂可以有效地促进反应的进行。
2. 亲核试剂的攻击在亲核取代反应中,亲核试剂攻击碳原子的位置非常重要。
碳原子可以通过两种方式进行亲核攻击:SN1和SN2机理。
- SN1机制:这是一种两步反应,首先,亲核试剂离去一个离子,形成一个带电的中间体。
然后,亲核试剂攻击中间体上的位点,取代离去的离子。
- SN2机制:这是一种一步反应,亲核试剂直接攻击碳原子,并同时取代离去的基团。
3. 碳原子的离去基团在亲核取代反应中,碳原子上的离去基团是影响反应速率和反应机理的重要因素。
常见的离去基团包括卤素原子、氨基和醇基等。
不同的离去基团会导致不同的反应速率和产物选择。
4. 反应条件的影响亲核取代反应的条件也会对反应的进行产生影响。
常见的反应条件包括溶剂的选择、温度和反应时间等。
选择合适的反应条件可以提高反应的收率和选择性。
5. 反应机理的解释了解亲核取代反应的机理对于理解反应过程和预测产物是非常重要的。
通过观察亲核试剂攻击碳原子的位置、反应速率以及产物选择等因素,可以确定反应机理。
在总结中,亲核取代反应是有机化学中基本的反应类型之一。
了解碳原子的亲核取代反应的基础知识点可以帮助我们理解反应机理、预测产物以及进行有机合成的设计。
当然,亲核取代反应还有很多细节和应用等待我们深入探索和学习。
亲核取代
CH2C6H5 C CH3 H OH TsCl
CH2C6H5 C CH3 H O H Cl
O S O Me
A R
R
AcO B
CH 2 C 6 H 5 AcO C H
S
CH 2 C 6 H 5 OH HO C H
S
CH 3
C
CH 3
H Br H OH CH3 CH3 H H
Br H CH3 CH3 Br CH3 CH3 H Br H CH3 Br
H Br
-
CH3
OH
H Br H OH CH3 CH3 H H
Br H CH3 CH3 Br CH3 Br H CH3 Br
-
H CH3 Br H
CH3
OH
内消旋体
第
六
章
饱和碳原子上的亲核取代反应
NMe 3 NMe 3
R
R
第
六
章
饱和碳原子上的亲核取代反应
Aliphatic Nucleophilic Substitution
如:
第
六
章
饱和碳原子上的亲核取代反应
Aliphatic Nucleophilic Substitution
二. 反应机理与反应中的立体化学 1 SN1与SN2机理 (1).单分子亲核取代(SN1)
CH 2 ph CH 3 a=( + OAc B a=( CH
33
o
OH )
TsCl A CH 2 ph
CH 2 ph CH 3 CH OTs a=( + 31.1o ) OH C CH 3 a=( CH 2 ph CH
有机化学:第八章 sp3杂化碳原子的亲核取代反应

31
底物中烃基结构的影响
表8-4 SN2反应过渡态和SN1活性中间体结构特点对比
SN2反应过渡态 电荷离域
中心碳原子空间较拥挤
SN1活性中间体 电荷定域
中心碳原子空间不拥挤
32
应取决于过渡态结构与能量,而SN1反应则取决于活性 中间体的结构与能量。
29
离去基团的影响
反应活性:碘代烷 > 溴代烷 > 氯代烷 > 氟代烷 因为不同的卤素负离子碱性强弱不同。
FH
pKa
3.2
Cl H -7
Br H -9
IH -10
不同类型化合物进行亲核取代反应的活性顺序如 下:
磺酸酯,碘代烷 > 溴代烷 > 氯代烷 > 氟 代烷 >> 醇 > 醚
一步协同反应双分子机理sn215亲核取代反应的两种机理?双分子亲核取代反应sn2?单分子亲核取代反应sn1nucx????cx????cxcnucnu协同同分步步碳正离子中间体cnux16两种不同的亲核取代反应机理nucx????cnuxcx????cxcnucnu?动力学二级反应?双分子反应?反应过渡态能量高低影响活性?动力学一级反应?单分子反应?活性中间体能量高低影响活性?立体化学特征
3
7. 质子性溶剂SN2和SN1反应分别有何影响? 8. 亲核性与原子半径有什么关系?, 9. SN2反应进行的方向与碱性强弱有何关系? 10. SN1 反应中,亲核试剂对反应速率有无影 响? 11. 亲核反应的两种反应历程中,那种易发生 碳正离子重排产物,那种发生构型反转? 12. 什么是亲核取代反应中的邻基参与效应?
影响亲核取代反应的因素

影响亲核取代反应的因素摘要亲核取代反应是有机化学中一类重要的反应,饱和碳原子上的亲核取代反应可按S N1和S N2两种不同历程进行。
亲核取代反应的两种历程,在反应中同时存在,相互竞争。
对同一反应物来说,在不同的反应条件下反应速率是不同的;在相同的条件下,不同的反应物的活性也不同。
本文讨论了影响亲核取代反应的因素,并总结了某些规律。
关键词亲核取代反应速率影响因素卤代烃的亲核取代反应是一类重要的反应。
由于这类反应可用于各种官能团的转变以及碳碳键的形成,因此在有机合成中具有广泛用途。
本文将以卤代烃的亲核取代反应为例,讨论影响亲核取代反应的因素,即亲核取代反应的反应活性。
大量研究表明,亲核取代反应的活性与反应物的结构(包括烃基和离去基团的结构)、亲核试剂的亲核性和溶剂的性质等因素都有密切的联系。
1反应物的结构1.1烃基的结构烃基的影响体现在两个方面,一个是电子效应,另一个是空间(立体)效应。
一般来说,烃基的电子效应对S N1反应的影响更大,烃基的空间效应对S N2反应的影响更显著。
1.1.1在S N2反应中,烃基的空间效应影响占主导地位,α—碳或β—碳上支链增加,阻碍了亲核试剂从离去基团的背面进攻,且会造成过渡态拥挤程度增加,降低了过渡态的稳定性,使反应速率明显下降。
例如,不同的烷基发生S N2反应的平均相对速度如下:R-CH3-CH3CH2-(CH3)2CH-相对速度30 1 2.5⨯10-2卤代烃按S N2机理进行的活性次序是:烯丙型、苄基型、甲基卤代烷>伯>仲>叔>乙烯型、芳卤、桥头卤代烷在烯丙卤、苄卤的S N2反应中,当亲核试剂进攻α-碳原子时,其反应过渡态应该有p轨道的重叠,旁边的碳碳双键能帮助它分散电荷,起稳定作用。
在乙烯型、芳卤的S N2反应中,因其分子中存在着p-π共轭,使碳卤键键长缩短,键能增加,卤原子不易离去。
桥头卤代烷因桥环的立体障碍,亲核试剂不能从背面进攻α-碳原子,故不易发生S N2反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
取代反应是指化合物的原子或原子团被其它原子或原子团 所取代的反应。
(1)亲核取代 (2)亲电取代 (3)游离基取代
亲核取代反应的通式:
中心碳原子(饱和碳原子)
Nu- + C X
Nu C + X-
亲核试剂
底物
产物
离去基团 L
亲核试剂 (Nu):带负电荷的离子或带未共用电子对的中性分子。
底物:
反应中接受试剂进攻的物质。
HH δNu C δL
R'
T
协同反应
R'CH2 Nu +LSN2反应 的能量变 化曲线
8
S N 2 反应机理:
Nu
C
L
Nu
C
Nu
C
L
过渡态为线性结构
L
Nu
C
L
在过渡态中,亲核试剂的孤对电子所占有的轨道和中心碳原子的 p轨 道交盖的程度,与离去基团和中心碳原子的 p轨道的交盖程度相同。
9
• SN2机理的溶剂解反应是双分子历程,但实验测得的结果是动力学一级,
• 当Nu是溶剂时,所发生的亲核取代反应称为溶剂解反应 (Solvolysis),属于 (1) 型。
• 根据作用物(底物)、亲核试剂、离去基团和反应条件的 不同,脂肪族亲核取代反应可以按不同的历程进行。两种极 限的情况是SN1和SN2历程。
4
二、 亲核取代机理
1、单分子亲核取代 Unimolecular Nucleophilic Substitution
第八章 饱和碳原子上的亲核取代反应
(Aliphatic Nucleophilic Substitution)
1 亲核取代反应类型 2 亲核取代反应机理 SN1机理SN2机理 3 亲核取代反应的立体化学 4 影响反应活性的因素 5 邻基参与反应 6 分子内亲核取代反应 7 亲核取代反应的应用
1
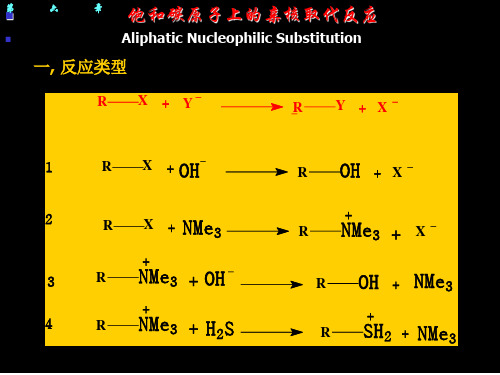
一、亲核取代反应类型
实验二:
n-C6H13H
128I- +
CI
CH3
翻转
C6H13 HO C H
CH3
(S) - (-) - 2 - 辛醇 [α]25D= -9.90°
对映体的纯度=100%
128I
HC6H13-n
转化(消旋化) (消旋化产物)
⑴ 解离的正负离子形成紧密的离子对,整个离子对被溶剂化。
⑵ 溶剂介入离子对后,正负离子被溶剂隔开。
⑶ 离解的离子为自由离子。
亲核试剂可以进攻四种状态的底物,从而得到不同的产物。
11
机理相关
SN2机理:
Nu- + C L
δ
Nu
C
Lδ
R L +Nu- R Nu + L-
( SN1)
反应分两步进行:
ν = k1 R L
第一步 正碳离子的生成:
R L慢
δR δL
动力学上为一级反应
R+ + L-
第二步 亲核试剂进攻正碳离子:
R+ + Nu- 快 R Nu
• 第一步是决定反应速率的一步。 5
SN1反应的能量变化曲线
例如: 二苯基氯甲烷在丙酮的水解反应:
10
3、离子对机理 介于SN1 与 SN2 之间的机理,建立在SN1机理基础之上。
底物的解离成正碳离子是经几步完成的,形成不同的离子对:
R L 离子化
Nu SN 2
构型翻转
三个阶段:
R+L- 溶剂介入 R+ L-
R+ + L-
离解的离子
Nu 紧密离子对
Nu 溶剂介入 离子对
Nu SN 1
翻转(主要)
Nu C
Walden转化
由于试剂从离去基团的背后进攻中心碳原子,所以产 物发生构型转化-Walden转化。
Nu:
L
Nu
+ L-
12
SN2的立体化学
过渡态
构型相反 • 瓦尔登转化
13
实验一:
构型
H
C6H13 C Br
NaOH SN 2
CH3
(R) - (-) - 2 – 溴辛烷
[α]25D= -34.25° 对映体的纯度=100%
1
3
• 20世纪30年代起,Ingold C. K. 和Hughes E. D. 在亲核取代反 应的理论研究中做了大量的工作。
• 饱和碳原子上的亲核取代反应是脂肪族化合物的主要反应, 也是研究的最多、最系统的有机反应。对脂肪族亲核反应的 研究,不仅在理论上有重要的意义,在有机合成上也有实际 意义。
离去基团: 带着一对电子离去的分子或负离子。 2
2
3
亲
核
⑴ 底物为中性,亲核试剂带着一对孤对电子:
取 代 反
R L + Nu:
RNu+ + L-
Bu3P + CH3CH2I
Bu3P+ CH2CH3+ I-
应
⑵ 底物为中性,亲核试剂带有负电荷:
R L +Nu- R Nu + L-
PhCH2Cl + CN- PhCH2CN+Cl-
4
和
类 型
反 应
和
前
后
有反
电应
荷前
⑶ 底物带有正电荷,亲核试剂带有孤对电子:
变后 化无
R L+ + Nu
R Nu++L
电 但荷
(CH3)3S++ (CH3)3N
(CH3)4N++(CH3)2S
两变 者化
相
⑷ 底物带有正电荷,亲核试剂带有负电荷:
反类
RL++Nu- R Nu +L
型
CH3O+ H2+ Cl- CH3Cl +H2O
ν = k1 R L
因为亲核试剂(溶剂)大大过量,不显示浓度变化。这种现象在动力学上 称为“假一级”。
• Eschenmoser等人通过实验,对SN2反应的过渡态必须是线性结构提供了强 有力的证据:
SO2
O base
CH2 CH3 Ts
SO2 O CH3
CH Ts
SO3
CH CH 3 Ts
交叉实验证明,带阴离子的碳进攻另一分子的甲基,而不是同一分子中附近 的甲基,即反应是分子间进行,而不是分子内。
Ph2CH
Cl
丙酮 慢
Ph2C+H + Cl
Ph2C+H
H2O -H+
Ph2CH
OH
按SN 1 机理进行反应的体系: 叔卤代烷及其衍生物和被共轭
体系稳定的仲卤代烃及其衍生
物。
6
2、双分子亲核取代 Bimolecular Nucleophilic Substitution ( SN 2)
动力学研究表明,有一类亲核取代反应的速率与底物的 浓度和试剂的浓度同时相关:
R L +Nu- R Nu + L-
ν = k[R L][Nu]
二级反应
SN2 机理表现为二级动力学,对反应物和亲核试剂都是 一级。这种反应物和亲核试剂两种分子都参与了过渡态的过 程叫双分子亲核取代反应,记为SN2。
7
其反应机理为:
Nu- + R'CH2 L
亲核试剂从离去基 团的背面接近中心碳原 子,与此同时离去基团 也正在逐步地离开底物 分子。新键的形成与旧 键的断裂是同时发生的, 旧键断裂时所需的量, 是由新键形成所放出的 能量提供的。两者达到 平衡时,体系能量高。 其状态为过渡态 T.
