1有机化学 下(13碳负离子)习题讲评
13C-NMR

13C-核磁共振波谱的特点
• ②给出不与氢相连的碳的共振吸收峰。季碳、C=
O、C=C=C、C≡C、N=C=O、C≡N等基团中的碳不与 氢直接相连,从氢谱中得不到直接的信息,只能靠分子式 及其对相邻基团值的影响来判断。而在碳谱中均能给出各 自的特征吸收峰。
整理ppt
13C-核磁共振波谱的特点
整理ppt
4. 门控去偶
质子噪声去偶失去了所有的偶合信息,偏共振去偶也 损失了部分偶合信息,而且都因NOE不同而使信号的相 对强度与所代表的碳原子数目不成比例。为了测定真正 的偶合常数或做各类碳的定量分析,可以采用门控去偶 或反转门控去偶的办法。
在脉冲傅立叶变换核磁共振波谱仪中有发射门(用以 控制射频脉冲的发射时间)和接受门(用以控制接受器 的工作时间)。门控去偶是指用发射门及接受门来控制 去偶的实验方法,用这种方法与用单共振法获得的13CNMR谱较为相似,但用单共振法得到同样一张谱图,需 要累加的次数更多,耗时很长。门控去偶法借助于NOE 的帮助,在一定程度上补偿了这一方法的不足。
δ C 2 5 0 .3
2 2 0 .2
1 9 1 .1
整理ppt
3.助电子基团及其密集性
①卤素 (主要为诱导效应。电负性基团会使邻近13C
核去屏蔽。基团的电负性越强,去屏蔽效应越大。)
F Cl Br I 电负性δC-F >δC-Cl >δC-Br >δC-I,
其中 I 的效应是屏整蔽理pp效t 应(高场)
偶的碳谱,各个裂分的谱线彼此交叠,很难识别。故常规 的碳谱都是质子噪声去偶谱,去掉了全部13C-1H偶合,
得到的各种碳的谱线都是单峰。
整理ppt
13C-核磁共振波谱的特点
有机化学第13章参考答案

O NH3, NaBH3CN MeOH, pH 6
O3S
Cl NH2
NN
N NN
COOH OH
(12) O O
H2, Raney-Ni O
O
EtOH
NO2
O
NaBH3CN O
O
AcOH
NH2
O
HN
O (13)
O
(14)
H
H
H N
1) LiAlH4, THF, 60 oC 2) H3O+
O
O O
O + HN O
NH2 > Cl
(3) FCH2CH2NH2 > F2CHCH2NH2 > F3CCH2NH2
NH2
NH2
NH2
NH2
CN Cl
CN
(4)
>
>
>
CN
O
(5)
NH >
>
NH
N
H
O
NH2 NH2
13-5 完成下列反应:
(1)
CH2Cl 1. NaN3, DMSO
?
2. LiAlH4, Et2O
(2) O2N
HCO2H
H
H
H N
N O
13-6 由指定原料和必要的试剂合成下列化合物:
Cl
Br
(1)
H
(2)
O2N
N
O
CH3 (3)
CO2H
HO
OH
O
(4)
OH
CH3
NHC2H5 CH3
O (5)
O N
(6)
Br
NH2
(7)
高等有机化学 第02节:碳负离子的重排
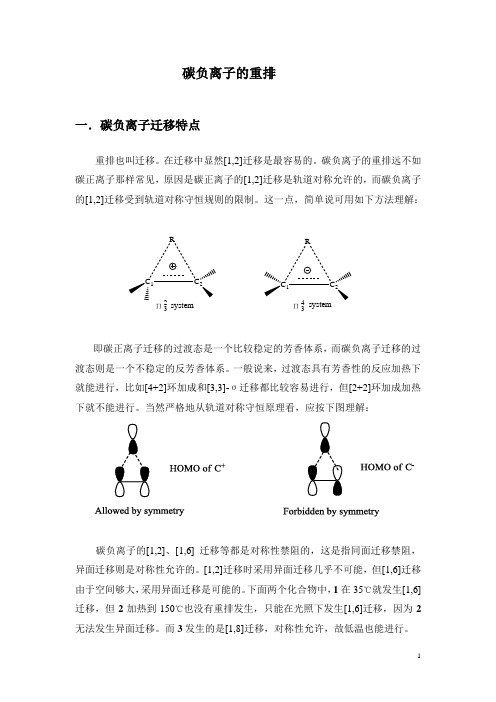
碳负离子的重排一.碳负离子迁移特点重排也叫迁移。
在迁移中显然[1,2]迁移是最容易的。
碳负离子的重排远不如碳正离子那样常见,原因是碳正离子的[1,2]迁移是轨道对称允许的,而碳负离子的[1,2]迁移受到轨道对称守恒规则的限制。
这一点,简单说可用如下方法理解:C 1CRC 1CRΠ32Π34systemsystem即碳正离子迁移的过渡态是一个比较稳定的芳香体系,而碳负离子迁移的过渡态则是一个不稳定的反芳香体系。
一般说来,过渡态具有芳香性的反应加热下就能进行,比如[4+2]环加成和[3,3]-σ迁移都比较容易进行,但[2+2]环加成加热下就不能进行。
当然严格地从轨道对称守恒原理看,应按下图理解:碳负离子的[1,2]、[1,6] 迁移等都是对称性禁阻的,这是指同面迁移禁阻,异面迁移则是对称性允许的。
[1,2]迁移时采用异面迁移几乎不可能,但[1,6]迁移由于空间够大,采用异面迁移是可能的。
下面两个化合物中,1在35℃就发生[1,6]迁移,但2加热到150℃也没有重排发生,只能在光照下发生[1,6]迁移,因为2无法发生异面迁移。
而3发生的是[1,8]迁移,对称性允许,故低温也能进行。
二.重排机理1.加成-消除机理饱和的烃基负离子基本不发生[1,2]迁移,但是不饱和的烃基负离子可以发生[1,2]迁移,如下面的高烯丙基负离子重排。
由于轨道对称性的限制,这种迁移不可能是协同反应,实验表明这种迁移遵循加成-消除机理。
例如:(符号的表示)芳基也能在碳负离子中发生[1,2]迁移,不过比乙烯基困难一些。
在格氏试剂中不能迁移,在锂试剂中可以缓慢重排,在钾和铯试剂中可以迅速发生[1,2]迁移,但一般要求在迁移源要留下至少一个芳基来稳定得到的负离子。
多个芳基基团竞争重排时,能使中间体负离子更加离域的芳基优先迁移,例如下例中对二苯基的迁移绝对优先于间二苯基。
当然,如果重排的中间体是自由基而不是碳负离子,那么对二苯基的重排照样比间二苯基快,所以(7)式结果还不能证明苯基重排的中间体是碳负离子。
高考化学一轮复习专题十三有机化学基础(课时作业):13-3a含解析.doc
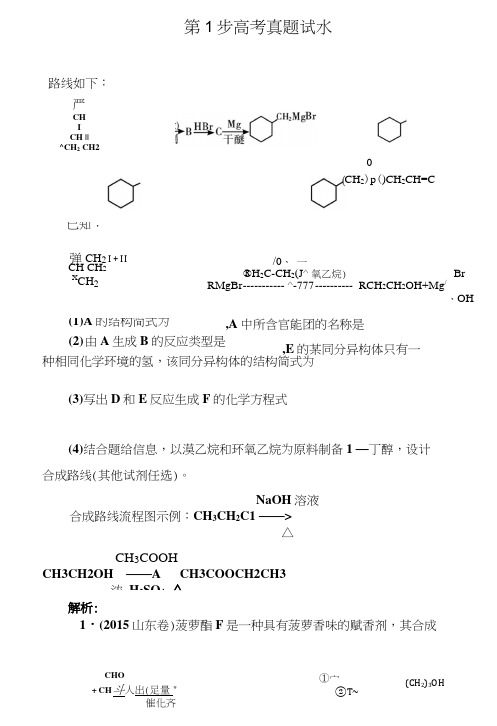
第1步高考真题试水1・(2015山东卷)菠萝酯F 是一种具有菠萝香味的赋香剂,其合成路线如下:严CH I CH || ^CH 2 CH2CH 2)p ()CH 2CH=C H已知:弹 CH 2 I + IICH CH 2 XCH 2/0、 一®H 2C-CH 2(J^ 氧乙烷) BrRMgBr ----------- ^-777 ---------- RCH 2CH 2OH+Mg /、OH,A 中所含官能团的名称是(1) A 的结构简式为(2) 由A 生成B 的反应类型是种相同化学环境的氢,该同分异构体的结构简式为,E 的某同分异构体只有一(3)写出D 和E 反应生成F 的化学方程式(4)结合题给信息,以漠乙烷和环氧乙烷为原料制备1 —丁醇,设计合成路线(其他试剂任选)。
NaOH 溶液 合成路线流程图示例:CH 3CH 2C1 ——>△CH 3COOHCH3CH2OH ——A CH3COOCH2CH3浓 H 2SO 4, △解析:CHO+ CH 斗人出(足量 "催化齐①宀②T~(CH 2)3OH0 / \ ①H.C ——CH.----- :--------- CH 7 CH CH CH ,OH②H +3222迁移题中已知信息可知A 的结构简式为-CHO ,根据A —&的转化条件可知发生加成反应』丄与H 班再发生取代反应生),C 与Mg 反应后再发生与已知信息类 o的结构简式为成C(CH’Br(CH)3OH(CH)3OH发生催(CH 2)2CHO(CH 2)2CHO再(CH)COOH (D ),D 再与E 发生酯化反应,由F 逆推可知E 为C 比 =CHCH^OH 3 (2)E 为(2比 =CHCH2H,不饱和度为1,其只有一种相同化 学环境的氢的同分异构体为CH_COCH 3C (4)由渡乙烷制取 1 •丁醇可迁移题中信息打臭乙烷先与Mg 反应,再与环氧乙烷 反应并酸化即可。
有机合成 第五章 稳定化碳负离子1

反应介质可分为质子性或非质子性溶剂,还可以分 为极性或非极性溶剂 只有pKa大于碳氢化合物的溶剂才能在碳负离子的 反应中使用,质子性溶剂一般难以满足要求,故反 应时一般选择非质子性溶剂,如苯、THF、DMF等 极性大的溶剂促进离子的溶剂化,利于离子型反应
综上,反应一般选合适的碱在非质子性的
-OH
CH2O + H-CH2CHO
HOCH2-CH2CHO
-OH
2CH2O
浓-OH
(HOCH2)3CCHO
CH2O
(HOCH2)4C + HCOOH
Cannizzaro 反应 甲醛的羰基碳极为活泼,在所有醛酮中优先反应
2、苯甲醛可以作为单纯的羰基参与羟醛缩合反应, 比如Claisen-Schimdt缩合、Perkin反应等
(i-C3H7)2NLi + C4H10
5.1 稳定化碳负离子形成的原理
六、影响负离子形成及反应的因素:
1.碱(B-)的影响:
有机原料酸性越弱,则应使用越强的碱,如:
强碱带来正向反应的增加,但也带来副反应,如:
交叉羟醛缩合反应时需防止强碱带来的自身缩合
王鹏
5.1 稳定化碳负离子形成的原理
王鹏
5.2 碳负离子的缩合反应
交叉羟醛缩合反应:
两种不同的醛、酮之间发生的羟醛缩 合反应称为交叉的羟醛缩合反应。
有两种情况 (1)只有一种醛或酮有-H,常见于甲醛和苯甲醛的反应 (2)原料醛酮有不同的-H。需控制碱性进行定向反应
王鹏
5.2 碳负离子的缩合反应
第一种情况:
1、甲醛的缩合反应大多属于此类情况,如
-OH
《有机化学》第四版[1]._高鸿宾版_课后练习答案(新)
![《有机化学》第四版[1]._高鸿宾版_课后练习答案(新)](https://img.taocdn.com/s3/m/2e51507deefdc8d376ee32b9.png)
第二章饱和烃习题(P60)(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) (2)3-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3) (4)2,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5) (6)乙基环丙烷2-环丙基丁烷(7) (8)1,7-二甲基-4-异丙基双环[4.4.0]癸2-甲基螺[]壬烷烷(9) (10)5-异丁基螺[]庚烷新戊基(11) (12)2-甲基环丙基2-己基 or (1-甲基)戊基(二) 写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。
(1) 2,3-二甲基-2-乙基丁(2) 1,5,5-三甲基-3-乙基己(3) 2-叔丁基-4,5-二甲基己烷烷烷2,3,3-三甲基戊烷2,2-二甲基-4-乙基庚烷2,2,3,5,6-五甲基庚烷(4) 甲基乙基异丙基甲烷(5) 丁基环丙烷(6) 1-丁基-3-甲基环己烷2,3-二甲基戊烷1-环丙基丁烷1-甲基-3-丁基环己烷(三) 以C2与C3的σ键为旋转轴,试分别画出2,3-二甲基丁烷和2,2,3,3-四甲基丁烷的典型构象式,并指出哪一个为其最稳定的构象式。
解:2,3-二甲基丁烷的典型构象式共有四种:2,2,3,3-四甲基丁烷的典型构象式共有两种:(四) 将下列的投影式改为透视式,透视式改为投影式。
(1)(2)(3)(4)(5)(五)解:它们是CH3-CFCl2的同一种构象——交叉式构象!从下列Newman投影式可以看出:将(I)整体按顺时针方向旋转60º可得到(II),旋转120º可得到(III)。
同理,将(II)整体旋转也可得到(I)、(III),将(III)整体旋转也可得到(I)、(II)。
(六) 解:⑴、⑵、⑶、⑷、⑸是同一化合物:2,3-二甲基-2-氯丁烷;⑹是另一种化合物:2,2-二甲基-3-氯丁烷。
(七) 解:按照题意,甲基环己烷共有6个构象异构体:(A)(B)(C)(D)(E)(F)其中最稳定的是(A)。
大学有机化学总结习题及答案讲解

有机化学总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOH3 2)锯架式:CH 3OHHHOH 2H 53)纽曼投影式: 4)菲舍尔投影式:COOH CH 3OHH5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C HC 2H 5CH 3CC H2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3CCH CH 3HCH 3CC H HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
第三节 碳核磁共振(13C-NMR)

13C信号的取代基位移(SCS,Δδc)
β-D-glucose 的苷化位移(glycosylation shift,GS)
各类碳的化学位移范围
1.碳原子的轨道杂化状态 2.碳核周围的电子云密庋 3.诱导效应 4.共轭效应 5.立体效应 6.其他影响 溶剂:氢键:
7.取代基位移(SCS)
八、13C-NMR图谱δ的计算 13C-NMR谱中,取代基位移有很好的 加和性。 取代苯:128.5+∑Ai
羰基碳、双键季碳因T1值很大,故吸收信 号非常弱,有时甚至弱到无法观测的程度。 在COM上仍可大体根据峰高对同类型碳核 的碳数比例作出粗略的估计。
2.偏共振去偶(OFR) 质子宽带去偶虽大大提高了13C NMR的 灵敏度,简化了谱图,但同时也失去了许 多有用的结构信息。无法识别伯、仲、叔、 季不同类型的碳。 又研制了偏共振去偶谱(OFR)。 用途:识别伯、仲、叔、季不同类型的 碳。
季碳消失
A+C-B A-C
90°
七、化学位移
13C-NMR化学位移的幅度较宽,通常为
0~230ppm。 在COM谱中,信号均为单峰,彼此之间 很少重叠,识别起来比较容易。 化学位移的影响因素: 碳原子的杂化状态、碳核的电子云密 度、诱导效应、共轭效应、立体效应、其 它因素。
1.碳原子的轨道杂化状态
三、13C核的灵敏度
1.
13C
与 1H核性质比较
13C 1H
I
γ 天然丰度%
1/2
6.726 1.11
1/2
26.752 99.98
Hale Waihona Puke 2.灵敏度(S/N)的比较: S/N∝
H
2 0 02
3
NI I 1
