第13章羧酸衍生物
第13章 羧酸衍生物
注意反应溶剂
13.3.4 羧酸衍生物与金属试剂的反应
常用于制备含有两个相同取代基的叔醇
如果要停留在酮,反应温度控制至关重要
13.3.5 酰胺的特殊反应
很好的亲核试剂
2 3 2 2
5 o 3 2
2 3 2 2 2
5 2
2 o
2 3 2 2 2
5
Hofmann降解:
(或NaOX) 反应机理:
制备少一个碳的伯胺
碱性条件下的酯交换
(2) 酸性介质中的反应,先是羰基质子化
O RC OR' O RC NH2 + H2O H
+
O RC OH
酸性条件下的酯交换
(3) 反应活性
O RCH2C X O RCH2C O OCR' O RCH2C OR' O RCH2C NH2
羰基碳的正电性减小,-H的活性减小
L的离去能力减小(离去基团的稳定性减小)
羰基的活性减小(取决于综合电子效应)
O
13.3.3 还原反应
RC O R O RC
X
LiAlH4 O
H
RCH2OH
LiAlH4 R LiAlH4 H3O+
H
O
RCH2OH
OR'
RCH2OH + R'OH
O RC O RC O RC NR'2 LiAlH4 H2O RCH2 NR'2 NHR' LiAlH4 H2O RCH2 NHR' NH2 LiAlH4 H2O RCH2 NH2
3
2
2
3 2
3
7
4
9
香蕉香
菠萝香
13-羧酸衍生物
衍生物命名注意事项:
• 1 酰卤:首先正确叫出原羧酸的名称,改 成酰氯即可。 • 2 酸酐:准确叫出两个羧酸的名称,然后 再改成酸酐,相同羧酸的酸酐可以省略一 个。 • 3 酯:首先准确叫出羧酸的名称,然后准 确叫出醇的名称,最后定名为某酸某酯。 • 4 酰胺:先叫出N上的取代基,然后再叫出 羧酸名称,最后定名为酰胺。
酸性:
HCl > RCOOH > ROH > NH3
4~ 5 16~19 34
pKa: ~2.2
离去能力:Cl-> -OCOR> -OR’ > -NH2
∴活性:酰氯 > 酸酐> 酯 > 酰胺
(2) 酸碱理论:离去基团的难易 碱性越弱,越容易离去。离去基团L 的碱性由强到弱的次序:
Cl
> RCOO > RO > NH2
O C O
O C CH3
庚二酸单酰氯 6-氯甲酰基-己酸
O C O O C CH3
甲乙酸酐
O C O CH(CH3)2
COOEt
乙酸苯甲酸酐 混合酸酐命名:分别叫出 两个羧酸然后加” 酐” 。 O C OH 邻羟基苯甲酰苯胺 N-苯基邻羟基苯甲酰胺 NH
Cl 间氯苯甲酸异丙酯 3-氯苯甲酸异丙酯 COOCH3 对苯二甲酸甲乙酯
L
d
-
① p- 共轭使羰基碳上正电密度降低
R-C
使C-L具有部分双键性质 不利于酰基化反应发生
O p- -Cl <
期元素
-O-C-R
酰基是 吸电子基
<
-O-R' < -NH2
烃基是 斥电子基 电负性:
共轭的强度: 第三周
O>N
即酰氯的羰基碳最正。
∴活性:酰氯>酸酐>酯>酰胺
第十三章 羧 酸 衍 生 物

剧烈反应
O
=
(C H 3)3C C O O H 位阻大
SOCl2
(C H 3)3C C O C l
C6H5OH 吡 啶
(C H 3)3C C O C 6H5
O C
O
反应活性较差
应可用于从低沸点酯制备高沸点酯。如:
C H2 =C HC O O C 3 H + C H3(C H2)2C H2O H
b.p: 80.5℃ 低沸点酯
综上所述,羧酸衍生物的反应活性顺序为:
O X > R C O R C
R C
=
=
O O > R C
=
O > R C OR’
=
O NH2
醛/酮的活性介于酸酐和酯之间,其中醛的活性大于酮
=
⑴ 水解
特点: a.产物均有羧酸生成。 b.活性:酰卤
O R C Cl
剧烈反应
〉酸酐 〉酯 〉酰胺
+
H 2O
RCOOH+ HCl 2RCOOH RCOOH+ R'OH RCOOH+ NH4+
MgX
O + O O
H2O
COCH2CH2COOH H3CO
H3CO
⑶ 酯与格氏试剂的反应
+ R C= O R” R’MgX
醚
R C O R” R’
R’MgX 醚
OR ”
R C R’
R R’ C OH
R R’ C R’
H3O
=
O
O MgX
Mg
X
O
+
O MgX
结构 R’ 对称的 叔醇
比较反应活性:
< R C R’ R C= O R”
第十三章-+羧酸衍生物

Ac2O
H2N CH3
KMnO4 / H+ AcHN CH3
AcHN
COOH
H+ / H2O
H2N
COOH
降低反应活性,制备酚、芳胺的单卤代化合物
OH
Ac2O
OAc
Br2 / Fe
OAc
H+ / H2O
OH
Br
Br
23
五、格氏反应
O Ph C Cl CH3MgBr Et2O OMgBr Ph C Cl CH3 -MgBrCl O Ph C CH3 CH3MgBr OMgBr Ph C CH3 CH3 H3O+ OH Ph C CH3 CH3
R CO2C2H5 O NaOC2H5 C2H5OH
R CO2C2H5 O
R R' R'X CO2C2H5 O 1) NaOH 2) H3O O R R' 双烷基化
乙酰乙酸乙酯制备甲基酮衍生物
甲酸己酯:苹果香味 甲酸苄酯:香蕉香气 乙酸苯乙酯:玫瑰清甜蜜香 苯乙酸苄酯:茉莉香气
11
二、化学性质:亲核取代反应
1.水解反应(hydrolysis)
O R C O R C O R C O R C NH2(R') OR' O X H 2O HX O C R' O O R H2 O HOR' H+ or OH H2 O H+ or OH HNH2 (HNHR') C OH + HO C R'
苯甲酰溴
4
2、酸酐的命名
以酐为母体,前面加酸的名称
CH3CH2CO-O-OCCH3
O O H C O C H
[工学]第十三章--羧酸及其衍生物PPT课件
![[工学]第十三章--羧酸及其衍生物PPT课件](https://img.taocdn.com/s3/m/b7c4094d53d380eb6294dd88d0d233d4b04e3f5c.png)
强、宽谱带
NMR:
-COOH 上质子的化学位移9.5~13ppm
-
11
§13.3 羧酸的化学性质
-COOH的结构: C(近似)sp2杂化
O
O
P-π共轭,羟基、
R
C O
R H
C
O.. H
羰基不是独立的
H离解后负电荷为- 三原子共同承担
12
O
O-
RC
RC
O-
O
共 振酸 结根 构的 式
亲核试剂进攻生成羧酸衍生物
反丁烯二酸 (富马酸)
-
6
§13.2 羧酸的物理性质和波谱性质
• C1~3:无色透明液体 C4~10: 油状液体 C10以上:蜡状固体。 • 饱和一元羧酸的沸点随分子量的增加而升高。
分子量相近时,沸点:羧酸>醇。
原因:羧酸氢键较稳定,并形成双分子缔合。
O HO
H3CC OH
CCH3 O
例:甲酸 (101℃) > 乙醇 (78℃)
解: -Cl 连在开链烃上主要为诱导效应,距离越近作用越大。
酸性:CH3CHClCOOH > CH2ClCH2COOH
-
18
例:比较酸性
COOH
COOHCOOH COOH
OC3H HO
H2N
解:供电子强弱顺序:-NH2 > -OH > -OCH3 都使酸性减弱
COOH COOH COOH COOH
-
30
二.由烃氧化制备
CH 3
KMnO4
H+
COOH
烯烃、有α-H的烷基苯氧化
三.由R-MgX制备
R-MgX + O=C=O
羧酸衍生物

第十三章羧酸衍生物第一节羧酸衍生物的结构和命名一、羧酸衍生物的结构羧酸衍生物在结构上的共同特点是都含有酰基(),酰基与其所连的基团都能形成P-π共轭体系。
二、羧酸衍生物的命名酰卤和酰胺根据酰基称为某酰某。
酸酐的命名是在相应羧酸的名称之后加一"酐"字。
例如:酯的命名是根据形成它的酸和醇称为某酸某酯。
例如:三、羧酸衍生物的光谱性质1.IR:醛、酮、羧酸、酰卤、酸酐、酯和酰胺都含有羰基,因此,在IR都有C=O的强吸收峰。
醛、酮的νC=O 1705~1740cm-1 ,羧酸衍生物的C=O伸缩振动扩大到了1550~1928 cm-1. 这是因为:酸酐:在1800-1860cm-1(强)和1750-1800cm-1(强)区域有两个C=O伸拉振动吸收峰,这两个峰往往相隔60cm-1左右。
对于线形酸酐,高频峰较强于低频峰,而环状酸酐则反之。
另外:C-O的伸拉振动吸收在1045~1310/cm(强)。
酯:酯的C=O伸缩振动稍高于酮,在1735~1750cm-1处,与芳基相连的则降至1715~1730 cm-1 ,酯在1015~1300 cm-1 区域内有两个强的C-O伸缩谱带。
可以与酮相区别。
一级酰胺,-NH2的N-H吸收为两个峰。
二级酰胺N-H为一个尖峰。
2.核磁共振(NMR):酯:RCOOCH δ=3.7~4.1ppm。
酰胺:RCONH δ=5~8ppm。
往往不能给出一个尖锐的峰。
四.羧酸衍生物的亲核取代反应分为加成-消除两步:加成一步取决于电子因素和空间因素。
消除一步取决于L的碱性和稳定性。
L碱性越弱,越容易离去;L 越稳定,越容易离去。
就酰氯、酸酐、酯、酰酐、酰胺而言,L的碱性为:Cl-< R-COO-< R'O-< NH2-;L的稳定性为:Cl->R-COO-> R'O-> NH2-,所以羧酸衍生物的活性为:羧酸的衍生物在碱性或酸性条件下比在中性溶液中更容易水解,这是可以理解的:碱性溶液提供给氢氧根离子,它充当一种强的亲核试剂;酸性溶液提供给氢离子,它接到羰基氧上从而使分子易受弱亲核试剂,即水的进攻。
第十三章羧酸衍生物ppt文档

O H3C C
O
乙酸甲酯
CH 3
CH3 O H2C= CC
O CH3
甲基丙烯酸甲酯
O H3C C
OCH 2CH 3
乙酸乙酯
O H3C C
O CH=C2 H
乙酸乙烯酯
内酯用希腊字母标明羟基的位置,酯前加 “内”字
γ-丁内酯
δ-戊内酯
二元羧酸与一元醇生成的酯,分为酸性酯和中性酯。
CONH2 Br2
NaOH H2O
COOH
NH2 COOH
减碳反应,制伯胺
反应历程:
O
OH
RC-NH + Br2
H
O
O
OH
RC-N Br
RC -N
Br
H
R N=C=O H2O
OH
RNH2 + CO32-
13.5 碳酸衍生物
HC O OH CC l Cl RC OOR
13.4.1 酰基上的亲核取代反应 三解(水解、氨解、醇解)
酰化剂:能够提供酰基的化合物称为酰化剂 常用酰卤、酸酐。
酰化反应:由酰化剂与含活泼氢的化合物 (如醇、酚、氨、胺、含α-H的酯、醛、酮等) 进行的反应称为酰化反应,也叫酰基转移反应。
酰化反应的应用
有机合成中保护易氧化的酚羟基和芳胺基
降低某些化合物的反应活性 (如制备酚、芳胺的单卤代化合物) 药物中引入酰基可改善疗效。
酰卤的三解
H2O
O
R C + R'OH
X
NH3
RCOOH + HX
O
RC
+ HX
O R'
O
第十三章 羧酸衍生物

O
O + R C OH
O CF3 C O
混酐
37
O
O OH
C R + CF3 C
三氟乙酸形成的混酐是一个良好的酰化试剂,在合成 上用处很大。 例:酚不易和酸形成酯,而在三氟乙酐存在下这个反应 很容易进行。
CH3 CH3 COOH CH3
H 3C
O CF3 C
+ HO
H 3C
CH3
2
O 25℃
CH3 CH3
(CH3CO)2O CH2CH2C
O
CH2CH2C O
CH3CH2OH CH2CH2COOC2H5
SOCl2
CH2CH2COOC2H5 CH2CH2COCl
Br
CH2CH2COOH
Br2
CH2CH2COOC2H5 CH3CH2OH CH2CHCOOC2H5 CH2CHCOCl Br
30
CH2CH2COOC2H5
酰氯:1800 cm-1
酸酐:1825 ~ 1815,1755 ~ 1745 cm-1 两个吸收峰
这两个峰往往相隔 60 cm-1 酯: 1740 cm-1
酰胺: 1690 ~ 1630 cm-1 腈: 腈的C≡N伸缩振动吸收在2240~2260cm-1
11
酰胺的N-H伸缩振动吸收:
O R
O R NHR'
Cl:表现为吸电子诱导效应,与羰基共轭效应很弱。 例:
CH3 Cl
178.9 pm
178.4 pm
4
N:表现为与羰基的共轭效应。
O
例:
H
NH2
CH3 NH2
137.6 pm
147.4 pm
α氢的活泼性:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:
O 2 ( C H 3 C ) 2 O+H O
常 用 酰 基 化 试 剂
O
O HH 2 S O 4
9 3 %
C H 3 C O
O O C C H 3+2 C H 3 C O O H
酚 酯
O
O
H + , 9 4 %
C H 2 = C H - C - O C H 3 + C H 3 C H 2 C H 2 C H 2 O H
第13章羧酸衍生物cyclohexanecarboxylate
多元醇的酯,一般把”酸”名放在后面,称为” 某醇某酸酯”
O
CH2 O
C
CH3
CH2 O
C
CH3
乙二醇二乙酸酯
O
C H 2O N O 2
CHONO2
甘油三硝酸酯
C H 2O N O 2
第13章羧酸衍生物
酰胺的命名:RCONH2
• 酰胺 ×酸 →×酰胺 N-烃基×酰胺 • -ic acid → -amide
沸点: 酰卤、酸酐、酯的沸点低于羧酸; 伯酰胺的沸点高于羧酸。
第13章羧酸衍生物
IR光谱
例1:丙酸酐的红外光谱。 例2:乙酸乙酯的红外光谱。
NMR谱:
例:乙酸乙酯的第核13章磁羧酸共衍振生物谱。
(三) 羧酸衍生物的化学性质
(1)酰基上的亲核取代
(5) 与有机金属试剂的反应
(甲) 水解
(6) 酰氨氮原子上的反应
-carboxylic acid → -carboxamide
O CH 3C NH 2
O C
NH 2
O HCN(C3)H 2
乙酰胺 环戊烷羧酰胺 N,N-二甲基甲酰胺
Acetamide Cyclopentanecarboxamide N,N-Dimethylformamide
第13章羧酸衍生物
(二) 羧酸衍生物的物理性质
(甲) 水解
O R-C-Cl
O (R-C)2O
O R-C-OR'
+ H2O
HCl
RCOOH +
羧酸
RCOOH R'OH
O
R-C-NH2
NH3
O
O
O
O
水解速度 剧 R-烈 : C放 -> C热 (l热 R水 -第21C3O中 章)羧> 酸进 衍R加 H生+行 o-物热 rCO-催 -H > O化 RR催 高 , '-化 温 C-剂 下 2N, 长 H时难 间! 回
第十三章 羧酸衍生物 Carboxylic Acid Derivatives
教学目标与要求: ➢掌握羧酸衍生物的命名 ➢掌握酰基化反应及规律 ➢掌握重要的羧酸衍生物及其性质 ➢简单了解碳酸衍生物的化学性质
第13章羧酸衍生物
第十三章 羧酸衍生物
(一) 羧酸衍生物的命名 (二) 羧酸衍生物的物理性质 (三) 羧酸衍生物的化学性质 (四) 碳酸衍生物
第13章羧酸衍生物
(一) 羧酸衍生物的命名
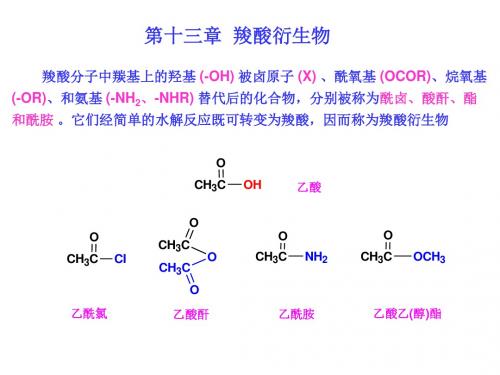
羧酸衍生物系指酰卤、酸酐、酯、酰胺,它们经 简单水解后都得到羧酸。
O R-C-X
酰卤
O R-C
O R-C
O 酸酐
O
O
R-C-OR' R-C-N2H
酯
酰胺
(R或R'可以是Ar或H)
取代酸(如氨基酸、羟基酸、卤代酸等)通常不属 于羧酸衍生物。
本章还将讨论碳酸第衍13生章羧物酸衍。生物
物态及水溶解性: 酰氯、酸酐:分子间无氢键作用,挥发性强,有刺鼻气味 的液体。沸点随着相对分子质量↑而↑。遇水水解。 酯:酯不溶于水。低级酯是有酯香味的液体。高级脂肪酸 的高级脂肪醇酯为固体,俗称“蜡”。
酰胺:分子间氢键作用强,一般为固体,但DMF或DEF为液 体,是常用的非质子性溶剂。低级酰胺可溶于水,随着 分子量↑,水溶解度↓。
酯的命名:RCO2R’
O
O
• 酯 ×酸×(烃基名)酯 R C OH • -ic acid → alkyl -ate
R C OR
羧酸的氢被烃基取代
O CH3C OCH2CH3
O C OCH3
O C OC(C3H)3
乙酸乙酯 Ethyl acetate
苯甲酸甲酯 环己烷羧酸叔丁酯 Methyl benzoate tert-Buthyl
酰卤的命名: RCOX
• 酰卤 相应的羧酸名称去掉“酸”字 + “酰卤”
• -ic acid → -yl + halide or -carboxylic acid → carbonyl + halideO CH3来自ClO CBr
O C
Cl
乙酰氯 苯甲酰溴
环己烷甲酰氯
Acetyl chloride Benzoyl bromide Cyclohexanecarbonyl 第13章羧酸衍生物chloride
CH2CH2COOH OH
邻 羟 基 苯 丙 酸
O
O
C H 3 C - N H
B rC 2 H 5 O H - H 2 O , K O H
9 5 %
C H 3 C O - K ++H 2 N
B r
对 溴 乙 酰 苯 胺
第13章羧酸衍生乙 物酸 钾
对 溴 苯 胺
(乙) 醇解
O
R-C-Cl
O
活 (R-C)2O
性 降
O
+ HOR'
低 R-C-OR''
O
R-C-NH2
HCl
RCOOR' +
酯
RCOOH R''OH
NH3
O
O
O
O
醇解速度 R-: C-> C(lR-2OC)>R-C-> ORR'-C-2 NH难!
常用酰基化剂 可逆,酯交 难换 ,醇需过量 直接醇解 从低级酯制高级酯 第1( 3章羧如 酸衍涤 生物 纶的生产)
(乙) 醇解
(甲) 酰胺的酸碱性
(丙) 氨解 (2)酰基上的亲核取代反应机 理 (3)酰基化试剂的相对活性
(乙) 酰胺脱水 (丙) Hofmann降解反应
(4)还原反应
(甲) 用氢化铝锂还原
(乙)用金属钠-醇还原
(丙) Rosenmund还原
第13章羧酸衍生物
(三) 羧酸衍生物的化学性质
(1) 酰基上的亲核取代
例:
O
(C6H5)2CHC2HCCl
H2O。,N2aCO3
0 C,95%
3,3-二苯基丙酰氯
O
(C6H5)2CHC2HCOH
3,3-二苯基丙酸
O
H3C C O HC O
H2O, 94%
顺-2-甲基丁烯二酸酐
H3C C COOH H C COOH
顺-2-甲基丁烯二酸
H2O,NaOH
O O ,90%
邻 羟 基 苯 丙 酸 内 酯
酸酐的命名: RCO2COR’
• 酸酐 ×酸 →×(酸)酐 x酸×酸酐 • acid→anhydride
O
OO
OO
CH3C O C CH3 HC O C CH3
O
乙酸酐 Acetic anhydride
甲(酸)乙(酸)酐
Acetic formic anhydride
第13章羧酸衍生物
O
丁二酸酐 Butanedioic anhydride
