最新11第十三章羧酸衍生物
第13章 羧酸衍生物
注意反应溶剂
13.3.4 羧酸衍生物与金属试剂的反应
常用于制备含有两个相同取代基的叔醇
如果要停留在酮,反应温度控制至关重要
13.3.5 酰胺的特殊反应
很好的亲核试剂
2 3 2 2
5 o 3 2
2 3 2 2 2
5 2
2 o
2 3 2 2 2
5
Hofmann降解:
(或NaOX) 反应机理:
制备少一个碳的伯胺
碱性条件下的酯交换
(2) 酸性介质中的反应,先是羰基质子化
O RC OR' O RC NH2 + H2O H
+
O RC OH
酸性条件下的酯交换
(3) 反应活性
O RCH2C X O RCH2C O OCR' O RCH2C OR' O RCH2C NH2
羰基碳的正电性减小,-H的活性减小
L的离去能力减小(离去基团的稳定性减小)
羰基的活性减小(取决于综合电子效应)
O
13.3.3 还原反应
RC O R O RC
X
LiAlH4 O
H
RCH2OH
LiAlH4 R LiAlH4 H3O+
H
O
RCH2OH
OR'
RCH2OH + R'OH
O RC O RC O RC NR'2 LiAlH4 H2O RCH2 NR'2 NHR' LiAlH4 H2O RCH2 NHR' NH2 LiAlH4 H2O RCH2 NH2
3
2
2
3 2
3
7
4
9
香蕉香
菠萝香
13-羧酸衍生物
衍生物命名注意事项:
• 1 酰卤:首先正确叫出原羧酸的名称,改 成酰氯即可。 • 2 酸酐:准确叫出两个羧酸的名称,然后 再改成酸酐,相同羧酸的酸酐可以省略一 个。 • 3 酯:首先准确叫出羧酸的名称,然后准 确叫出醇的名称,最后定名为某酸某酯。 • 4 酰胺:先叫出N上的取代基,然后再叫出 羧酸名称,最后定名为酰胺。
酸性:
HCl > RCOOH > ROH > NH3
4~ 5 16~19 34
pKa: ~2.2
离去能力:Cl-> -OCOR> -OR’ > -NH2
∴活性:酰氯 > 酸酐> 酯 > 酰胺
(2) 酸碱理论:离去基团的难易 碱性越弱,越容易离去。离去基团L 的碱性由强到弱的次序:
Cl
> RCOO > RO > NH2
O C O
O C CH3
庚二酸单酰氯 6-氯甲酰基-己酸
O C O O C CH3
甲乙酸酐
O C O CH(CH3)2
COOEt
乙酸苯甲酸酐 混合酸酐命名:分别叫出 两个羧酸然后加” 酐” 。 O C OH 邻羟基苯甲酰苯胺 N-苯基邻羟基苯甲酰胺 NH
Cl 间氯苯甲酸异丙酯 3-氯苯甲酸异丙酯 COOCH3 对苯二甲酸甲乙酯
L
d
-
① p- 共轭使羰基碳上正电密度降低
R-C
使C-L具有部分双键性质 不利于酰基化反应发生
O p- -Cl <
期元素
-O-C-R
酰基是 吸电子基
<
-O-R' < -NH2
烃基是 斥电子基 电负性:
共轭的强度: 第三周
O>N
即酰氯的羰基碳最正。
∴活性:酰氯>酸酐>酯>酰胺
第13章 羧酸衍生物

-甲基戊腈
3-甲基戊腈
-氰基丁酸
2-氰基丁酸
己二腈
己二腈
羧酸衍生物的物理性质
低级的酰氯和酸酐是有刺鼻气味的液体,高级的为固体; 低级的酯具有芳香的气味,可作为香料;C14酸以下 的甲酯和乙酯均为液体;
酰胺除甲酰胺外,由于分子内形成氢键,均是固体; 而当酰胺的氮上有取代基时,分子间的缔合消失,熔点和 沸点显著降低,为液体;
由于没有分子间的氢键作用,酰氯、酸酐和酯的沸点比 相对分子质量相近的羧酸低;
羧酸衍生物可溶于有机溶剂;酰氯和酸酐不溶于水, 低级的遇水分解;酯在水中溶解度小;低级酰胺可溶于水。 N’N-二甲基甲酰胺(DMF)和N’N-二甲基乙酰胺可与水互溶
羧酸衍生物的波谱性质
乙酸乙酯
羧酸衍生物的波谱性质
α-碳的化学位移 δ=2-3; 酯中烷氧基的质子δ=4; 酰胺中氮的质子δ=5-9;
+ R
O C OH
C
O
R
R"OH
O
R
C
OR'
H+ or R"O
C
OR"
+
R'OH
•反应可逆,用过量的醇 R”OH 和除去生成的醇 R’OH 使反应 进行完全。 酸或碱对反应是必需的
羧酸衍生物的胺解反应
• 酰氯,酸酐和酯与胺或酰胺作用,都可以生成酰胺
羧酸衍生物的相互转换关系
亲核取代反应的机理
• 首先是亲核试剂Nu进攻羰基生成四面体中间体; • 离去基团L离去,生成取代产物——另一种羧酸衍生物
羧酸衍生物亲核取代反应的相对活性:
活性次序:
O R C X R O C O O C R R O C OR' R O C NH2(R)
第十三章 羧 酸 衍 生 物

剧烈反应
O
=
(C H 3)3C C O O H 位阻大
SOCl2
(C H 3)3C C O C l
C6H5OH 吡 啶
(C H 3)3C C O C 6H5
O C
O
反应活性较差
应可用于从低沸点酯制备高沸点酯。如:
C H2 =C HC O O C 3 H + C H3(C H2)2C H2O H
b.p: 80.5℃ 低沸点酯
综上所述,羧酸衍生物的反应活性顺序为:
O X > R C O R C
R C
=
=
O O > R C
=
O > R C OR’
=
O NH2
醛/酮的活性介于酸酐和酯之间,其中醛的活性大于酮
=
⑴ 水解
特点: a.产物均有羧酸生成。 b.活性:酰卤
O R C Cl
剧烈反应
〉酸酐 〉酯 〉酰胺
+
H 2O
RCOOH+ HCl 2RCOOH RCOOH+ R'OH RCOOH+ NH4+
MgX
O + O O
H2O
COCH2CH2COOH H3CO
H3CO
⑶ 酯与格氏试剂的反应
+ R C= O R” R’MgX
醚
R C O R” R’
R’MgX 醚
OR ”
R C R’
R R’ C OH
R R’ C R’
H3O
=
O
O MgX
Mg
X
O
+
O MgX
结构 R’ 对称的 叔醇
比较反应活性:
< R C R’ R C= O R”
有机化学第十三章羧酸衍生物总结

反应活性较差
叔醇
吡啶
O C OC(CH3)3
不仅起催化作用 还可吸收产生的HCl
2) 酯交换:由低级醇酯制高级醇酯
= H+
CH2 CHCOOCH3 + CH3(CH2)2CH2OH
b.p: 80.5℃ 低沸点酯
= CH2 CHCOO(CH2)3CH3 + CH3OH
b.p: 145℃
b.p: 64.7℃
R C =O > X
=
R C =O
O RC
O
> R C =O > R C =O
OR′
NH2
第二步——取决于离去基团的离去能力。
基团的离去能力:
! 试解释之
X > RCOO > RO > NH2
碱性越小离去能力越强。
碱性强弱:
X < RCOO < RO < NH2
结论:
羧酸衍生物的反应活性顺序为
R C =O > X
== =
== =
O C O C4H9_ n
C OH
O
邻苯二甲酸单正丁酯
O CH3 C O CH2 CH3 C O CH2
O
乙二醇二乙酸酯
CH2OCOR CHOCOR'
甘油三酯:脂肪和油
CH2OCOR''
O
H3C
CH3
H3C
HO H3CH2CH
OH O
O
CH3
CH3 OH HO O
O O
N(CH3)2
青霉素 ( penicillin )
酸酐:两个羧酸名加“酐”字。
O
OO
OO
COC
羧酸衍生物

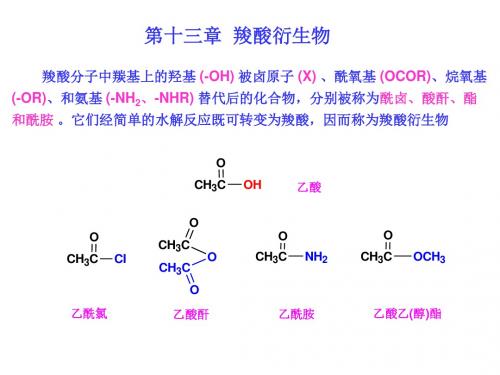
第十三章羧酸衍生物第一节羧酸衍生物的结构和命名一、羧酸衍生物的结构羧酸衍生物在结构上的共同特点是都含有酰基(),酰基与其所连的基团都能形成P-π共轭体系。
二、羧酸衍生物的命名酰卤和酰胺根据酰基称为某酰某。
酸酐的命名是在相应羧酸的名称之后加一"酐"字。
例如:酯的命名是根据形成它的酸和醇称为某酸某酯。
例如:三、羧酸衍生物的光谱性质1.IR:醛、酮、羧酸、酰卤、酸酐、酯和酰胺都含有羰基,因此,在IR都有C=O的强吸收峰。
醛、酮的νC=O 1705~1740cm-1 ,羧酸衍生物的C=O伸缩振动扩大到了1550~1928 cm-1. 这是因为:酸酐:在1800-1860cm-1(强)和1750-1800cm-1(强)区域有两个C=O伸拉振动吸收峰,这两个峰往往相隔60cm-1左右。
对于线形酸酐,高频峰较强于低频峰,而环状酸酐则反之。
另外:C-O的伸拉振动吸收在1045~1310/cm(强)。
酯:酯的C=O伸缩振动稍高于酮,在1735~1750cm-1处,与芳基相连的则降至1715~1730 cm-1 ,酯在1015~1300 cm-1 区域内有两个强的C-O伸缩谱带。
可以与酮相区别。
一级酰胺,-NH2的N-H吸收为两个峰。
二级酰胺N-H为一个尖峰。
2.核磁共振(NMR):酯:RCOOCH δ=3.7~4.1ppm。
酰胺:RCONH δ=5~8ppm。
往往不能给出一个尖锐的峰。
四.羧酸衍生物的亲核取代反应分为加成-消除两步:加成一步取决于电子因素和空间因素。
消除一步取决于L的碱性和稳定性。
L碱性越弱,越容易离去;L 越稳定,越容易离去。
就酰氯、酸酐、酯、酰酐、酰胺而言,L的碱性为:Cl-< R-COO-< R'O-< NH2-;L的稳定性为:Cl->R-COO-> R'O-> NH2-,所以羧酸衍生物的活性为:羧酸的衍生物在碱性或酸性条件下比在中性溶液中更容易水解,这是可以理解的:碱性溶液提供给氢氧根离子,它充当一种强的亲核试剂;酸性溶液提供给氢离子,它接到羰基氧上从而使分子易受弱亲核试剂,即水的进攻。
第十三章羧酸衍生物ppt文档

O H3C C
O
乙酸甲酯
CH 3
CH3 O H2C= CC
O CH3
甲基丙烯酸甲酯
O H3C C
OCH 2CH 3
乙酸乙酯
O H3C C
O CH=C2 H
乙酸乙烯酯
内酯用希腊字母标明羟基的位置,酯前加 “内”字
γ-丁内酯
δ-戊内酯
二元羧酸与一元醇生成的酯,分为酸性酯和中性酯。
CONH2 Br2
NaOH H2O
COOH
NH2 COOH
减碳反应,制伯胺
反应历程:
O
OH
RC-NH + Br2
H
O
O
OH
RC-N Br
RC -N
Br
H
R N=C=O H2O
OH
RNH2 + CO32-
13.5 碳酸衍生物
HC O OH CC l Cl RC OOR
13.4.1 酰基上的亲核取代反应 三解(水解、氨解、醇解)
酰化剂:能够提供酰基的化合物称为酰化剂 常用酰卤、酸酐。
酰化反应:由酰化剂与含活泼氢的化合物 (如醇、酚、氨、胺、含α-H的酯、醛、酮等) 进行的反应称为酰化反应,也叫酰基转移反应。
酰化反应的应用
有机合成中保护易氧化的酚羟基和芳胺基
降低某些化合物的反应活性 (如制备酚、芳胺的单卤代化合物) 药物中引入酰基可改善疗效。
酰卤的三解
H2O
O
R C + R'OH
X
NH3
RCOOH + HX
O
RC
+ HX
O R'
O
有机化学第13章 羧酸衍生物

35
另一方面,乙酰胺的水溶液能与氧化汞作用生成稳定的汞盐。
酰胺与金属钠在乙醚溶液中作用,也能生成钠盐,但它遇水即 分解。这些说明酰胺具有弱酸性。
O C NH C O
邻苯二甲酰亚胺
36
2.酰胺脱水
酰胺与强脱水剂共热或高温加热,则分子内脱水生成腈,这
是合成腈最常用的方法之一。常用的脱水剂有五氧化二磷和亚硫
10
IR:
11
酰卤的C=O伸缩振动在1815~1785cm-1区域有强吸收,其C—X
的面内弯曲振动在645 cm-1附近。
12
酸 酐的 C=O伸 缩 振动 吸 收 与其它 羰 基 化合物 明 显不 同 , 在 1850~1800cm-1和1780~1740 cm-1区域内有两个C=O伸缩振动的强 吸收峰。线型酸酐的高频峰强于低频峰,而环状酸酐则相反。酸酐
26
酰基化试剂中离去基团离去的难易,取决于离去基团(L)的碱 性。碱性愈弱,愈易离去。离去基团L的碱性由弱到强的次序是:
C1—<RCOO—<RO—<NH2—。因此氯原于是最容易离去的基团,
而氨基则是最难离去的基团。即酰氯是最活泼的酰基化试剂,而酰 胺是最弱者。 离去基团碱性的强弱,可从其共轭酸的酸性强弱得知(强酸的 共轭碱是弱碱):
酯的醇解亦称酯交换反应。例如:
21
腈的醇溶液和浓硫酸或盐酸共热,则发生醇解反应得到酯。 例如:
22
3.氨解
酰氯、酸酐和酯与氨或胺作用,都可以生成酰胺。例如:
23
N-未取代的酰胺与胺反应生成N-取代酰胺。例如:
以上这些反应对羧酸衍生物是发生了水解、醇解或氨解;但对 水、醇或氨则是发生了酰基化反应。酰氯、酸酐和酯都是酰基化试 剂,酰胺的酰化能力极弱,一般不用作酰基化试剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OO CH2COOH CH3COCCH3
COOH
O O O
(B) 混酐的制备——酰卤与无水羧酸盐共热
O C H 3 C O O N a+ C H 3 C H 2 C C l
O O C H 3 C O C C H 2 C H 3+N a C l
(C) 二元羧酸制酐(成五元或六元环的)
CH2COOH CH2COOH
α-氢原子
亲核取代反应
一、酰基碳上的亲核取代(加成-消除)反应
(1)
亲核加成 R的性质影响
(2)
消除反应
•碱性越弱 越易离去
亲核反应活性
O C RX
酰卤
OO CC R O R'
酸酐
O C R OH
羧酸
O C R OR
酯
O C R' RN
R"
酰胺
酰卤 > 酸酐 > 羧酸 ~ 酯 > 酰胺 • 在亲核取代反应中,酰氯的活泼性最大,酸酐次之。 所以酰氯、酸酐在有机合成中常用为酰基化剂。
O
CH3 CH2 C OCH3
1 .1 5 2 .3 2
3 .6 7
O
CH3 CH2 C NH2
1 .1 5 2 .2 4
6 .2
13.3 羧酸衍生物的化学性质 羧酸衍生物分子结构通式如下
发生反应 部位
O R C C Z (Z = C l,O C R ,O R ',N H 2等 )
H
பைடு நூலகம்
羰 基
还原反应
二、 羧酸衍生物与格利雅试剂的反应
• 均可用来与格利雅试剂生成: 叔醇。
(1)酯与格利雅试剂的反应
第1步: 生成酮
第2步生成叔醇: 注意有2个支链是 一样的!
(2)酰氯与格利雅试剂作用
第1步生成酮
第2步生成叔 醇,2个支链 是一样的!
格氏试剂的应用(总结)
R COOH
羧酸
R CH2OH
1°醇
1.HCHO 2.H3O
1.CO2 2.H2O
O
O
OH
HCOR'
R CH 醛
RMgX
R CH R
2°醇
R
CH2CH2OH
1°醇
1. O 2.H3O
OH 1.R'CHO R CHR' 2.H3O
2°醇
R MgX
O
OH
R Li
R'COOR'' R CR' RMgX R C R'
酮
R
3°醇
1.R'COR''
O
OH
2.H3O
R'COCl
• 皂化——酯的碱性水解称为皂化。油脂(羧酸和丙三醇 生成的酯)碱性水解得到的高级脂肪酸盐就是肥皂。
• 酯的还原反应(常用的还原剂为钠加乙醇):
13.4.4 酰胺、酰亚胺、内酰胺
(1)酰胺的制备及特性 • 羧酸衍生物与氨作用 ; •腈化合物部分水解制备
CH3CH2CN
H2O,NaOH,6%~12%H2O2
•苯在特殊条件下才发生氧化使苯环破裂,例如:
(4)邻苯二甲酸酐——俗称苯酐
•主要用途--染料、药物、聚酯树脂、醇酸树脂, 塑料、涤纶等。
13.4.3 酯 • 由醇和羧酸在无机酸催化下酯化反应:
水解
• 酯也可在碱性条件下的水解:
O R COR'+OH-
OR COR'
OH
O R COH+-OR'
RCOO-+R'OH
RMgX
R CR'
R C R'
1. R'CN
OH
2.H3O
酮
R
R C R'
O
低温和空间位阻作用 3°醇
R''
R CR' 使用不活泼的金属试剂
3°醇
酮 可能将反应控制在酮的阶段
13.4 各类羧酸衍生物及其重要代表
一、 酰氯
(1)酰氯的制备
O 3 C H 3 C H 2 C H 2 C O H + P C l3
酰溴的制备:用PBr3
O 3 C H 3 C H 2 C H 2 C C l+ H 3 P O 3
O C H 3 (C H 2 )6 C O H + P C l5
COOH
O C H 3 (C H 2 )6 C C l+ P O C l3+ H C l
沸点196℃ 沸点107.2℃
COCl
+ SOCl2
例如:傅-克酰基化反应(P131)
1. 羧酸衍生物的水解 与水发生加成-消除反应生成相应的羧酸:
水解反应的难易次序:酰氯酸酐酯酰胺
• 酸催化的反应历程: • 碱催化的反应历程:
2. 羧酸衍生物的醇解——酯的生成
可 逆 反 应
• 一般难以制备的酯和酰胺,可通过酰氯来合成:
3. 羧酸衍生物的氨解——酰胺的生成 可逆反应,得到N-烷基酰胺,实际意义不大。
沸点79℃
+ SO2 + HCl
沸点197℃
(2)酰氯的还原
(a)
罗森门德还原法
O CC l H 2,p d -B aS O 4
硫 — 喹 啉
(b)
O CH
二、 酸酐 •酸酐中两个酰基相同的叫单酐; 不同的叫混酐.
(A) 单酐的制备
O
R C OH P2O5
R C OH 或乙酐
O
O RC R C O+ H2O
CH2COOH CH2
CH2COOH
O O + H2O OO O + H2O
脱水
(1)乙酸酐(简称乙酐,又名醋酐)
•主要用于制造醋酸纤维、燃料、医药和香料等。
• 工业上制醋酐(1)
• 乙酸钴-乙酸铜作催化 剂,2.5~5MPa、45~50℃, 氧气氧化。
• 工业上制醋酐(2) 乙酸与乙烯酮加成制取乙酐:
• 霍夫曼(Hofmann)酰胺降解反应
• 用于8个碳以下的酰胺降解反应.
RCONH2+NaOX+2NaOH
RNH2+Na2CO3+NaX+H2O
例1:
有时用NaOH,X2
伯胺 (减少一个碳)
+
(2)乙烯酮——是简单的不饱和酮
•作乙酰化剂。可看成乙酸分子内脱水而得的酸酐。
• 工业上制乙烯酮 ——乙酸或丙酮热解:
• 乙烯酮与含活泼氢的化合物反应——引入一个乙酰基: • 乙烯酮是有剧毒的气体,极易聚合成二聚体:
(3)顺丁烯二酸酐——又叫马来酸酐 主要用途:聚酯树脂、醇酸树脂,各种涂料和塑料等。
11第十三章羧酸衍生物
O
OO
O
O
R C X R C O C R' R C OR' R C NH2
酰卤
酸酐
酯
酰胺
( RCN)
腈
它们经水解反应可转变为羧酸。
• 乙酸乙酯的核磁共振谱
O
CH3 CH2 C Cl 1 .2 4 2 .9 3 O
(C H 3 C H 2 C H 2 C ) 2 O 1 .0 1 .6 9 2 .4 3
P2O5,
CH3CH2CONH2
•工业上的制备方法:羧酸铵盐加热脱水
• 取代酰胺的制备 •——由羧酸或羧酸衍生物与伯胺或仲胺作用:
• 该化合物简称DMF,能溶解多种难溶有机物和高 聚物。
• 酰胺还原生成伯胺,N-烷基或N,N-二烷基酰胺还原 生成仲胺或叔胺:
注意产物:与羧酸、酰氯、酯和 LiAlH4还原不一样!
