尹日晖水通道蛋白介绍
水通道蛋白研究进展

水通道蛋白研究进展蒲春霞【摘要】水通道蛋白广泛存在于生物体中的各组织部位,影响着生物机体水代谢的过程,随着分子生物学技术的进步,对水通道蛋白的基础研究已经比较深入和成熟.对水通道蛋白的研究情况进行概要综述,目的在于利用水通道蛋白研究的基础成果,阐释临床水代谢障碍类疾病的发病机理及提供可能的解决思路.【期刊名称】《成都大学学报(自然科学版)》【年(卷),期】2010(029)002【总页数】3页(P104-106)【关键词】水通道蛋白;水代谢;研究进展【作者】蒲春霞【作者单位】成都大学,医护学院,四川,成都,610017【正文语种】中文【中图分类】R329水通道蛋白(aquaporin,AQPs),最初由Agre等于1988年偶然在红细胞膜上发现,称为形成通道的整合膜蛋白28(CHIP),1991年,研究人员完成其cDNA克隆并进一步确定其为细胞膜上转运水的特异性通道蛋白,并称CHIP 28为AQP1.此后,又陆续从哺乳动物组织中鉴定出 9种水通道蛋白(AQP2~AQP10).目前,人们所发现的水通道蛋白均属晶体纤维中的主要内源性蛋白(major intrinsic protein, MIP)家族,后经证明MIP亦有弱的水通道活性,被命名为AQP0.这些相继发现的专一性运输水的通道蛋白被统称为AQPs[1,2].水通道蛋白分子的一级结构由2个分别位于肽链两侧的重复部分构成,各自拥有天冬酰胺—脯氨酸—丙氨酸(Asn-Pro-Ala,NPA)特征性序列,呈180°中心对称排列.每个分子包括6个跨膜区域和5个环(A、B、C、D、E),其中:B、D环及羧基、氨基末端均在胞内,A、C、E环定位于质膜外侧.B、E环显著疏水,E、B环的任何变异都会引起水通道活性的下降; A环有N-连接糖基化位点;E环NPA序列前的半胱氨酸是水通道蛋白的汞抑制部位[3].水通道的立体结构资料主要来源于AQP1的分子结构研究.AQP1在质膜中形成4聚体.在4个单体的中空部分含有独立的孔道,每一个孔道的大小约为一个单水分子,直径318A.孔道中间部位的正电荷阻止带电荷的质子和其他离子通过[3,4].水通道蛋白普遍存在于微生物、植物及动物界.例如,在啮齿类动物体内陆续发现的多种水通道蛋白具体分布如下:AQP0分布于眼睛的晶状体,AQP1分布于血管、肾近曲小管、眼睛和耳朵,AQP2分布于肾脏,AQP3分布于肾脏、呼吸、消化器官;AQP4分布于脑星形胶质细胞、眼、耳、骨骼肌、胃壁细胞和肾集合小管,AQP5分布于分泌性腺体,如唾液腺、泪腺、汗腺等,AQP6分布于肾集合小管细胞内小泡上, AQP7主要分布于睾丸,AQP8分布于肾脏,睾丸和肝脏,AQP9分布于肝脏和白细胞,AQP10分布于肠腔内.研究还发现,人类的胰腺组织有大量的AQP1和AQP5表达[5,6].根据AQPs的渗透特异性可将AQPs的作用分为2类:第一类只对水有渗透性,包括AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8;第二类除转运水之外,还对其他小分子溶质有渗透性,尤其是甘油,其包括AQP3、AQP7、AQP9、AQP10.按照AQPs在各组织系统中所发挥的作用,水通道蛋白可具体归纳如下:2.1 泌尿系统对AQP1~AQP4转基因小鼠体液代谢的研究结果揭示了AQP在整体肾功能的生理学作用.缺失AQP1的小鼠多表现中度多尿,尿渗透压明显降低,而同时缺乏AQP1和AQP3的小鼠则呈现严重多尿. AQP4的基因敲除则较轻地影响小鼠尿浓缩能力.AQP1分布在近曲小管的顶膜和基底膜,在近曲小管的液体重吸收过程中起重要作用.AQP1缺失将导致髓袢降支细段的水通透性降低10倍,此也表明AQP1是该段的主要水通道.AQP2、AQP3和AQP4共同参与集合管尿浓缩过程.AQP3和AQP4表达在集合管上皮细胞的基底外侧膜.AQP3主要分布在皮质和外髓集合管,而AQP4在内髓集合管.基因敲除小鼠实验结果表明,在尿浓缩能力方面,AQP3比AQP4起更重要的作用.AQP4缺失只表现最大尿浓缩能力的轻微降低.这个实验结果支持水主要在集合管的皮质和外髓段被重吸收的理论.此外,AQP2突变可引起人遗传性肾性尿崩症[7-9,15].2.2 神经系统相关研究表明,AQP1~AQP5、AQP8、AQP9在啮齿类动物脑中均有表达.AQP1是在脉络丛上皮细胞发现的,是脉络丛上的主要水转运蛋白,与脑脊液的形成和流动有关.AQP4主要在神经胶质细胞膜、内层室管膜、小脑、海马、齿状回、室上核和视旁核表达.Tsukaguchi等在星形胶质细胞中发现AQP9的mRNA表达,Badaut等于2001年在小鼠脑中发现AQP9蛋白表达,另外,在白质区域发现了AQP4和AQP9表达.AQP9协助AQP4促进水在脑脊液与脑组织之间的流动.T omas等发现注射脂多糖(LPS)可使小神经胶质细胞充分表达AQP4蛋白和AQP4 mRNA,提示血脑屏障的破坏、脑水肿与AQP4表达密切相关[9-10].Nicchia等通过改变细胞外的渗透压来研究体外培养的星形胶质细胞容积的改变,结果发现细胞容积的改变与AQP4蛋白有关[11,12,14,20].在成年老鼠脊髓内AQP4主要位于灰质的神经胶质细胞和脊髓白质星形胶质细胞的血管周足上,AQP9主要位于白质内神经胶质纤维酸性蛋白反应性的星形胶质细胞,AQP8主要位于室管膜内层.这些蛋白与脊髓内水的正常流动密切相关[12,13].2.3 消化系统相关研究证明,消化系统的多个器官与水代谢密切相关.唾液腺表达多个水通道蛋白,例如AQP1在血管内皮,AQP4在导管上皮,而AQP5则在腺泡细胞顶膜.AQP5敲除小鼠的唾液分泌量明显减少,唾液的盐浓度增高,但AQP1和AQP4敲除小鼠未见明显异常[15],此表明,AQP5在腺体分泌功能方面起主要作用.AQP4虽然在分泌胃酸的胃壁细胞表达,但AQP4敲除并不影响胃酸的分泌.AQP1表达在脂肪消化吸收相关的胃肠道多个部位,包括肝细胞、胰腺血管内皮、小肠乳糜管和胆囊[11,12].2.4 呼吸系统哺乳动物的肺组织至少包括种3种AQP水通道蛋白,AQP1位于直径0.3 mm的微血管内皮细胞上,AQP4位于气道上皮细胞,AQP5位于肺泡上皮细胞.最新研究发现,AQP3不仅存在于主气道,而且也分布于细支气管内,与肺水肿密切相关[6,17].2.5 其他系统AQP1在腹膜的毛细血管内皮细胞表达,AQP1敲除导致腹腔液体吸收速度降低215倍,提示AQP1在腹膜透析过程中起重要作用.肌肉组织表达高水平的AQP4,但AQP4缺失并不引起肌肉的功能改变.AQP1存在于眼非色素睫状上皮和小梁网内皮. AQP1敲除明显降低眼球内压.由于表达部位不同, AQP1缺失引起角膜厚度变薄,但AQP5缺失却增加角膜厚度.皮肤中存在的AQP3对维持皮肤的弹性和湿度有重要作用,甘油则可改正由AQP3缺失造成的皮肤弹性和湿度降低[13,14].2.6 其他功能相关研究证实,AQP4参与钾离子的缓冲,与听觉功能相关.AQP0突变可引起白内障功能变化[15,16].AQPs的调节机制可以大致分为3种:第一种是通过调节AQP的活性来调节其功能.AQP1、AQP2、AQP4、AQP5都含有蛋白激酶 A(protein kinase A, PK A)和蛋白激酶C(PKC)磷酸化的同源序列,这些水通道受磷酸化作用直接调节.研究表明,磷酸化和AQP的运输、门控以及重新分布有关.AQP1、AQP2、AQP4、AQP5的磷酸化作用提示体内可能存在短时快速调节膜水通道的生理机制.第二种是至少有3种哺乳动物的水通道蛋白直接为pH值所调节.第三种是通过改变膜上AQP的含量来调节跨膜水流动,例如AQP1、AQP2、AQP5、AQP8在某些物质的作用下可进行重新分布,这种调节方式主要通过胞吐及内吞作用使水通道蛋白在胞内贮存囊泡与质膜之间不断地循环,从而调节膜对水的通透性[4,9,10,19,20].AQPs发现至今已超过10年,研究人员利用分子生物学和生理学研究手段对AQPs 的结构与功能有了相当深刻的了解.随着人们对AQPs研究的不断深入,将不仅为有机体水转运的生理现象提供分子解释,而且还将促进人类对某些因水平衡紊乱而引起的疾病的发病机理的进一步认识,从而为对其的有效治疗提供理论依据.【相关文献】[1]Preston G M,Carroll T P,Guggino W B,et al.Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein[J].Science,1992,256(5055):385-387.[2]Benga G.Birth of water channel proteins——the aquaporins [J].Cell Biol Int,2003,27(9):701-709.[3]刘树荣,张少斌.水通道蛋白结构与功能研究进展[J].现代预防医学,2007,34(12):2260-2261.[4]Nemeth C KL,Kalman K,Hall J E.Molecular basis of PH and Ca2+regulation of aquaporin water permeability[J].The Journal of General Physiology,2004,123(5):573-580.[5]马磊,何华.兴奋或则抑制汗液分泌对小鼠汗腺水通道蛋白免疫定位的影响[J].中国组织化学与细胞化学杂志,2008,17(6);555-556.[6]T owne J E,Krane CM,Bachurski CJ,et al.Tumor necrosisf actoralpha inhibits aquaporin-5expression in mouse lungepit helial cells[J].J Biol Chem,2001,276(22):18657-18664.[7]范亚平,蒋季杰.水通道蛋白与肾脏[J].国外医学泌尿系统分册,2001,21(5):215-219.[8]Gradilone S A,Garcia F,Huebert R C,et al.Glucagon induces the plasma membrane insertion of functional aquaporin-8water channels in isolated rathepatocytes[J].Hepotology,2003,37 (6):1435-1441.[9]Benga G,Popescu O,Borza V,et al.Water permeability inhuman erythrocytes:Identification of membrane proteins involved in water transport[J].Eur J CellBiol,1986,41(2):252-262.[10]Verkman A S.Applications of aquaporin inhibitors[J].Drug News Perspect,2003,14(7):412-420.[11]Yasui M,Hazama A,K won T H,et al.Rapid gating and anionpermeability of an intracellular aquaporin[J].Nature,1999, 402(67):184-187.[12]Yang B,G illespie A,Carlson EJ,et al.Neonatal mortality in an aquaporin-2knock-in mouse model of recessive nephrogenic diabetes insipidus[J].J Biol Chem,2001,276(4):2775-2779.[13]Verkman A S,Yang B,Song Y,et al.Role of water channelsin fluid transport studied by phenotype analysis of aquaporin knockout mice[J].Exp Physiol,2000,85(1):233-241. [14]Kageyama Y,Ishibashi K,Hayashi T,et al.Expression of aquaporins-7and-8in the developing rat testis[J].Andrologia, 2001,33(3):165-169.[15]Ma T,YangB,G illespie A,et al.Severely impaired urinary concentrating ability in transgenic mice lacking aquaporin-1water channels[J].J Biol Chem,1998,273(8):4296-4299.[16]Ma T,YangB,G illespie A,et al.Generation and phenotype of a transgenic knock-out mouse lacking the mercurial-in sensitive water channel aquaporin-4[J].J ClinInvest,1997,100(5):957 -962.[17]Verkman A S,Li J,Ma T,et al.Role of aquaporin waterchannels in kidney function studied using transgenic mice[J].Clin Exp Nephrol,2001,5(1):75-84.[18]Verkman A S.Aquaporin water channels and endothelial cellfunction[J].JAnat,2002,200(6):617-627.[19]Hara M,Verkman A S.Glycerol replacement corrects defective skinhydration,elasticity,and barrier function in aquaporin-3-deficient mice[J].Proc Natl AcadSci USA,2003,100(12):7360-7365.[20]Ward D T,Hammond T G,Harris H W.Modulation of vasopressin-elicited water transport by trafficking of aquaporin-2-containing vesicles[J].Annu Rev Physiol,1999,61(1):683-697.。
通道蛋白:生命的分子门禁

通道蛋白:生命的分子门禁
吴霞琴
【期刊名称】《科学(上海)》
【年(卷),期】2004(056)001
【摘要】@@ 所有生物都是由细胞构成的,一个人体大约有100亿个细胞.不同的细胞,如肌细胞、肾细胞和神经细胞等构成了人体的各种复杂系统.
【总页数】3页(P49-51)
【作者】吴霞琴
【作者单位】上海师范大学生命与环境科学学院教授
【正文语种】中文
【中图分类】Q25-19
【相关文献】
1.水通道蛋白磁共振分子成像与水通道蛋白4表达的相关性研究 [J], 陈秋雁;吴富淋;彭晓澜;李春丽;江敏;陈婷婷;魏鼎泰
2.水通道蛋白分子靶向治疗和分子靶向成像研究进展 [J], 辛军;孙天娇;张新;杨帆;李宏利;赵周社;郭启勇
3.狭鳕鱼皮胶原蛋白肽经由水通道蛋白质3信号分子对过氧化氢诱导的HaCaT细胞氧化损伤的保护作用 [J], 张艳;徐宏伟;韩彦弢;张德岩;苗德森;谢靖
4.利用ForteBio OctetRed多通道生物分子相互作用系统非标记实时检测小分子和蛋白质结合的动力学常数 [J], 杨淑静
5.膜通道的分子学多样性、疾病基因(2) 细胞膜·膜蛋白·通道蛋白·离子通道·门通道[J],
因版权原因,仅展示原文概要,查看原文内容请购买。
水通道蛋白的名词解释

水通道蛋白的名词解释水通道蛋白是一类存在于生物体细胞膜上的蛋白质,其主要功能是调节细胞内外水分的平衡。
这些蛋白质以其独特的细胞膜通透性,通常被形容为“细胞的水渠”。
尽管细胞膜对水具有一定的渗透性,但水通道蛋白的出现使得水分的跨膜运输变得更加高效和方便。
水通道蛋白主要通过形成一个微小的通道,让水分子直接穿过细胞膜,从而加速细胞内外的水分交换。
水通道蛋白最早被发现于红细胞膜,其中最为著名的是被称为Aquaporin-1(AQP1)的蛋白质。
AQP1被发现能够高效地传输水分子,使其成为研究者们研究水通道蛋白的重要起点。
此后,越来越多的水通道蛋白被发现,它们在各种生物体的细胞膜上广泛存在。
水通道蛋白家族主要包括两类:小分子量蛋白(20~35kDa)和大分子量蛋白(约为50~90kDa)。
小分子量蛋白包括AQP1、AQP2和AQP4等,它们主要负责水分子的传输。
大分子量蛋白则包括AQP0、AQP5和AQP6等,除了与水分交换有关,这些蛋白质还可能参与其他细胞功能的调节。
水通道蛋白在生物体中具有广泛而重要的作用。
例如,在人体内,水通道蛋白在器官和组织中起着维持水分平衡的关键作用。
当体内水分过多或过少时,水通道蛋白能够根据需要调整细胞膜的通透性,控制水分大量吸收或排泄。
这一过程在保持人体内部环境稳定方面非常重要。
此外,水通道蛋白还在植物、昆虫、微生物等生物体中发挥着类似的功能。
在植物体内,水通道蛋白不仅参与了水分的吸收和输送,还对维持细胞渗透稳定性和调节植物生长发育起到了重要作用。
在昆虫和微生物中,水通道蛋白也发挥着类似的水分调节作用,确保它们能够在不同环境下生存和繁衍。
随着科学技术的发展,研究人员对水通道蛋白进行了深入的研究。
他们通过结构生物学、细胞生物学以及分子生物学等多种手段,揭示了水通道蛋白的分子结构和生理功能,并进一步研究了其与疾病之间的关系。
例如,某些疾病,如肾脏功能障碍、肿瘤、水肿等,与水通道蛋白的异常表达或功能失调密切相关。
水通道蛋白与白内障研究进展

水通道蛋白与白内障研究进展魏远建;徐国兴【期刊名称】《国际眼科杂志》【年(卷),期】2013(13)7【摘要】水通道蛋白(aquaporins,AQPs)主要介导自由水沿渗透压梯度的被动跨生物膜转运,对水有高度选择性.晶状体只有两种水通道蛋白,晶状体上皮细胞表达的AQP1和晶状体纤维细胞表达的AQP0,它们共同调节晶状体水代谢,维持晶状体生理功能及透明性,其异常表达可导致白内障的发生.术文综述了近年来对水通道蛋白0,1的研究,并讨论水通道蛋白与白内障发生的关系.%Water channel protein ( aquaporins, AQPs) mainly mediates the passive transport of free water along the osmotic pressure gradient to across biological membrane. It is highly selective for water. There are only two kinds of water channel protein in lens, lens epithelial cells express AQP1, lens fiber cells express AQPO, together they adjust the lens water metabolism, physiological functions and maintain the lens transparency, their abnormal expression can lead to cataracts. We reviewed the research of the water channel protein 0, 1 in recent years and discussed the relationship between water channel protein and cataract.【总页数】3页(P1341-1343)【作者】魏远建;徐国兴【作者单位】350005,中国福建省福州市,福建医科大学附属第一医院,福建省眼科研究所;350005,中国福建省福州市,福建医科大学附属第一医院,福建省眼科研究所【正文语种】中文【相关文献】1.水通道蛋白 0和水通道蛋白 1在老年性白内障及透明晶状体前囊膜上皮细胞的表达 [J], 高炜;赖建武;李斌;刘垠;宋天勤;俞青2.水通道蛋白-0与白内障关系的研究进展 [J], 杨扬;张虹3.氯通道蛋白-3和水通道蛋白-1在大鼠半乳糖性白内障晶状体中表达水平的变化[J], 丁熊;王平;陈瑜;赵婷;仲苏鄂4.水通道蛋白与年龄相关性白内障关系的研究进展 [J], 占志云;徐国兴5.水通道蛋白与先天性白内障研究进展 [J], 赵靖康;刘旭;何媛因版权原因,仅展示原文概要,查看原文内容请购买。
水通道蛋白的基本结构与特异性通透机理

水通道蛋白的基本结构与特异性通透机理王晶桑建利(北京师范大学生命科学学院北京100875 )摘要水通道蛋白是一个具有跨膜运输水分子功能的蛋白家族。
从1988 年Agre 等发现水通道蛋白起,目前在不同物种中已经发现了200 余种水通道蛋白,其中存在哺乳动物体内的有13 种。
概述了水通道蛋白的结构、组织特异性分布及特异性通透机理。
关键词水通道蛋白水分跨膜转运水分子的跨膜转运对维持不同区域的液体平衡和内环境稳态非常重要。
水分子作为一种不带电荷且半径极小的极性分子,很早被证实能通过自由扩散穿透脂质双分子层。
在发现水通道蛋白以前,人们一直认为这是水分子透过质膜的唯一方式。
但通过实验发现,红细胞和肾小管细胞中水的通透速率之快远非简单扩散强度所能提供的,因此猜测,质膜上可能存在某种通道介导水的转运。
1 水通道蛋白的发现1988年,Agre等从人类红细胞膜上纯化分离分子量为32X 106的Rh多肽时,偶然鉴定到一种新的分子量为28X 106的整合膜蛋白,并且通过免疫印迹发现这类蛋白也存在于肾脏的近端肾小管中[1],把它称为类通道整合膜蛋白(channel-like integralmembrane protein, CHIP28。
随后,在1991 年Agre 和Preston成功克隆得到了CHIP28的cDNA通过分析其编码的氨基酸序列,发现CHIP28含有6个跨膜区域、2个N-糖基化位点、且N端和C端都位于膜的胞质一侧。
另外,对比CHIP28 与早期从牛晶体纤维中克隆得到的主要内源性蛋白(major intrin sicprotei n,MIP )的DNA序列,发现二者具有高度同源性。
由于很早以前就证实了MIP 家族的成员蛋白参与形成允许水和其他小分子通透的膜通道,因此,推测CHIP28 可能也具有类似功能[2]。
1992 年,Preston 等通过在非洲爪蟾的卵母细胞中表达CHIP28,首次证实它是一种水通道蛋白。
水通道蛋白
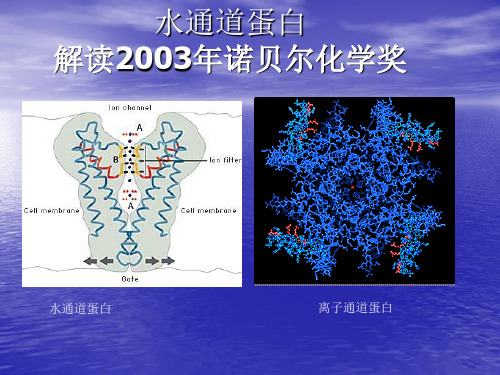
水通道蛋白的发现
Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现 了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜 蛋白28(channel-forming inte—gral membrane protein, CHIP28),1991年完成了其eDNA克隆(Verkman,2003)。 但当时并不知道该蛋白的功能,在进行功能鉴定时,将体 外转录合成的CHIP28 eDNA注入非洲爪蟾的卵母细胞中, 发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min内破 裂。为进一步确定其功能,又将其构于蛋白磷脂体内,通 过活化能及渗透系数的测定及后来的抑制剂敏感性等研究, 证实其为水通道蛋白。从此确定了细胞膜上存在转运水的 特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
•
20世纪80年代中期,美国科学家彼得· 阿格雷研究了不 同的细胞膜蛋白,经过反复研究,他发现一种被称为水通 道蛋白的细胞膜蛋白就是人们寻找已久的水通道。为了验 证自己的发现,阿格雷把含有水通道蛋白的细胞和去除了 这种蛋白的细胞进行了对比试验,结果前者能够吸水,后 者不能。为进一步验证,他又制造了两种人造细胞膜,一 种含有水通道蛋白,一种则不含这种蛋白。他将这两种人 造细胞膜分别做成泡状物,然后放在水中,结果第一种泡 状物吸收了很多水而膨胀,第二种则没有变化。这些充分 说明水通道蛋白具有吸收水分子的功能,就是水通道。
学奖。
Peter Agre
Roderick MacKinnon
• 2000年,阿格雷与其他研究人员
一起公布了世界第一张水通道蛋 白的高清晰度立体照片。照片揭 示了这种蛋白的特殊结构只允许 水分子通过。 • 水通道的发现开辟了一个新的研 究领域。目前,科学家发现水通 道蛋白广泛存在于动物、植物和 微生物中,它的种类很多,仅人 体内就有11种。它具有十分重要 的功能,比如在人的肾脏中就起 着关键的过滤作用。通常一个成 年人每天要产生170升的原尿, 这些原尿经肾脏肾小球中的水通 道蛋白的过滤,其中大部分水分 被人体循环利用,最终只有约1 升的尿液排出人体。
水通道蛋白

细胞就好像一个交通繁忙的城市,进出城的城门就是细胞膜上的离子通道。
那么,细胞是如果调控它与外界的交通运输的呢?新的研究发现一个甘油分子直径上的“一埃”(长度单位)的差异都可能使它变成一个封锁道路的信号;除非你是一部滑溜溜的具有水分子尺寸的“先进”跑车,才可能勉强通过。
这些车道就在水通道蛋白(apuaporins)中。
水通道蛋白是一类形成所有生命形式的细胞屏障中膜转移通道的蛋白质,它们容许水在细胞和它的周围环境间运动。
水通道蛋白的一个亚家族还可容许稍微大点的分子如甘油通过。
在人类中,已经确定出了11种水通道蛋白,其中的大部分存在于肾脏、大脑和眼睛中。
这种蛋白功能的损伤与多种疾病有关。
美国伊利诺斯州大学贝克曼高等科技研究所理论和计算机生物物理学研究组的研究人员对这种水通道蛋白进行了深入的研究。
通过利用“拉伸分子动力学”(steered molecular dynamics,生物通注),贝克曼的研究人员解开了数年来蛋白结晶法无法破解的谜团。
这项研究的结果公布在8月的Structure上。
研究人员证明使得一个水通道蛋白成为一个甘油通道的主要结构差异在于它比一个普通的水通道加宽仅仅一埃(一埃等于10-7毫米)。
即使甘油分子也像水分子通过水通道那样排列起来,但它微微“肥胖”的体形也会使它难以幸免。
除了入口点即一个“选择性过滤器”非常窄外,还存在其他阻止这个路径的严密的屏障。
膜蛋白很难结晶,因此到目前为止许多膜蛋白的结构还没有确定出来。
近年来,这个研究组已经确定出了四种水通道蛋白的结构。
在最新的研究中,他们集中调查了其中的两种蛋白。
这两种蛋白都来自线虫。
两个蛋白中,一个是水通道,一个是甘油通道。
由于它们结构很相似,所以研究人员试图通过突变位于通道孔的氨基酸来将水通道转化成一个甘油通道或其他通道,但以失败告终。
研究的线虫蛋白是水通道AqpZ和甘油通道GlpF。
通过对计算机产生的图像进行平行比较,研究人员发现这些通道在本质上似乎是相同的。
水通道蛋白简介

上图:注入水通道蛋白AQP1mRNA的蛙卵细胞在蒸馏水中迅速膨胀 下图:正常蛙卵细胞
水通道蛋白的性质
• 水通道蛋白家族主要存在于动物和植物中, 除一部分水通道蛋白允许少量甘油通过外, 其余的水通道蛋白只允许水分子快速通过。 AQP1就是一个只存在于哺乳动物体内的特 异性的水通道蛋白,它在哺乳动物中的保 守性非常好。 • 水通道蛋白传输水的速率大概是自由扩散 的25倍,每秒能通过30亿个水分子。
水通道蛋白的发现
• 阿格雷小组使用蛙的卵细胞进行这种蛋白 的功能测试。 • 将这种蛋白的mRNA注射到蛙卵细胞中,使 其细胞膜上具有这种蛋白。然后将蛙卵放 入蒸馏水中,结果卵细胞迅速吸水膨胀破 裂。 • 这个蛋白被命名为水通道蛋白,官方命名 为AQP1。 • 人们又陆续发现了10种水通道蛋白,构成 了水通道蛋白家族的主体。
• 其中,罗德里克· 麦金农是因为钾离子通道 蛋白结构和机理研究上的贡献获奖
水如何进入细胞?
b. 不同分子通过人工脂双层的渗透系数(cm/s)(引自B. Alberts等)
问题的提出
• 在人工脂双层的通透性实验中可知,水分 子可以以自由扩散的方式穿过脂双层。但 是在一些要求高通透性的细胞中水分子的 扩散速度是很缓慢的,例如红细胞、肾小 管、唾液腺等。 • 在20世纪50年代到80年代,很多研究红细 胞的学者提出在红细胞膜上应该有可以运 输水的蛋白。而且用汞的化合物处理红细 胞膜可以抑制水的转运,由此推断运输水 的蛋白应该是含巯基的蛋白。
水通道蛋白的发现
• 第一个水通道蛋白的发现和纯化纯属意外 收获。1988年,阿格雷的小组在研究Rh抗 原的过程中,总有一种28kDa的蛋白质被同 时提纯。开始认为是大的多肽的降解产物, 后来发现在红细胞膜上这种蛋白非常丰富, 大约每个红细胞上有200,000个。而且从结 构上分析它应该是一种通道。后来在肾小 管中也提取出了这种蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20世纪90年代初,Wayne等指出在植物的质 膜上存在着水分运输通道。
1992年第一次分离出具有水分运输特性的 蛋白CHIP28(channel-forming protein
of 28 ku),它是红细胞质膜内在蛋白,在质膜上 形成水分选择性运输通道,由约翰霍普金斯 大学医学院的彼得·阿格雷发现,他与通过X 射线晶体学技术确认钾离子通道结构的洛 克斐勒大学霍华休斯医学研究中心的罗德 里克·麦金农共同荣获了2003年诺贝尔化学 奖。
Ups and downs of a transcriptional landscape shape iron deficiency associated chlorosis of the maize inbreds B73 and Mo17
与玉米自交系B73和Mo17萎黄病相关的转录景观形 状缺铁性的起伏
水通道蛋白
液泡膜内在 蛋白(TIPs)
质膜内在蛋 白(PIPs)
NLM蛋白 (Nodulin 26 like MIPs)
1 magggdhsqt ngghvdqral eegrkeefad qgcaamvvsv pfiqkiiaei fgtyflmfag
61 cgavtinask ngqitfpgva ivwglavmvm vyavghisga hfnpavtlaf atsgrfpwrq
Developing Maize Leaf
通过对发育中的玉米叶的全基因组分析揭示 了水通道蛋白Байду номын сангаас横跨膜的溶质转运蛋白间 的相关性。
水通道蛋白介绍
尹日晖
水通道蛋白(Aquaporin)又名水孔蛋白
Discovery
误解:自由扩散
后来慢慢注意到动植物的一些器官、组织 具有独特的水分运转能力,远非只凭扩散 运输所能解释的。
例:人的肾脏细胞平均每昼夜要过滤180L 的水,植物在种子萌发及花粉管伸长时要 伴随着由体积增大而发生的水分快速吸收
1997年被基因组命名委员会重命名为AQP1
AQP1的发现,掀起了人们分离、鉴定水孔蛋 白(亦称水通道蛋白)的高潮。
短短几年内,人们已在细菌、酵母、动物、植 物中分离出许多水孔蛋白同源基因。
植物中第一个水孔蛋白C-TIP是由Maure等于 1993年从拟南芥中分离出来的,属于植物 水孔蛋白中液胞膜内在蛋白(Tonoplastmembrane intrinsic protein,TIP)。
植物质膜内在蛋白( Plasma membrane intrinsic protein, PIP) 也是在拟南芥中首次发 现的。
植物水通道蛋白根据序列同源性可以分为3 类: 质膜内在蛋白(PIPs) 、液泡膜内在蛋白 (TIPs) 和类根瘤素26蛋白(Nodulin 26 like MIPs, NLMs)
Herbivory of maize by southern corn rootworm induces expression of the major intrinsic protein ZmNIP1;1 and leads to the discovery of a novel aquaporin ZmPIP2;8
/interactive/8E QJWE/models/
Function
水通道蛋白在植物体内形成水选择性运输 通道, 在植物种子萌发、细胞伸长、气孔运 动、受精等过程中调节水分的快速跨膜运 输。
有些还在植物逆境应答中起着重要作用,研 究水孔蛋白与植物抗旱性的关系引起了广 泛关注。
南方玉米根虫的食草性减弱了主要内在蛋白 ZmNIP1;1的表达并且引导了一种新型水通道蛋白 ZmPIP2;8的发现
Correlation of Aquaporins and Transmembrane Solute Transporters Revealed by Genome-Wide Analysis in
正如其命名一样, PIPs主要分布在细胞质
膜上, TIPs主要分布在细胞液泡膜上,而NLMs 蛋白中除了NOD26(Nodulin26)已知分布在细 菌与植物的共生膜上外其他成员在细胞中 的定位未知。NLMs中的NOD26, 除运输水分 以外, 对甘油、甲酰胺等不带电的溶质分子 也具有较高的通透性。
121 lpayvlaqml gatlasgtlr lmfggrhehf pgtlptgsev qslvieiitt fylmfvisgv
181 atdnraigel aglavgatil lnvliagpvs gasmnparsv gpalvsgeyt siwvyvvgpv
241 vgavagaway nlirftnkpl reitkstsfl kstsrmnsaa sa
