MEGAZYME直链淀粉试剂盒说明书
直链淀粉含量检测试剂盒说明书 微量法

直链淀粉含量检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4265规格:100T/96S产品简介:直链淀粉是D-葡萄糖基以α-(1,4)糖苷键链接的多糖链,直链淀粉含量影响着食品的食用品质和外观品质,与食品安全息息相关。
直链淀粉和碘形成蓝色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到直链淀粉含量。
试验中所需的仪器和试剂:可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体110mL×1瓶,4℃保存;试剂二:乙醚100mL×1瓶,自备;试剂三:液体55mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体0.5mL×1支,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg直链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的直链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、直链淀粉的提取:称取0.005g烘干样本于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计/酶标仪预热30min以上,调节双波长至550nm和485nm,蒸馏水调零。
抗性淀粉试剂盒说明书

抗性淀粉检测试剂盒K-RSTAR(100次分析)前言抗性淀粉(RS)是指在人小肠内不能被酶解的淀粉,在大肠部分或完全发酵。
RS是总膳食纤维的组分之一。
原理(AOAC法 ;AACC法32-40)抗性淀粉的测定方法:样品使用α-胰淀粉酶和淀粉葡糖苷酶(AMG)37℃振荡水浴孵育16小时,在这期间,通过两种酶的联合作用,非抗性淀粉被溶解,水解成D-葡萄糖,孵育结束后,加入等体积的乙醇或工业甲基化酒精(IMS,变性乙醇)终止反应。
离心上述溶液,收集上清勿弃,底部残留絮状团即为样品中的RS,用含水的IMS或乙醇(50%v/v)洗涤絮状团,洗涤后离心,再重复一次洗涤离心,收集离心后获得的上清,与之前收集的上清混合。
小心倒出试管残留的液体,将絮状团置于冰水浴中,加入2M KOH溶解,溶解的同时用磁力搅拌机剧烈搅拌。
用醋酸盐缓冲液将这个溶液调至中性,用AMG将淀粉定量水解成葡萄糖。
D-葡萄糖用葡糖氧化酶/过氧化物酶试剂(GOPOD)测定,这也是对样品中RS含量的测定。
非抗性淀粉(可溶性淀粉)的测定可通过集中的上清液并定容至100mL,再用GOPOD测定D-葡萄糖完成。
应用性和精确性这个方法需要样品中RS含量多于2% w/w。
如RS含量多于2% w/w,常规标准误差为+5%。
少于2% w/w RS的误差更高。
试剂盒瓶子1:淀粉葡糖苷酶AMG,12 mL,3300U/ mL,条件为,40℃下,底物为可溶性淀粉,[单位或为200U/mL,条件为,40℃下,底物为对硝基苯基β-麦芽糖苷]。
AMG溶液应完全没有可检测到的游离D-葡萄糖。
4℃下稳定性> 3年。
瓶子2:α-胰淀粉酶(胰酶,10g,3Ceralpha U/mg)。
4℃下稳定性> 3年。
瓶子3:GOPOD 试剂缓冲液。
磷酸钾缓冲液(1M,),对羟基苯甲酸(0.22M)和叠氮化钠(%W/V)。
4℃下稳定性> 3年。
瓶子4:GOPOD试剂酶。
葡糖氧化酶(>12,000U)加上过氧化物酶(>650U)和4-氨基安替比林(80mg)。
α-淀粉酶检测试剂盒(速率法)产品说明书

α-淀粉酶检测试剂盒(速率法)说明书[产品名称] 通用名称:α-淀粉酶检测试剂盒(速率法)英文名称:α-Amylase Aassay Kit(α-Amy)[包装规格] R:2×20ml;R:3×20ml;R:6×20ml;R:6×60ml;R:4×25ml。
[预期用途] 用于体外定量检测人血清中的α-淀粉酶的活力。
[检验原理]α-AMYGal-G2-α-CNP Gal-G2 + CNPCNP(2-氯-4-硝基苯酚)的生成在波长405nm处吸光度上升,上升的速率与α-AMY活力成正比。
[主要组成成份]由试剂R组成。
试剂R:2-氯-4-硝基苯-α-半乳糖-麦芽糖苷(Gal-G2-α-CNP)、三羟甲基氨基甲烷(Tris)缓冲液。
[储存条件及有效期] 试剂盒在2℃~8℃、无腐蚀性气体条件下避光储存,有效期为12个月,开瓶后2℃~8℃条件下保质期30天。
备注:生产日期及失效日期见外盒或瓶标签。
[适用仪器]日立7170、奥林巴斯AU640、贝克曼LX-20全自动生化分析仪。
[样本要求]使用新鲜的非溶血血清。
[检验方法](1)单试剂无需配制,直接使用。
(2)试验条件:样本(S):5 µl 试剂 (R) :250 µl 温度:37 ℃测定类型:速率法主波长:405 nm 副波长:660nm 反应方向:上升方法:先将样本与R1混合,37 ℃测定2分钟至4分钟之△A/min 。
0 2 4 10 (反应时间:10min)37℃样本:5 µlR:250 µl(3)校准程序:每天进行试剂空白测试。
(4)质量控制程序:选用适当的质控品进行质量控制。
各实验室建立各自的质控频率和可接受范围值。
当测定结果超出可接受范围时,有必要采取相应措施。
(5)计算△A / min × Vt × 1000 △A/ min × 0.255 × 1000α-AMY(U/L)= ————————————— = ———————————————— Lp ×ε× Vs 1.0 × 13.4 × 0.005= △A / min × 3806Vt:反应总体积 0.255 mlVs:样品体积 0.005 mlε:摩尔吸光系数13.41000:将 U/ml 转换成了U/LLp:比色光径(1.0 cm)[参考区间] 血清:< 220 U/L (建议各实验室建立自己的正常参考范围。
各类淀粉的消化性能

抗性淀粉 RS(%)=[TS -(RDS + SDS)]/TS × 100 式中:G20 为淀粉酶水解 20min 后产生的葡萄糖含量 (mg);FG 为酶水解处理前淀粉中葡萄糖含量(mg);G120 为淀粉酶水解 120min 后产生的葡萄糖含量(mg);TS 为 样品中总淀粉含量(mg)。 1.3.3 淀粉的糊化特性研究 淀粉的糊化特性测定采用 AACC 提出的标准方法 61-02[8]并进行改良。准确称取 3g 淀粉(水分含量 14%), 加入 25ml 蒸馏水,混合于 RVA 专用铝盒内,调成一定 浓度的淀粉乳。具体测定条件:50 ℃下保持 1min ;以 5℃/min 的速度上升到 95℃(9min);95℃下保持 7min; 以 6℃/min 下降到 50℃(7.5min);50℃下保持 4.5min;搅 拌器在起始 10s 内转动速度为 960r/min,之后保持在 160r/min。测得淀粉糊黏度曲线,并通过 RVA 专用测试 软件 T C W 分析得到 6 个特征参数:峰值黏度( p e a k viscosity,PV)、谷值黏度(trough viscosity,TV)、最 终黏度(final viscosity,FV)、崩解值(breakdown,PVT V ) 、回值( s e t b a c k ,F V - P V ) 及成糊温度( p e a k t e m p e r a t u r e ) 。黏滞性值用“C P s ”作单位表示。
p < 0.05; r= - 0.978, p < 0.01, respectively). For tuber starches, the breakdown value is negatively correlated with SDS (r= -
特色香蕉类型‘美食蕉’品种果肉中淀粉与矿物质在后熟期的变化

特色香蕉类型‘美食蕉’品种果肉中淀粉与矿物质在后熟期的变化傅金凤1,2,王 娟1,*,王 琳1,盛 鸥2,*(1.华南理工大学食品科学与工程学院,广东 广州 510641;2.广东省农业科学院果树研究所,农业农村部南亚热带 果树生物学与遗传资源利用重点实验室,广东省热带亚热带果树研究重点实验室,广东 广州 510640)摘 要:目的:以新选育的抗枯萎病特色香蕉栽培类型‘美食蕉’(Plantain)品种(‘美食蕉1号’、‘美食蕉2号’)为研究对象,比较其与鲜食香蕉栽培类型‘香牙蕉’(Cavendish)品种(‘中蕉8号’)在后熟期间果肉中淀粉质量分数和矿物质含量的变化,以期为美食蕉品种资源的利用提供参考。
方法:采用比色卡和色差仪进行成熟度分析,通过抗性淀粉质量分数测定和光学显微镜观察进行淀粉物理性质的研究,此外,使用发射光谱仪测定果肉矿物质元素含量。
结果:催熟前‘美食蕉1号’和‘美食蕉2号’抗性淀粉质量分数占总淀粉质量分数比例均比‘中蕉8号’高26%左右,三者分别为74.99%、75.23%、48.64%;后熟过程中,三者的总淀粉和抗性淀粉质量分数均随着催熟时间的延长而降低;‘美食蕉1号’和‘美食蕉2号’的香蕉粉颗粒均呈长椭圆形,‘中蕉8号’的香蕉粉颗粒多呈不规则状,后熟期间3 种香蕉粉的颗粒数目逐渐减少;催熟后,‘美食蕉1号’和‘美食蕉2号’的果肉硬度比‘中蕉8号’大,其果皮炭疽病斑的形成也较晚;‘中蕉8号’果肉中的K含量高于‘美食蕉1号’和‘美食蕉2号’,然而‘美食蕉’果肉在后熟期可较多地保留K元素。
结论:‘美食蕉’在香蕉深加工和健康食品开发方面具有更广阔的应用前景。
关键词:香蕉;美食蕉;品种差异;抗性淀粉;矿物质;采后成熟Changes of Starch and Minerals in Pulp of Plantain Cultivars (Musa spp. AAB) during Postharvest RipeningFU Jinfeng1,2, WANG Juan1,*, WANG Lin1, SHENG Ou2,*(1. School of Food Science and Engineering, South China University of Technology, Guangzhou 510641, China; 2. Key Laboratory of South Subtropical Fruit Tree Biology and Genetic Resource Utilization, Ministry of Agriculture and Rural Affairs, Guangdong Province Key Laboratory of Tropical and Subtropical Fruit Tree Research, Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China)Abstract: Objective: To investigate changes in starch and mineral contents of the pulp of two new Plantain (Musa spp.AAB) cultivars resistant to Fusarium wilt, ‘Meishijiao 1 and 2’, during postharvest ripening and to compare them with those of the Cavendish banana cultivar (Musa spp. AAA) ‘Zhongjiao 8’. Methods: The maturity evaluation was carried out usinga colorimeter with colorimetric cards, the physical properties of starch were studied by measurement of resistant starchcontent and optical microscopic observation, and mineral contents were determined by inductively coupled plasma optical emission spectrometry (ICP-OES). Results: For freshly harvested fruit, resistance starch accounted for 74.99% and 75.23% of the total starch in ‘Meishijiao 1 and 2’, respectively, which were approximately 26% higher than that in ‘Zhongjiao 8’(48.64%); during the ripening process, a significant decrease in total starch and resistant starch contents was observed for all 收稿日期:2020-01-06基金项目:广东省自然科学基金项目(2018A030313026);中央高校基本科研业务费专项资金项目(2019MS098);“十三五”国家重点研发计划重点专项(2019YFD1000200;2018YFD1000205);现代农业产业技术体系建设专项(CARS-32-01);广东省现代农业产业技术体系创新团队项目(2020KJ109);广东省乡村振兴战略专项;广东省农科院高水平农科院建设项目(R2017PY-QY001)第一作者简介:傅金凤(1996—)(ORCID: 0000-0001-5769-9578),女,硕士研究生,研究方向为食品科学与工程。
α-淀粉酶(AMY)测定试剂盒(EPS底物法)产品技术要求sainuopu
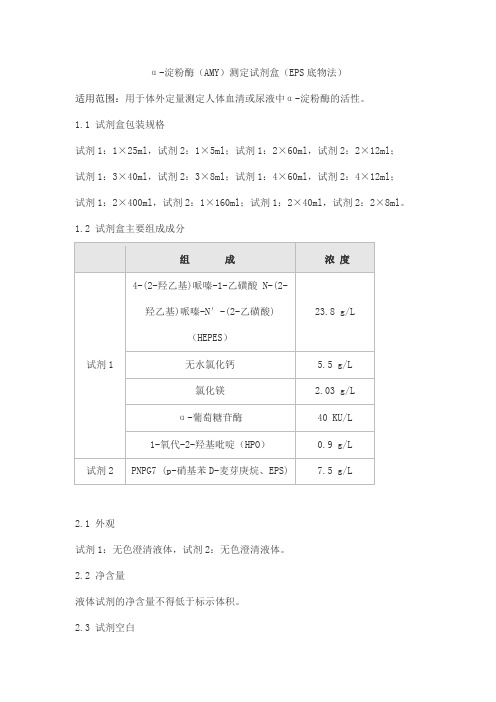
α-淀粉酶(AMY)测定试剂盒(EPS底物法)适用范围:用于体外定量测定人体血清或尿液中α-淀粉酶的活性。
1.1 试剂盒包装规格试剂1:1×25ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×12ml;试剂1:3×40ml,试剂2:3×8ml;试剂1:4×60ml,试剂2:4×12ml;试剂1:2×400ml,试剂2:1×160ml;试剂1:2×40ml,试剂2:2×8ml。
1.2 试剂盒主要组成成分2.1 外观试剂1:无色澄清液体,试剂2:无色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白2.3.1试剂空白吸光度在37℃、405nm波长、1cm光径条件下,试剂空白吸光度应不大于0.35。
2.3.2试剂空白吸光度变化率在37℃、405nm波长、1cm光径条件下,试剂空白吸光度变化率(ΔA/min)应不大于0.002。
2.4 分析灵敏度测定活性为100U/L样本时,吸光度变化率(ΔA/min)应不小于0.006。
2.5 线性范围在(5,1000)U/L线性范围内,线性相关系数r不小于0.996。
在[50,1000)U/L,范围内的线性相对偏差不大于±10%;测定结果(5,50)U/L时,线性绝对偏差不大于±5U/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不大于±10%。
2.9 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8要求。
淀粉含量测定方法大致可分为酸水解或酶程序
淀粉测定说明书淀粉含量测定方法大致可分为酸水解或酶程序,酸水解方法只能适用于纯淀粉样品,从而应用受到限制。
酶的程序不同的前处理工序,淀粉糊化,液化及糊精,糊精水解为葡萄糖和血糖测量。
AACC方法76-11指定在含水条件下的淀粉糊化高压釜中.其次是淀粉转化为葡萄糖淀粉葡萄糖苷酶和葡萄糖的测量. AACC方法76—11低估了淀粉含量在一定范围内的样品和材料,包括高直链淀粉玉米淀粉和许多谷物加工的产品。
当今使用的大多数方法A-淀粉酶结合处理热稳定期间或紧随淀粉糊化工序。
难以糊化(如高直链淀粉玉米淀粉)的样品,如氢氧化钠或氘代二甲亚砜(DMSO)溶剂.在一个过程中,以确保完全溶解,淀粉,膳食纤维的测定,Englyst 和Cunmmings的包括处理淀粉脱支酶,支链淀粉酶.为了满足非常样品的需要,尚未定量和可靠的,程序为总淀粉Megazyme的测量产生,并备有一个总淀粉耐高温A-淀粉酶和淀粉葡萄糖苷酶(麦克利等)的基础上使用的检测试剂盒。
该方法已通过AOAC(官方方法996.11)和AACC(方法76.13)。
最近,耐高温α—淀粉酶是积极和稳定在较低的pH值变得可行.因此,我们用酶更新了我们的总淀粉的方法。
这种改进的主要优点是让耐高温A—淀粉酶和淀粉葡萄糖苷酶活化在同一PH值(5。
0),这反过来,简化了要执行的步骤法和生产的异构麦芽糖(4-A—吡喃葡糖基—D-果糖)的可能性减至最小,这是抗淀粉葡萄糖苷酶和A—淀粉酶水解。
Megazyme总淀粉分析程序可以测量总淀粉广泛的食品,饲料,植物和谷物产品(自然或加工).大多数样品(如面粉),淀粉完全溶解大约培养样本在100℃并有耐高温A-淀粉酶的存在。
样品中含有高含量的抗性淀粉(例如高直链淀粉玉米淀粉),要求预先溶解在寒冷的2 M KOH或相关DMSO。
含有可溶性淀粉或麦芽糖糊精,烹饪用的热稳定的样品A—淀粉酶是不需要的。
原理:耐高温α—淀粉酶水解淀粉转化为可溶的支链和直链麦芽糊精(1)。
直链 支链 总淀粉含量(酶法)试剂盒说明书
直链/支链/总淀粉含量(酶法)试剂盒说明书(货号:G0548F分光法48样)一、产品简介:常用直链淀粉测定方法有电位测定法、旋光分析法或碘与直链淀粉结合力的比色法,然而这些方法存在不确定性。
因为支链淀粉-碘复合物在此过程中同样会形成,导致直链淀粉含量的高估,因此需要修正。
本试剂盒利用伴刀豆球蛋白A只与支链淀粉结合而不与直链淀粉结合的特性,使其分离,再用仅水解淀粉的酶复合物使淀粉水解为葡萄糖,通过检测葡萄糖含量得到直链、支链和总淀粉的含量。
二、试剂盒的组成和配制:试剂名称规格保存要求备注试剂一粉体g×1瓶4℃保存用前加100mL蒸馏水溶解,并用50%的乙酸(1mL 蒸馏水+1mL冰乙酸)逐滴加入约40μL,务必核定PH为6.4,(不能低于6.4,否则重新配置)试剂一稀释液:30mL试剂一+70mL蒸馏水混匀试剂二粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂一稀释液溶解备用。
试剂三液体50mL×1瓶4℃保存试剂四粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂三溶解备用。
试剂五粉剂mg×瓶-20℃保存用前甩几下使试剂落入底部,再加8.2mL的蒸馏水溶解备用。
试剂六液体56mL×1瓶4℃保存标准品粉剂mg×1支4℃保存用前甩几下使试剂落入底部,再加2mL的试剂三溶解,即为1mg/mL葡萄糖。
三、所需的仪器和用品:可见分光光度计、1mL玻璃比色皿(光径1cm)、水浴锅、可调式移液器、研钵、冰、二甲基亚砜(DMSO)、乙醇、乙酸和蒸馏水。
四、淀粉含量测定:建议正式实验前选取2个样本做预测定,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①取1-5g样本烘干(50℃)至恒重,磨碎并过筛(如0.5mm筛)得到待检均匀粉末样本;取10mg粉末样本至2mL的EP管中,加入0.5mL的DMSO并涡旋振荡使样本分散悬浮于液体中(勿沉积于管底或块状悬浮)。
α-淀粉酶(α-AL)活性检测试剂盒说明书
α-淀粉酶(α-AL )活性检测试剂盒说明书微量法注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
货号:BC0615规格:100T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件试剂一液体20 mL×1瓶常温保存试剂二液体5 mL×2瓶2-8℃保存试剂三粉剂×2支2-8℃保存标准品粉剂×1支2-8℃保存溶液的配制:1、试剂一:若有黄色晶体析出,需加热溶解后再用;2、试剂二:临用前取1支试剂三加入1瓶试剂二中,置于常温水中并加热至煮沸,期间不断搅拌粉剂至溶解,用不完的试剂2-8℃保存4周;3、标准品:10 mg 无水葡萄糖。
临用前加1 mL 蒸馏水,配成10 mg/mL 葡萄糖标准液,2-8℃保存两周。
产品说明:淀粉水解酶,包括α-淀粉酶和β-淀粉酶。
α-AL (EC 3.2.1.1)随机催化淀粉中α-1,4-糖苷键水解,生成葡萄糖、麦芽糖、麦芽三糖、糊精等还原糖,同时使淀粉的粘度降低,因此又称为液化酶。
淀粉水解酶催化淀粉水解生成还原糖,还原糖还原3,5-二硝基水杨酸生成棕红色物质,在540nm 有吸收峰;通过测定540nm 吸光度增加速率,计算淀粉酶活性。
α-AL 耐热,但是β-淀粉酶可在70℃钝化15min 。
因此粗酶液经过70℃钝化15min ,就只有α-AL 能够催化淀粉水解。
Reducing Sugar3-Amino-5-Nitrosalicylate (540nm)注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:酶标仪/可见分光光度计、水浴锅、台式离心机、可调式移液器、96孔板/微量玻璃比色皿、研钵/匀浆器和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)称取约0.1g 样本,加0.8mL 蒸馏水匀浆;匀浆后在室温下放置提取15min ,每隔5min 振荡1次,使其充分提取;6000g ,室温离心10min ,吸取上清液并且加蒸馏水定容至10mL ,摇匀,即为淀粉酶原液。
济凡核酸提取试剂盒-FineMag Quick Viral DNA RNA 提取试剂盒说明书
核酸提取试剂使用说明书[产品名称]FineMag快速磁珠法病毒DNA/RNA提取试剂盒1.通用名称:核酸提取试剂2.英文名称:FineMag Quick Viral DNA/RNA提取试剂盒[包装规格]96次/盒[预期用途]用于全血、唾液、拭子、血清、血浆、淋巴液、无细胞体液、细胞培养上清液、组织匀浆液或各种病毒保存液中纯化高质量病毒核酸。
[检验原理]本试剂盒以超顺磁性的纳米磁性粒子为基质,这种磁性粒子在高浓度离液剂的条件下可通过氢键和静电特异的吸附核酸,而蛋白质或其它非特异吸附的少量杂质经洗涤被去除,最后用低盐缓冲液或RNase Free ddH2O洗脱核酸。
纯化的核酸可适用于各种常规操作,包括RT-PCR、qRT-PCR、荧光定量PCR等各种下游实验。
[主要组成成分]本试剂盒包含以下组分:[储存条件及有效期]本试剂盒置于室温(15℃~25℃)干燥条件下可保存12个月。
[适用仪器]济凡Purifier HT[样本要求]1.适用样本类型:肺泡灌洗液、咽拭子、全血、血清、血浆、淋巴液等。
2.样本采集:用无菌容器采集样本,样本量应不少于1mL。
3.样本保存和运送:待测样本可在2℃~8℃放置24小时,长期保存应置于≤-20℃条件下或专业的病毒保存液内,避免反复冻融。
标本运送采用冰壶加冰或泡沫箱加冰密封进行运输。
[检验方法]1.从试剂盒中取出预封装96孔板。
2.用涡旋振荡器震荡板位3的96孔板4角,使磁珠悬浮。
3.小心撕去96孔板铝箔封口膜,避免孔板振动,防止液体溅出。
4.在板位1(Buffer MVN)的96孔位中加入20μl ProteinaseK和200μl样品(样品需平衡至室温)。
注:请在加样后1h内上机运行程序。
5.将磁力套放入板位2(Buffer DW1P)中。
6.按照提示将4块预封装板放入机器正确位置。
7.选择程序“GF_FM502T5_P96”/“GF_FM502T5K S”(快速版)并运行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
前言:
谷类淀粉的许多特性决定其最终用途,这些取决于直链淀粉/支链淀粉的比率。
这些特性包括糊化和凝胶化,溶解度,抗性淀粉的形成以及整颗大米的烹饪和构造特性。
因此,淀粉中直链淀粉含量的测定是淀粉加工的一个重要的质量参数。
最常用的测定谷物淀粉中直链淀粉含量的方法是利用电势,电流测定或直链淀粉的碘结合能力比色测定直链淀粉-碘色合配合物。
然而,这些方法具有不确定性。
支链淀粉-碘复合物也可以形成,这样降低了利用非比色法测定的游离碘离子的浓度,并且用比色法测量时,该复合物可能和直链淀粉-碘复合物吸收相同波长的光。
这种复合物致使直链淀粉的测定含量超过实际含量,需要进行校正。
Gibson等详细列举了使用这些方法所遇到的许多其他问题。
支链淀粉结合ConA的特殊复合物为淀粉中直链淀粉的测定提供了一种替代方法,而且不存在不确定性问题。
在指定pH值,温度和离子强度的条件下,ConA特异性结合分支多糖并形成沉淀,这种结合以多个非还原性末端基团上的α-D-吡喃葡萄糖基或α-D-吡喃甘露糖基单位为基础。
因此,ConA可以有效结合淀粉中的支链淀粉成分,但是不能结合线性为主的直链淀粉成分。
此方法是Yun和Matheson改进的ConA方法。
分析之前用乙醇预处理去除脂质。
原理:
淀粉样品通过加热完全地溶解在二甲基亚砜(DMSO)里。
用乙醇沉淀淀粉去除其中的脂质,回收沉淀的淀粉。
用醋酸/盐溶液溶解沉淀的样品,加入ConA,特异性沉淀支链淀粉,离心去除沉淀。
单位体积上清液中的直链淀粉用酶水解为D-葡萄糖,然后用葡萄糖氧化酶/过氧化物酶试剂进行测定。
另外一份单位体积醋酸/盐溶液中的总淀粉同样用酶水解为D-葡萄糖,然后加入葡萄糖氧化酶/过氧化物酶,用比色法测定。
根据ConA沉淀样品的上清液和与总淀粉样品中的GOPOD在510 nm处的吸光光度值之比判断直链淀粉在总淀粉中的含量。
该方法适用于所有的纯淀粉和谷物粉。
精确性
样品如为纯淀粉,相对标准偏差为<5%。
样品如为谷物面粉,相对标准偏差为~10%。
试剂盒:
瓶子1:冻干的Con A (伴刀豆球蛋白A concanavalin A) ,200 mg,-20℃下稳定性>5年。
瓶子2:淀粉葡糖苷酶【200U,条件为消化对硝基苯基β-麦芽糖苷(也就是3300U,条件为pH4.5,40℃下消化淀粉)】加上真菌α-淀粉酶(500U ,条件为pH5.0,40℃下消化Ceralpha 试剂),2mL,4℃下稳定性>5年。
瓶子3:GOPOD 试剂缓冲液。
磷酸钾缓冲液(1M,pH7.4),对羟苯甲酸(0.22M)和叠氮化钠(0.02% W/W)。
4℃下稳定性> 3年。
瓶子4:GOPOD试剂酶。
葡糖氧化酶(>12,000U)加上过氧化物酶(>650U)和4-氨基安替比林(80mg)。
冻干粉,-20℃下稳定性>5年。
瓶子5:D-葡萄糖标准溶液(5 mL,1.0mg/mL)溶于苯甲酸0.2%(w/v)。
室温下稳定性>5年。
瓶子6:淀粉参考样品(含有特定含量的直链淀粉),室温下稳定性>5年。
试剂制备的准备:
1、用50mlCon A试剂将瓶子1中药品溶解,分成适当的几部分存放在聚丙烯管中,尽可能在-20℃下使用或冷藏。
-20℃下稳定性>2年。
2、用20ml醋酸钠缓冲液将瓶子2中的药品溶解,分成适当的几部分存放在聚丙烯管中,
尽可能在-20℃下使用或冷藏。
-20℃下稳定性>2年。
3、用蒸馏水将中的药品(GOPOD 试剂缓冲液)稀释至1L。
现配现用。
(注意:如果瓶子3意外存放在-20℃下,一些盐可能会结晶。
配制时要确保所有的结晶物质都溶解在1L的蒸馏水中)
4、用20ml GOPOD 试剂缓冲液溶解GOPOD试剂酶,并定量的转移到存放GOPOD 试剂缓冲液的瓶子中,用铝箔封住瓶子,避光保存。
这种试剂黑暗中保存,2-5℃下能保存大约3个月,-20℃下稳定性大于12个月。
5、按提供的方法使用D-葡萄糖标准溶液和淀粉参考样品,室温下稳定性>5年。
安全考虑:
1、DMSO对皮肤有刺激性,用的时候要格外小心。
它通过皮肤被吸收,对皮肤和眼睛都有刺激性。
穿保护装、戴手套,避免溶剂溅出。
尽可能在通风橱中进行试验。
2、ConA通过呼吸、皮肤接触或摄入体内,对人体是十分有害的。
这种伤害不可逆转,可能会致畸。
在使用ConA结晶体球蛋白和含有ConA的溶剂时要穿保护装、戴手套和特制的面具。
3、叠氮化钠是有毒的化学试剂,必须要有专门的处理。
它要添加特殊的缓冲液来充当防腐剂。
毒性通过缓冲可以被消除,但是缓冲液必须在4℃下保存。
缓冲液或溶剂:
1、乙酸钠缓冲液(10mM,pH 4.5)
加5.9ml1.05g/ml的冰醋酸到900ml的蒸馏水中用4g/100ml的NaOH溶液调pH到4.5(大约30ml),加0.2g叠氮化钠,用蒸馏水定容至1L。
室温下稳定性>2年。
2、ConA 浓缩液(600 mM, pH 6.4 乙酸钠缓冲液)
称取49.2g无水醋酸钠,175.5g氯化钠,0.5gCaCl2.2H2O ,0.7 gMgCl2.6H2O 和0.7 g MnCl2.4H2O ,用900 mL 蒸馏水将其溶解逐滴加入冰醋酸调pH为6.4,再用蒸馏水定容至1L。
4℃下保存2周。
(注意:配制这种复合缓冲液时,pH的调节特别重要,如果pH低于6.4,就会有沉淀物形成,就算pH再调回来,沉淀物也不会溶解。
结果会导致缓冲液必须丢弃重新配制。
)
3、ConA 溶液(使用浓度)
将30ml ConA 浓缩液用蒸馏水稀释至100ml。
现配现用。
4、DMSO
分析纯试剂。
室温下可保存5年。
预处理:淀粉样品事先用乙醇进行预处理,除去脂质。
如果样品没有用乙醇进行预处理,在某些样品中测得的直链淀粉含量会低50%。
实验步骤:
A、淀粉预处理
1、准确称取淀粉或面粉样品至10ml的样品管中。
记录样品重量精确到0.1mg。
2、加1ml DMSO至试管,在漩涡混合器中慢速混匀,在沸水浴中加热直至分散(大约1分钟)确保淀粉没有结团结块。
3、密封试管,高速混匀。
沸水浴加热15min,再高速间歇混匀。
4、室温放置大约5min,加2ml 95%乙醇,混匀,再加4ml乙醇,盖上盖子,颠倒混匀。
形成淀粉沉淀物,将试管静止15min(条件允许过夜静止)。
5、2000r,5min离心,弃去上清液,倒置在纸巾上10min,确保乙醇全部挥发。
在接下来直链淀粉和淀粉的测定中使用此沉淀物。
6、加2ml DMSO到淀粉沉淀物中,将试管沸水浴15min(间或混匀),确保没有块状。
7、从沸水浴中取出试管,立即加入4ml ConA 溶液,将试管中药品转移至25ml容量瓶中。
用ConA 溶液定容。
(整个过程必须在2h内完成)
B、支链淀粉- ConA 沉淀物和直链淀粉的测定
1、量取1mlA试剂到2ml的试管中,加0.54ml的ConA 溶液,盖上盖子,反复颠倒,混匀。
避免样品起泡。
2、室温静置1h。
14000r,10min,室温下离心。
3、转移1ml的上清液到15ml的离心管中,,加3ml100mM醋酸钠缓冲液,pH4.5,混合药品。
轻轻塞住管口,沸水浴5min,使ConA变性。
4、将试管在40℃下水浴,平衡5min,,加1ml淀粉转葡萄糖苷酶和a-淀粉酶的混合物,40摄氏度下反应30min,2000r离心5min。
5、准确量取1ml上清液,加4ml GOPOD试剂,40摄氏度下反应20min,使空白试剂和D-葡萄糖标准液同时反应。
6、在510nm下测定每一个样品和D-葡萄糖标准液的吸光光度值。
C、总淀粉的测定
1、将0.5mlA溶液和4ml100mM乙酸钠溶液混合,pH 4.5
2、加1ml淀粉转葡萄糖苷酶和a-淀粉酶的混合物,40摄氏度下反应10min,
3、准确量取1ml上清液,加4ml GOPOD试剂,40摄氏度下反应20min。
这个反应必须让样品和标准液按B部分同时进行。
