考试命题细目表(高一化学)
合集下载
高一年级化学期中考试答案及双向细目表

25.答案:
(1)硅、氮、硫、砷、磷(2)H3AsO4、H3PO4、H2SO4(3)NH3、PH3、SiH4
五、计算题(11分)
26.答案:40
27.答案:2N2O5(g) 4NO2(g) + O2(g)
起始n(mol):4 0 0
转化△n(mol):4×20% 2×(4×20%) 1/2×(4×20%)
5min后n(mol):4-(4×20%) 2×(4×20%)-0 1/2×(4×20%)-0
(1)υ(NO2)=△C/t=(1.6÷2)/5=0.16mol/(L·min)
υ(O2)=△C/t=(0.4÷2)/5=0.04mol/(L·min)
(2)N2O5气体占混合气体总体积的百分比为[3.2/(3.2+1.6+0.4)]×100%=61.54%
17,24
29分
第三章
第一节甲烷
16,18
19
9分
合计
34分
45分
21分
100分
顺德一中08-09学年第二学期高一年级化学科
期中考试题答案
一、二选择题
题号
1
2
3
45678 Nhomakorabea9
10
答案
B
C
B
B
C
A
A
B
D
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
D
BD
B
D
AD
D
C
CD
A
三、填空(共20分)
21.答案:(1)H + O + H→H O H
(1)硅、氮、硫、砷、磷(2)H3AsO4、H3PO4、H2SO4(3)NH3、PH3、SiH4
五、计算题(11分)
26.答案:40
27.答案:2N2O5(g) 4NO2(g) + O2(g)
起始n(mol):4 0 0
转化△n(mol):4×20% 2×(4×20%) 1/2×(4×20%)
5min后n(mol):4-(4×20%) 2×(4×20%)-0 1/2×(4×20%)-0
(1)υ(NO2)=△C/t=(1.6÷2)/5=0.16mol/(L·min)
υ(O2)=△C/t=(0.4÷2)/5=0.04mol/(L·min)
(2)N2O5气体占混合气体总体积的百分比为[3.2/(3.2+1.6+0.4)]×100%=61.54%
17,24
29分
第三章
第一节甲烷
16,18
19
9分
合计
34分
45分
21分
100分
顺德一中08-09学年第二学期高一年级化学科
期中考试题答案
一、二选择题
题号
1
2
3
45678 Nhomakorabea9
10
答案
B
C
B
B
C
A
A
B
D
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
D
BD
B
D
AD
D
C
CD
A
三、填空(共20分)
21.答案:(1)H + O + H→H O H
多维细目表(化学)
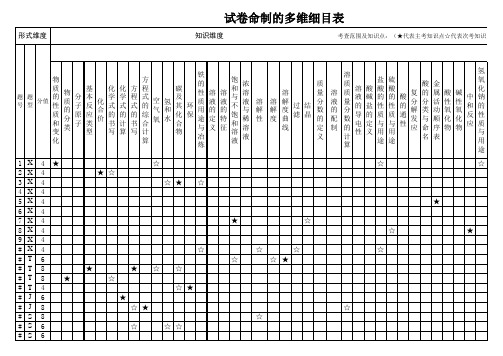
检 验
知 物 识 常 质 跨 见 物 的 其 度 气 质 他 分 等 体 的 离 级 的 鉴 与 制 别 提 备 纯
综 合 运 用 知 识 的 能 力
实 验 能 力
理 解 能 力
表 达 能 力
获 取 知 识 的 能 力
审 题 能 力
心 理 素 质
应 试 能 力
计 算 能 力
整卷 100
整卷 100
科目化学
2002--2003年度
上
期 中 (中、期
次考知识点)
能力维度
考查范围及知识点:(▲代表主考能力因素△代表次考能力因素)
相关指标
学科能力
一般能力
氢 氧 化 钙 的 性 质 与 用 途
碱 的 通 性
P H 结 碱 常 盐 晶 指 试 的 见 的 水 示 纸 命 的 性 合 剂 的 名 盐 质 物 使 用
△ △ △ △ △ △ △ △ △ △ △ △ △ △ ▲ ▲ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △
3.5 3 2 3 3 2.5 3 2 2 2.5 4 6 4.5 2.5 4 6 4 4 2
0.88 0.75 0.5 0.75 0.75 0.63 0.75 0.5 0.5 0.63 0.66 0.75 0.56 0.63 0.66 0.75 0.5 0.66 0.33
饱 和 与 不 饱 和 溶 液
浓 质 溶 溶 量 溶 液 溶 溶 解 分 液 过 结 与 解 解 度 数 的 滤 晶 稀 性 度 曲 的 配 溶 线 定 制 液 义
溶 质 质 量 分 数 的 计 算
溶 液 的 导 电 性
酸 碱 盐 的 定 义
盐 酸 的 性 质 与 用 途 ☆
知 物 识 常 质 跨 见 物 的 其 度 气 质 他 分 等 体 的 离 级 的 鉴 与 制 别 提 备 纯
综 合 运 用 知 识 的 能 力
实 验 能 力
理 解 能 力
表 达 能 力
获 取 知 识 的 能 力
审 题 能 力
心 理 素 质
应 试 能 力
计 算 能 力
整卷 100
整卷 100
科目化学
2002--2003年度
上
期 中 (中、期
次考知识点)
能力维度
考查范围及知识点:(▲代表主考能力因素△代表次考能力因素)
相关指标
学科能力
一般能力
氢 氧 化 钙 的 性 质 与 用 途
碱 的 通 性
P H 结 碱 常 盐 晶 指 试 的 见 的 水 示 纸 命 的 性 合 剂 的 名 盐 质 物 使 用
△ △ △ △ △ △ △ △ △ △ △ △ △ △ ▲ ▲ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △ △
3.5 3 2 3 3 2.5 3 2 2 2.5 4 6 4.5 2.5 4 6 4 4 2
0.88 0.75 0.5 0.75 0.75 0.63 0.75 0.5 0.5 0.63 0.66 0.75 0.56 0.63 0.66 0.75 0.5 0.66 0.33
饱 和 与 不 饱 和 溶 液
浓 质 溶 溶 量 溶 液 溶 溶 解 分 液 过 结 与 解 解 度 数 的 滤 晶 稀 性 度 曲 的 配 溶 线 定 制 液 义
溶 质 质 量 分 数 的 计 算
溶 液 的 导 电 性
酸 碱 盐 的 定 义
盐 酸 的 性 质 与 用 途 ☆
高考化学试题双向细目表

6
7 一般
全部
常见无机物及其应用-卤素及其化合物-氯及其化合物-氯气
6
7 较难
全部
化学反应原理-化学反应原理综合考查
6
7 一般
全部
物质结构与性质-元素周期表 元素周期律-元素周期律-元素周 6
期律的应用-微粒半径大小的比较方法
7 一般
全部
化学反应原理-化学能与电能-原电池-原电池原理-原电池电极反 6
11 困难
全部
化学反应原理-化学能与热能-化学反应中能量变化-盖斯定律及 14
11 较难
全部
五、有机推断题
12 较难
全部
其有关计算-盖斯定律与热化学方程式
物质结构与性质-原子结构与性质-基态原子核外电子排布的表 15
示-核外电子排布规律
共 15
分
有机化学基础-烃的衍生物-卤代烃-卤代烃的性质-卤代烃的消去 15
反应
应式书写
7 较难
全部
化学反应原理-水溶液中的离子平衡-水的电离及溶液的酸碱性6
酸碱中和滴定
二、工业流程题
共 14 分
8 一般
全部
认识化学科学-氧化还原反应-氧化还原反应综合分析-氧化还原 14
反应方程式的配平
பைடு நூலகம்
三、实验题
共 14 分
9 一般
全部
常见无机物及其应用-铁及其化合物-铁盐
14
四、原理综合题
共 29 分
2020 年高考化学试题双向细目表
考查范围:常见无机物及其应用、有机化学基础、化学反应原理、物质结构与性质、认识化
学科学
题号 难度 考查范围
知识点
分值
一、单选题
广东省湛江第一中学2018-2019学年高一上学期第二次大考化学命题双向明细表
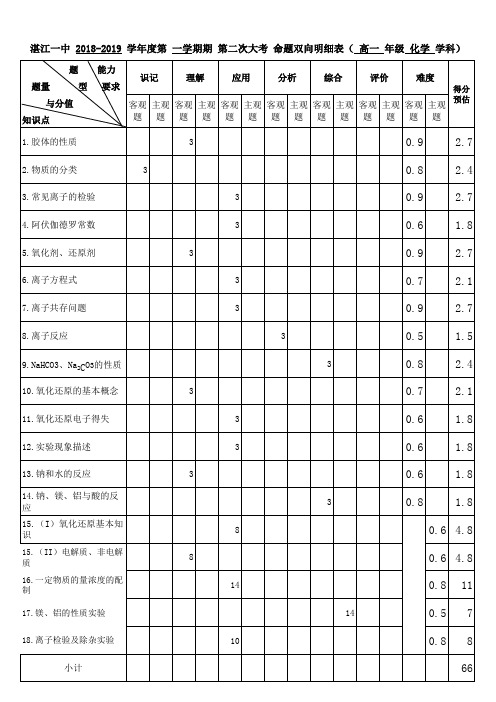
15.(II)电解质、非电解质 16.一定物质的量浓度的配制 17.镁、铝的性质实验 18.离子检验及除杂实验
能力 要求
型
识记
理解
应用
Байду номын сангаас
分析
综合
评价
难度
得分 预估
客观 主观 客观 主观 客观 主观 客观 主观 客观 主观 客观 主观 客观 主观 题 题 题 题 题 题 题 题 题 题 题 题 题 题 3 3 3 3 3 3 3 3 3 3 3 3 3 3 8 8 14 14 10
0.9 0.8 0.9 0.6 0.9 0.7 0.9 0.5 0.8 0.7 0.6 0.6 0.6 0.8
2.7 2.4 2.7 1.8 2.7 2.1 2.7 1.5 2.4 2.1 1.8 1.8 1.8 1.8 0.6 4.8 0.6 4.8 0.8 0.5 0.8 11 7 8 66
小计
合计 说明: 考试范围:化学必修1第一章、第二章、第三章(钠、镁、铝及其化合物的性质)
湛江一中 2018-2019 学年度第 一学期期 第二次大考 命题双向明细表( 高一 年级 化学 学科)
题 题量 与分值 知识点 1.胶体的性质 2.物质的分类 3.常见离子的检验 4.阿伏伽德罗常数 5.氧化剂、还原剂 6.离子方程式 7.离子共存问题 8.离子反应 9.NaHCO3、Na2CO3的性质 10.氧化还原的基本概念 11.氧化还原电子得失 12.实验现象描述 13.钠和水的反应 14.钠、镁、铝与酸的反 应 15.(I)氧化还原基本知 识
能力 要求
型
识记
理解
应用
Байду номын сангаас
分析
综合
评价
难度
得分 预估
客观 主观 客观 主观 客观 主观 客观 主观 客观 主观 客观 主观 客观 主观 题 题 题 题 题 题 题 题 题 题 题 题 题 题 3 3 3 3 3 3 3 3 3 3 3 3 3 3 8 8 14 14 10
0.9 0.8 0.9 0.6 0.9 0.7 0.9 0.5 0.8 0.7 0.6 0.6 0.6 0.8
2.7 2.4 2.7 1.8 2.7 2.1 2.7 1.5 2.4 2.1 1.8 1.8 1.8 1.8 0.6 4.8 0.6 4.8 0.8 0.5 0.8 11 7 8 66
小计
合计 说明: 考试范围:化学必修1第一章、第二章、第三章(钠、镁、铝及其化合物的性质)
湛江一中 2018-2019 学年度第 一学期期 第二次大考 命题双向明细表( 高一 年级 化学 学科)
题 题量 与分值 知识点 1.胶体的性质 2.物质的分类 3.常见离子的检验 4.阿伏伽德罗常数 5.氧化剂、还原剂 6.离子方程式 7.离子共存问题 8.离子反应 9.NaHCO3、Na2CO3的性质 10.氧化还原的基本概念 11.氧化还原电子得失 12.实验现象描述 13.钠和水的反应 14.钠、镁、铝与酸的反 应 15.(I)氧化还原基本知 识
高中化学必修1双向细目表

√
22.硅、二氧化硅、硅酸盐
√
23、N2.NO2.HNO3
√
24.氨气、氨水、铵盐
√
25.次氯酸,浓硫酸,浓硝酸的强氧化性
√
必修1命题细目表
章
考点
认知能力
题号
题型
分值
预计
难度
实测难度
知道
了解理解Βιβλιοθήκη 应用必修1第一章1.化学实验安全
√
2.常见离子检验(Cl-、SO42-、CO32-、Al3+、Fe3+、NH4+)
√
3.分离提纯的方法(过滤、蒸发、蒸馏、萃取)
√
4.物质的量、阿伏伽德罗常数
√
5.配制一定物质的量浓度的溶液
√
6.物质的质量、摩尔质量、物质的微粒数、物质的量、气体摩尔体积、物质的量浓度等之间的关系
√
必修1第二章
7、物质的分类方法
√
8、胶体、丁达尔效应
√
9、离子反应
√
10、离子共存
√
11.氧化还原反应
√
12.举例说明生产、生活中常见的氧化还原反应
√
必修1第三章
13.钠、铝、铁、铜等金属及其重要化合物的物理性质
√
14.钠、铝、铁、铜等金属与氧气、水、酸、碱、盐溶液反应的共性和个性
√
15.氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物与水、酸、碱溶液的反应
√
16.氢氧化铝、氢氧化铁、氢氧化亚铁的制备
√
17、碳酸钠、碳酸氢钠在水中的溶解性、热稳定性、与酸的反应,及它们的鉴别方法
√
18、Fe3+的氧化性;Fe3+和Fe2+之间的相互转化
√
必修1第四章
19、氯、氮、硫、硅等非金属及其重要化合物的物理性质
22.硅、二氧化硅、硅酸盐
√
23、N2.NO2.HNO3
√
24.氨气、氨水、铵盐
√
25.次氯酸,浓硫酸,浓硝酸的强氧化性
√
必修1命题细目表
章
考点
认知能力
题号
题型
分值
预计
难度
实测难度
知道
了解理解Βιβλιοθήκη 应用必修1第一章1.化学实验安全
√
2.常见离子检验(Cl-、SO42-、CO32-、Al3+、Fe3+、NH4+)
√
3.分离提纯的方法(过滤、蒸发、蒸馏、萃取)
√
4.物质的量、阿伏伽德罗常数
√
5.配制一定物质的量浓度的溶液
√
6.物质的质量、摩尔质量、物质的微粒数、物质的量、气体摩尔体积、物质的量浓度等之间的关系
√
必修1第二章
7、物质的分类方法
√
8、胶体、丁达尔效应
√
9、离子反应
√
10、离子共存
√
11.氧化还原反应
√
12.举例说明生产、生活中常见的氧化还原反应
√
必修1第三章
13.钠、铝、铁、铜等金属及其重要化合物的物理性质
√
14.钠、铝、铁、铜等金属与氧气、水、酸、碱、盐溶液反应的共性和个性
√
15.氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物与水、酸、碱溶液的反应
√
16.氢氧化铝、氢氧化铁、氢氧化亚铁的制备
√
17、碳酸钠、碳酸氢钠在水中的溶解性、热稳定性、与酸的反应,及它们的鉴别方法
√
18、Fe3+的氧化性;Fe3+和Fe2+之间的相互转化
√
必修1第四章
19、氯、氮、硫、硅等非金属及其重要化合物的物理性质
高一化学双向细目表1-6班 (1)

2014年高二年级化学学科期末考试命题双向细目表1-6班
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.高分子材料成分识别及简单性质
√
选择
5
0.6
2.糖类、油脂、蛋白质结构与性质
√
选择
5
0.72
3.醇类,醛类等有机物生活中应用及性质
√
选择,填空
20
0.6
4.脂肪烃与含氧衍生物性质的综合考察
√
选择,
√
选择
20
0.5
19.同分异构、同系物、性质的综合考察
√
选择、填空
15
0.5
20.有机物性质、结构推断综合考察
√
选择、填空
35
0.5
试卷评价:
√
选择
5
0.5
12.有机物的实验室制备及其知识迁移
√
填空、填空
26
0.6
13.烷烃混合气体燃烧的计算与判断
√
选择
2.5
0.5
14.有机物的有关计算
√
选择、填空、计算
10
0.4
15.有机物的鉴别
√
填空
5
0.6
16.有机物除杂
√
填空
5
0.45
17.酸与醇酯化的实质考察
√
选择
2.5
0.8
18.有机物性质的迁移考察
5
0.6
5.有机物成分、结构的综合考察
√
选择
25
0.6
6、研究有机物一般经过以下几个基本方法
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.高分子材料成分识别及简单性质
√
选择
5
0.6
2.糖类、油脂、蛋白质结构与性质
√
选择
5
0.72
3.醇类,醛类等有机物生活中应用及性质
√
选择,填空
20
0.6
4.脂肪烃与含氧衍生物性质的综合考察
√
选择,
√
选择
20
0.5
19.同分异构、同系物、性质的综合考察
√
选择、填空
15
0.5
20.有机物性质、结构推断综合考察
√
选择、填空
35
0.5
试卷评价:
√
选择
5
0.5
12.有机物的实验室制备及其知识迁移
√
填空、填空
26
0.6
13.烷烃混合气体燃烧的计算与判断
√
选择
2.5
0.5
14.有机物的有关计算
√
选择、填空、计算
10
0.4
15.有机物的鉴别
√
填空
5
0.6
16.有机物除杂
√
填空
5
0.45
17.酸与醇酯化的实质考察
√
选择
2.5
0.8
18.有机物性质的迁移考察
5
0.6
5.有机物成分、结构的综合考察
√
选择
25
0.6
6、研究有机物一般经过以下几个基本方法
高一化学双向细目表1-6班
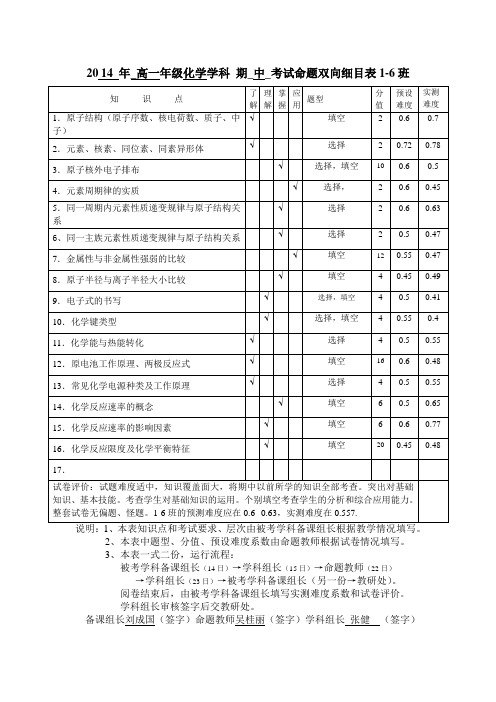
16.化学反应限度及化学平衡特征
√
填空
20
0.45
0.48
17.
试卷评价:试题难度适中,知识覆盖面大,将期中以前所学的知识全部考查。突出对基础知识、基本技能。考查学生对基础知识的运用。个别填空考查学生的分析和综合应用能力。整套试卷无偏题、怪题。1-6班的预测难度应在0.6--0.63,实测难度在0.557.
2014年_高一年级化学学科期_中_考试命题双向细目表1-6班
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.原子结构(原子序数、核电荷数、质子、中子)
√
填空
2
0.6
0.7
2.元素、核素、同位素、同素异形体
√
选择
2
0.72
0.78
3.原子核外电子排布
√
选择,填空
10
0.6
0.5
4.元素周期律的实质
学科组长审核签字后交教研处。
备课组长刘成国(签字)命题教师吴桂丽(签字)学科组长张健(签字)
说明:1、本表知识点和考试要求、层次由被考学科备课组长根据教学情况填写。
2、本表中题型、分值、预设难度系数由命题教师根据试卷情况填写。
3、本表一式二份,运行流程:
被考学科备课组长(14日)→学科组长(15日)→命题教师(22日)
→学科组长(23日)→被考学科备课组长(另一份→教研处)。
阅卷结束后,由被考学科备课组长填写实测难度系数和试卷评价。
√
选择,
2
0.6
0.45
5.同一周期内元素性质递变规律与原子结构关系
√
填空
20
0.45
0.48
17.
试卷评价:试题难度适中,知识覆盖面大,将期中以前所学的知识全部考查。突出对基础知识、基本技能。考查学生对基础知识的运用。个别填空考查学生的分析和综合应用能力。整套试卷无偏题、怪题。1-6班的预测难度应在0.6--0.63,实测难度在0.557.
2014年_高一年级化学学科期_中_考试命题双向细目表1-6班
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.原子结构(原子序数、核电荷数、质子、中子)
√
填空
2
0.6
0.7
2.元素、核素、同位素、同素异形体
√
选择
2
0.72
0.78
3.原子核外电子排布
√
选择,填空
10
0.6
0.5
4.元素周期律的实质
学科组长审核签字后交教研处。
备课组长刘成国(签字)命题教师吴桂丽(签字)学科组长张健(签字)
说明:1、本表知识点和考试要求、层次由被考学科备课组长根据教学情况填写。
2、本表中题型、分值、预设难度系数由命题教师根据试卷情况填写。
3、本表一式二份,运行流程:
被考学科备课组长(14日)→学科组长(15日)→命题教师(22日)
→学科组长(23日)→被考学科备课组长(另一份→教研处)。
阅卷结束后,由被考学科备课组长填写实测难度系数和试卷评价。
√
选择,
2
0.6
0.45
5.同一周期内元素性质递变规律与原子结构关系
2018-2019学年第一学期段考双向细目表(高一化学)
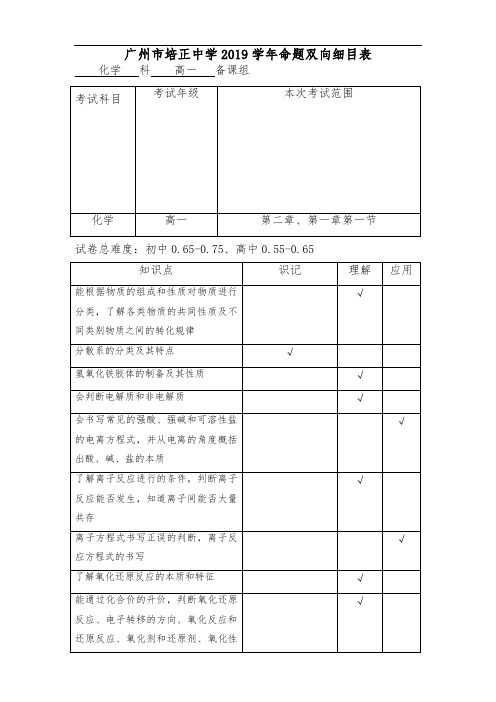
√
掌握粗盐提纯的操作流程
√
能够说出硫酸根离子和氯离子的检验方法
√
题型分布建议:
单选题
填空题
25题
2分
4题
50分
题
分
题
分
题
分
50%
55%
%
%
%
补充说明:
1.四道填空题分别为实验题(原理、操作、仪器)、氧化还原题(含单/双线桥法)、物质的分离提纯、检验题和实验探究题(含化学方程式、离子方程式的书写)。
√
氧化性、还原性强弱的比较
√
能用双线桥和单线桥法表达氧化还原反应电子转移的数目和方向
√
知道一些基本的实验安全措施和意外事故的紧急处理方法,能识别一些化学品安全标识
√
理解过滤和蒸发的原理,能够用过滤和蒸发的方法分离对应的混合物。
√
了解蒸馏、萃取、分液的基本原理,掌握萃取和分液的实验操作
√
了解物质分离提纯的一般方法:过滤、蒸发、蒸馏、萃取和分液过程中使用的仪器及其功能
氢氧化铁胶体的制备及其性质
√
会判断电解质和非电解质
√
会书写常见的强酸、强碱和可溶性盐的电离方程式,并从电离的角度概括出酸、碱、盐的本质
√
了解离子反应进行的条件,判断离子反应能否发生,知道离子间能否大量共存
√
离子方程式书写正误的判断,离子反应方程式的书写
√
了解氧化还原反应的本质和特征
√
能通过化合价的升价,判断氧化还原反应、电子转移的方向、氧化反应和还原反应、氧化剂和还原剂、氧化性和还原性、被氧化和被还原。
广州市培正中学2019学年命题双向细目表
化学科高一备课组
考试科目
考试年级
掌握粗盐提纯的操作流程
√
能够说出硫酸根离子和氯离子的检验方法
√
题型分布建议:
单选题
填空题
25题
2分
4题
50分
题
分
题
分
题
分
50%
55%
%
%
%
补充说明:
1.四道填空题分别为实验题(原理、操作、仪器)、氧化还原题(含单/双线桥法)、物质的分离提纯、检验题和实验探究题(含化学方程式、离子方程式的书写)。
√
氧化性、还原性强弱的比较
√
能用双线桥和单线桥法表达氧化还原反应电子转移的数目和方向
√
知道一些基本的实验安全措施和意外事故的紧急处理方法,能识别一些化学品安全标识
√
理解过滤和蒸发的原理,能够用过滤和蒸发的方法分离对应的混合物。
√
了解蒸馏、萃取、分液的基本原理,掌握萃取和分液的实验操作
√
了解物质分离提纯的一般方法:过滤、蒸发、蒸馏、萃取和分液过程中使用的仪器及其功能
氢氧化铁胶体的制备及其性质
√
会判断电解质和非电解质
√
会书写常见的强酸、强碱和可溶性盐的电离方程式,并从电离的角度概括出酸、碱、盐的本质
√
了解离子反应进行的条件,判断离子反应能否发生,知道离子间能否大量共存
√
离子方程式书写正误的判断,离子反应方程式的书写
√
了解氧化还原反应的本质和特征
√
能通过化合价的升价,判断氧化还原反应、电子转移的方向、氧化反应和还原反应、氧化剂和还原剂、氧化性和还原性、被氧化和被还原。
广州市培正中学2019学年命题双向细目表
化学科高一备课组
考试科目
考试年级
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
满填表
2.本表中“试题难易程度”的界定如下(此项必填):
1)“容易”指预估试题难度系数值在0.7以上(平均得分率在70%以上);
2)“中等”指预估试题难度系数值在0.4-0.7之间(平均得分率在40%-70%之间)3)“较难”指预估试题难度系数值在0.4以下(平均得分率在40%以下)3.本表中“认知能力层次”的界定如下(此项必填):
考试命题细目表1.本表中知识模块、知识点、题号、题型、分值、试题难易程度、认知能力层次必填;
2)“理解”指对该部分内容在识记的基础上,能进一步理解有关的性能和规律并能做出正确解释;3)“简单应用”指能运用该知识点分析解决简单的具体问题;
4)“综合应用”指能运用与该部分内容有关的多个知识点去分析和解决综合性的实际问题。
