化学教学:过渡金属元素
过渡金属(Fe,Al,Cu)

I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2==2FeCl3Fe+S= FeSFe+I2= FeI2②跟水反应: 3Fe+4H2O==(高温)== Fe3O4+4H2③跟酸作用:Fe+2H+=Fe2++H2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+3.生铁与钢的比较4.炼铁和炼钢的比较①还原剂的生成C+O2CO2CO2+C2CO ②铁的还原Fe2O3+3CO2Fe+3CO2③炉渣的生成CaCO3CaO+CO2①氧化:2Fe+O22FeOFeO氧化铁水里的Si、Mn、C等。
如C+FeOFe+CO②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
③脱氧,并调整Mn、Si含量2FeO+Si2Fe+SiO2CaO+SiO2CaSiO31.过渡元素位于周期表中中部从ⅢB~ⅡB族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。
所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。
高中化学过渡金属教案

高中化学过渡金属教案教学目标:1. 了解过渡金属的基本性质和特点;2. 掌握过渡金属的电子排布规律;3. 了解过渡金属的反应特点及应用。
教学重点:1. 过渡金属的电子排布规律;2. 过渡金属的反应特点及应用。
教学难点:1. 过渡金属的复杂电子排布规律;2. 过渡金属在化学反应中的角色。
教学准备:1. 实验器材:过渡金属元素样品、试管、试剂等;2. 教学资料:过渡金属相关的教材、PPT等;3. 教学环境:化学实验室或教室。
教学过程:一、导入(5分钟)通过展示过渡金属元素的化学性质和应用场景引入课题。
二、讲解过渡金属的基本性质和特点(10分钟)1. 介绍过渡金属的通用性质,如金属性、导电性等;2. 分析过渡金属元素的电子排布规律,引导学生了解过渡金属的复杂电子结构。
三、展示实验(15分钟)1. 展示过渡金属元素的实验现象,如溶解性、形成配合物等;2. 让学生根据实验现象尝试解释过渡金属的反应特点。
四、讨论与练习(15分钟)1. 针对过渡金属的反应特点开展讨论,引导学生归纳总结;2. 给学生提供练习题目,并指导学生思考过渡金属的应用场景。
五、总结与展望(5分钟)对本堂课的内容进行总结,并引导学生展望过渡金属在未来的研究和应用。
六、作业布置(5分钟)布置相关的作业,巩固学生对过渡金属的理解和应用。
教学反思:通过本节课的教学,学生对过渡金属的基本性质和反应特点有了更深入的了解,同时也培养了学生的实践能力和探究精神。
在未来的教学中,可以结合更多的实验案例和应用场景,提高学生对过渡金属的兴趣和理解深度。
过渡金属(一)PPT课件

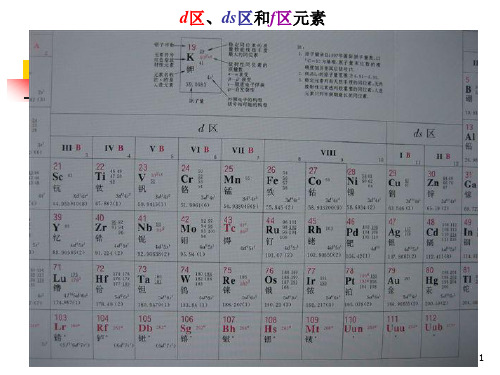
第一过渡 系元素
IIIB IVB VB VIB VIIB
VIII
21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni
钪钛 钒 铬锰铁钴镍
39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd
钇 锆铌 钼 锝 钌 铑钯 57-71 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt La-Lu 铪 钽 钨 铼 锇 铱 铂
V(OH)4+1 .0VO2+ 0 .3V43+-0 .2V26+-1 .1V8 Nb2O50.05Nb3+ -1.N 1b Ta2O5-0.7T5a
.
9
20-3 钒分族
一、存在和发现 钒的主要矿物有:绿硫钒矿VS2或V2S5,钒铅矿 Pb5[VO4]3Cl等。 Nb和Ta因性质相似,在自然界中共生,矿物为 Fe[(Nb,Ta)O3]2如果Nb的含量多就称铌铁矿,反之为 钽铁矿。 二、单质的性质和用途 电子构型为(n-1)d3ns2价态有+V、+IV、+III、+II, V、Nb、Ta以+V价最稳定,V的+IV价也较稳定。 它们的单质容易呈钝态、都溶于硝酸和氢氟酸的 混合酸中,钽不溶于王水。
.
2
1. 电子构型 除Pd外,它们都有未充满的d轨道,最外层也仅 有1-2个电子,过渡元素通常指价电子层结构即: (n-1)d1-9ns1-2。 2. 氧化值 它们的(n-1)d和ns轨道能级的能量相差很小,d电 子也可部分或全部作为价电子参加成键。一般由+2价 直到与族数相同的氧化态(VIII例外)。 3. 单质的化学性质 IIIB族是它们中最活泼的金属,性质与碱土金属 接近。同族元素的活泼性从上到下依次减弱。
第6章过渡金属元素

6.2 ⅣB~ⅥB族金属元素及其化合物 6.2.1 钛
钛的含量(0.63%)在地球中十分丰富。过渡金属中含量 仅次于Fe;总数第十位。
存在:金红石TiO2,钛铁矿 (FeTiO3)
四川攀枝花钒钛铁矿(FeTiO3)探明储量约15亿吨。
钛的应用较晚。首先它纯度不高时,表现为脆性。最主要 是Ti 的冶炼十分困难。
又如: Cr2O72- + H+ + H2C2O4(草酸 ) → Cr3+ + CO2↑
监测司机酒后驾车情况
Cr2O72-+ C2H5OH → Cr3+ + CH3COOH
(2) Cr(OH)3 两性
(NH3·H2O)
-
O H
-
O H
C 3 + r H + CH r3 () O H +
(NH4 + )
1.性质及应用
钛,银白色,是高熔点(1948K)、低密度 ( 4.5g cm-3)。纯钛较软,其合金硬度大(接近 钢) ,耐腐蚀(常温下,Ti不与无机酸反应,即使是 王水也不能溶解,在HCl、H2SO4、HNO3中均“钝 化”)。
钛及其ห้องสมุดไป่ตู้金有如下主要用途:
(4)由于钛的耐蚀性好、密度小,且表面与生物体 组织相容性好,并和生物体组织结合牢固,因此是 理想的植入材料,医疗上用钛来制作人造骨骼。钛 人造骨骼能与骨骼肌肉生长在一起,与人体不排斥, 称为“生物金属”
6.1.2 化学性质
1.金属活泼性
①同一过渡系金属:活泼性从左到期右逐渐减弱(ⅡB除外)。 ⅢB是过渡元素中最活泼的金属。例如,Sc、Y、La在空气中 能迅速被氧化,与水反应放出H2 ,活泼性接近于碱土金属。 第一过渡系元素(Cu除外),在酸性溶液中,EθM+/M >0 (Cu除外),所以,这些金属能溶液于非氧化性稀酸,并能置换 出H2 。 同时, EθM+/M从左到右逐渐升高,表明金属的还原性减弱。 第二、三过渡系金属元素都有不活泼,与氧化性酸在加热时 才有可能发生反应。 ②同一族的过渡元素,除ⅢB外,其他各族元素活泼性都是自 上而下降低。 ⅣB: Ti + 2HCl = TiCl2 而Zr、Hf仅能溶液于王水及氢氟酸。 一般认为是由于同族元素自上而而下,原子半径增加不大,, 核电荷 数却增加较多,故对电子吸引力增强,所以第二、三过渡 系元素的活泼性急剧下降。
《过渡金属元素》课件

佩戴防护设备:如防护服、 手套、口罩等
遵守操作规程:严格按照 操作规程进行操作
定期进行安全培训:提高 员工安全意识和技能
建立应急处理机制:应对 突发安全事故
遵守法律法规:遵守国家 及行业相关法律法规
定期进行安全检查:及时 发现并消除安全隐患
过渡金属元素废弃物的分类和处理方法 资源化利用的技术和设备 资源化利用的经济效益和社会效益 资源化利用的法律法规和政策支持
氧化还原反应是 化学反应中常见 的反应类型
过渡金属元素在 氧化还原反应中 具有较高的活性
过渡金属元素在氧 化还原反应中能够 形成多种化合物
过渡金属元素在化学反应中具有催化作用 催化作用可以提高化学反应速率 催化作用可以降低化学反应的活化能 催化作用可以改变化学反应的方向和产物
PART FIVE
过渡金属元素在合金 材料中的作用:提高 合金的强度、硬度、 耐磨性等性能
有重要作用
过渡金属元素在自然界中主要以矿物和矿石的形式存在 常见的过渡金属矿物有铁、铜、镍、钴等 矿石是含有过渡金属元素的岩石,如铁矿石、铜矿石等 过渡金属元素在矿石中的含量和分布会影响其经济价值
过渡金属元素在自然界中主要 以矿物形式存在
提取方法:物理提取法、化学 提取法、生物提取法等
纯化方法:溶剂萃取法、离子 交换法、电化学法等
纯化程度:根据应用需求选择 合适的纯化程度
PART FOUR
配位键:过渡 金属元素与配 体形成的化学
键
作用:稳定过 渡金属元素的 电子结构,增 强其化学活性
应用:在化学 反应中,配位 键可以促进过 渡金属元素的
反应速率
例子:铁离子 与水形成配位 键,生成氢氧
化铁沉淀
过渡金属元素在 氧化还原反应中 起到重要作用
过渡金属元素(I)

三 元素电势图
显然 (1)Cr3+在酸性条件下具有极弱的还原性, 很稳定,在碱性条件下具有强的还原性. (2)Cr2O72-在酸性条件下具有强的氧化能力, 但在碱性条件下,存在形式为CrO42-(黄色) 很弱的氧化性.2rO4 +2-
2H+
Cr2O72- + H2O
K = 1014
四 成键特征
1-2 过渡金属元素的重要特征 1.它们都是金属元素,均具有较强的还原能力 2. 同一种金属元素具有多变的氧化数 Cr +6,+3,+2,0 Mn +7,+6,+4,+3,+2,0. 另外:第四周期第一渡金属元素高氧化数的化合物 具有强氧化性,低氧化性稳定.
第二、三过渡金属高氧化数化合物稳定.
3. 水合离子或含氧酸根离子具有较深的颜 色 前者是d—d轨道跃迁.( La系元素是f—f轨道)跃 迁所致
②较强的氧化剂
V2O5与浓HCl反应放出Cl2(g)
V2O5 + 6HCl(浓) == 2VOCl2 + Cl2 + 3H2O 那些氧化物与浓HCl反应放出Cl2? 2. 矾酸盐及多矾酸盐 VO43-如同ClO4-、SO42-、PO43-一样皆为四面体结构, 因离子中存在较弱的pπ—dπ反馈π配键,
CrO42-(黄色)Cr2O72-(橙红色)Cr(OH)3(灰兰色胶状)
4—2 Cr的重要化合物
+3,+6氧化数 对应的化合物 从前面的Cr的元素电势图可以看出:
酸性溶液中Cr3+是最稳定具有很弱的还原性, Cr2O72-是强氧化剂; 碱性溶液中Cr3+、Cr(OH)4-具有强还原性, CrO42-弱氧化性
第20章过渡金属1无机化学ppt课件

2 用 途:
① 钛及其合金广泛地用于制造喷气发动机、超音速飞机和潜水艇(防雷达、防磁性水雷)以及海军化工设备。 ② 钛与生物体组织相容性好,结合牢固,用于接骨和制造人工关节;钛具有隔热、高度稳定、质轻、坚固等特性,由纯钛制造的假牙是任何金属材料无法比拟的,所以钛又被称为“生物金属”。因此,继 Fe、Al 之后,预计 Ti 将成为应用广泛的第三金属。
—
-1.63
-1.13
-0.90
-1.18
可溶该金 属的酸
各种 酸
热HF HCl
浓H2SO4 HNO3 HF
稀HCl H2SO4
稀H2SO4 HCl等
元素
Fe
Co
Ni
Cu
Zn
E (M2+/M)/V
-0.44
-0.277
-0.257
0.34
-0.7626
可溶该金 属的酸
稀HCl H2SO4 等
*
(2) 二氧化锆 (ZrO2) ZrO2有三种晶型:单斜(monoclinic);四方 (tetragonal);立方(cubic)。三者之间可以相互转换
物性: ZrO2 白色粉末,不溶于水,熔点很高。 化性: 除 HF 外不与其他酸作用。
*
ZrO2 至少有两种高温变体,1370 K 以上为四方晶型,2570 K 以上为立方萤石晶型。
-0.257
第二过渡系
Cd
-0.403
Pd
+0.92
第三过渡系
Hg
+0.8535
Pt
+1.2
*
钛副族元素处于周期表 ⅣB 族,包括钛Ti, 锆 Zr,铪 Hf 3种元素。
原子的价电子层结构 ( n-1) d2 ns2,最稳定的氧化态为 + 4,其次是 +3,而 +2 氧化态较为少见,化合态的钛还有可能呈现 0 和 –1 的低氧化态。
第17章过渡金属元素ppt课件
CO CO CO CO
Ni(CO)4 四面体
问 实测:Ni—C键长184 pm,理论:Ni—C键长198 pm;
题 CO把电子给予Ni,Ni上负电荷过剩,使该化合物不稳定, 而事实Ni(CO)4十分稳定。
19
CO的分子轨道式
接受Ni的d电子
(1σ)2 (2σ)2 (3σ)2 (4σ)2 (1π)4 (5σ)2 (2π)0 (6σ)0
V(OH)2 弱B
V(OH)3 更弱B
V(OH)4 AB
HVO3 A
Cr(OH)2 B
Cr(OH)3 BA
H2CrO4 A
Fe(OH)2 B
Fe(OH)3 BA
同一元素低价态化合物碱性比高价态碱性强。
八、配合物:
形成配合物倾向 比主族Mn+大得多:
① (n-1) d 与 ns 能量相近,(n-1)d电子参与成键; ② d 区 Mn+: (9 17)e构型, (强极化力 + 大变形性)。
2. 羰基簇合物 (分子中含有M—M键的化合物) 过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。
双核和多核羰基簇合物中羰基与金属原子的结合方式: (1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO 与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
OsO4
Fe(VI) 和 Ni(VI) 具有强氧化性
FeO42- 高铁酸根 NiO42- 高镍酸根 Z *↑,不是所有(n-1)d电子都参与成键。
5
3. 氧化态的稳定性
(1) 同一周期
IIIB
VIIB
VIII
最高氧化态
+3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配位化合物
6-3.2
配位化合物
配位化合物-混成轨域与几何形状
具有平面四边形及八面体形结构之错合物,有可 能具有几何异构物。
例如:二氯二氨铂,
具有顺式与反式两种异构物,如图:
例如:卤素离子、氰离子、硫氰离子 (SCN-)、 一氧化碳、氨和水等。
若配位子中有两个以上的原子具有孤对电子,可同时 和中心金属形成键结,则称为 多牙 配位子,
例如: 乙二胺( 化学式: H2N-CH2-CH2-NH2 ),
• 常以 en 表示, • 分子中两个氮原子皆具有一对孤对电子,可分别与中心金
6-3.1 常见过渡金属元素的性质
一.Fe
由鼓风炉炼铸而得的铁称为生铁,又称铸铁, 含有约2 ∼ 4.5%的碳,
质脆缺乏韧性及强度。 再经由一连串的热处理程序,可使其中的含碳
量减少,并使其结构重组,而形成所谓碳钢; 碳钢依其含碳量可分为:
低碳钢、中碳钢及高碳钢, 其机械性质不同,各有不同用途。如表: 炼铁产生的熔渣则可用来制造水泥。
动画:金属错合物
第二价称为配位数 (coordination number),
即中心金属与配位子间的键结数目。
例如:黄血盐 K4[Fe(CN)6], 中心为氧化数+2 的亚铁离子,其配位数为 6。
6-3.2
配位化合物
常见过渡金属离子的配位数
配位数多寡与中心金属的大小、电荷数与电子组 态有关,
一般最常见到之配位数为 6, 其次则为 4 配位和 2 配位。
为强调配位化合物中错离子的部分, 一般会以 [ ] 括号标记。
6-3.2
配位化合物
配位化合物的发现
配位化合物早在 1700 年代即被发现,但直至1890
年代才由瑞士化学家维尔纳 (A. Werner) 提出键结理
论来解释其性质。
维尔纳认为,配位化合物之中心金属具有“双价”
以现今观点说明, 第一价即为中心金属的氧化数,
中心金属则提供空价轨域, 扮演电子对接受者 (electron-pair acceptor) 的角色,
此种金属与配位子间的键结,其共享电子对全由配位 子提供,称为 配位共价键 。 (coordinate covalent bond)
6-3.2
配位化合物
配位化合物-配位子
配位子与中心金属间仅形成一个键结者, 称为 单牙 配位子,
例如: 草酸根也是双牙配位子。 乙二胺四乙酸根 (常以 EDTA4-表示) 则可与中心金属 形成六个键结,故为六牙配位子。
6-3.2
配位化合物
配位化合物-配位子
多牙配位子易与金属离子形成键结,常用以除去重金 属离子。
例如: 衣服沾染铁锈可用草酸根去除; EDTA 更广泛添加于各类清洁用品中,以除去重金属, 医院中也使用 EDTA 作为金属中毒之解毒剂。
6-3.1 常见过渡金属元素的性质
一.Fe
铁可形成+2 及+3 价两种阳离子,
其中 Fe3+ 为浅黄色,较安定, 台湾东北角特殊的景观「阴阳海」即因海水中含有 Fe3+ 而造成; 淡绿色的 Fe2+ 在空气中易被氧化成 Fe3+。
检验 Fe3+ 的存在,常藉由加入六氰铁(Ⅱ)酸钾 (K4[Fe(CN)6]‧3H2O,俗称 黄血盐 ),
除锌之外,其他元素都有两种以上的氧化态。
第一列过渡金属元素在高氧化态时,是以共价性 的含氧离子存在,如:
VO2+ ( V 氧化态: +5 )、 CrO42- ( Cr 氧化态: +6 )、 MnO4- ( Mn 氧化态: +7 )。
多数过渡金属元素的离子或化合物具有颜色,
常见离子及化合物的颜色,如表:
二铬酸钾是橘红色的晶体,其氧化力略低于过锰 酸钾,但与有机物接触仍有起火爆炸之虞。
6-3.1 常见过渡金属元素的性质
六.Mn
二氧化锰 (MnO2) 是黑褐色粉末,
难溶于水, 具有氧化力,可用以氧化氯离子产生氯气,
在干电池中作为氧化剂, 亦可作为陶瓷及玻璃之着色剂。
范例 6-9
下列有关过渡金属化合物之性质,何者正确? (A)在 FeCl3(aq) 中加入 K3[Fe(CN)6] 可生成蓝色沉淀 (B) K2Cr2O7 在强碱性环境中具有强氧化力 (C) KMnO4 在酸性环境下被还原成为 Mn2+ (D) TiO2 呈白色,可作为颜料 (E)二氧化锰在干电池中作为氧化剂
赤铜矿可直接以焦炭将其还原而得铜,故较易 提炼。
6-3.1 常见过渡金属元素的性质
二.Cu
五水合硫酸铜 (CuSO4‧5H2O) 为蓝色晶体, 是最常见的铜化合物,
加热至约 110 ℃ 可使其变为 CuSO4‧H2O, 最后一个结晶水则须加热至约 250 ℃以上始能去 除,而成白色的无水硫酸铜 (CuSO4)。
藉由紫外光作用,将空气中的水分子和氧分别转变为 氢氧自由基 (hydroxyl radical, ‧OH ) 及超氧阴离 子 (superoxide anion, ‧O2- ), 达到杀菌除臭等功效。
6-3.1 常见过渡金属元素的性质
四.Cr
三氧化二铬 (Cr2O3) 俗称 铬绿 , 为不溶于水的绿色粉末,性质安定,
属形成一个配位共价键,故为双牙配位子;
6-3.2
配位化合物
配位化合物-配位子
配位子与中心金属间仅形成一个键结者, 称为 单牙 配位子,
例如:卤素离子、氰离子、硫氰离子(SCN-)、 一氧化碳、氨和水等。
若配位子中有两个以上的原子具有孤对电子,皆可以 和中心金属形成键结,则称为 多牙 配位子,
学习目标:
了解第一列过渡金属元素及其常见化合物的 性质及反应
了解何谓配位化合物,并学习其基本性质及 简单的键结理论
6-3.1 常见过渡金属元素的性质
第一列过渡金属元素
第一列过渡金属元素位于第 4 周期,见下表:
(S钪c)(钛Ti)(钒V)(C铬r()锰nM)(F铁e()C钴o(N)镍(iC铜) u()Z锌n)
Fe3+ 亦可以硫氰化钾检验, 生成血红色之硫氰酸铁(Ⅲ)离子。
6-3.1 常见过渡金属元素的性质
二.Cu
铜的活性很小,在自然界中可以元素态存在, 但含量极少,大部分以化合物存在。
含铜的主要之矿石有
赤铜矿 (Cu2O)、 辉铜矿 (Cu2S)、 黄铜矿 (CuFeS2) 及 蓝铜矿〔(CuCO3)2‧Cu(OH)2〕等,
解答 (A) Fe3+ 遇 [Fe(CN)6]4- 才会生成普鲁士蓝。
(B) Cr2O72- 在碱中变为 CrO42-,失去氧化力。
练习题 6-9
下列有关炼铁的叙述,何者正确? (A)鼓风炉所炼得的铁为铸铁,富延性、展性而可制
成铁丝 (B)黄铁矿 (FeS2) 最适合炼铁 (C)加入煤焦作为燃料及氧化剂 (D)铁矿中,所含泥沙 (主要为 SiO2),可藉添加灰石
6-3.1 常见过渡金属元素的性质
一.Fe
铁为地壳中含量
仅次于铝的金属,
赤铁矿
其主要之矿石有
赤铁矿 (Fe2O3)、 磁铁矿 (Fe3O4)、
磁铁矿 褐铁矿
褐铁矿 (Fe2O3‧3H2O)、
菱铁矿 (FeCO3) 及
黄铁矿 (FeS2),
菱铁矿 黄铁矿
其中黄铁矿因含有难以去掉的硫,并不适合炼铁。
产生普鲁士蓝 (化学式: Fe4[Fe(CN)6]3 )。
普鲁士蓝难溶于水,可作为蓝色染料。
6-3.1 常见过渡金属元素的性质
一.Fe
检验 Fe2+ 的存在,常藉由加入六氰铁(Ⅲ)酸钾 (K3[Fe(CN)6],俗称 赤血盐 ),
反应亦得普鲁士蓝。
黄血盐和 Fe3+ 反应及赤血盐和 Fe2+ 反 应,均生成普鲁士蓝 (Fe4[Fe(CN)6]3)。
(CaCO3) 形成熔渣而去除
6-3.2
配位化合物
过渡金属元素可与阴离子或具孤对电子之分子形 成配位化合物 (coordination compound) 或称错合物 (complex)。
配位化合物常包含错离子 (complex ion),
错离子是由中心金属和配位子 (ligand) 所构成。
点火后,须不断地由炉底打入 热空气,使煤焦燃烧产生高温, 产生的一氧化碳亦可使氧化铁 还原。
6-3.1 常见过渡金属元素的性质
一.Fe
鼓风炉法炼铁 鼓风炉的结构如图:
加入的灰石 (CaCO3) 作为熔剂, 其目的在于与铁矿中之杂质 (如泥沙,主成分为 SiO2) 形成 熔渣 (CaSiO3)。
6-3.2
配位化合物
配位化合物-混成轨域与几何形状
配位化合物因为配位子与中心金属间之键结具有共 价键的特性,故会形成不同的几何形状,
六配位的错化物 (或错离子) 具有八面体形结构, 四配位者则可形成四面体形或平面四边形, 二配位者则为直线形 。
各种不同配位数之几何形状及常见实例见下页表:
6-3.2
6-3.1 常见过渡金属元素的性质
这些元素中,铁的含量最丰富,铜的活性最小, 而锌的熔点最低,第一列过渡金属元素之一般性 质见下表:
6-3.1 常见过渡金属元素的性质
过渡金属元素的价电子与主族元素之计算方式不 同,其价电子为最外层 3d 与 4s 轨域的电子, 其最大氧化数不超过价电子总数。
6-3.1 常见过渡金属元素的性质
六.Mn
过锰酸钾 (KMnO4) 及二铬酸钾 (K2Cr2O7) 是实验室中最常使用的氧化剂。
过锰酸钾为深紫色晶体,
有金属光泽, 在化学分析中常供亚铁盐、草酸等定量之用, 医药上也常用作消毒剂。 过锰酸钾是很强的氧化剂,与有机物接触起剧烈氧化 还原反应放出大量的热,易起火爆炸,须小心处理。
Cr2O3可由加热 Cr(OH)3 或 (NH4)2Cr2O7 获得,
