第一章_周期结构
元素周期表

X
m种 n种
则b=a+n
0
IA
第一周期 第二周期 第三周期
1H 3Li
bY
n种
则b=a+m
bY
IIA 相差25 相差1 相差 相差
4Be
IIIA IVA VA VIA VIIA 2He 2
(1)、同周期IIA、IIIA元素原子序数的关系 、同周期 、 元素原子序数的关系
除相同长周期第Ⅱ 族 族元素的原子序数相差11或 外 除相同长周期第ⅡA族、ⅢA族元素的原子序数相差 或25外,其余原子序数相差均 族元素的原子序数相差 为1。 。
(2)、同主族相邻元素原子序数的关系 、
ⅢA~ⅦA a.ⅠA和ⅡA相邻元素,原子序数相差上一周期的元素种数。 元素种类 Ⅰ 和 相邻元素, 元素种类 相邻元素 原子序数相差上一周期的元素种数。 ⅠA~ⅡA
周期:电子层数相同,原子序数从左到右依次增大。 周期:电子层数相同,原子序数从左到右依次增大。
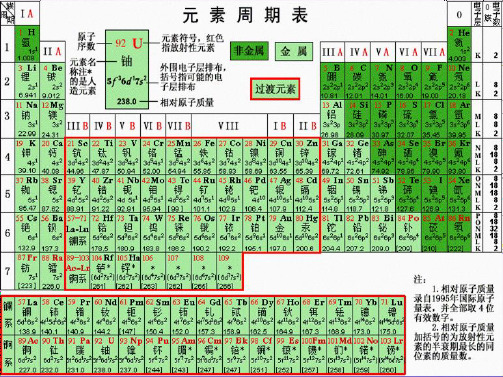
一、元素周期表结构: 元素周期表结构:
族:最外层电子数相同,原子序数从上到下依次增 最外层电子数相同, 大。
锕系。 锕系。 注意:1.IIIB有两个系:镧系、 注意: 有两个系:镧系、 有两个系 2.从IIIB到IIB共10个纵行的元素称过渡元素, 从 个纵行的元素称过渡元素, 到 共 个纵行的元素称过渡元素 这些元素都是金属,又称过渡金属。 这些元素都是金属,又称过渡金属。 0
元 素 周 期 表
1、周期: 周期: 周期表中,把电子层数目相同的元素, 原子序数递 周期表中,把电子层数目相同的元素,按原子序数递 增的顺序从左到右排成横行,形成一个周期 周期。 增的顺序从左到右排成横行,形成一个周期。 ①七个横行,七个周期。其中:三个短周期(1、2、 七个横行,七个周期。其中:三个短周期( ),三个长周期 三个长周期( ),一个不完全周期 一个不完全周期( 3),三个长周期(4、5、6),一个不完全周期(7) ②每一周期元素电子层数相同,从左到右原子序数递 每一周期元素电子层数相同, 增。 ③周期序数=电子层数 周期序数=
第一章第1节元素周期表

二、元素周期表的结构
不同横行中最外层电子数相同的 2、族: 元素按电子层数递增的顺序由上 到下排成纵行。
共 18 个纵行, 16 个族
七 共7个主族 主族序数=最外层电子数 主 (A族)表示为罗马数字加A 七 副族: ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 副 族 共7个副族 零 (B族)表示为罗马数字加B 八 包含三列(8、9、10) 第VIII 族: 族 最外层稳定结构的稀有气体元素 零族:
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的 难易程度。置换出氢越容易,则金属性越强。
已知金属A可与冷水反应, 金属B和热水才能反应,金属 C和水不能反应,判断金属A、 B、C金属性强弱如何?
金属性 A〉 B〉 C
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的
碱金属与氧气反应比较
单质 Li Na K Rb Cs 与O2反应 Li2O Na2O、Na2O2 K2O、K2O2、KO2 更为复杂 更为复杂 反应程度
越 来 越 剧 烈
(1)碱金属元素原子的最外层都有 1个电子,它们的化学性质相似 ①与O2的反应
Δ Δ 4Li + O2 = 2Li2O
Li、Rb、Cs 又如何呢?
二、元素周期表的结构
具有相同电子层数的元素,按 1、周期: 照原子序数递增顺序由左往右 排成横行。 共 7 横行— 7 个周期
周期数 = 电子层数
短周期 三 短 周期 四 长周期 长 (横向)
第1周期: 2种元素 第2周期:
第3周期:
第4周期:
8种元素 18种元素
第5周期:
第6周期: 32种元素 第7周期: 26种元素
化学:《元素周期表-周期表结构》课件(新人教版必修2)

氕 (氢)
(重氢) 氘
(超重氢) 氚
H、D、T这三种核素互称为同位素
常见的同位素:
碳 碳-12
12C
6
碳-13
13C
6
碳-14
14C
6
氧 氯 铀
16O
8
17O
8
18O
8
35Cl
17 92
37Cl
17
234U
235U
92
238U
92
【同位素小结】
两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
(2)碱金属元素从上到下(Li 、Na、K、 Rb、Cs),随着核电荷数的增加,碱金属 元素原子的电子层数逐渐 增多 ,原子核 对 最外层电子 的引力逐渐减弱,原子失 电子的能力逐渐 增强 。 元素的金属性逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
第88号元素: 88-86 =2
第五周期第ⅦA 族。
第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
6、下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D )
A.0 11 18 19
C.
6 11 12 13 24
D.
6 14 31 32
7
7. A、B、C是周期表中相邻的三种元素,其中A、B是同 周期,B、C是同主族。此三种元素原子最外层电子数之
卤素原子结构的相似性,决定了单质化学性质的相似性。
与氢反应的能力渐弱 氢化物的稳定性渐弱 与水反应的能力渐弱
元素非金属性强弱判断依据:
1、单质跟氢气反应生成气态氢化物的 难易;
_元素周期表tyy

注意:同周期的第IIA与第IIIA元 素的原子序数的差值 第2周期:? 1 第3周期:? 1 第4周期:? 1+10 第5周期:? 1+10 第6周期:? 1+10+14 第7周期:? 1+10+14
注意:同主族中相邻元素的原子序数关系的规律
主 族 规 律
Ⅰ A族
Ⅱ A族
同一主族相邻元素原子序数之 差为上一周期元素的种类数目
5、下列各表为周期表的一部分(表中 为原子序数),其中正确的是( D )
2 3 11 19 4 2
10
11
6 12 24
6
7
(C)
( D)
14 31 32
6、下列各组中的元素用原子序 数表示,其中都属于同一主族 的一组元素是( C ) (A)14、24、34
(B)26、31、35
1.相似性: 原子最外层电子都 只有一个电子 2.递变性: 从上到下 电子层数↑, 原子半径↑, (原子核对最外层 电子的引力↓)
递变性: 从上到下,越来越易失电子, 则还原性逐渐↑,金属性↑
IA
碱 金 属 元 素 的 递 变 性
Li
Na
电子层数 ↑
原子半径 ↑ 原子核对最外层电子的吸引力 ↓
失电子能力 ↑ 金属性(还原性) ↑
△
(2) 碱金属的原子结构与化学性质的关系
碱金属元素的性质探究:
①与O2的反应 4Li + O2 ==== 2Li2O
△ 2Na + O2 ==== Na2O2 △ K + O2 ==== KO2(超氧化钾)
△
Li只生成Li2O
Na有Na2O、Na2O2
K有K2O、K2O2、KO2等
第一章 物质结构元素周期律(知识点总结)

Z 第一章物质结构元素周期律班级姓名一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N) 1.原子(A X)原子序数=质子数= 核电荷数=原子的核外电子数核外电子(Z个)2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷(质子)数的同一类原子的总称。
核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列;②将电子层数相同......的各元素从左到右排成一横行..③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..(注意:周期序数=原子的电子层数;主族序数=原子最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)长周期第五周期 5 18种元素周第六周期 6 32种元素期不完全周期:第七周期 7 未填满(已有26种元素)表主族:7个主族族副族:7个副族(18个纵行)第Ⅷ族:三个纵行(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。
2.同周期元素性质递变规律(从左到右):电子层数相同,最外层电子数依次增加,原子半径依次减小,金属性减弱,非金属性增强,与H2的化合由难到易,氢化物的稳定性由弱到强。
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
2010-固体理论第一章周期性结构

a 2 a
(-1,1,1); (-1,-1,1);
a 2 a 2
(1,-1,1) (1,-1,-1)
2 (-1,1,-1); a 2 (-1,-1,-1)
第一章 周期性结构
有6个次近邻格点:
a (1,0,0); a (-1,0,0);
a (0,1,0); a (0,-1,0);
a (0,0,1) a (0,0,-1)
i 1
3
n i bi
第一章 周期性结构
一般尽可能取最短的矢量为基矢。
由不共面的三个基矢b1、b2、b3所围成的原 胞的体积为:
Ω
*
b1 ( b 2 b 3 )
第一章 周期性结构
一般取倒点阵中的W-S原胞为倒点阵的原胞
当倒点阵的W-S原胞的中心正好为倒空间的 原点时,倒点阵中的W-S原胞所包含的区域 为第一布里渊区(Brillouin Zone)
重合
体心立方晶格的倒格子是面 心立方格子。本图中用实心 圆点标出了倒格点。在倒空 间中画出它的第一布里渊区。 如果正格子体心立方体的边 长是a,则倒格子为边长等于 4π /a的面心立方。
主要的对称点: 2 Γ :2(0, 0);H: (1, 0) 0, ; 0,
a
a
aP:Leabharlann 2 1 1 1 ( , ,) a 2 2 2
第一章 周期性结构
一般尽可能取最短的矢量为基矢。
由不共面的三个基矢a1 、a2 、a3 所围成的 原胞的体积V为:
Ω a1 (a 2 a 3 )
第一章 周期性结构
原胞的选取原则(Bravais Rule) : 1、应充分反映点阵的对称性; 2、格子直角应尽可能多 ; 3、所包括的阵点数应尽可能少 ; 4、基矢应尽可能短
知识点总结化学物质结构

第一章物质结构元素周期律一、原子结构1、原子A ZX中,质子有Z 个,中子有A-Z 个,核外电子有Z 个。
2、质量数(A)= 质子数(Z)+ 中子数(N)(质量数在数值上等于其相对原子质量)原子中:原子序数= 核电荷数= 质子数= 核外电子数阳离子中:质子数=核电荷数=离子核外电子数+ 离子电荷数阴离子中:质子数=核电荷数=离子核外电子数- 离子电荷数3、电子层划分电子层数 1 2 3 4 5 6 7符号K L M N O P Q离核距离近远能量高低低高4、核外电子排布规律(一低四不超)(1)核外电子总是尽先排布在能量低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层摆布(即排满K层再排L层,排满L层再排M层)。
(2)各电子层再多容纳的电子数是2n2 个(n表示电子层)(3)最外层电子数不超过8个(K层是最外层时,最多不超过2 个);次外层电子数不超过18 个;倒数第三层不超过32 个。
5、概念元素:具有相同核电荷数的同一类原子的总称核电荷数决定元素种类核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子之间的互称。
例:氕(1 1H)、氘(2 1D )、氚(3 1T )同素异形体:同种元素原子组成结构不同的不同单质之间的互称。
例:O2与O3,白磷与红磷,石墨与金刚石等6、粒子半径大小的比较(1)同周期元素的原子或最高价阳离子的半径随着核电荷数的增大而逐渐减小(除稀有气体外)。
例:Na>Mg>Al>Si, Na+>Mg2+>Al3+(2)同主族元素的原子或离子随核电荷数增大而逐渐增大。
例:Li<Na<K, Li+<Na+<K+ (3)电子层结构相同(核外电子排布相同)的离子半径(包括阴阳离子)随核电荷数的增加而减小。
例:O2->F->Na+>Mg2+>Al3+(上一周期元素形成的阴离子与下一周期元素形成的阳离子有此规律)(4)同种元素原子形成的粒子半径大小为:阳离子<中性原子<阴离子;价态越高的粒子半径越小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[e
如果令
ik ( r R l )
k ( r R l )] e
i k r
i k r
(r )
u (r ) e
(r )
是正点阵的周期函数
可得
uk (r Rl ) uk (r)
布洛赫函数
k ( r ) u k ( r ) exp(i k r )
kBZ
exp[ k ( R R )] N
l s
Rl Rs
普遍适用于周期结构中的电子、声子和自旋波等 3. 求和与积分关系 相邻k值的间距 k i
bi (i=1, 2, 3) Ni
每一许可k值所占的体积为
* (2 ) 3 (2 ) 3 k1 ( k 2 k 3 ) N1 N 2 N 3 N V
空间群包含平移、旋转、反射、滑移反映、螺旋轴等对称操作 空间群算符操作: | t r t 代表旋转、反映等点群对称操作,t代表平移。
E | Rl
---平移群 ---点群 ----螺旋轴或滑移反映面
| 0
|
| t | s | s t 算符相乘:
由于确定n值的 En (k ) 是倒点阵的周期函数,必有能量的上界和下界 不同k同一n的所有能级包括在界内,组成一能带。 不同的n代表不同的能带,它们的总体称为晶体的带结构。
能带存在的结论来自布洛赫函数的振幅是正点阵的周期函数这一普遍性特征。
周期结构中一切波的能(频)谱都成带
4. 布里渊区和晶体的对称性
j
1
( r ) (E | a j r ) ( r a j ) D(E | a j ) ( r )
(r )
是一维表示的基函数。
D是表示一维矩阵,实际上是一个数。
D ( r ) E | N j a j ( r ) E | 0 ( r ) ( r ) Nj
不同的波矢,它们可以唯一地标记平移群的N个不可约表示。
k ai
(i=1, 2, 3) (K=0的对称多面体,W-S元胞)
固体物理学的几个关系
1. 平移群不可约表示的正交关系
exp[i( k k ') R ] N
l Rl
kk '
2. 平移群特征标的正交关系
Chapter 1
Periodic Structure
1.Crystal Lattice and Reciprocal Lattice The most important characteristics of Crystals: Periodic Array of Atoms(ions, Molecules)------Lattice
1
j=1,2,3
D
Nj
1,
D exp(2i
nj Nj
)
其中nj =0, 1, 2, …
由此可得:
E | Rl ( r ) ( r R) ( r l1 a1 l 2 a 2 l3 a3 ) 3 exp2i (l j n j / N j ) ( r ) j 1 1
E | Ni ai E | Ni ai 1 E | 0
E | R l r r Rl
N-1
N
1
2 3
N-2
E | R r r Rl l
1
N-3
----平移算符
E | Rl f ( r ) f (E | Rl r ) f ( r R) 1
E n (k )
只是属于该晶体空间群的点群操作。 在每一能带中如果把能量En(k)看作布里渊区中“位置”的函数,它便 具有点阵点群 性。
| 0
的全部对称性,此即简单空间群中En(k)的对称
例如:二维正点阵BZ为正方形,保持BZ不变的点群操作有8个,4mm标记。 对于BZ中矢量k1施于上述点群操作后,它变为k2, k3, k4, k5, k6, k7, k8. 这8个点在 同一能带中有相同的能量。
可求出
E n (k )
* n,k * n,k
* n , [ k ]
( r ) H n , [ k ] ( r )d 3 r
( r ) | t H | t n ,k ( r )d 3 r
1
( r ) H n ,k ( r )d 3 r
1.由a1, a2, a3组成的平行六面体is called as Primitive Cell。
2.Each cell contains only one lattice site。
3.The chose of the cell and primitive vector is not unique。 The cell’s volume::
在倒逆空间中定义一个波矢
k
j 1
3
nj Nj
bj
i k Rl (r ) E | Rl k ( r ) k ( r R l ) e
1
布洛赫定理
D定义的k可作为平移群不可约表示的标记。 以上方程可理解为平移算符的本征方程,exp(ikRl)是它的k个本征值。 进一步可得
逆: | t1 1 | 1t
晶体空间群的定义:包括平移群作为不变子群的 | t
元素集合
| tE | Rl | t1 E | Rl
不变子群条件要求 Rl 仍为正格矢,即点阵经旋转等点群操作后应与自身重合, 这就限制了晶体中只可能出现2、3、4、6次旋转轴,使晶体空间群成为有限群 (1 )布里渊区(BZ)中En(k)的对称性
对于元胞数为 N = N1N2N3 的晶体,
组成平移群 共有 N 个平移算符 E | R l
波恩-卡门循环边界条件
(1)任意两次相继的平移仍为一平移;相继两次平移的效果与它们作用的先后次序无关。
(2)满足乘法结合律 (3)存在逆元素。 (4)存在恒等操作 E | 0
3. 布洛赫定理
因而,界面几乎不影响体的物理特性,与边界条件的选择无关。
波恩-卡门边界条件 严格讲,只有无限理想晶体才具有平移对称性;
实际晶体的尺寸比元胞大得多,表面效应并不重要;
边长为Na1, Na2, Na3 的有限晶体沿a1, a2, a3 三个方向首尾相接形成 循环边界条件。
波恩-卡门循环边界条件在数学上表现为:
可简化为在一正点阵的一个元胞中求解
因此,晶体中单电子能量是k的多值函数
每一个确定的k描述一套能级 由于
En (k ) 和状态 n,k (r )
在BZ外布洛赫函数无新态
n ,k K n ,k
n
E n (k K n ) E n (k )
k限于BZ,是取以k=0为中心的W-S元胞
Any lattice point in the array can be represented by the lattice vector
Rl l1 a 1 l 2 a 2 l3 a 3
l1, l2, l3 are arbitrary integers ,a1, a2, a3are the lattice primitive vectors(or fundamental translation vectors)
元胞的体积: b1 (b2 b3 )
称为倒格矢。
布里渊区 相应的W-S元胞作为倒点阵的元胞:在此多面体边界上的任意一点可 由另一点加上一个倒格矢的平移达到。 当它的中心为原点时,W-S元胞所包含的区域称为第一布里渊区,用BZ表 示,又称简约区 倒点阵与正点阵的关系
* (2 )3 K n Rl 2 ni li 2m
| t ,则晶体的哈密顿H应与 | t 对易,即H对于空间群 设晶体属于空间群
| t 的一切操作是不变的,有对称性:
| t1 H | t H
| t n,k ( r ) 可以证明: n, [ k ] ( r )
| |2 1
a2 a1
The primitive cells and vectors in a 2D lattice
Cell:The smallest unit in the lattice, which can serve as a building block
for the crystal structure.
i 3
m为整数
BZ具有晶格点阵点群的全部对称性。
2. 平移对称性
点阵是格点在空间中的无限周期性重复排列; 点阵具有平移对称性,表现为将整体作任意正格矢的平移后,它将恢复原状; 即从空间任意一点出发,作任意正格矢的位移,必达到等效的点上 实际的晶体有界面,但体的尺寸比界面大107 ~108个数量级
a1 (a 2 a 3 )
Wigner-sietz cell(W-S cell) 它是由一个格点与最近邻格点(有时也包括次近邻格点)的连线中垂面 所围成的多面体,其中只包含一个结点。 它能更明显地反映点阵的对称性。 它具有所属点阵点群的全部对称性(旋转、反射、反演操作)。
a2 a1
对于N(N=N1N2N3)个元胞的晶体满足波恩-卡门条件时,具有平移对称性: 由于N阶平移群的每个元素本身自成一个共轭类
