分子晶体与原子晶体
分子晶体和原子晶体

学与问
1、怎样从原子结构角度理解金刚石、硅 和锗的熔点和硬度依次下降?
解释:结构相似的原子晶体,原子半径越小, 键长越短,键能越大,晶体熔点越高 金刚石 > 碳化硅 > 晶体硅
2、“具有共价键的晶体叫做原子晶体”。这 种说法对吗?为什么?
知识拓展-石墨
一种结晶形碳,有天然出产的矿物。铁黑 色至深钢灰色。质软具滑腻感,可沾污手指成 灰黑色。有金属光泽。六方晶系,成叶片状、 鳞片状和致密块状。密度2.25g/cm3,化学性 质不活泼。具有耐腐蚀性,在空气或氧气中强 热可以燃烧生成二氧化碳。石墨可用作润滑剂, 并用于制造坩锅、电极、铅笔芯等。
因此,比较分子晶体的熔、沸点高低, 实际上就是比较分子间作用力(包括范力 和氢键)的大小。
(1)组成和结构相似的物质,
分子量越大,熔沸点越高。 ___________________________________
烷烃、烯烃、炔烃、饱和一元醇、醛、 羧酸等同系物的沸点均随着碳原子数的增 加而升高。
因为CO2是分子晶体,SiO2是原子晶体, 所以熔化时CO2是破坏范德华力而SiO2是破 坏化学键。所以SiO2熔沸点高。
破坏CO2分子与SiO2时,都是破坏共价 健,而C-O键能>Si-O键能,所以CO2分子更 稳定。
4、原子晶体熔、沸点比较规律 在共价键形成的原子晶体中,原子半
径小的,键长短,键能大,晶体的熔、沸 点高。如:金刚石 > 碳化硅 > 晶体硅
2 、分子晶体和原子晶体
一、分子晶体
1、概念 分子间以分子间作用力(范德华力,氢键)相 结合的晶体叫分子晶体。
构成分子晶体的粒子是分子,
粒子间的相互作用是分子间作用力 .
分子晶体有哪些物理特性,为什么?
分子晶体与原子晶体

晶胞类型 观察同一种点,如观察空心圆点 Cl-,正
六面体的 8 个顶点和各面的中心,均有一个。所以为面心
立方晶胞。
整理课件
23
小结、晶体结构的基本单元 --晶胞
1、 晶胞是晶体的最小结构重复单元。
晶胞是从晶体结构中截取出来的大小、形状完 全 相同的平行六面体。
晶体是晶胞“无隙并置”而成 2、 晶胞必须符合两个条件: 一是代表晶体的化学组成;二是代表晶体的对称性, 即与晶体具有相同的对称元素 —— 对称轴,对称面 和对称中心 ) 。
3
Ti
8=1 Ca:1
整理课件
O
40
现有甲、乙、丙、丁四种晶胞(如图2-8所
示 比)为_,_1可_:_1推_;知乙:晶甲体晶的体化中学A与式B为的_C_离_2子_D_个;数丙 晶体的化学式为_E__F___;丁晶体的化学式 为_X__Y__2_Z。
整理课件
41
巩固练习:
某晶胞结 构如图所示, 晶胞中各微粒 个数分别为:
整理课件
14
干冰晶体结构
整理课件
碘晶体结构 15
二﹑晶胞 组成晶体的细胞 1. 晶胞:描述晶体结构的基本单元
蜂巢与蜂室
铜晶体
铜铜晶晶胞胞
晶体与晶胞的关系可用蜂巢与峰室的关系比 喻
整理课件16Fra bibliotek 晶体与晶胞整理课件
17
NaCl晶体结构和晶胞
整理课件
18
干冰的晶体结构图 将图中的CO2分子换成I2分子 即为碘晶体的结构图
二 氧 化 碳 分 子
整理课件
19
CsCl晶体
整理课件
20
1、体心——全部 2、面心——1/2 3、棱上的点——1/4 4、顶点(具体问题具体分析)
无机化学——原子晶体与分子晶体
B
B
C A
A
面心立方 紧密堆积
六方紧密堆积
Body-centered cubic cell (BCC)
体心立方紧密堆积 CN=12,利用率 =68% K、Rb、Cs、Li、 Na A B
A
体心立方 紧密堆积
7.4.2 金属键 金属键:金属原子的价电子可以完全失去成为自由电子,并在 晶格中运动,自由电子把金属阳离子胶合成金属晶体,这种胶 合作用就叫金属键。金属键无饱和性和方向性。
氯化氢、氨、三氯化磷、冰等由极性键构成的极性分子,晶体 中分子间存在色散力、取向力、诱导力,有的还有氢键,所以 它们的结点上的粒子间作用力大于分子量相近的非极性分子之 间的引力。
分子晶体的特性 分子晶体是以独立的分子出现的 ,化学式就是分子式。
分子晶体可以是非金属单质,如卤素、H2、N2、O2; 非金属化合物,如CO2、H2S、HCl、HN3等 绝大多数有机化合物,稀有气体的晶体
7.6.3 离子极化对物质性质的影响 一、离子的电子构型
外层电子结构 电子构型 阳离子实例
ns2np6
8
Na+, Mg2+,Al3+,Ti4+
ns2np6 nd1-9
9-17
Cr3+,Mn2+,Fe3+,Cu2+
ns2np6 nd10
18
Ag+,Zn2+,Cd2+,Hg2+
s2p6d10ns2
18+2
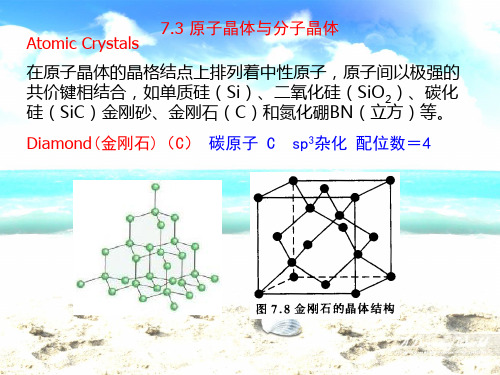
7.3 原子晶体与分子晶体 Atomic Crystals
在原子晶体的晶格结点上排列着中性原子,原子间以极强的 共价键相结合,如单质硅(Si)、二氧化硅(SiO2)、碳化 硅(SiC)金刚砂、金刚石(C)和氮化硼BN(立方)等。
分子晶体和原子晶体

分子晶体和原子晶体
1、分子晶体和原子晶体区别:
(1)单体结构不同。
分子晶体一般是有物质分子构成,而原子晶体一般有单个原子构成;
(2)晶体内作用力不同。
分子晶体一般是通过分子间范德华力作用形成,而原子晶体一般通过原子共价键作用形成;
(3)物理性质不同。
分子晶体一般硬度、熔点较低,而原子晶体一般硬度、熔点很高。
比如白糖属于分子晶体,而钻石属于原子晶体,二者硬度、熔点差别很大;
(4)存在形式有差异。
分子晶体一般有固、液、气三种存在形式,而原子晶体一般只有固体存在形式。
分子晶体典型代表:
1、所有非金属氢化物;
2、大部分非金属单质(稀有气体形成的晶体也属于分子晶体),如:卤素(X2)、氧气、硫(S8)、氮(N2)、白磷(P4)、C60等(金刚石,和单晶硅等是原子晶体);
3、部分非金属氧化物,如:CO2、SO2、SO3、P4O6、P4O10等(如SiO2是原子晶体) ;
4、几乎所有的酸;
5、绝大多数有机化合物,如:苯、乙酸、乙醇、葡萄糖等 ;
6、所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、
易挥发的固态物质。
原子晶体类型:
1、某些金属单质:晶体锗(Ge)等;
2、某些非金属化合物:氮化硼(BN)晶体、碳化硅、二氧化硅等;
3、非金属单质:金刚石、晶体硅、晶体硼等。
原子晶体 分子晶体

原子晶体分子晶体
原子晶体和分子晶体都是固体的一种形式,它们之间的主要区别在于它们的基本构建单位。
1. 原子晶体:
•构建单位:在原子晶体中,基本的构建单位是原子。
这些原子通过离子键、共价键或金属键等方式相互结合,形成均匀的晶体结构。
•例子:金属晶体(如铁、铜)、离子晶体(如氯化钠NaCl)是原子晶体的例子。
在金属晶体中,金属原子通过金属键结合,形成具有电子云的电子海。
在离子晶体中,正负离子通过离子键相互吸引形成晶体结构。
2. 分子晶体:
•构建单位:在分子晶体中,基本的构建单位是分子。
分子通过分子间的力(如范德华力、氢键、共价键等)相互结合,形成晶体结构。
•例子:葡萄糖、水合铜硫酸是分子晶体的例子。
在葡萄糖中,分子是由碳、氢、氧原子组成的葡萄糖分子,它们通过共价键结合在一起。
在水合铜硫酸中,分子是由铜、氧、硫、氢和水分子组成,它们通过范德华力等相互结合。
总的来说,原子晶体和分子晶体的区别在于它们构建晶体结构的基本单位:是原子还是分子。
在实际应用中,这两种类型的晶体具有不同的性质和特征。
第二节 分子晶体与原子晶体

第三章第二节分子晶体与原子晶体第一课时分子晶体教学目标1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
教学重点、难点重点掌握分子晶体的结构特点和性质特点难点是氢键的方向性和氢键对物体物理性质的影响从三维空间结构认识晶胞的组成、结构教学方法建议:运用模型和类比方法诱导、分析、归纳教学过程:[引入]我们已经知道,固体有晶体和非晶体之分,绝大多数常见的固体是晶体。
现在给出下列晶体的熔点:甲烷(-182.5℃)氮(-210.1℃)金刚石(3900℃)氧化铝(2030℃),氯化钠(801℃)同为晶体,为什么它们的熔点及其性质有如此大的差异呢?物质结构决定物质性质,我们需要探讨晶体的内部结构来回答这个问题。
分类研究是科学研究的基本方法之一,根据晶体结构的不同,我们把年个吨毫2分为若干类型,其中,只含分子的晶体称为分子晶体。
一、分子晶体1、定义:含分子的晶体称为分子晶体也就是说:分子间以分子间作用力相结合的晶体叫做分子晶体分子,就属于分子晶体问:还有哪些属于分子晶看图,如:碘晶体中只含有I2体?2、较典型的分子晶体有非金属氢化物,部分非金属单质,部分非金属氧化物,几乎所有的酸,绝大多数有机物的晶体。
3、分子间作用力和氢键过度:首先让我们回忆一下分子间作用力的有关知识阅读必修2 科学视野教师诱导:分子间存在着一种把分子聚集在一起的作用力叫做分子间作用力,也叫范徳华力。
分子间作用力对物质的性质有怎么样的影响?学生回答:一般来说,对于组成和结构相似的物质,相对分子量量越大分子间作用力越大,物质的熔、沸点也越高。
教师诱导:但是有些氢化物的熔点和沸点的递变却与此不完全符合,如:NH3、H2 O和HF的沸点就出现反常。
分子晶体与原子晶体

一、分子晶体
回顾:分子间作用力(分子与分子之间的相互作用),存在于分子之间。
分子间作用力
范德华力 氢键
分子间作用力大小的影响因素:
①相对分子质量:同类型分子,相对分子质量越大, 分子间作用力越大。
②分子的极性:分子的极性影响分子间作用力,极性>非极性。
分子通常指的是小分子,不是指高分子。
• 典型的分子晶体:
对于组成和结构相似、晶体中又不含氢键的物质来说,相对分子质量增大, 分子间作用力增强,熔沸点升高。
对于分子间不含氢键的物质来说,由于分子间的作用力无方向性也使得分子 在堆积时会尽可能利用空间并采取紧密堆积方式,这一点与金属晶体和离子晶体 相似,分子的形状、极性以及氢键的存在都会影响分子的堆积方式。
思考与交流
小结:怎么比较晶体的熔点呢?
三、晶体熔、沸点的比较 (1)不同类型晶体熔、沸点的比较: ①不同类型晶体的熔、沸点高低的一般规律:
原__子__晶__体_____>_离__子__晶__体____>_分__子__晶__体____。 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点
很高,汞、铯等熔、沸点很低。
晶胞
金刚石中 每个C原子都以SP3杂化轨道与周围4个碳原子以共价键结合,构成正四面体。 C—C键间的夹角为109.5°。因为中心原子周围排列的原子的数目是有限的,所以这 种比较松散的排列与金属晶体和离子晶体中的紧密堆积排列有很大的不同。
(1)每个碳与①________以共价键结合,形成正四面体结构 (2)键角均为②________ (3)最小碳环由③____个C组成且六原子不在同一平面内 (4)每个C参与4条C—C键的形成,C原子数与C—C键之比为④______
阴离子,如金属晶体。 (4)易误认为金属晶体的熔点比分子晶体的熔点高,其实不一定,如Na
分子晶体与原子晶体

1.晶体类型:原子晶体>分子晶体
2.常温下状态:固态>液态>气态 3.同一类型晶体:
同为原子晶体:原子半径↓,键长↓,键能↑, (共价键强弱) 共价键越稳定,熔沸点↑
a.组成、结构相似:相对分子质量↑,熔沸点↑
同为分子晶体:
(分子间作用力强弱)
b.不相似:分子极性↑,熔沸点↑ c.有氢键:熔沸点↑ d.同分异构体:支链↑,熔沸点↓
1:在SiO2晶体中每个硅原子周围紧邻的氧原 子有多少个?每个氧原子周围紧邻的硅原子有 多少个?在SiO2晶体中硅原子与氧原子个数之 比是多少? 4mol 2:1mol二氧化硅的晶体含几摩尔的Si-O键? 3:在二氧化硅的晶体结构中,最小的环由几个 原子构成? 12
2018年12月15日星期六8时3分4秒
分子的密堆积:
若分子间只存在范德华力,则每个分子周围 通常有12个紧邻的分子,分子晶体的这一特 征称为分子密堆积。
2018年12月15日星期六8时3分4秒
分子的非密堆积:
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
2018年12月15日星期六8时3分4秒
分子晶体结构特征
(1)密堆积
只有范德华力,无分子间氢键——分子 密堆积。这类晶体每个分子周围一般有12个 紧邻的分子,如:C60、干冰 、I2、O2。
B)
B.无色晶体,熔点3 550℃,不导电,质硬,难溶于水
和有机溶剂 C.无色晶体,能溶于水,质硬而脆,熔点为800℃, 熔化时能导电 D.熔点-56.6℃,微溶于水,硬度小,固态
1、依据结构—组成晶体的微粒和微粒间的作用力判断: 原子晶体:微粒是原子,作用力是共价键; 分子晶体:微粒是分子,作用力是分子间作用力。 2、依据物质种类判断 3、依据性质: 熔点:原子晶体的熔点很高,一般在1部分分子溶于水能导电;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
每个CO2分子周围有几个与之紧邻等距的 CO2分子? 12
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
分子的密堆积:
若分子间只存在范德华力,则每个分子周围 通常有12个紧邻的分子,分子晶体的这一特 征称为分子密堆积。
知识拓展-石墨
石 墨 晶 体 结 构
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
1、石墨为什么很软?
石墨为层状结构,各层之间是范德华力结合, 容易滑动,所以石墨很软。
2、石墨的熔沸点为什么很高(熔点高于金刚石)?
石墨各层均为平面网状结构,碳原子之间 存在很强的共价键,故熔沸点很高。 3、石墨属于哪类晶体?为什么? 石墨为混合键型晶体。
(2)非密堆积
有分子间氢键——氢键具有方向性,使晶体 中的空间利率不高,留有相当大的空隙.这种晶 体不具有分子密堆积特征。如:HF 、NH3、冰( 每个水分子周围只有4个紧邻的水分子)。
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
1.下列叙述不正确的是(
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
分子的非密堆积:
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
分子晶体结构特征
(1)密堆积
只有范德华力,无分子间氢键——分子 密堆积。这类晶体每个分子周围一般有12个 紧邻的分子,如:C60、干冰 、I2、O2。
2013年10月14日星期一4时49分56秒
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
1.晶体类型:原子晶体>分子晶体
2.常温下状态:固态>液态>气态 3.同一类型晶体:
同为原子晶体:原子半径↓,键长↓,键能↑, (共价键强弱) 共价键越稳定,熔沸点↑
a.组成、结构相似:相对分子质量.由分子构成的物质其熔点一般较低 B.分子晶体在熔化时,共价键没有被破坏 C.分子晶体中分子间作用力越大,其化学性 质越稳定
D.物质在溶于水的过程中,化学键一定会被
破坏或改变
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
讨论:
CO2和SiO2的一些物理性质如下表所示,通过 比较判断SiO2晶体是否属于分子晶体? 熔 点 干 冰(CO2) -56.2℃ 沸 点 -78.4℃
一.分子晶体与原子晶体:
晶体类型 概念 组成微粒 作用力 熔沸点 硬度 溶解性
原子晶体 原子间以共价键相结 合形成空间网状结构
原子 共价键 很高 很大 不溶于任何溶剂
分子晶体 分子间以分子 间作用力结合
分子 分子间作用力 较低 较小 部分溶于水
导电性 不导电,个别为半导体 固体和熔融态都不导 电,部分溶于水导电 实例
和有机溶剂 C.无色晶体,能溶于水,质硬而脆,熔点为800℃, 熔化时能导电 D.熔点-56.6℃,微溶于水,硬度小,固态
邹平一中高二化学多媒体课件——晶体结构与性质
1、依据结构—组成晶体的微粒和微粒间的作用力判断: 原子晶体:微粒是原子,作用力是共价键; 分子晶体:微粒是分子,作用力是分子间作用力。 2、依据物质种类判断 3、依据性质: 熔点:原子晶体的熔点很高,一般在1部分分子溶于水能导电;
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
1:在SiO2晶体中每个硅原子周围紧邻的氧原 子有多少个?每个氧原子周围紧邻的硅原子有 多少个?在SiO2晶体中硅原子与氧原子个数之 比是多少? 4mol 2:1mol二氧化硅的晶体含几摩尔的Si-O键? 3:在二氧化硅的晶体结构中,最小的环由几个 原子构成? 12
B
)
2.比较金刚石、硅和锗的熔沸点和硬度?
金刚石>硅>锗
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
1.根据下列性质判断,属于原子晶体的或液态时不导
电的物质是(
B)
A.熔点2 700℃,导电性好,延展性强
B.无色晶体,熔点3 550℃,不导电,质硬,难溶于水
同为分子晶体:
(分子间作用力强弱)
b.不相似:分子极性↑,熔沸点↑ c.有氢键:熔沸点↑ d.同分异构体:支链↑,熔沸点↓
邹平一中高二化学多媒体课件——晶体结构与性质
1.下列物质固态时熔点的比较正确的是( A.F2>Cl2>Br2 B.金刚石>P4>O2 C.S>HBr>金刚石 D.I2>CH4>冰
B
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
44 ×4 NA ρ =m/v= ( 2 d)3
g.cm-3
(1)每个CO2分子周围有______个与之紧 邻等距的CO2分子; (2)若设它们间的间距为d cm,则干冰的 密度为:
邹平一中高二化学多媒体课件——晶体结构与性质
原子晶体多为非导体,有些为半导体,如:硅、锗
硬度和机械性能:原子晶体硬度大,分子晶体硬度小
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
我国的激光技术在世界上处于领先地位,据 报道,有科学家用激光将置于铁室中石墨靶 上的碳原子炸松,与此同时再用射频电火花 喷射氮气,此时碳、氮原子结合成碳氮化合 物薄膜。据称,这种化合物可能比金刚石更 坚硬。其原因可能是( ) A.碳、氮原子构成平面结构的晶体 B.碳氮键比金刚石中的碳碳键更短 C.氮原子电子数比碳原子电子数多 D.碳、氮的单质的化学性质均不活泼
邹平一中高二化学多媒体课件——晶体结构与性质
第二节 分子晶体与原子晶体
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
二氧化碳
碘晶体
金刚石
三种晶胞中的结构微粒和微粒间的作用力?
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
SiO2
1723℃
2230℃
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
2013年10月14日星期一4时49分56秒
邹平一中高二化学多媒体课件——晶体结构与性质
(1)在金刚石晶体中,C采取什 么杂化方式?每个C与多少个C成 键?最小碳环由多少个碳原子组 成?它们是否在同一平面内? (2)在金刚石晶体中,C原子 个数与C—C键数之比为多少? 1:2 (3)12克金刚石中C—C键数为 多少NA? 2N A
