物理化学 第五版 统计热力学
天津大学物理化学第五版-第四章-多组分系统热力学
G ( ) T , nB V B p
B ( ) T , x VB p
B ( ) T Vm ,B p
结论:几种纯液体在恒温恒压下,混合成理想液态混合物时,混合前 后系统的体积不变。
( 2)
mix H 0
结论:几种纯液体在恒温恒压了混合成理想液态混合物时,混合前 后系统的焓不变,因而混合(焓)热等于零。
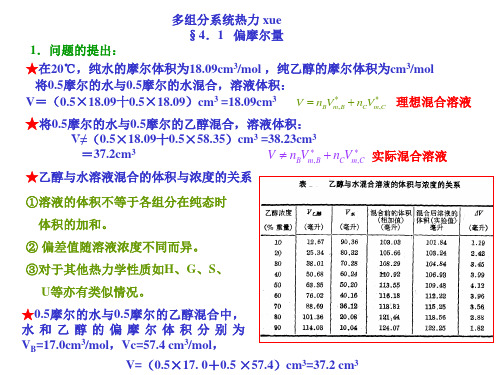
4.偏摩尔量与摩尔量的差别 [1]若B,C形成理想混合物 V*m,B和V*m,C为两纯液体的摩尔体积
Vm~xc作图得一条直线(见图中虚线) 截距:V*m,B 斜率:V*m,C-V*m,B
[2]若B,C形成了真实混合物 Vm~xc作图得一条曲线(见图中实线) 过d作Vm~xc曲线的切线,此切线在纵坐标轴上的 截距为该组成下两组分的偏摩尔体积VB,Vc
>0 非自发过程
化学势判据
★
3、化学势判据及应用举例 在恒温恒压下,若系统中存在有多相(α,β…),多组分(B,C …) 则:
dG dG dG
dn dn B B B B dn B B
B B B
<0 自发过程 =0 平衡状态
由享利定律可知,当溶质、溶剂和温度都一定时,亨利常数就为定值, 气体的分压越大,则该气体在溶液中的溶解度也就越大。所以增加气体的 压力有利于吸收操作。 由下表可知,随温度的升高,k值增大,因而当CO2分压相同时,随 着温度的升高,CO2的溶解度xCO2将下降。反之降低温度,则xCO2的溶解 度将增大,所以低温有利于吸收操作。
3.拉乌尔定律和亨利定律的微观解释 ※拉乌尔定律的微观解释 溶液中加入溶质 B ,单位液面上 A 分子数占液面总分子数的分数从纯 溶剂时的1下降至溶液的xA,致使单位液面上溶剂 A的蒸发速率按比例下降, 溶液中溶剂A的饱和蒸气压也相应地按比例下降。 pA=p*AxA ※亨利定律的微观解释 在溶解平衡时,气相中B在单位表面上的凝结速率与蒸发速率相等,故 气相中B的平衡分压力正比于溶液中B的摩尔分数。
热力学统计物理第五版答案

热力学统计物理第五版答案【篇一:热力学与统计物理答案第四章】ass=txt>4.1 若将u看作独立变量t,v,n1,?,nk的函数,试证明:(a)u??nii?u?u?v; ?ni?v(b)ui??u?u?ui. ?ni?v解:(a)多元系的内能u?u?t,v,n1,?,nk?是变量v,n1,?,nk的一次齐函数. 根据欧勒定理(式(4.1.4)),有??u??uu??ni??v,(1) ??vi??ni?t,v,nj式中偏导数的下标ni指全部k个组元,nj指除i组元外的其他全部组元.(b)式(4.1.7)已给出v??nivi,i其中vi??u??niui,(2)i??v???u?偏摩尔体积和偏摩尔内能. 将式(2),u????i??ni?t,p,nj??ni?t,p,nj代入式(1),有??u???u?(3) nu?nv?n????iiii?i????v?t,nii??ni?t,v,njii上式对ni的任意取值都成立,故有4.2 证明?i?t,p,n1,?,nk?是n1,?,nk的零次齐函数???i?ni???0. ??ni?i???u???u?ui?vi??.(4) ?????v?t,ni??ni?t,v,nj解:根据式(4.1.9),化学势?i是i组元的偏摩尔吉布斯函数 ?i????g?.(1) ???ni?t,p,njg是广延量,是n1,?,nk的一次齐函数,即g?t,p,?n1,?,?nk???g?t,p,n1,?,nk?.(2)将上式对?求导,有左方??g?t,p,?n1,?,?nk???????g?t,p,?n1,?,?nk???ni???i??ni??nii???nig?t,p,?n1,?,?nk???ni?i?t,p,?n1,?,?nk?,(3)i右边????g?t,p,n1,?,nk??? ????g?t,p,n1,?,nk???ni?i?t,p,n1,?,nk?.(4)i令式(3)与式(4)相等,比较可知?i?t,p,?n1,?,?nk???i?t,p,n1,?,nk?. (5)???i?n??0. (6) ?j?j??ni?上式说明?i是n1,?,nk的零次齐函数. 根据欧勒定理(式(4.1.4)),有4.3 二元理想溶液具有下列形式的化学势:?1?g1?t,p??rtlnx1,?2?g2?t,p??rtlnx2,xi是溶液中i组元的摩尔分数. 当物其中gi?t,p?为纯i组元的化学势,质的量分别为n1,n2的两种纯液体在等温等压下合成理想溶液时,试证明混合前后(a)吉布斯函数的变化为?g?rt?n1lnx1?n2lnx2?.(b)体积不变,即?v?0.(c)熵变?s??r?n1lnx1?n2lnx2?. (d)焓变?h?0, 因而没有混合热. (e)内能变化为多少?解:(a)吉布斯函数是广延量,具有相加性. 混合前两纯液体的吉布斯函数为g0?t,p??n1g1?t,p??n2g2?t,p?.(1)根据式(4.1.8),混合后理想溶液的吉布斯函数为g?t,p??n1?1?t,p??n2?2?t,p??n1g1?t,p??n1rtinx1?n2g2?t,p??n2rtinx2.(2)混合前后吉布斯函数的变化为?g?g?t,p??g0?t,p?其中x1??rt?n1lnx1?n2lnx2?, (3)n1n2,x2?分别是溶液中组元1,2的摩尔分数. n1?n2n1?n2(b)根据式(4.1.10),混合前后体积的变化为????v???g??0. (4)?p??t,n1,n2(c)根据式(4.1.10),混合前后熵的变化为????s????g???t?p,n1,n2??r?n1lnx1?n2lnx2?. (5)注意x1和x2都小于1,故?s?0, 混合后熵增加了.(d)根据焓的定义h?g?ts, 将式(3)和式(5)代入,知混合前后焓的变化为?h??g?t?s?0.(6)混合是在恒温恒压下进行的.在等压过程中系统吸收的热量等于焓的增加值,式(6)表明混合过程没有混合热.(e)内能u?h?pv. 将式(6)和式(4)代入,知混合前后内能的变化为?u??h?p?v?0.(7)4.4 理想溶液中各组元的化学势为?i?gi?t,p??rtlnxi.(a)假设溶质是非挥发性的. 试证明,当溶液与溶剂的蒸气达到平衡时,相平衡条件为g1??g1?rtln?1?x?,其中g1?是蒸气的摩尔吉布斯函数,g1是纯溶剂的摩尔吉布斯函数,x是溶质在溶液中的摩尔分数.(b)求证:在一定温度下,溶剂的饱和蒸气压随溶质浓度的变化率为p??p???. ??1?x??x?t(c)将上式积分,得px?p0?1?x?,其中p0是该温度下纯溶剂的饱和蒸气压,px是溶质浓度为x时的饱和蒸气压. 上式表明,溶剂饱和蒸气压的降低与溶质的摩尔分数成正比. 该公式称为拉乌定律.解:(a)溶液只含一种溶质. 以x表示溶质在液相的摩尔分数,则溶剂在液相的摩尔分数为1?x. 根据式(4.6.17),溶剂在液相的化学势?1为?1?t,p,x??g1?t,p??rtln?1?x?.(1)??t,p?. (2) ?1??t,p??g1在溶质是非挥发性的情形下,气相只含溶剂的蒸气,其化学势为平衡时溶剂在气液两相的化学势应相等,即?1?t,p,x???1??t,p?.(3)??t,p?, (4) g1?t,p??rtln?1?x??g1将式(1)和式(2)代入,得式中已根据热学平衡和力学平衡条件令两相具有相同的温度t和压强p. 式(4)表明,在t,p,x三个变量中只有两个独立变量,这是符合吉布斯相律的.(b)令t保持不变,对式(4)求微分,得????g1???g1rtdp?dx?????dp. (5) 1?x??p?t??p?t??g???vm,所以式(5)可以表示为 ?p??t根据式(3.2.1),?rtdx, (6) 1?x?和vm分别是溶剂气相和液相的摩尔体积. 由于vm???vm,略去其中vm?vm??vm?dp??vm,并假设溶剂蒸气是理想气体,pvm??rt,可得rtp??p?????. (7) ????x?t?1?x?vm?1?x(c)将上式改写为dpdx??.(8) p1?x在固定温度下对上式积分,可得px?p0?1?x?, (9)式中p0是该温度下纯溶剂的饱和蒸气压,px是溶质浓度为x时溶剂的饱和蒸气压. 式(9)表明,溶剂饱和蒸气压的降低与溶质浓度成正比.4.5 承4.4题:(a)试证明,在一定压强下溶剂沸点随溶质浓度的变化率为rt??t??, ????x?pl1?x2其中l为纯溶剂的汽化热.(b)假设x??1. 试证明,溶液沸点升高与溶质在溶液中的浓度成正比,即rt2?t?x.l解:(a)习题4.4式(4)给出溶液与溶剂蒸气达到平衡的平衡【篇二:热力学统计物理_答案】程可由实验测得的体胀系数?及等温压缩系数??,根据下述积分求得:如果??,?t?1t1,试求物态方程。
(NEW)傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解

目 录第1章 气 体1.1 复习笔记1.2 课后习题详解1.3 名校考研真题详解第2章 热力学第一定律2.1 复习笔记2.2 课后习题详解2.3 名校考研真题详解第3章 热力学第二定律3.1 复习笔记3.2 课后习题详解3.3 名校考研真题详解第4章 多组分系统热力学及其在溶液中的应用4.1 复习笔记4.2 课后习题详解4.3 名校考研真题详解第5章 相平衡5.1 复习笔记5.2 课后习题详解5.3 名校考研真题详解第6章 化学平衡6.1 复习笔记6.2 课后习题详解6.3 名校考研真题详解第7章 统计热力学基础7.1 复习笔记7.2 课后习题详解7.3 名校考研真题详解第8章 电解质溶液8.1 复习笔记8.2 课后习题详解8.3 名校考研真题详解第9章 可逆电池的电动势及其应用9.1 复习笔记9.2 课后习题详解9.3 名校考研真题详解第10章 电解与极化作用10.1 复习笔记10.2 课后习题详解10.3 名校考研真题详解第11章 化学动力学基础(一)11.1 复习笔记11.2 课后习题详解11.3 名校考研真题详解第12章 化学动力学基础(二)12.1 复习笔记12.2 课后习题详解12.3 名校考研真题详解第13章 表面物理化学13.1 复习笔记13.2 课后习题详解13.3 名校考研真题详解第14章 胶体分散系统和大分子溶液14.1 复习笔记14.2 课后习题详解14.3 名校考研真题详解第1章 气 体1.1 复习笔记一、气体分子动理论1.理想气体理想气体:在任何压力、任何温度下都符合理想气体状态方程pV=nRT 的气体。
理想气体状态方程中,p为气体压力,单位是Pa;V为气体的体积,单位是m3;n为物质的量,单位是mol;T为热力学温度,单位是K;R是摩尔气体常数,。
2.气体分子动理论的基本公式(1)气体分子运动的微观模型①气体是大量分子的集合体;②气体分子不断地作无规则的运动,均匀分布在整个容器之中;③分子彼此的碰撞以及分子与器壁的碰撞是完全弹性的。
南京大学物理化学第五版03章_热力学第二定律讲解

熵增加原理
对于绝热系统 Q 0
所以Clausius 不等式为
dS 0
等号表示绝热可逆过程,不等号表示绝热不
可逆过程。
熵增加原理可表述为:在绝热条件下,趋向于平
衡的过程使系统的熵增加。
或者说在绝热条件下,不可能发生熵减少的过程 如果是一个隔离系统,环境与系统间既无热的
交换,又无功的交换,则熵增加原理可表述为:
对于卡诺循环: Q1 Q2 0 T1 T2
证明任意可逆循环热温商的加和(环程积分) 等于零,即
i
( Qi Ti
)R
0
或
δ Q
T R
0
证明如下:
p
(1)在任意可逆循环的曲
线上取很靠近的PQ过程
R
T
V
PO Q
W
(2)通过P,Q点分别作RS和
X N
TU两条可逆绝热膨胀线, (3)在P,Q之间通过O点作 等温可逆膨胀线VW
§3.6 热力学基本方程与T-S图
要使系统恢复原状, 可经定温压缩过程
( )T U=0, H=0, Q=-W0,
真 空
膨胀
p1,V1,T
p2,V2,T
压缩
p1,V1,T
结果环境对气体做功W,气体对环境放出热Q ,环 境是否能恢复原状,决定于热Q能否全部转化为功 W而不引起任何其它变化
2.热由高温物体传向低温物体:
高温热源T2
如: 方向 热: 高温低温 电流:高电势低电势 气体:高压低压 钟摆:动能热
限度 温度均匀 电势相同 压力相同 静止
决定因素 温度 电势 压力
热功转化
那么决定一切自发过程的方向和限度的共同因 素是什么?
天大物理化学(第五版)第二章

也可以表述为:第一类永动机是不可 能制成的。第一定律是人类经验的总结。
第一类永动机(first kind of perpetual motion mechin对外作功的机器称为第
热 潜热--相变时,T不变,系统吸收或放出的热
反应热--化学反应时,系统吸收或放出的热
5.热力学能(也称内能) 定义:系统内部所有粒子全部能量的总和 (除整体的动能和外场中的势能外)
符号:U
单位:J(kJ)
若始态时系统的热力学能为 U1,末态 时热力学能为 U2,则绝热情况下
△U= U2- U1=W绝热 此式为热力学 能的定义式
由功的传递 方向的规定:
W =F dh=pamb As dh = pamb d(Ash)
W = - pamb dV
对于宏观过程, W = - ∑pamb dV 若环境压力恒定则: W = - pamb(V2-V1)
①恒(外)压过程(isobaric or constant pamb) 恒外压过程: W= – pamb(V2-V1) 恒压过程(pamb= p): W = – p(V2-V1)
如:体积V、物质的量n、质量m ¨¨¨ 强度量: 与物质的数量无关的性质称 为强度量或强度性质。 强度量不具有加和性。 如:压力p、温度T、组成c ¨¨¨
广度量与广度量之比是强度量。 如:摩尔体积Vm(V/n),偏摩尔内能Um ¨¨¨
(3) 平衡态
定义: 指在一定条件下,系统中各个相 的热力学性质不随时间变化,且 将系统与其环境隔离,系统的性 质仍不改变的状态。 平衡状态时,各种状态函数才具有 唯一值。
热力学统计物理第五版课件演示文稿

熵增加原理的简单应用 自由能和吉布斯函数
§1. 1 热力学系统的平衡状态及其描述
一 、பைடு நூலகம்力学系统(简称为系统)
定义:热力学研究的对象——宏观物质系统 系统分类: ⑴ 孤立系统:与外界没有任何相互作用的系统 ⑵ 封闭系统:与外界有能量交换,但无物质交换的系统 ⑶ 开放系统:与外界既有能量交换,又有物质交换的系统
微观量 描写单个微观粒子运动状态的物理量
一般只能间接测量 如分子的质量 m、大小 d等
气体的物态参量及其单位(宏观量)
1 气体压强 p :作用于容器壁上
单位面积的正压力(力学描述).
单位: 1 P a 1 N m 2
p,V,T
标准大气压: 4 5 纬度海平面处, 0 C 时的大气压.
1 a tm 1 .0 1 3 1 0 5 P a
三、状态参量
定义:系统处于平衡态时,可以表征、描述系统状态的变量
状态参量
几何参量:体积 力学参量:压强 化学参量:摩尔数,浓度,摩尔质量 电磁参量:电场强度,电极化强度,磁场强度,磁化强度 热学参量:温度(直接表征热力学系统的冷热程度)
宏观量 表征系统宏观性质的物理量
如系统的体积V、压强P、温度T等,可直接测量 可分为广延量和强度量 广延量有累加性:如质量M、体积V、内能E等 强度量无累加性:如压强 P,温度T等
Onsager
Prigogine
预备知识
Preliminaries
1. 数学
① 多元复合函数的微分(附录A) a) 偏导数与全微分 b) 隐函数、复合函数 c) 雅克比行列式 d) 完整微分条件和积分因子 ② 概率基础知识(附录B)
统计物理学常用的积分形式(附录C)
物理化学第五版统计热力学答案

第七章统计热力学初步答案一、判断题:1.错。
U,V,N一定时,系统有多少种分布以及每一种分布的微态数都是确定的。
2.错。
U,V,N一定时,粒子可以在不同能级间转移。
3.错。
E,V,N一定时系统处于每一个微观状态的概率相等。
4.前半句话对,后半句话不对。
玻尔兹曼分布就是最概然分布,但它不是平衡分布,只是能代表平衡分布。
5.对。
6.对。
7.错。
8.对。
9.错。
10.对。
11.错。
S、C V与零点选择无关。
12.对。
13.错。
14.错,W B<< Ω。
15.错。
g r = T/σΘ适用的条件是T>> Θr,不能用于低温。
二、单选题:1. B;2. D;3. C;4. B;5. A;6. C;7. B;8. B;9. B;10.C;11.A;12.C;13.D;14.B;15.C;16.C;17.C;18.A;19.B;20.B;21.B;22.B;23.C;24.B;25.D;26.B;27.B;28.C;29.A;30.C;31.D;32.B;33.C;34.D;35.A;36.C;37.D;38.C;39.D;。
三、多选题:1. AC ;2. B ;3. BC ;4. AB ;5. DE ;6. CD ;7. DE ;8. AD ;9. AB ;四、计算题1.解:氟原子的电子配分函数:q(电子) = g0exp(-∈0/kT) + g1exp(-∈1/kT) + g2exp(-∈2/kT)= (2J0 + 1)exp(-∈0/kT) + (2J1 + 1)exp(-∈1/kT) + (2J2 + 1)exp(-∈2/kT)= 4 ×e0 + 2 × exp(-0.5813) + 6 × exp(-147.4) = 5.1182.解:(1) q0,V = 1/[1-exp(-Θv/T)] = 1/[1-exp(-Θv/1000)] = 1.25exp(-Θv/1000) = 1-1/1.25 = 0.20 所以Θv = 3219K(2) N0/N = g0exp(-∈0/kT)/q0,V = g0exp(-∈0/kT)/[exp(-∈0/kT)q0,= 1/q0,V = 1/1.25 = 0.803.解:(1)写出q R= 8π2I kT/(σh2)= 8 × 3.142 × 1.89 × 10-46 × 1.38 × 10-23 × 900/[1 × (6.626 × 10-34)2] = 421.5(2)写出U R,m = RT2(∂ln q R/∂T)N,V = RT2 × (1/T) = RT写出转动对C V,m的贡献C V,m,R= (∂U m,R/∂T)V,N = R = 8.314 J·K-1·mol-14.解:(1)q= Σexp(-εi/kT) = 1 + exp(-ε1/kT)(2)U = N A kT2(∂ln q/∂T)V = N A kT2{[1/[1 + exp(-ε1/kT)]]exp(-ε1/kT)[ε1/kT]= N Aε1/[exp(-ε1/kT)] 或= N Aε1exp(-ε1/kT)/[1 + exp(-ε1/kT)](3)在极高的温度时,kT >> ε1,则exp(-ε1/kT) = 1 ,故U = Nε1在极低的温度时,kT << ε1,则exp(-ε1/kT)0 ,所以U = 05.证明:q = q(平)q(电)(核) = (2πm kT/h2)3/2(RT/p)q(电)q(核)依据S = k ln(q N/N!) + U/T等温时,系统的U不随压力变化,故S2(p2)-S1(p1) = R ln(p1/p2)6.证明:写出U m= ∑n i∈i,n i = (L/q)g i exp(β∈i),得出U m = (L/q)∑g i exp(β∈i)·∈i∵q= ∑g i exp(β∈i) ,∴(∂q/∂β)V= Σg i exp(β∈i) ·∈i故U m = (L/q)( ∂q/∂β)V = L(∂ln q/∂β)V。
热力学统计物理_第五版_汪志诚_完整ppt课件

注意
1)理动态平衡。
2020/4/18
.
17
三、状态参量
定义:系统处于平衡态时,可以表征、描述系统状态的变量
状态参量
几何参量:体积 力学参量:压强 化学参量:摩尔数,浓度,摩尔质量 电磁参量:电场强度,电极化强度,磁场强度,磁化强度 热学参量:温度(直接表征热力学系统的冷热程度)
热力学第二定律 卡诺循环 热力学温标 克劳修斯等式和不等式 熵和热力学基本方程 理想气体的熵
热力学第二定律的数学 表达式
熵增加原理的简单应用 自由能和吉布斯函数
2020/4/18
.
13
§1. 1 热力学系统的平衡状态及其描述
一 、热力学系统(简称为系统)
定义:热力学研究的对象——宏观物质系统 系统分类: ⑴ 孤立系统:与外界没有任何相互作用的系统 ⑵ 封闭系统:与外界有能量交换,但无物质交换的系统 ⑶ 开放系统:与外界既有能量交换,又有物质交换的系统
处在平衡态的大量分子仍在作热运动,而且因 为碰撞,每个分子的速度经常在变,但是系统的宏 观量不随时间改变。
例如:粒子数
箱子假想分成两相同体积的部分, 达到平衡时,两侧粒子有的穿越 界线,但两侧粒子数相同。
2020/4/18
.
16
平衡态的特点
1)单一性( p , T 处处相等);
2)物态的稳定性—— 与时间无关; 3)自发过程的终点; 4)热动平衡(有别于力平衡).
2020/4/18
.
18
宏观量 表征系统宏观性质的物理量
如系统的体积V、压强P、温度T等,可直接测量 可分为广延量和强度量 广延量有累加性:如质量M、体积V、内能E等 强度量无累加性:如压强 P,温度T等
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章统计热力学初步练习题一、判断题:1.当系统的U,V,N一定时,由于粒子可以处于不同的能级上,因而分布数不同,所以系统的总微态数Ω不能确定。
2.当系统的U,V,N一定时,由于各粒子都分布在确定的能级上,且不随时间变化,因而系统的总微态数Ω一定。
3.当系统的U,V,N一定时,系统宏观上处于热力学平衡态,这时从微观上看系统只能处于最概然分布的那些微观状态上。
4.玻尔兹曼分布就是最概然分布,也是平衡分布。
5.分子能量零点的选择不同,各能级的能量值也不同。
6.分子能量零点的选择不同,各能级的玻尔兹曼因子也不同。
7.分子能量零点的选择不同,分子在各能级上的分布数也不同。
8.分子能量零点的选择不同,分子的配分函数值也不同。
9.分子能量零点的选择不同,玻尔兹曼公式也不同。
10.分子能量零点的选择不同,U,H,A,G四个热力学函数的数值因此而改变,但四个函数值变化的差值是相同的。
11.分子能量零点的选择不同,所有热力学函数的值都要改变。
12.对于单原子理想气体在室温下的一般物理化学过程,若要通过配分函数来求过程热力学函数的变化值,只须知道q t这一配分函数值就行了。
13.根据统计热力学的方法可以计算出U、V、N确定的系统熵的绝对值。
14.在计算系统的熵时,用ln W B(W B最可几分布微观状态数)代替1nΩ,因此可以认为W B与Ω大小差不多。
15.在低温下可以用q r = T/σΘr来计算双原子分子的转动配分函数。
二、单选题:1.下面有关统计热力学的描述,正确的是:(A) 统计热力学研究的是大量分子的微观平衡系统;(B) 统计热力学研究的是大量分子的宏观平衡系统;(C) 统计热力学是热力学的理论基础;(D) 统计热力学和热力学是相互独立互不相关的两门学科。
2.在统计热力学中,物系的分类常按其组成的粒子能否被辨别来进行,按此原则,下列说法正确的是:(A) 晶体属离域物系而气体属定域物系;(B) 气体和晶体皆属离域物系;(C) 气体和晶体皆属定域物系;(D) 气体属离域物系而晶体属定域物系。
3.在研究N、V、U有确定值的粒子系统的统计分布时,令∑n i = N,∑n iεi = U,这是因为所研究的系统是:(A) 系统是封闭的,粒子是独立的;(B) 系统是孤立的,粒子是相依的;(C) 系统是孤立的,粒子是独立的;(D) 系统是封闭的,粒子是相依的。
4.某种分子的许多可能级是εo、ε1、ε2,简并度为g0 = 1、g1 = 2、g2 = 1。
5个可别粒子,按N0 = 2、N1 = 2、N2 = 1的分布方式分配在三个能级上,则该分布方式的样式为:(A) 30 ;(B) 120 ;(C) 480 ;(D) 3 。
5.假定某种分子的许可能级是0、ε、2ε和3ε,简并度分别为1、1、2、3。
四个这样的分子构成的定域系统,其总能量为3ε时,系统的微观状态数为:(A) 40 ;(B) 24 ;(C) 20 ;(D) 28 。
6.对热力学性质(U、V、N)确定的系统,下面描述中不对的是:(A) 系统中各能级的能量和简并度一定;(B) 系统的微观状态数一定;(C) 系统中粒子在各能级上的分布数一定;(D) 系统的吉布斯自由能一定。
7.对于定位系统,N个粒子分布方式D所拥有微观状态数W D为:(A) W D = N!πN i g i/N i!;(B) W D = N!πg i Ni/Ni!;(C) W D = N!πg i Ni/Ni;(D) W D= πg i Ni/Ni!。
8.设一粒子系统由三个线性谐振子组成,系统的能量为(11/2) hν,三个谐振子分别在三个固定点a、b、c上振动,系统总的微观状态数为:(A) 12 ;(B) 15 ;(C) 9 ;(D) 6 。
9.使用麦克斯韦 - 玻尔兹曼分布定律,要求粒子数N很大,这是因为在推出该定律时:(A) 假定粒子是可别的;(B) 应用了斯特令近似公式;(C) 忽略了粒子之间的相互作用;(D) 应用拉氏待定乘因子法。
10.式子∑N i = N和∑N iεi = U的含义是:(A) 表示在等概率假设条件下,密封的独立粒子平衡系统;(B) 表示在等概率假设条件下,密封的独立粒子非平衡系统;(C) 表示密闭的独立粒子平衡系统;(D) 表示密闭的非独立粒子平衡系统。
11.下面关于排列组合和拉格朗日求极值问题的描述正确的是:(A) 排列组合都是对可别粒子而言的,排列考虑顺序,组合不考虑顺序;(B) 排列是对可别粒子而言的,而组合是对不可别粒子而言的;(C) 拉格朗日未定因子法适用于自变量相互独立的多元函数的求极值问题;(D) 拉格朗日未定因子法适用于一定限制条件下的不连续多元函数的求极值问题。
12.对于玻尔兹曼分布定律n i =(N/Q)·g n·exp(-εi/kT) 的说法:⑴n i是第i能级上的粒子分布数;⑵随着能级升高,εi增大,n i总是减少的;⑶它只适用于可区分的独立粒子系统;⑷它适用于任何的大量粒子系统。
其中正确的是:(A) ⑴⑶;(B) ⑶⑷;(C) ⑴⑵;(D) ⑵⑷。
13.玻尔兹曼统计认为:(A) 玻尔兹曼分布不是最可几分布但却代表平衡分布;(B) 玻尔兹曼分布只是最可几分布但不代表平衡分布;(C) 玻尔兹曼分布不是最可几分布也不代表平衡分布;(D) 玻尔兹曼分布就是最可几分布也代表平衡分布。
14.对于分布在某一能级εi上的粒子数n i,下列说法中正确是:(A) n i与能级的简并度无关;(B) εi值越小,n i值就越大;(C) n i称为一种分布;(D) 任何分布的n i都可以用波尔兹曼分布公式求出。
15.在N个独立可别粒子组成系统中,最可几分布的微观状态数t m与配分函数Q之间的关系为:(A) t m = 1/N! ·q N;(B) t m = 1/N! ·q N·e U/kT;(C) t m = q N·e U/kT ;(D) t m = N! q N·e U/kT 。
16.I2分子的振动能级间隔是0.43 × 10-20J,则在298K时某一振动能级和其较低能级上分子数之比为:(A) 1 ;(B) 0.43 × 10-20;(C) 0.35 ;(D) 无法计算。
17.在已知温度T时,某种粒子的能级εj = 2εi,简并度g i = 2g j,则εj和εi上分布的粒子数之比为:(A) ½exp(εj/2kT) ;(B) 2exp(-εj/2kT) ;(C) ½exp(-εj/2kT) ;(D) 2exp(-2εj/kT) 。
18.如分子第一激发态的能量为400kJ·mol-1,则系统中10%的分子被激发到第一激发态时,系统的温度(K)是:(A) 2.2 × 104;(B) 2.0 × 104;(C) 2.0 × 103 ;(D) 2.2 × 105。
19.I2的振动特征温度ΘV = 307K,相邻两振动能级上粒子数之n(v + 1)/n(v) = ½的温度是:(A) 306K ;(B) 443K ;(C) 760K ;(D) 556K 。
20.某一理想气体系统由含N A个A分子与N B个B分子的两个系统组成。
分子配分函数分别为q A、q B,若不考虑分子间相互作用,则系统配分函数表示为:(A) q A N Aq B N B/(N A + N B)!;(B) q A N A·q B N B;(C) q A N A/N!·q B N B/N B!;(D) (q A·q B)N A + N B 。
21.下面哪组热力学性质的配分函数表达式与系统中粒子的可别与否无关:(A) S、G、F、C V;(B) U、H、P、C V;(C) G、F、H、U;(D) S、U、H、G。
22.各种运动形式的配分函数中与压力有关的是:(A) 电子配分函数;(B) 平动配分函数;(C) 转动配分函数;(D) 振动配分函数。
23.分子运动的振动特征温度Θv是物质的重要性质之一,下列正确的说法是:(A) Θv越高,表示温度越高;(B) Θv越高,表示分子振动能越小;(C) Θv越高,表示分子处于激发态的百分数越小;(D) Θv越高,表示分子处于基态的百分数越小。
24.下列哪个系统不具有玻尔兹曼-麦克斯韦统计特点:(A) 每一个可能的微观状态以相同的几率出现;(B) 各能级的各量子态上分配的粒子数,受保里不相容原理的限制;(C) 系统由独立可别的粒子组成,U= ∑n iεi;(D) 宏观状态参量N、U、V为定值的封闭系统。
25.下列几种运动中哪些运动对热力学函数G与A贡献是不同的:(A) 转动运动;(B) 电子运动;(C) 振动运动;(D) 平动运动。
26.下面对转动配分函数计算式的对称数σ差别理解不对的是:(A) 对配分函数的修正;(B) 对粒子等同性的修正;(C) 对量子态等同性的修正;(D) 对转动量子数的修正。
27.对于下列各个亥姆兹自由能函数公式,哪一公式适用于晶系统统:(A) A = - kT ln(q N/N! ) ;(B) A = -NkT lnq ;(C) A = - NkT(lnq/N + 1) ;(D) A = -NkT lnq e/N。
28.三维平动子的平动能为εt = 7h2/(4mv2/3),能级的简并度为:(A) 1 ;(B) 3 ;(C) 6 ;(D) 2 。
29.HI的转动特征温度Θr = 9.0 K,300K时HI的摩尔转动熵为:(A) 37.45 J·K-l·mol-1;(B) 31.70 J·K-l·mol-1;(C) 29.15 J·K-l·mol-1;(D) 30.5 J·K-l·mol-1。
30.O2的转动惯量J = 19.3 × 10-47 kg·m2,则O2的转动特征温度是:(A) 10K ;(B) 5K ;(C) 2.07K ;(D) 8K 。
31.下面关于分子各种运动形式配分函数计算公式的能量标度零点选取的描述错误的是:(A) q t的计算公式是近似地以基态能级的能量为能量标度的零点;(B) q r的计算公式是以基态的能量为能量标度的零点;(C) q e和q n的计算公式是基态能级的能量标度的零点;(D) q v的计算公式是以基态能级的能量标度的零点。
32.对于单原子理想气体在室温下的物理过程,若要通过配分函数来求过程中热力学函数的变化:(A) 必须知道q t、q R、q v、q n各配分函数;(B) 只须知道q t一个配分函数;(C) 必须知道q t、q n配分函数;(D) 必须知道q t、q R、q v配分函数。
