苯酚
苯酚ppt课件

苯酚在其他领域的应用
塑料工业
苯酚可以与其他物质合成许多塑料,如酚醛树脂 、聚酚等。
橡胶工业
苯酚可以与其他物质合成橡胶,如丁苯橡胶、丁 腈橡胶等。
油漆和染料工业
苯酚可以与其他物质合成油漆和染料,如酸性染 料、酸性媒介染料等。
05 苯酚的发展前景与展望
苯酚的市场需求和发展趋势
苯酚市场需求持续增长
随着化工、医药、农药等行业的快速发展,苯酚作为重要的中间 体,市场需求量不断攀升。
油等。
合成药物
苯酚是许多药物和合成药物的原料 ,如阿司匹林、布洛芬等。
消毒剂
苯酚具有杀菌作用,可用于医疗器 械、手术工具、伤口等的消毒。
苯酚在农药领域的应用
杀虫剂
苯酚可以与其他物质合成杀虫剂 ,用于防治农业害虫。
除草剂
苯酚可以与其他物质合成除草剂 ,用于清除农田杂草。
杀菌剂
苯酚可以与其他物质合成杀菌剂 ,用于防治植物病害。
合成原料
苯酚可用于合成许多有机化合 物,如酚醛树脂、染料等。
化工原料
苯酚可用于制造其他化学品, 如苯胺、苯甲酸等。
02 苯酚的生产方法
苯酚的合成方法
苯酚的合成方法有多种,其中最常用 的是苯酚的直接氧化法。该方法以苯 为原料,在催化剂的作用下,通过空 气氧化生成苯酚。
此外,还有苯酚的生物合成法,利用 微生物或酶催化苯氧化生成苯酚。
苯酚ppt课件
目录
CONTENTS
• 苯酚的简介 • 苯酚的生产方法 • 苯酚的危害与防护 • 苯酚的应用领域 • 苯酚的发展前景与展望
01 苯酚的简介
苯酚的物理性质
沸点:181.7℃
熔点:40.3℃
01
02
苯酚

苯酚别名:石灰酸,羟基苯英文名:phenol;carbolic acid;phen(yl)ic acid;phenyl hydroxide;(hydr)oxybenzene结构式:C6H5OH分子式:C6H6O物化性质:无色针状结晶或白色结晶熔块。
可燃。
腐蚀力强。
有毒。
不纯品在光和空气作用下变为淡红或红色。
与大约8%水混合可液化。
可吸收空气中水分并液化。
有特殊臭味和燃烧味,极稀的溶液具有甜味。
1克溶于约15ML水,12ML苯。
易溶于乙醇、乙醚、氯仿、甘油、二硫化碳、凡士林、挥发油、固定油、强碱水溶液。
几乎不溶于石油醚。
相对密度(d204)1.0576。
凝固点41℃。
熔点43℃。
沸点181.7℃(182℃)。
折射率(n41D)1.54178。
闪点79.5℃。
自燃点715℃。
用途:重要的有机化工原料,可用以制取酚醛树脂、己内酰胺、双酚A、水杨酸、苦味酸、五氯酚、己二酸、酚酞N-乙酰乙氧基苯胺等化工产品及中间体。
在合成纤维、塑料、合成橡胶、医药、农药、香料、染料、涂料和炼油等工业中有着重要用途。
此外,还可以用作溶剂、实验试剂和消毒剂。
制法:1、磺化法:以苯为原料,用硫酸进行磺化生成苯磺酸,用亚硫酸中和,再用烧碱进行碱熔,经磺化和减压蒸馏等步骤而制得。
C6H6 +H2SO4→C6H5SO3+H2O2C6H5SO3+NaOH→2SO3Na+SO2+H2O2、异丙苯法:丙烯与苯在三氯化铝催化剂作用下生成异丙苯,异丙苯经氧化生成氢过氧化异丙苯,再用硫酸或树脂分解。
同时得到苯酚和丙酮。
3、氯苯水解法:氯苯在高温高压下与苛性钠水溶液进行催化水解,生成苯钠,再用酸中和得到苯酚。
4、粗酚精致法:由煤焦油粗酚精致而得。
5、拉西法:苯在固体催化剂存在下,高温下进行氯氧反应,生成氯苯和水,氯苯进行催化水解,得到苯酚和氯化氢,氯化氢循环使用。
质量标准:由于制法不同,有两种产品质量标准。
一、工业苯酚(适用于炼焦副产品)指标名称一级品合格品外观白色或淡红色白色或棕红色结晶点/℃≥ 39.5 38.5中性油/%≤ 0.3 0.5水分/%≤ 0.5 0.5二、合成苯酚GB339-89指标名称优级品一级品二级品结晶点/℃≥ 40.6 40.5 40.0水中溶解度/%≤ 0.03 0.04 0.14(1:20吸光度)蒸发残渣/%≤ 0.10 0.10 0.16水分/%≤ 0.1毒性及防护:苯酚蒸汽在较冷空气中凝成粉尘。
苯酚是什么

苯酚是什么苯酚是一种广泛应用的有机化合物,也被称为羟基苯或碳酸基酚。
它是由苯环上的一个氢原子被一个羟基取代而形成的。
苯酚是无色结晶固体,有特殊的芳香味道。
在本文中,我们将探讨苯酚的化学性质、用途以及对环境和健康可能产生的影响。
首先,苯酚的化学性质使其具有广泛的用途。
由于它具有强大的抗菌性能,所以在制造消毒剂和杀真菌剂时被广泛应用。
此外,苯酚也被用作生物化学试剂,如DNA和RNA的提取和纯化过程中的溶剂。
此外,苯酚还用于制造塑料、染料、杀虫剂等各种产品。
然而,尽管苯酚有许多有用的用途,但它也对环境和人类的健康产生潜在的危害。
苯酚是一种可能有毒的物质,吸入或接触大量苯酚可能会对人体产生严重的危害。
长期接触高剂量的苯酚可能导致中毒症状,包括头痛、恶心、呕吐、中枢神经系统抑制等。
此外,苯酚还可以对水生生物产生毒性影响,污染水体中的苯酚可能导致生态系统的破坏。
对于苯酚的环境排放和处理也是一个重要的问题。
苯酚的排放往往来自于工业废水和废弃物处理厂等源头,这些排放物质可能对环境和水资源造成污染。
为了减少苯酚的排放,需要加强工业企业的管理和监督,实施严格的环境保护措施。
此外,苯酚的处理也是一个挑战,因为苯酚在水中的溶解度较高,容易被传播和扩散。
为了减少苯酚对环境和人类健康的潜在危害,许多国家和地区都制定了相关的法规和标准。
这些法规要求企业减少苯酚的排放,采取有效的治理措施,并对苯酚的使用进行限制。
此外,相关的监测和检测方法也得到了广泛的研究和应用,以保证人们生活和工作环境中的苯酚浓度处于安全水平。
总结起来,苯酚是一种有机化合物,具有广泛的应用。
它具有杀菌功能,可用于制造消毒剂和杀真菌剂等产品。
然而,长期接触高剂量的苯酚可能对人体和环境产生危害。
因此,加强苯酚的管理和监控,减少苯酚的排放,对于保护人类健康和环境具有重要意义。
同时,还需要进一步研究苯酚的毒性机制和治理技术,以期找到更好的解决方案。
苯酚的性质

苯酚的性质苯酚是一种碱式有机化合物,其化学式为C6H5OH,是一种低分子量碱性有机化合物,分子量约为94.11,为弱酸。
苯酚无色液体,具有独特的气味,通常为无色液体或淡黄色晶体。
苯酚酸性强,可与碱和弱碱反应,且可溶于水、有机溶剂、氧化剂和碱性溶剂中。
一、苯酚的性质1、溶解性苯酚在水、二甲醚、乙醇、乙醚、苯、醚和其它易溶有机溶剂中可溶解,但溶解度较低,可能因其物质间的疏水作用而变为坚硬的晶体。
2、稳定性苯酚的热稳定性较好,可在100℃下烘干后保持其外观不变,然而在空气中容易发生氧化反应,特别是在温度较高时,由于它与氧发生氧化反应,更容易发生氧化反应。
3、pH值苯酚的pH值为4.7,稍高于中性,它是一种弱酸,可以发生酸碱反应,可与碱和弱碱反应生成盐和水。
二、苯酚的用途合成颜料和溶剂苯酚可用于合成颜料,常用于染料、香料、香料和医药行业中的色料等。
催化剂苯酚可作为催化剂,可用于进行多种反应,例如油水反应、聚合反应和氧化反应等。
清洗剂苯酚也可用作清洗剂,因其具有高性能、无毒、高通用性和环保性等特点,广泛用于电子材料、机械工程、电子和工厂等行业的清洗应用。
三、苯酚的安全性苯酚虽然具有许多优异的性质,但其对人体有一定的负面影响。
高浓度苯酚会刺激眼睛和皮肤,如果处理不当,还可能导致中毒。
因此,使用苯酚时应加以认真的防护措施,并确保正确的使用方法,以避免不必要的伤害和损害。
总之,苯酚是一种独特的有机物质,具有良好的性能,可用于许多化学反应和应用,但也有可能引起机体不良反应。
因此,使用苯酚时,应注意安全防护措施,并确保科学正确的使用方法,以保证苯酚的安全性。
苯酚
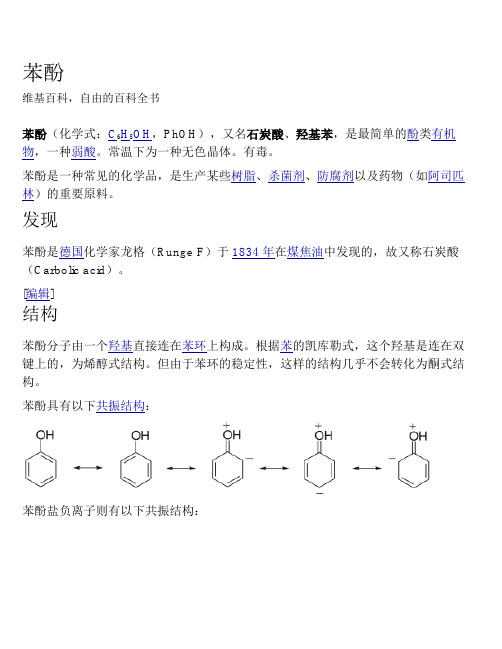
苯酚维基百科,自由的百科全书苯酚(化学式:C6H5OH,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
苯酚是一种常见的化学品,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
发现苯酚是德国化学家龙格(Runge F)于1834年在煤焦油中发现的,故又称石炭酸(Carbolic acid)。
[编辑]结构苯酚分子由一个羟基直接连在苯环上构成。
根据苯的凯库勒式,这个羟基是连在双键上的,为烯醇式结构。
但由于苯环的稳定性,这样的结构几乎不会转化为酮式结构。
苯酚具有以下共振结构:苯酚盐负离子则有以下共振结构:酚羟基的氧原子采用sp2杂化,提供1对孤电子与苯环的6个碳原子共同形成离域键。
大Π键加强了烯醇的酸性,羟基的推电子效应又加强了O-H键的极性,因此苯酚中羟基的氢可以电离出来。
[编辑]物理性质苯酚熔点为40.5℃,沸点为181.7℃,常温下为一种无色或白色的晶体,有特殊气味。
苯酚密度比水大,微溶于冷水,可在水中形成白色混浊;但易溶于65℃以上的热水。
易溶于醇、醚等有机溶剂。
[编辑]化学性质酸碱反应苯酚是一种弱酸,能与碱反应:苯酚pKa=10,酸性介于碳酸两级电离之间,因此苯酚不能与NaHCO3等弱碱反应:此反应现象:二氧化碳通入后,溶液中出现白色混浊。
显色反应苯酚遇三氯化铁溶液显紫色,原因是苯酚根离子与Fe3+形成了有颜色的络合物。
(紫色)取代反应■苯环上的亲电取代:苯酚由于结构中有苯环,可以在环上发生类似苯的亲电取代反应,如硝化、卤代等:对比苯的相应反应可以发现,苯酚环上的取代比苯容易得多。
这是因为羟基有给电子效应,使苯环电子云密度增加。
值得注意的是,苯酚的亲电取代总是发生在羟基的邻位和对位。
这是羟基等给电子基团的共性。
■酚羟基上的取代:酚羟基上的氢原子可以被含碳基团取代,生成醚或酯。
氧化还原反应苯酚在空气中久置会变为粉红色,是因为生成了苯醌:苯酚的氧化产物一般是对苯醌。
苯酚的性质和应用

苯酚的性质和应用苯酚,又称为羟基苯,是一种有机化合物,化学式为C6H6O。
它是一种无色或微黄色的固体晶体,具有特殊的芳香味道。
苯酚可以溶于水、乙醇和醚等常见溶剂,具有一定的挥发性。
下面我将详细介绍苯酚的性质和应用。
首先,让我们来了解一下苯酚的性质。
苯酚是一种酚化合物,具有独特的化学性质。
它可以与酸反应生成对应的酚盐,例如与盐酸反应生成盐酸苯酚。
此外,苯酚还可以与酚醛类化合物发生缩合反应,形成呈深红色的产物。
这种缩合反应在有机合成中有重要的应用价值。
苯酚还具有一定的物理性质。
它的熔点为40°C,沸点为181°C,密度为1.07 g/cm³。
苯酚具有较强的刺激性气味和腐蚀性,对皮肤和黏膜有刺激作用,应避免直接接触。
接下来,我们来探讨一下苯酚的应用。
由于苯酚具有一系列特殊的化学性质,因此在很多领域都有广泛的应用。
首先,苯酚被广泛应用于医药领域。
作为一种消毒剂,苯酚可以杀灭细菌和病毒,常用于外科手术器械的消毒和灭菌。
此外,苯酚还具有一定的麻醉作用,在一些外科手术中被用作局部麻醉剂。
此外,苯酚还可以用于制备一些药物原料,制成消炎止痛的药物。
其次,苯酚在化工工业中也有重要的应用。
由于苯酚具有较强的溶解性和稳定性,它常被用作溶剂和中间体。
苯酚可以用于制备各种化工产品,如合成树脂、合成橡胶和合成香料等。
此外,苯酚还可以用于电镀工业,作为硫酸电镀液中的还原剂,用于电镀金属表面。
在有机合成中,苯酚可以通过苯酚酸化反应制备羧酸,这一反应广泛应用于有机合成的领域。
此外,苯酚还可用于染料工业。
苯酚可以与胺类化合物发生偶氮反应,生成偶氮染料。
这些染料具有鲜艳的颜色和良好的耐光性,广泛应用于纺织和印刷工业。
最后,苯酚还可以用于农业。
苯酚具有一定的杀菌作用,可以用于农作物的防治。
此外,苯酚还可以用作杀虫剂,帮助农民保护农作物。
综上所述,苯酚是一种具有特殊性质和广泛应用的化合物。
它在医药、化工、染料和农业等领域都扮演着重要的角色。
苯酚
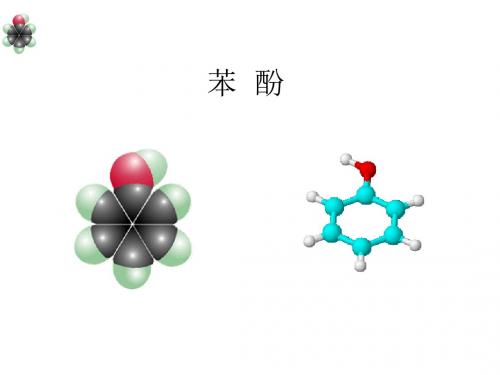
1、组成和结构 分子式: C6H6O
结构简式:
OH
OH
或C6H5OH
官能团: -OH
2、物理性质 无色晶体(放置时间较长的苯酚为粉红色) 有特殊气味, 熔点43℃,
2、物理性质 无色晶体(放置时间较长的苯酚为粉红色) 有特殊气味, 熔点43℃, 室温下,在水中的溶解度是9.3g,当温度高 于65℃时,能与水混溶, 易溶于乙醇等有机溶剂, 有毒、有腐蚀性。
苯酚化学性质探究
• 实验仪器:试管、胶头滴管、药匙 • 实验药品:苯酚、蒸馏水、酸性高锰酸钾 溶液、NaOH溶液、盐酸 • 探究:1、苯酚的氧化反应 2、苯酚的酸性
(2)弱酸性
OH + NaOH ONa + H2O
ONa + HCl
OH + NaCl
ONa + CO2 + H2O
OH + NaHCO 3 NaHCO 33
酸性:H2CO3>C6H5OH>HCO3-
思考
• 分析苯酚的结构,猜想苯酚的酸性是由哪 部分结构决定的? • 为什么乙醇中也有羟基,但却没有酸性?
类别 结构简式 官能团 酸性 与钠反应
乙醇 CH3CH2OH -OH 无 比水缓和 酚羟基比醇羟基活泼
苯酚
-OH 有 比水剧烈
结论பைடு நூலகம்
原因
苯环对酚羟基的影响使羟基上的氢变得 更活泼,易电离出H+
羟基对苯环是否有影响?
OH
(3)取代反应
OH + 3Br2 Br OH Br + 3HBr
Br
类别 结构简式
苯
苯酚
液溴 饱和溴水 溴的状态 条件 FeBr3作催化剂 不需要催化剂 溴 化 反 应
苯酚

苯酚【知识要点】一、苯酚的结构苯酚:分子式:C6H6O 结构简式:或C6H5OH二、物理性质无色晶体,有特殊气味,在空气中易被氧化而呈粉红色,熔点低,常温下在水中溶解度不大,加热时易溶(>65℃时任意比溶于水),易溶于乙醇等有机溶剂,有腐蚀性三、化学性质(一)、弱酸性(石炭酸)石炭酸酸性比碳酸弱,不能使酸碱指示剂变色酸性:H2CO3 > C6H5OH > HCO3-(二)、苯环上的取代反应(三)、显色反应(四)、加成反应四、用途:化工原料,制酚醛树脂、医药、染料等,稀溶液用作防腐剂和消毒剂。
【典型例题】例题1苯酚沾在皮肤上,正确的处理方法是().酒精洗涤 B.水洗 C.氢氧化钠溶液洗涤 D.溴水处理例题2下列有机物属于酚的是(). C6H5—CH2OH C HO—C6H4—CH3. C10H7—OH D C6H5—CH2CH2OH例题3除去苯中所含的苯酚,可采用的适宜方法是()A 加70℃以上的热水,分液 B. 加适量浓溴水,过滤C 加足量NaOH溶液,分液 D. 加适量FeCl3溶液,过滤例题4下列有机物不能与HCl直接反应的是()A苯 B.乙烯 C.丙醇 D.苯酚钠例题5为了把制得的苯酚从溴苯中分离出来,正确的操作是()A. 把混合物加热到70℃以上,用分液漏斗分液B. 加烧碱溶液振荡后分液,再向上层液体中加盐酸后分液C. 加烧碱溶液振荡后分液,再向上层液体中加食盐后分液D. 向混合物中加乙醇,充分振荡后分液例题6用一种试剂就能区分开苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液这六种无色液体。
它是()A.水B.FeCl3溶液C.金属钠D.CuO例题7由C6H5—、C6H4—、—CH2—、—OH四种原子团共同组成属于酚类的物质,可得到的结构有()A.2种B.3种C.4种D.5种例题8能证明苯酚具有弱酸性的方法是()①苯酚溶液加热变澄清②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
案例分析
对新教材中含酚废水处理实验的改进
普通高中课程标准实验教科书《有机化学基础》(江苏教育出版社,2004年12月第1版)在介绍酚的性质和应用这一节内容时,设计了探究性实验让学生初步认识含酚废水的处理。
含酚(主要是苯酚和甲酚)废水的处理一直是人们密切关注的工业污染处理问题之一,因为水体中含有少量的酚,会对人体、水生生物及附近的农作物造成一定的危害。
但实验区的许多教师在做该实验时,却反映教材上的实验步骤、实验现象及效果都不甚理想,尤其是不能将工业上处理含酚废水的方法很好地表达清楚。
教材中(P74)该实验的实验步骤如下:向4mL含苯酚的废水中滴加几滴FeCl3溶液,将得到的紫色溶液转移到两支试管中,分别加入约0.5mL苯或少量活性炭,振荡,观察实验现象。
按教材上的实验步骤进行实验后,实验现象是:加入活性炭后,紫色可褪去;加入苯后,振荡静置,溶液分层,上层为无色,下层为紫色,紫色并没褪去。
实验结果证明活性炭能使苯酚和FeCl3反应后生成的紫色络合物(H3[Fe(C6H5O)6])褪色,但是苯却没能使紫色褪去。
在工业上,苯可以用作含酚废水的萃取剂,故教材上的该实验的反常现象使不少教师颇感困惑,究其原因:一是没注意到苯酚和紫色络合物在苯中的溶解性有很大差异;二是该实验的操作顺序设置不妥。
笔者多次试做了教材上的实验,并对该实验作了改进。
实验过程简述如下:
1 实验用品
含苯酚废水(8000mg/L),1%FeCl3溶液,苯,活性炭。
2 实验步骤及现象
(1)向4mL含苯酚废水加入约10滴左右FeCl3,溶液显紫色,加入活性炭后,振荡,紫色褪去。
(2)向4mL含苯酚废水加入约10滴左右FeCl3,溶液显紫色,加入约2mL苯,振荡后静置,溶液分层,上层为无色苯层,下层为紫色水层。
结论I:活性碳的吸附能力较强,能够吸附该紫色物质。
苯不易从水中萃取该紫色络合物H3[Fe(C6H5O)6],既该紫色络合物在水中的溶解度远大于在苯中的溶解度。
(3)向4mL含苯酚废水加入约2mL苯后,振荡后静置,待溶液分层后,将苯层和水层分开:
在苯层中加入约10滴左右FeCl3水溶液,振荡后静置,溶液分层,上层为无色苯层,下层为紫色水层。
在水层中滴加约10滴左右FeCl3,将其与含酚废水直接加FeCl3后的紫色溶液颜色对照,其紫色明显变淡。
3 实验结论
苯不易从水中萃取紫色络合物,苯能够萃取水中部分苯酚。
通过实验改进,可使学生更好地了解并领会含酚废水处理的原理和方法,使学生对于活性炭的吸附性能和萃取法在工业上的应用有更深刻的认识,让学生体会到了知识的实用性。
4 讨论
(1)含酚废水的浓度从几百毫克每升到几万毫克每升不等,浓度≥1000mg/L的属于高浓度含酚废水,工业上就要考虑酚的回收和再利用。
在实验中,为了使现象更加明显,可以配制高浓度的含酚废水。
(2)查阅文献可知,不同的萃取剂对于酚的萃取能力不同。
萃取能力的大小主要以酚在萃取剂和水中的浓度比,即分配系数K的大小来表示,如表1[1]:
表1 酚在不同有机溶剂中的分配系数。
