第三章酰化反应优秀课件
合集下载
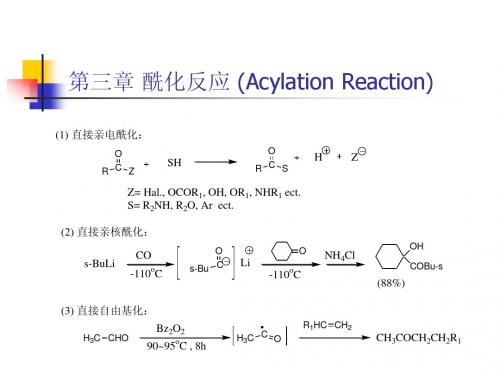
第三章 酰化反应 (Acylation Reaction)
OCH3
RCOOR1
N N N N C O O C 2H 5 CH3 C H COOCH3
R C O O R 1=
C O O C 2H 5 OCH3
(9 9 % )
(9 7 % )
(9 7 % )
4. 酰氯为酰化剂
RCOCl 反应机理: R 1O H RCOCl
N O R H C OR N N COR
o
OAc C 9H 19
HO
C H 2O A c
(6 8 % ) Py
AcO C H 2O A c
HO
C H 2O H
(6 2 % )
(1)羧酸-三氟乙酸混合酸酐
RCOOH (C F 3 C O ) 2 O
O R F 3C C O C O
RCO O CO CF3
C F 3C O O H
OH
H
R F 3C
R 1O
M eO O C
COOMe O O
i- P r O O C
C O O P r -i O O
i-P rO H
T i(O P r-i) 4 70 C , 3h
o
(9 1 % )
M eO O O
C 12H 25
OH Ar
DM AP
O Ar O O
C 12H 25
A r-= 1 -萘 基
O COOMe Ph OH
Ph OCOPh O TM S OCOPh
B u 2 S n O /T o l re flu x
Ph O O S nB u2
PhC O C l r.t., 1 h
TM SCl r.t., 1 ~ 2 h
Ph
O TM S
(9 8 % )
RCOOR1
N N N N C O O C 2H 5 CH3 C H COOCH3
R C O O R 1=
C O O C 2H 5 OCH3
(9 9 % )
(9 7 % )
(9 7 % )
4. 酰氯为酰化剂
RCOCl 反应机理: R 1O H RCOCl
N O R H C OR N N COR
o
OAc C 9H 19
HO
C H 2O A c
(6 8 % ) Py
AcO C H 2O A c
HO
C H 2O H
(6 2 % )
(1)羧酸-三氟乙酸混合酸酐
RCOOH (C F 3 C O ) 2 O
O R F 3C C O C O
RCO O CO CF3
C F 3C O O H
OH
H
R F 3C
R 1O
M eO O C
COOMe O O
i- P r O O C
C O O P r -i O O
i-P rO H
T i(O P r-i) 4 70 C , 3h
o
(9 1 % )
M eO O O
C 12H 25
OH Ar
DM AP
O Ar O O
C 12H 25
A r-= 1 -萘 基
O COOMe Ph OH
Ph OCOPh O TM S OCOPh
B u 2 S n O /T o l re flu x
Ph O O S nB u2
PhC O C l r.t., 1 h
TM SCl r.t., 1 ~ 2 h
Ph
O TM S
(9 8 % )
第三章 酰化反应1

O Lewis 酸催化 R C Cl
AlCl3 配位键,增大碳的正电性
O R C Cl + AlCl3
O R C Cl
AlCl3
O R C
AlCl4
2015-3-21
第三章 酰化反应
24
碱催化 ① 无机碱:去酸剂 ② 有机碱:Py, Et3N, DMAP PPY: DMAP: N
2015-3-21
R
C
O O O H
R
C
O OH O
O R C +
O F3C C OH
F3C C
F3C C
羧酸-三氟乙酸混合酸酐的制备 (CF3CO)2O+RCOOH
O O F3C C O C R + CF3COOH
2015-3-21
第三章 酰化反应
23
4) 酰氯为酰化剂 Lewis酸催化 (酸酐、酰氯均适于位阻较大的醇)
O + R C OAlCl3
2015-3-21
第三章 酰化反应
20
③ 碱催化: 有机碱:吡啶, Et3N
CH3 DMAF OH + Ac2O 回流 O OH + C C O O CH3 OAc CH3 N N CH3 Et3N TEA
DMAF: 对二甲 氨基吡啶
CH3 C3 H7 C CH3
O CH3 C O C C3H7 C O CH3 OH
OH
Rt H3C
COO CH3 COOCEt3 CH3
AgCN HMPT
六甲基磷酰胺
2015-3-21
第三章 酰化反应
28
5) 酰胺为酰化剂 (活性酰胺)
O R C O R C R' N R'' N N N 的共轭效应使酰胺酯化作用弱 O R C N N O R C N N N HN N + CO2 + N H
AlCl3 配位键,增大碳的正电性
O R C Cl + AlCl3
O R C Cl
AlCl3
O R C
AlCl4
2015-3-21
第三章 酰化反应
24
碱催化 ① 无机碱:去酸剂 ② 有机碱:Py, Et3N, DMAP PPY: DMAP: N
2015-3-21
R
C
O O O H
R
C
O OH O
O R C +
O F3C C OH
F3C C
F3C C
羧酸-三氟乙酸混合酸酐的制备 (CF3CO)2O+RCOOH
O O F3C C O C R + CF3COOH
2015-3-21
第三章 酰化反应
23
4) 酰氯为酰化剂 Lewis酸催化 (酸酐、酰氯均适于位阻较大的醇)
O + R C OAlCl3
2015-3-21
第三章 酰化反应
20
③ 碱催化: 有机碱:吡啶, Et3N
CH3 DMAF OH + Ac2O 回流 O OH + C C O O CH3 OAc CH3 N N CH3 Et3N TEA
DMAF: 对二甲 氨基吡啶
CH3 C3 H7 C CH3
O CH3 C O C C3H7 C O CH3 OH
OH
Rt H3C
COO CH3 COOCEt3 CH3
AgCN HMPT
六甲基磷酰胺
2015-3-21
第三章 酰化反应
28
5) 酰胺为酰化剂 (活性酰胺)
O R C O R C R' N R'' N N N 的共轭效应使酰胺酯化作用弱 O R C N N O R C N N N HN N + CO2 + N H
南中医药合考试ppt第三章 酰化反应

30
第三节 C-酰化反应
一. 芳烃的酰化
1. Friedel-Crafts酰化反应 定义:酰氯、酸酐、羧酸等酰化剂在Lewis酸或质子酸催化下, 对芳烃进行亲电取代生成芳酮反应。
Lewis acid + RCOZ or 质子酸 COR + HZ
Z = X,R'COO-, HO-, R'O-
31
机理
10
该反应是可逆反应,采用除去生成的醇以打破平 衡; 适用于活性较小的羧酸以及结构复杂的醇; 常用甲酯或乙酯合成高级酯。
MeO O O
C12H25 +
OH DMAP Ar
O Ar O O
C12H25
Ar = 1-Naphtyl 97%
11
局麻药丁卡因的合成
12
抗胆碱药溴美喷酯的合成
13
3. 酸酐(anhydride)为酰化剂 酸酐为强酰化剂,且酰化反应是不可逆反应; 多在酸或碱催化下进行,如硫酸、氯化锌、对甲苯磺酸、吡啶、 三乙胺、DMAP等;
NMe2 DMF/POCl3
NMe2 CHNMe2 Cl H2O
NMe2 化剂活性决定。
被酰化物:
RCH2
> RNH > RO > RNH2 > ROH
RCOX > (RCO)2O > RCOOR', RCOOH > RCONHR'
(活性酯和活性酰胺除外) 本章主要讨论O, N, C 上的酰化反应
14
在反应困难或位阻较大的醇羟基进行酰化,往往 使用DMAP等作为催化剂
Py,加热 DMAP
81% 95%
15
4. 酰氯(Acid chloride)为酰化剂
第三章 酰化反应-药物合成反应_gczppt课件

酯变为另一种酯。反应类型有三类:
RCOOR'+R''OH
RCOOR'' +R'OH
RCOOR'+R''COOH
R'COOR'' +RCOOH
RCOOR'+R''COOR'''
RCOOR''' +R''COOR'
上述三种酯交换方式都是利用反应的可逆性来实现的,其中第 一种酯交换方式应用最广,其反应过程常用质子酸或醇钠进行 催化。
2)酰化能力与羧酸酯的OR’的共轭酸R’OH的酸性大小有关, R’OH酸性越强,酯的酰化能力越强,所以一般而言, RCOOAr>RCOOMe>RCOOEt.
3)由于在反应过程中常常采用蒸出所生成的低沸点的醇(如 甲醇、乙醇等)来打破平衡,所以一般选用甲酯和乙酯。
25
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
反应进行,常常设法除去反应生成的水
H
R 'O H HO R '
RCO H
RCO H
RCO H
O
O H
O H
O R '
RCO ¨ H
O H 2
-H2O OH H
O
-H2ORCOR'
RCOR'
8
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
•提高收率:(1)增加反应物浓度
•
(2)不断蒸出反应产物之一
•
第三章 酰化反应
Chapter 3 Acylation Reaction
RCOOR'+R''OH
RCOOR'' +R'OH
RCOOR'+R''COOH
R'COOR'' +RCOOH
RCOOR'+R''COOR'''
RCOOR''' +R''COOR'
上述三种酯交换方式都是利用反应的可逆性来实现的,其中第 一种酯交换方式应用最广,其反应过程常用质子酸或醇钠进行 催化。
2)酰化能力与羧酸酯的OR’的共轭酸R’OH的酸性大小有关, R’OH酸性越强,酯的酰化能力越强,所以一般而言, RCOOAr>RCOOMe>RCOOEt.
3)由于在反应过程中常常采用蒸出所生成的低沸点的醇(如 甲醇、乙醇等)来打破平衡,所以一般选用甲酯和乙酯。
25
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
反应进行,常常设法除去反应生成的水
H
R 'O H HO R '
RCO H
RCO H
RCO H
O
O H
O H
O R '
RCO ¨ H
O H 2
-H2O OH H
O
-H2ORCOR'
RCOR'
8
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
•提高收率:(1)增加反应物浓度
•
(2)不断蒸出反应产物之一
•
第三章 酰化反应
Chapter 3 Acylation Reaction
第三章-酰化反应

构型反转
OH
O
可以对光学活性的仲醇进行构型的转化
(4) 应用特点
① 伯醇酯的制备
O NH HO O N O + OH NO2 COOH 1)DEAD/PPh3 r.t., 1h OH OH O2N O C O O NH O N O
OH
② 仲醇酯的制备
COOH OH + NO2 DEAD/PPh3/THF 55℃, 10h
R1OH
+
RCOOH
RCOOR1 + H
② Lewis酸催化
O R C O R C O BF3 或AlCl3 R C O R C O 或 R C O O BF3 R C O BF3 O O R C
R1OH
+ RCOOBF3 RCOOR1 + H
③吡啶类碱催化
(3) 影响因素
① 酸酐结构的影响
羰基的α位有吸电子基团,亲电性增强
(B) Z的离去能力越强酰化能力越强。Z的离去 能力与其共轭酸HZ的酸性相一致。 (C) R1的空间位阻(取代基体积)越大,酰化 能力越弱 常见酰化剂酰化能力强弱顺序
(4)被酰化物的活性
被酰化物的亲核性越强越易被酰化
亲核性
碱性 碱性越强,亲核性越强 RNH2>ROH>RH 空间位阻 位阻越小,亲核性越强
佐匹克隆
③叔醇的酰化 加入Ag+、Li+盐,提高收率
HMPA/AgCN COCl + (Et)3COH
COOC(Et)3
六甲基磷酰三胺(HMPA)
二、酚的O-酰化
(1)反应通式
酰氯 酸酐 (2)反应机理
(3)影响因素
酚结构的影响
第三章-酰化反应

体积小的短链的羧酸乙酯、甲酯更常用。 空间位阻效应,沸点低。
②醇结构的影响
醇作为被酰化物,其影响与前面所讲 的被酰化物活性影响因素一致
(4)应用特点
①羧酸甲酯或乙酯的应用:用高级醇置换低级醇。
OH HO
C CO2CH3
N
Na 110-120℃
CH3
OH C CO2
N
CH3OH
CH3
②活性酯的应用 i. 羧酸硫醇酯:
N
O R CO
N C
N H
O
CN H+
+
N CN H O
R C O-..
O R CO
R' O .. H
O
H +N C N H
(15)
O . R C O-..
例:
R
C
+
O
R'
+
N H
H H+
O R C OR'
CN H
ii. 用来提高醇反应活性的催化剂
N COOEt DEAD
N COOEt
偶氮二羧酸二乙酯;
O Py
EtO P OEt -HCl
Br
O
O
R'OH
R C O P OEt
OEt
RCOOR'
4. 酰氯为酰化剂
(1)反应通式
催化剂:Lewis酸、有机碱
(2)反应机理
①吡啶类碱的催化
吡啶类碱还能中和反应中产生的氯化氢
② Lewis酸催化
O R C Cl + AlCl3
O AlCl3 R C Cl
须用强酰化剂:酰氯、酸酐、活性酯 电子效应
苯环上有给电子基团时,增加酰化反应的活性 苯环上有吸电子基团时,减小酰化反应的活性
②醇结构的影响
醇作为被酰化物,其影响与前面所讲 的被酰化物活性影响因素一致
(4)应用特点
①羧酸甲酯或乙酯的应用:用高级醇置换低级醇。
OH HO
C CO2CH3
N
Na 110-120℃
CH3
OH C CO2
N
CH3OH
CH3
②活性酯的应用 i. 羧酸硫醇酯:
N
O R CO
N C
N H
O
CN H+
+
N CN H O
R C O-..
O R CO
R' O .. H
O
H +N C N H
(15)
O . R C O-..
例:
R
C
+
O
R'
+
N H
H H+
O R C OR'
CN H
ii. 用来提高醇反应活性的催化剂
N COOEt DEAD
N COOEt
偶氮二羧酸二乙酯;
O Py
EtO P OEt -HCl
Br
O
O
R'OH
R C O P OEt
OEt
RCOOR'
4. 酰氯为酰化剂
(1)反应通式
催化剂:Lewis酸、有机碱
(2)反应机理
①吡啶类碱的催化
吡啶类碱还能中和反应中产生的氯化氢
② Lewis酸催化
O R C Cl + AlCl3
O AlCl3 R C Cl
须用强酰化剂:酰氯、酸酐、活性酯 电子效应
苯环上有给电子基团时,增加酰化反应的活性 苯环上有吸电子基团时,减小酰化反应的活性
第三章-酰化反应

(4) 应用特点
① 选择性酰化
i. 1, 2-二醇的酰化反应
OH OH +
O
Cl (CH3)2SnCl2 /K2CO3 r. t. 12h
ii. 非1, 2-二醇的酰化反应
OH H3C
O
OH +
H3C
Cl
N
collidine
- 40oC
② 仲醇的酰化
O N
N
N
N
OH
O N
Cl Cl
N CH3 HCl
须用强酰化剂:酰氯、酸酐、活性酯 电子效应
苯环上有给电子基团时,增加酰化反应的活性 苯环上有吸电子基团时,减小酰化反应的活性
立体效应:邻、对位的取代基影响较大
(4)应用特点 ① 酰氯为酰化剂 常用NaOH, Na2CO3, AcONa, Et3N, Py 等碱作为缚酸剂或催化剂
≤10℃
② 酸酐为酰化剂
羰基的α位有吸电子基团,亲电性增强
② 催化剂的影响
i. 酸类催化剂 质子酸:H2SO4, p-TsOH, HClO4 Lewis酸:BF3, ZnCl2, AlCl3, CoCl2
ii. 碱类催化剂
Et3N, AcONa
吡啶 对二甲氨基吡啶 4-吡咯吡啶
③反应溶剂的影响 ④反应温度的影响
在较低的温度下滴加酸酐,再缓慢升到室温反应, 或者加热至回流。
③ 活性酯为酰化剂
第四节 碳原子上的酰化反应
• 芳烃的C-酰化 • 羰基化合物a位的C-酰化
芳烃的C-酰化
• 包括两种形式:
– 直接酰化反应:酰化剂直接对芳烃的亲电酰 化的Friedel-Crafts反应,简称F-C酰化;
CH2CONH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HO
HO
C H =C H -C O O H +C H 3O H B F3/Et2O
CH=CH-COOCH3
COOH
对甲苯磺酸
TsOH
+ C12H25OH Xylene
HO
OH
HO
OH
CO OC12H25
OH OH
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
(4) DCC 二环己基碳二亚胺
R
醇 C H 3 O H E t O H n - C 3 H 7 O H C H 2 = C H C H 2 O H P h C H 2 O H 异 丙 醇 叔 丁 醇
V 1 0 . 8 4 0 . 8 4 0 . 6 4 0 . 6 8 0 . 4 7 0 . 0 2 6
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
催化剂
(1)质子酸催化法: 浓硫酸, 氯化氢气体, 磺酸等
O H+ OH RCOH RCOH
OH RCOH
H
C H 2C O O H T sO H /PhH
O H
△,
H
H
O O
H
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
(2)Lewis酸催化法: (AlCl3, SnCl4,FeCl3,等)
概述 催 化
酸碱催化
碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的
亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更
大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
例:
R C O+H
H
R C OH
H
R CO
H
路易斯酸C O BH3质子源自剂C O H-O-RI
O
CH2 O C
O
I
96%
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
例:镇痛药盐酸呱替啶的合成
H3CN
COOH
CH H 3C O l(H g/a C s6)H6/△H3C N
例:局部麻醉药盐酸普鲁卡因的合成
COOC2H5 ·HCl
O 2 N
H O C H 2 C H 2 N (C 2 H 5 )2 /二 甲 苯
第一节 氧原子的酰化反应
O R O H + R ' CL
O R ' CO R + H L
是一类形成羧酸酯的反应 是羧酸的酯化反应 是羧酸衍生物的醇解反应
第一节 氧原子的酰化反应
一 醇的氧酰化
1) 羧酸为酰化剂 R-OH + R'COOH
提高收率: (1) 增加反应物浓度
R'COOR + H2O
(2) 不断蒸出反应产物之一
第三章酰化反应
概述
1 定义:有机物分子中O、N、C原子上导入酰基的反应 O
RC
O
O
R C L + Nu-H
酰化剂
被酰化物
R C Nu + HL
L: X, OCOR, OH, OR', NHR
Nu: R'O(O), R''NH(N), Ar(C)
2 分类:
根据接受酰基原子的不同可分为: 氧酰化、氮酰化、碳酰化
R-N=C=N-R
CH3-N=C=N-C(CH3)3 CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2
N C N (CH2)2 N O
NC N
O +R-C-OH
O H+
HN
R-C-O
C
N
活性酯
H
O R-C-O
N C
N H
O RC
HN +O C
HN
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
C O O H
H C l(g a s )
O 2 N
C O O C H 2 C H 2 N (C 2 H 5 )2
F e /H C l H 2 N
4 5 ℃ ,2 h
C O O C H 2 C H 2 N ( C 2 H 5 ) 2 · H C l
第一节 氧原子的酰化反应 一 醇的氧酰化2)羧酸酯为酰化剂
3 意义:药物本身有酰基;合成手段
概述: 常用的酰化试剂
常用的酰化试剂
O 羧酸 * C OH
O 羧酸酯 * C O R
酸酐 酰胺
O C
O C
O
O
C NH2 ,
O 酰卤* C X
O C NR2
乙烯酮 CH2=C=O
概 述 酰化机理
酰化机理:加成-消除机理
R CO+HNu 加 成
L
RO C
消 除
R CO+HL
2)羧酸酯为酰化剂
R C O O R ' + R ' ' O H R C O O R ' ' + R ' O H 沸 点 低 R ' = C H 3 , C H 2 C H 3
R C O O H + R ' ' O H R C O O R ' + H 2 O 沸 点 高
强,越不容易离去,CL- 是很弱的碱,-OCOR的碱性较强些, OH-、OR-是相当强的碱,NH2-是更强的碱。 ∴ RCOCL>(RCO)2O>RCOOH 、RCOOR′>RCONH2>RCONR2′
R: R带吸电子基团 利于进行反应;R带给电子不利于反应 R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行
A lC l3
O
A lC l3
O配 位 键 (增 加 C 的 正 电 性 )
RCO H
RCO H
(3)酸性树脂(Vesley)催化法: 采用强酸型离子交换树脂加硫酸钙法
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
O
例
OH CH3(CH2)3COOH
O C(CH2)3CH3
100℃
+ H2O
(3) 添加脱水剂或分子筛除水。(无水 CuSO4,无水AI2(SO4)3,(CF3CO)2O, DCC。)
加快反应速率: (1) 提高温度 (2) 催化剂(降低活化能)
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
醇的结构对酰化反应的影响 立体影响因素:伯醇>仲醇>叔醇
RO
O
< 立 体 效 应R CCO H RCO H
L Nu
L
(L=OH、 OR、 OCOR、 X、 NH2等 )
L:加成阶段反应是否易于进行决定于羰基的活性:
若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且 使中间体稳定;若是给电子的作用相反。
诱导效应: 共轭效应:
概述
酰化机理:加成-消除机理
在消除阶段 反应是否易于进行主要取决于L的离去倾向。L-碱性越
H3CO
CH3 COOH +
H2C HO CH
DCC/Et2O
R.T.20min
OH
CH3
酰化能力弱,因为可形成分子内氢键
H3CO
CH3 COOCH H2C
OH
CH3
CH3
OH
C
O
H3CO
OH
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
例:
C H 2 O H
OO +
C O O H D C C /D M A P O 2 5 ℃
