氧化还原反应课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应ppt课件

0
+5
+6
+4
1 S+ 6HNO3(浓)= H12SO4+ NO62↑+
得1e-
第四步、用质量守恒法配平其他物质
H2O
1 S+ 6HNO3(浓)= H12SO4+ NO62↑+ H2O2
第五步、检查质量,电荷,电子是否守恒
新/课/授/课
标变价 列得失 求总数 配系数 查守恒
标出有变价的元素的化合价 列出变价元素的得失电子情况 用最小公倍数配平使得得失电子数相等 用质量守恒法配平其他物质 检查质量,电荷,电子是否守恒
。
变式2
例/题/详/解
下列有关金属元素特征的叙述正确的是( ) A.金属元素的原子只有还原性,其阳离子只有氧化性 B.金属元素的单质在常温下都为固体 C.含金属元素的离子都是阳离子 D.金属阳离子被还原不一定得到金属单质
新/课/授/课
氧化性、还原性强弱的比较方法
氧化性强弱: 氧化剂 氧化产物 还原性强弱: 还原剂 还原产物
变式1
例/题/详/解
变式2
例/题/详/解
下 课见 中 学 次 BYE
下列微粒中,只有氧化性的是(
①S²- ②Fe2+ ③Fe3+ ④S
A.①②
B.②④
D.②④⑤⑥
) ⑤H+ ⑥Na+ ⑦Mg C.③⑤⑥
变式1
例/题/详/解
写出下列微粒在反应中表现出的性质。
S2-、Fe2+ 、H+、Cu、HCl、H2O
只能作氧化剂的是
。
只能做还原剂的是
。
既能作氧化剂又能做还原剂的是
氧化 还原 2
《氧化还原反应》PPT课件

氧化性: MnO4-> MnO2 > Cl2 > Br2 > Fe3+ > I2
第4讲 氧化还原反应方程式的 配平
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物) 还原性:B > b(还原产物)
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反 应方程式,并比较氧化性强弱。
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
第4讲 氧化还原反应方程式的 配平
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物) 还原性:B > b(还原产物)
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反 应方程式,并比较氧化性强弱。
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
氧化还原反应ppt课件

请找出下列反应的氧化剂、氧化产物、还原剂、还原产物
Fe2O3 + 3CO
高温
=
2Fe + 3CO2
2KMnO4 Δ= K2MnO4+MnO2+O2 ↑
SO2 + 2H2S = 3S↓+2H2O
1.3 氧化还原反应
第二课时
4、氧化还原反应的本质
点燃
2Na + Cl2 = 2NaCl 化合价发生改变的原因:电子得失
部分非金属单质
含有高价态元素的
氧
化合物
化 某些金属活动性较
剂 弱的元素对应的高
价态离子
过氧化物
O2、Cl2等 浓硫酸、HNO3、KMnO4、MnO2、
KClO3、K2Cr2O7等
Fe3+、Ag+、Pb4+、Cu2+等
Na2O2、H2O2等
4、氧化性 还原性
还原剂具有还原性(降低其他物质元素的化合价)
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
氧化剂:所含元素的化合价降低, 即得到电子(或电子对偏向)的反应物。
还原剂:所含元素的化合价升高, 即ห้องสมุดไป่ตู้去电子(或电子对偏离)的反应物。
记忆口诀
升失氧,降得还,要说剂,恰相反 还原剂: 化合价升高,失去电子,发生氧化反应,被氧化,生成氧化产物 氧化剂: 化合价降低,得到电子,发生还原反应,被还原,生成还原产物
2.单线桥法(不同元素,失电子物质指向得电子物质)
2×3e-
0 +3
0 +3
①必须箭头(失电子物质元素)指向箭尾(得电子物质对应元素) ②单线桥上不须注明“得到”或“失去”,仅注明电子转移数目
B (大本 P27 第 4 题)下列反应中,电子转移的方向和数目正确的是( )
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
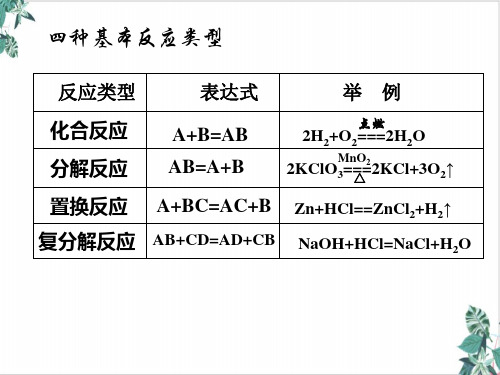
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
氧化还原反应课件

△
2Na2S+Na2SO3+6HCl===6NaCl+3S↓+3H2O
-2 +4 0
3Cl2 + 6NaOH == 5NaCl + NaClO3 +3H2O
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
电解
还原剂 氧化剂 还原产物 氧化产物
点燃
3)2Fe +3Cl2 == 2FeCl3
还原剂 氧化剂 既是还原产物又是氧化产物
练习1:
水(H2O)在很多化学反应中起极其重要 的作用。请研究下列有水参与的氧化还原反应: 2Na + 2H2 O === 2NaOH + H2↑ 3NO2 + H2O === 2HNO3 + NO 2H2O === 2H2↑+ O2↑ 2F2 + 2H2O === 4HF + O2 水只做氧化剂的是 ,水只做还原剂的是 ,水既做氧化剂又还原剂的是 ,水既不是氧化剂又不是还原剂的是 。
Cu
Cl
Mn
Cu
N
练习2
R、X、Y和Z是四种元素,其常见化合价 均为+2价,且X2+与单质R不反应; X2 + +Z=X+Z2 +; Y+Z2 + =Y2 + +Z。这四种离子被还原为0价时表现的氧化性大小符合() A. R2 + >X 2+ >Z 2+ >Y2+ B. X 2+ > R 2+ > Y 2+ >Z 2+ C. Y 2+ >Z 2+ > R 2+ >X 2+ D. Z 2+ > X 2+ > R 2+ >Y 2+
2Na2S+Na2SO3+6HCl===6NaCl+3S↓+3H2O
-2 +4 0
3Cl2 + 6NaOH == 5NaCl + NaClO3 +3H2O
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
电解
还原剂 氧化剂 还原产物 氧化产物
点燃
3)2Fe +3Cl2 == 2FeCl3
还原剂 氧化剂 既是还原产物又是氧化产物
练习1:
水(H2O)在很多化学反应中起极其重要 的作用。请研究下列有水参与的氧化还原反应: 2Na + 2H2 O === 2NaOH + H2↑ 3NO2 + H2O === 2HNO3 + NO 2H2O === 2H2↑+ O2↑ 2F2 + 2H2O === 4HF + O2 水只做氧化剂的是 ,水只做还原剂的是 ,水既做氧化剂又还原剂的是 ,水既不是氧化剂又不是还原剂的是 。
Cu
Cl
Mn
Cu
N
练习2
R、X、Y和Z是四种元素,其常见化合价 均为+2价,且X2+与单质R不反应; X2 + +Z=X+Z2 +; Y+Z2 + =Y2 + +Z。这四种离子被还原为0价时表现的氧化性大小符合() A. R2 + >X 2+ >Z 2+ >Y2+ B. X 2+ > R 2+ > Y 2+ >Z 2+ C. Y 2+ >Z 2+ > R 2+ >X 2+ D. Z 2+ > X 2+ > R 2+ >Y 2+
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应-ppt课件

第三节 氧 化 还 原 反 应
第一课时 氧化还原反应
【学习目标】
1.理解氧化还原反应的特征,学会识别和判断氧化还原反应。 2.从微观角度理解氧化还原的本质,建立氧化还原反应的认知模型。 (重难点)
一些常见元素化合价口诀 正一氢氨钾钠银,正二钙钡和镁锌。 三铝四硅五价磷,二三铁,二四碳。 二四六硫都齐全,铜汞二价最常见
3.从电子转移的角度认识氧化还原反应 ①对于金属与非金属的反应:2Na Cl2
+
2NaCl
+11 2 8 1
Na
Cl
7 8 2 +17
-e-
钠离子带正电荷
氯离子带负电荷
+ e-
+11 2 8 Na+
Na+ Cl-
8 8 2 +17
Cl化合价升降的原因——电子得失
② 对于非金属与非金属的反应
化合价升降原因: 共用电子对的偏移
Cl2+H2O=HCl+HClO
小结:
失电子 化合价升高
被氧化
得电子 化合价降低
被还原
(本质判据) (特征判据)
氧化反应 还原反应
规律:升、失、氧;降、得、还
问题1 氧化还原反应是否一定要有氧的参与?
Fe+CuSO4
Cu+FeSO4
氧化还原反应的特征现象:
问题2 问题3
反应前后元素化合价发生变化。 ——判断依据
有单质参加或生成的化学反应一定是氧化还原反应吗?
3O2
2O3
在氧化还原反应中一种元素被氧化,则一定有另一种元素被还 原,这句话对吗?
ቤተ መጻሕፍቲ ባይዱ
不对,可以是同一种元素既被氧化、又还原。
一、氧化还原反应
第一课时 氧化还原反应
【学习目标】
1.理解氧化还原反应的特征,学会识别和判断氧化还原反应。 2.从微观角度理解氧化还原的本质,建立氧化还原反应的认知模型。 (重难点)
一些常见元素化合价口诀 正一氢氨钾钠银,正二钙钡和镁锌。 三铝四硅五价磷,二三铁,二四碳。 二四六硫都齐全,铜汞二价最常见
3.从电子转移的角度认识氧化还原反应 ①对于金属与非金属的反应:2Na Cl2
+
2NaCl
+11 2 8 1
Na
Cl
7 8 2 +17
-e-
钠离子带正电荷
氯离子带负电荷
+ e-
+11 2 8 Na+
Na+ Cl-
8 8 2 +17
Cl化合价升降的原因——电子得失
② 对于非金属与非金属的反应
化合价升降原因: 共用电子对的偏移
Cl2+H2O=HCl+HClO
小结:
失电子 化合价升高
被氧化
得电子 化合价降低
被还原
(本质判据) (特征判据)
氧化反应 还原反应
规律:升、失、氧;降、得、还
问题1 氧化还原反应是否一定要有氧的参与?
Fe+CuSO4
Cu+FeSO4
氧化还原反应的特征现象:
问题2 问题3
反应前后元素化合价发生变化。 ——判断依据
有单质参加或生成的化学反应一定是氧化还原反应吗?
3O2
2O3
在氧化还原反应中一种元素被氧化,则一定有另一种元素被还 原,这句话对吗?
ቤተ መጻሕፍቲ ባይዱ
不对,可以是同一种元素既被氧化、又还原。
一、氧化还原反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2 + Cl2 ==2 H Cl
电子对偏向,化合价降低,发生还原反应
化合价升降的原因:电子的偏移
氧化还原反应的本质:有电子转移(得失或偏移)
的反应都是氧化还原反应。
氧化还原反应
17
【学习指导四】:请同学们认真默看课本37页最后 一自然段。
注意: (1)、找出氧化剂、还原剂的概念。 (2)、2分钟后比谁最先能说出下列问题: 氧化剂:在反应时所含元素的化合价 ,
氧化还原反应
13
检测:标出下列反应中各元素化合价。 并判断是否是氧化还原反应。
怎样判断??
0 +2+6 -2 +2 +6 -2 0
Fe + CuSO4 = FeSO4 + Cu 是
0
+1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2↑
是
+1 -2 +1 +1 -1 +1 -1 +1 -2
• 化合反应?
氧化反应?
• 由此可见,对化学反应可以从不同的角度进行分类,其目的在于 了解各类反应的本质。
氧化还原反应
3
化学反应的分类方法
• 方法1: • 化合、置换、分解、复分解反应 • 【思考】按照上面讲的分类方法,下面的反应属于什么反应类型?
• (此反应不包含在四种基本反应类型中。)
•
氧化还原反应
3. 电子转移是氧化还原反应的本质
失电子(偏离) 化合价升高
被氧化 还原剂
得电子(偏向) 化合价降低
被还原 氧化剂
(本质)
( 特征)
(变化) (反应物)
氧化还原反应
: 电子的物质,反应物本身被 。 还原剂:在反应时所含元素的化合价 , : 电子的物质,反应物本身被 。
氧化还原反应
18
讨论:先标出下列反应中各元素的化合价,再分析哪种
元素被氧化,哪种元素被还原,并指出氧化剂和还原剂。
化合价升高,被氧化
0
2Na
+
0
Cl2
+1 -1
= 2NaCl
(还原剂) (氧化剂)
4
分类方法2.氧化反应和还原反应
• 分类依据:根据反应中物质是否得到氧或失去氧,把化学反应分 为氧化反应和还原反应
氧化还原反应
5
电动车充电放
钢铁会生锈?
电是什么原理?
氧化还原反应
6
?
长时间放置食物会腐烂? 我们每天用“84”消毒液进行消毒
都因为发生氧了化还原反氧应 化还原反应。 7
第三节 氧化还原反应
升
化合价升高
降
化合价降低
化合价降低, 被还原
失
失去电子
得
得到电子
氧
发生氧化反应(被氧化)
还
发氧生化还还原反原应反应(被还原)
注意记 忆口诀
还
叫还原剂
氧
叫氧化剂
19
应用口诀练一练! 精彩会无限。
升失氧还,降得还氧
分析下列反应哪种元素被氧化,哪 种元素被还原,并指出氧化剂和还原剂。
1、Fe + CuSO4 = FeSO4 + Cu 2、Zn + 2HCl = ZnCl2 + H2↑
2Na+Cl2 == 2Na Cl
Na+
[ Cl ]-
化合价降低,得电子, 发生还原反应,也叫被还原
Na+ Cl -
化合价升降的原因: 电子的得失
氧化还原反应
16
3.从电子的得失或偏移观点认识(本质)
从电子偏移角度分析: HCl的形成过程
电子对偏离,化合价升高,发生氧化反应
H
Cl
H Cl
0
0
+1-1
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应
1
熊熊燃烧的祥云火炬、飞腾的神州系列火
箭无时不刻都在发生着化学反应。是什么 反应呢?氧化反应?
【思考】 (上述 反应过程中很多同 学会想到有氧的参 与),那么,氧化 反应是否一定要有 氧的参与呢?
氧化还原反应
2
点燃
C+O2= CO2
• 这个反应属于什么反应类型呢?
答案:
1、 氧化剂: CuSO4 ,Cu元素被还原; 还原剂:Fe, Fe元素被氧化。
2、氧化剂: HC1 ,氢元素被还原; 还原剂: Zn , Zn元素被氧化。
氧化还原反应
20
学会比较,学会总结
1. 得氧和失氧的反应只是氧化还原反应中的一部份。
2. 化合价发生改变是所有氧化还原反应的共同特征和判断 依据
高温
2CuO + C == 2Cu + CO2
对CuO失氧,被还原, 发生还原反应
同时 发生
思考:这个反应到底是氧化反 应还是还原反应?
氧化还原反应
10
【学习指导二】:
请同学们认真标出课本35页中间3个氧化还原反应中 各种元素的化合价,并默读最后一自然段。
注意找出:
(1)元素化合价升高发生的 是 反应,元素化合价降低 发生的是 反应 (填“氧化”或“还原”)
氧化还原反应
8
【学习指导一】:
请同学们认真默看课本35页第一自然段 注意:
(1)、划出重点语句。 (2)、说出CuO与C的反应中发生氧化反应、还原 反应的物质。
氧化还原反应
9
一、氧化还原反应:
1、从得氧失氧角度分析:
对C:得氧,被氧化, 发生氧化反应
我们从得氧失氧 的角度判断:凡 是有得氧失氧的 反应属于氧化还 原反应。
资料卡片: 1、单质的化合价为零 2、常见元素的化合价:
H +1;O -2;C +2、+4 Fe +2、+3;Cu +2. Zn +2; Ca +2; Na +1.
氧化还原反应
11
2、从元素化合价变化角度分析:
化合价升高,发生了氧化反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
化合价降低,发生了还原反应
NaOH + HCl = NaCl + H2O
不是
氧化还原反应
14
为什么在氧化还原反应中元素的 化合价会发生变化?
【学习指导三】:请同学们认真默看课本36页最后两自 然段至37页第一自然段。
注意: (1)、比较元素化合价的变化、电子得失与氧化还原反 应的关系。 (2)、比比谁最先能分清化合价升高时, 电
凡是有元素 化合价升降 的反应叫氧 化还原反应
氧化还原反应
12
1、氧化反应:元素化合价升高的反应 2、还原反应:元素化合价降低的反应
• 3、氧化还原反应:凡是有元素化合价升降的化学反 应
• 4、氧化还原反应的特征和判断依据:有元素的化合 价变化。
失去电子总数=化合价升高总数=得到电子总数=化合 价降低总数
子(填“得”或“失”),发生了 反应(填“氧化”或“还原”)。 反之呢?【以Na与CI2反应生成NaCI为例】
氧化还原反应
15
3.从电子的得失或偏移观点认识(本质) 从电子得失角度分析: NaCl的形成过程
Na 失去e-
Cl
化合价升高,失电子,发生氧化反应,也叫被氧化
失去e-后
得到e-后
00
+1 -1
