人教版高一氧化还原反应课件
合集下载
人教版高一化学课件-氧化还原反应(共18张PPT)

一、氧化還原反應
化合價變化本質原因的分析:以NaCl為例
Na
+11
Na+
+11
+17
Cl
化合價升高,失去電子
2Na + Cl2 == 2NaCl
化合價降低,得到電子
+17
Cl-
Na+ Cl-
化合價的升降——電子的得失
一、氧化還原反應
化以合HC價l為變例化本質原因的分析:H0 2
+
0
Cl2
=
+1-1
非氧化還原反應
置換反應
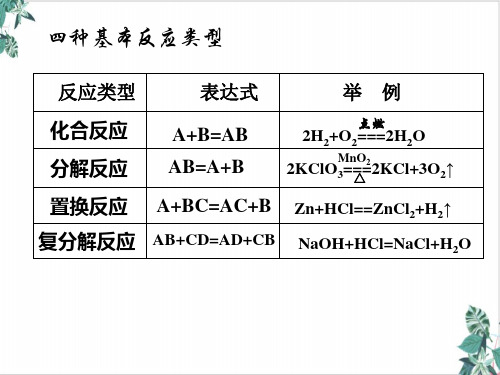
化合反應化學反應分解反應 氧化還原反應
複分解反應
一、氧化還原反應
分層訓練1:必做題
1、下列反應屬於氧化還原反應的是( BC )
A. CuO+2HCl=CuCl2+H2O B. 2Na2O2+2H2O=4NaOH+O2↑ C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3↓ + H2O
化合
CaO + H2O === Ca(OH) 2 反應
高溫
CaCO3===CaO+CO2 ↑
分解反應
2KClO3==△=2KCl+3O2 ↑
Fe+CuSO4 == Cu+FeSO4 置換反應
NaOH+HCl==NaCl+H2O 複分解反應
一、氧化還原反應
結論3:氧化還原反應與四種基本反應類型 的關係
屬於哪種基本反應類型?
讓我 想一想?
一、氧化還原反應
思考與交流1:
1.請舉幾個氧化反應和還原反應的實例,指 出這類化學反應的分類標準是什麼?
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
高中化学人教版必修一第二章第三节《氧化还原反应》ppt课件 (共50张PPT)

•上述反应中,哪些反应属于氧化 还原反应? •基本反应类型与氧化还原反应有 什么关系?
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
人教版高中化学必修一《氧化还原反应》物质及其变化PPT精品课件

有关氧化还原反应问题的思考与交流(2个),有关氧化还原反应与几种 反应类型的关系“学与问”问题的解答。
学 科
规律方法指导
核
心
素 养
信息提取
已知四个氧化还原反应化学方程式,要求判断其中氧 化剂、还原剂属于不同物质的选项。
思路建立
元素化合价变化→氧化剂、还原剂。
第四部分
课堂达标验收
课 堂
选择正确答案
研
标价态
习
明确变价元素的化合价升降关系。
连单线
始于氧化剂中的降价元素 一条线
止于还原产物中的相应元素
标得失 标出转移电子的总数。
课 堂
电子转移表示方法
探
双线桥法
究
正确标出反应前后各元素的化合价。
研
标价态
习
明确变价元素的化合价升降关系。
连双线
一条线 一条线
始于氧化剂中的降价元素 止于还原产物中的相应元素 始于还原剂中的升价元素 止于氧化产物中的相应元素
移)的反应
课 堂
基本概念和关系
探
失去电子,化合价升高,被氧化
究 研
发生
生成
化合价升高的物质
氧化反应
氧化产物
习 反 应 物
得 失 电 子 相
等
同 时 发 生
同 时 生 成
生 成 物
发生
生成
化合价降低的物质
还原反应
还原产物
得到电子,化合价降低,被还原
课 堂
电子转移表示方法
探
单线桥法
究
正确标出反应前后各元素的化合价。
课 前
认识氧化还原反应
新
知
3.从电子转移的角度——有电子得失的反应
学 科
规律方法指导
核
心
素 养
信息提取
已知四个氧化还原反应化学方程式,要求判断其中氧 化剂、还原剂属于不同物质的选项。
思路建立
元素化合价变化→氧化剂、还原剂。
第四部分
课堂达标验收
课 堂
选择正确答案
研
标价态
习
明确变价元素的化合价升降关系。
连单线
始于氧化剂中的降价元素 一条线
止于还原产物中的相应元素
标得失 标出转移电子的总数。
课 堂
电子转移表示方法
探
双线桥法
究
正确标出反应前后各元素的化合价。
研
标价态
习
明确变价元素的化合价升降关系。
连双线
一条线 一条线
始于氧化剂中的降价元素 止于还原产物中的相应元素 始于还原剂中的升价元素 止于氧化产物中的相应元素
移)的反应
课 堂
基本概念和关系
探
失去电子,化合价升高,被氧化
究 研
发生
生成
化合价升高的物质
氧化反应
氧化产物
习 反 应 物
得 失 电 子 相
等
同 时 发 生
同 时 生 成
生 成 物
发生
生成
化合价降低的物质
还原反应
还原产物
得到电子,化合价降低,被还原
课 堂
电子转移表示方法
探
单线桥法
究
正确标出反应前后各元素的化合价。
课 前
认识氧化还原反应
新
知
3.从电子转移的角度——有电子得失的反应
人教版高一化学课件-氧化还原反应(共16张PPT)

二、氧化劑和還原劑
〖遷移·應用〗
常見的氧化劑和還原劑有哪些?
常見氧化劑:O2 、Cl2、濃硫酸、 HNO3、 KMnO4、FeCl3等
常見還原劑:Na、Mg、Al、Zn、Fe、H2、 C、CO等
二、氧化劑和還原劑
〖 思考油漆,這樣做的目的是 什麼? 2、一些容易變質食品常採用真空包裝或往包裝 袋中裝入一小包鐵粉,這樣做的目的又是為啥?
B. NaCl → NaNO3 D. CuO → CuSO4
2、下列反應中,SO2作還原劑的是( C )
A.2H2S+SO2=3S↓+2H2O B.SO2+2Mg=2MgO+S C.Cl2+SO2+2H2O=H2SO4+2HCl D.SO2+2NaOH=Na2SO3+H2O
二、氧化劑和還原劑
【分層訓練】選做題 3、在K2Cr2O7 + 14 HCl == 2KCl + 2CrCl3
+ 3Cl2↑ + 7H2O反應中, C元r 素得電子, 化合價 降低 , K2Cr2O7是氧化劑; Cl元素失電子,化合價升高, HCl 是還原
劑; HCl 被氧化,K2Cr2O7被還原。
二、氧化劑和還原劑
氧化還原反應對立統 〖概括·整合〗 一關係的兩根推斷線
實質 元素(判斷依據) 反應過程 反應物 反應物性質 失e- → 化合價升高 → 氧化反應 → 還原劑 → 還原性 得e- → 化合價降低 → 還原反應 → 氧化劑 → 氧化性
非氧化還原反應
Cl2 + H2O== HCl + HClO 既是氧化劑又是還原劑
二、氧化劑和還原劑
〖交流·探究〗 從電子轉移的觀點說明氧化 劑、還原劑的實質是什麼?
【新人教版】高一化学必修第一册 第一章 第三节 氧化还原反应 (共45张PPT)

失去氧,化合价降低,被还原,发生还原反应
+1
0
H2O + C
高温
0
H2
+
+2
CO
得到氧,化合价升高,被氧化,发生氧化反应
失去氧,化合价降低,被还原,发生还原反应
+2
0
CuO + H2
高温
0
Cu
+1
+ H2O
得到氧,化合价升高,被氧化,发生氧化反应
结论:反应前后有元素化合价升降的反应是氧化还原反应。
从元素化合价的升降观点认识(特征) 氧化反应、还原反应和氧化还原反应
反应类型 氧化反应
化合价变化 所含元素化合价升高的反应
还原反应 所含元素化合价降低的反应 氧化还原 凡有元素化合价升降的反应(特征)
反应
氧化还原反应的判断
特征:反应前后有元素化合价的变化(判断依据) 下列反应是氧化还原反应的是
-1
-2 0
(1) 2H2O2 === 2H2O + O2
+4
+5 +2
第三节 氧化还原反应
学习目标: 1、掌握氧化还原反应的概念。 2、能从电子转移角度分析氧化还原反应。 3、掌握氧化还原反应与四种基本反应类型的关系。
从不同角度认识氧化还原反应
1.从得失氧的角度
还原
还原
结论:
氧化
氧化
一种物质被氧化,另一种物质被还原的反应叫氧化还原反应。
2.从元素化合价升降的角度
即氧化还原反应可能是有共用电子对对偏移)的化学反应叫
氧化还原反应。
3.从电子转移(得失或偏移)观点认识(本质) 氧化反应、还原反应和氧化还原反应
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT
还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
氧化还原反应ppt课件
有单质参加或生成的反应不一定是氧化还原反应。
②有单质参加的化合反应一定是氧化还原反应。 √
③有单质生成的分解反应一定是氧化还原反应。
√
知能通练
3.实验室常利用下列反应制取少量N2: NaNO2+NH4Cl === NaCl+N2↑+2H2O。下列关于该反应的说
法不正确的是( B ) A.该反应是氧化还原反应 B.NaNO2发生氧化反应,NH4Cl发生还原反应 C.被还原的物质是NaNO2,被氧化的物质是NH4Cl D.被氧化和被还原的元素是同一种元素
知能通练
4. ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4 === 2ClO2↑+K2SO4+2CO2↑+2H2O。下
列关于此反应的说法正确的是( A ) A.KClO3中部分元素的化合价降低,得到电子 B.H2SO4中部分元素的化合价降低 C.H2C2O4发生还原反应 D.H2C2O4既发生氧化反应又发生还原反应
否
Fe+2HCl === FeCl2 + H2↑
置换反应
是
Fe+CuSO4 === FeSO4 + Cu
置换反应
是
知识梳理 4.氧化还原反应与四大反应类型的关系
置换
复分解
知能通练 3.判断下列说法是否正确:
①有单质参加或生成的反应一定是氧化还原反应。 ×
放电
同素形体之间的转化不是氧化还原反应
3O2 === 2O3
知能通练
5. 下列反应既是置换反应又是氧化还原反应的是( A ) A.2F2+2H2O===4HF+O2 B.Cl2+H2O⥫⥬HCl+HClO C.3NO2+H2O===2HNO3+NO D.2Na2O2+2H2O===4NaOH +O2↑
人教版高一化学必修一2.3氧化还原反应课件(共28张PPT)
知识层面
2
具备自主预 习,发现、 分析问题能
力。
能力层面
3
运用已有知识 提升对新知识 的学习兴趣。
情感层面
四 教法学法分析
探究学习 做学一体
整个教学过程 中“教师为辅” 与学生共同获 取知识解决问 题,让学生 “学会”。
以学生为主,自 主学习、合作学 习、探究学习, 体验科学探究的 历程,让学生 “会学”。
谢谢指导!
氧化还原 概念的建构
氧化还原 与其他概念 关系建构
氧化还原概念 历史和发展
氧化还原概念 的功能价值
谜语引入 概念间关系 图的绘制
第一阶段
第二阶段
氧化还原 化学史介绍
生产生活中 氧化还原反 应的举例
第三阶段
第四阶段
教学过程的设计
五、教学过程
本质
电子 转移
• 问题引导:微粒本身变化过程中发生 建构
新课标人教版高中化学必修1说课
第二章 化学物质及其变化
第三节 氧化还原反应 第一课时
课标要求
• 课标要求:了解氧化还原的本质是电子的转移, 了解氧化还原在生产和生活中的应用。
• 课标解读: • 1、由表及里揭示氧化还原反应的概念。 • 2、关注生产与生活与化学的关系。
说课主要流程
教材分析 目标分析 学情分析
【设计意图】
2Na + Cl2======= 2NaCl
• 钠与氯气反应的动画演示
H2 + Cl2 ==== 2HCl
五、教学过程
特征
化合价变化
本质
发生电子转移
概念
有化合价变化的化学发应
氧化反应,还原反应
2Na+Cl2 ═ 2 NaCl
2
具备自主预 习,发现、 分析问题能
力。
能力层面
3
运用已有知识 提升对新知识 的学习兴趣。
情感层面
四 教法学法分析
探究学习 做学一体
整个教学过程 中“教师为辅” 与学生共同获 取知识解决问 题,让学生 “学会”。
以学生为主,自 主学习、合作学 习、探究学习, 体验科学探究的 历程,让学生 “会学”。
谢谢指导!
氧化还原 概念的建构
氧化还原 与其他概念 关系建构
氧化还原概念 历史和发展
氧化还原概念 的功能价值
谜语引入 概念间关系 图的绘制
第一阶段
第二阶段
氧化还原 化学史介绍
生产生活中 氧化还原反 应的举例
第三阶段
第四阶段
教学过程的设计
五、教学过程
本质
电子 转移
• 问题引导:微粒本身变化过程中发生 建构
新课标人教版高中化学必修1说课
第二章 化学物质及其变化
第三节 氧化还原反应 第一课时
课标要求
• 课标要求:了解氧化还原的本质是电子的转移, 了解氧化还原在生产和生活中的应用。
• 课标解读: • 1、由表及里揭示氧化还原反应的概念。 • 2、关注生产与生活与化学的关系。
说课主要流程
教材分析 目标分析 学情分析
【设计意图】
2Na + Cl2======= 2NaCl
• 钠与氯气反应的动画演示
H2 + Cl2 ==== 2HCl
五、教学过程
特征
化合价变化
本质
发生电子转移
概念
有化合价变化的化学发应
氧化反应,还原反应
2Na+Cl2 ═ 2 NaCl
高中化学人教版必修一课件:2.3氧化还原反应 (共36张PPT)
四、几种特殊的氧化还原反应
(一)部分氧化还原反应
2KMnO4 + 16HCl == 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(二)歧化反应
Cl2 + H2O = HCl + HClO
(三)归中反应:
H2SO4(浓) + H2S = SO2↑+ S↓+ 2H2O
目录
(一) 部分氧化还原反应 在氧化还原反应中,如果还原剂只有部分被
__2_:_1 __
(三)归中反应 不同价态的同一元素化合价可升高或降低至某
一中间价态。 同种元素不同价态之间发生氧化还原 反应遵循以下归中规律:
高价+低价→相同中间价(注“可靠拢、不交叉”)
例题 2H2S+SO2=3S+2H2O
氧化产物与还原产物的物质的量之比:__2_:1___
练习:C + CO2 = 2CO n(氧化产物):n(还原产物)=__1_:_1____
2、氧化还原的实质是( ) A、有氧化剂和还原剂 B、有氧原子得失的反应 C、有元素化合价升降的反应 D、有电子得失的反应
3、下列说法下说法正确的是(
)
A、氧化剂本身被子还原,生成氧化产物
B、氧化剂是在反应中得到电子(或电子对偏向)的物质
得电子,化合价降低,被还原
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(氧化性) (还原性 )
失电子,化合价升高,被氧化
2、口诀: “失, 升, 氧 , 得, 降, 还, 若 是 剂, 两 相 反 ”
3、Βιβλιοθήκη 氧化剂被还原还原产物
反 (氧化性) 得电子(化合价降低)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
还原性: S2->S>SO3
氧化性、还原性强弱比较方法之三:
从元素化合价高低来判断:一般地说,同一种变价
元素的几种物质,它们的氧化能力是由高价态到低
价态逐渐减弱,还原能力则依次逐渐增强。
★特殊性:氧化、还原能力还与物质的稳定 性、温度、浓度、酸碱性等有关。 如:氧化性HClO > HClO4; H2SO3 > H2SO4(稀)
22:13:14
结束
练习 2.0.3molCu2S与足量的硝酸反应,生成硝酸铜、 巩固 硫酸、一氧化氮和水,则参加反应的硝酸中
被还原的硝酸的物质的量为( B)
A.0.9mol B.1mol C.1.2mol D.2.2mol
根据得失电子守恒,失电子总数 巧解 =0.3×(2+8)=3 mol,故硝酸被
1.得失电子守恒 2.强氧化剂 + 强还原剂 =
弱还原剂 + 弱氧化剂 3.反应顺序:先强后弱 4.同一元素不同价态反应, 化合价变化规律:
“只靠拢,不交叉”
22:13:14
1. 金属性、非金属性强弱 2.根据反应规律(2) 3.同种元素主要看化合价 高低 4.其它
结束
综合 应用
1.判断下列反应能否发生?若能发 生,如何设计简易实验检验反应产 物?同时写出离子反应方程式,并 比较氧化性强弱。
0
5. NaH + NH3 = NaNH2 + H2↑
还原剂 氧化剂
氧化产物
还原产物
以5为例判断氧化剂、还原剂、氧化 产物、还原产物。
22:13:14
规结律束
一、基本概念
反应实质:有电子得失或电子对的偏移。 表现特征:元素化合价有升降。
氧化剂 发生还原反应(被还原) 还原产物
反 (具有氧化性) 得电子(化合价降低) (具有还原性) 生
22:13:14
结束
综合 2.根据上述实验,试写出少量氯
应用
水和足量氯水分别与FeBr2溶液反 应的离子方程式。
☆☆2FKeI3+溶+液2I滴- 入= 2FFeeC2l+3溶+ I液2 中 ☆☆2FBer2+2+水B滴r2入= F2eFSeO3+4溶+ 液2B中r☆☆MnKOM4-n+O45溶Fe液2++和8HF+eS=O45溶Fe液3+ 混+ M合n2+ + 4H2O
氧氧化化性性::Br2 > Fe3+
MnMOn4O->4- M>nFOe23>+ >ClI22 > Br2 > Fe3+ > 应一般规律之二:
反应发生条件 — 氧化性强的物质可以 氧化还原性强的物质;还原性强的物 质可以还原氧化性强的物质。
日常生活中常用到铁皮,为了防止被
腐蚀,常常镀上一层锌(白铁皮)或镀 上一层锡(马口铁)。一旦镀层有破损 以后,哪种铁皮先被腐蚀?理由?
金属被腐蚀→被氧化→失电子能力→ 还原性,白铁皮中锌还原性强,先被氧化, 铁皮依然得到了保护;而马口铁中,铁较 锡还原性强,更易被腐蚀。
应 物
还原剂
发生氧化反应(被氧化)
氧化产物
成 物
(具有还原性) 失电子(化合价升高) (具有氧化性)
22:13:14
结束
铁粉实或验小室铁在钉配,置试F用eS离O4子溶反液应时方总程是式放表入示一其些 中的原理。
FFee ++2 Fe33++ = 23Fe22++ ?
氧化还原反应一般规律之一: 电子得失守恒 — 化合价有升必有降,化 合价升高总数等于化合价降低总数;电 子有得必有失,失电子总数必等于得电 子总数。
KMnO4氧化性:酸性 > 中性 > 碱性
22:13:14
结束
想一想 是否还有其它的方法可用来比 较氧化性、还原性强弱?试举 例说明。
电极反应(原电池、电解池)
氯气、硫分别与铁反应 反应产物
钠、镁、铝分别与水反应 反应条件
22:13:14
结束
课堂小结 氧化还原反应
反应实质 表现特征 一般规律 强弱比较
主菜单
教学目标 强弱判断 基本概念 课堂小结 反应规律 综合应用
22:13:14
结束
氧化还原反应知识目标
通过复习达到以下目的:
掌握氧化还原反应的实质,氧 化还原反应中氧化剂、还原剂的 判断。
掌握氧化还原反应的一般规律, 重点掌握氧化性、还原性的强弱 比较。
22:13:14
结束
置换反应
电极反应
化合反应
氧化还 原反应
分解反应
有机反应
生物作用
返回
一.基本概念
判断下列哪些反应是氧化还原反应?理由?
1. 2.
Na2O + H2O 2Fe + Al2O3
△= 2NaOH = 2Al + Fe2O3
3. 4.
CIBHr4++H2COl2=→光HBCr H+3CHlIO+
HCl
+1-1 -3+1
+1-3+1
放电(得电子)能力增强 与金属活动性顺序相反
22:13:14
方法结2束
金属单 质的还 原性随 金属性 增强而 增强, 其离子 的氧化 性相应 减弱
22:13:14
非金属 单质的 氧化性 随非金 属性增 强而增 强,其 离子的 还原性 相应减 弱
结束
已知:5PbO2+4H++2Mn2+=5Pb2++2MnO4-+2H2O 根据方程式判断氧化性强弱。
氧化性:PbO2 > MnO4 对于任何氧化还原反应,都满足下列规律:
强氧化剂 + 强还原剂 = 弱还原剂 + 弱氧化剂
A
B
b
a
氧化性:A >a 还原性:B > b
22:13:14
结束
判断氧化性强弱: Fe3+与Fe2+ KMnO4与MnO2;
还原性强弱:S2-、S与SO3
氧化性: Fe3+>Fe2+ KMnO4>MnO2 ;
还原成NO共 1 mol。
继续 未被还原的硝酸的物质的量呢?
分析:未被还原的硝酸以Cu(NO3)2形 式存在,共有0.6molCu,故未被还原
的硝酸有0.6×2=1.2mol
22:13:14
结束
氧化性、还原性强弱比较
根据金属性、非金属性强弱来判断
【应用】电解池反应中阴极的放电顺序 如何排列?
K+、 … Al3+(H+) …Zn2+ …H+、Cu2+
22:13:14
结束
氧化还原反应一般规律之三: 反应发生的先后顺序—一般地,氧化剂 总是先氧化还原性强的还原剂;还原剂 总是先还原氧化性强的氧化剂。
能否用浓硫酸干燥H2S气体?理由?
SO2气体呢? 从化合价角度考虑
氧化还原反应一般规律之四: 不同物质中,同一元素的不同价态发生 变化时,该元素的化合价变化规律是: “只靠拢,不交叉”。
氧化性、还原性强弱比较方法之三:
从元素化合价高低来判断:一般地说,同一种变价
元素的几种物质,它们的氧化能力是由高价态到低
价态逐渐减弱,还原能力则依次逐渐增强。
★特殊性:氧化、还原能力还与物质的稳定 性、温度、浓度、酸碱性等有关。 如:氧化性HClO > HClO4; H2SO3 > H2SO4(稀)
22:13:14
结束
练习 2.0.3molCu2S与足量的硝酸反应,生成硝酸铜、 巩固 硫酸、一氧化氮和水,则参加反应的硝酸中
被还原的硝酸的物质的量为( B)
A.0.9mol B.1mol C.1.2mol D.2.2mol
根据得失电子守恒,失电子总数 巧解 =0.3×(2+8)=3 mol,故硝酸被
1.得失电子守恒 2.强氧化剂 + 强还原剂 =
弱还原剂 + 弱氧化剂 3.反应顺序:先强后弱 4.同一元素不同价态反应, 化合价变化规律:
“只靠拢,不交叉”
22:13:14
1. 金属性、非金属性强弱 2.根据反应规律(2) 3.同种元素主要看化合价 高低 4.其它
结束
综合 应用
1.判断下列反应能否发生?若能发 生,如何设计简易实验检验反应产 物?同时写出离子反应方程式,并 比较氧化性强弱。
0
5. NaH + NH3 = NaNH2 + H2↑
还原剂 氧化剂
氧化产物
还原产物
以5为例判断氧化剂、还原剂、氧化 产物、还原产物。
22:13:14
规结律束
一、基本概念
反应实质:有电子得失或电子对的偏移。 表现特征:元素化合价有升降。
氧化剂 发生还原反应(被还原) 还原产物
反 (具有氧化性) 得电子(化合价降低) (具有还原性) 生
22:13:14
结束
综合 2.根据上述实验,试写出少量氯
应用
水和足量氯水分别与FeBr2溶液反 应的离子方程式。
☆☆2FKeI3+溶+液2I滴- 入= 2FFeeC2l+3溶+ I液2 中 ☆☆2FBer2+2+水B滴r2入= F2eFSeO3+4溶+ 液2B中r☆☆MnKOM4-n+O45溶Fe液2++和8HF+eS=O45溶Fe液3+ 混+ M合n2+ + 4H2O
氧氧化化性性::Br2 > Fe3+
MnMOn4O->4- M>nFOe23>+ >ClI22 > Br2 > Fe3+ > 应一般规律之二:
反应发生条件 — 氧化性强的物质可以 氧化还原性强的物质;还原性强的物 质可以还原氧化性强的物质。
日常生活中常用到铁皮,为了防止被
腐蚀,常常镀上一层锌(白铁皮)或镀 上一层锡(马口铁)。一旦镀层有破损 以后,哪种铁皮先被腐蚀?理由?
金属被腐蚀→被氧化→失电子能力→ 还原性,白铁皮中锌还原性强,先被氧化, 铁皮依然得到了保护;而马口铁中,铁较 锡还原性强,更易被腐蚀。
应 物
还原剂
发生氧化反应(被氧化)
氧化产物
成 物
(具有还原性) 失电子(化合价升高) (具有氧化性)
22:13:14
结束
铁粉实或验小室铁在钉配,置试F用eS离O4子溶反液应时方总程是式放表入示一其些 中的原理。
FFee ++2 Fe33++ = 23Fe22++ ?
氧化还原反应一般规律之一: 电子得失守恒 — 化合价有升必有降,化 合价升高总数等于化合价降低总数;电 子有得必有失,失电子总数必等于得电 子总数。
KMnO4氧化性:酸性 > 中性 > 碱性
22:13:14
结束
想一想 是否还有其它的方法可用来比 较氧化性、还原性强弱?试举 例说明。
电极反应(原电池、电解池)
氯气、硫分别与铁反应 反应产物
钠、镁、铝分别与水反应 反应条件
22:13:14
结束
课堂小结 氧化还原反应
反应实质 表现特征 一般规律 强弱比较
主菜单
教学目标 强弱判断 基本概念 课堂小结 反应规律 综合应用
22:13:14
结束
氧化还原反应知识目标
通过复习达到以下目的:
掌握氧化还原反应的实质,氧 化还原反应中氧化剂、还原剂的 判断。
掌握氧化还原反应的一般规律, 重点掌握氧化性、还原性的强弱 比较。
22:13:14
结束
置换反应
电极反应
化合反应
氧化还 原反应
分解反应
有机反应
生物作用
返回
一.基本概念
判断下列哪些反应是氧化还原反应?理由?
1. 2.
Na2O + H2O 2Fe + Al2O3
△= 2NaOH = 2Al + Fe2O3
3. 4.
CIBHr4++H2COl2=→光HBCr H+3CHlIO+
HCl
+1-1 -3+1
+1-3+1
放电(得电子)能力增强 与金属活动性顺序相反
22:13:14
方法结2束
金属单 质的还 原性随 金属性 增强而 增强, 其离子 的氧化 性相应 减弱
22:13:14
非金属 单质的 氧化性 随非金 属性增 强而增 强,其 离子的 还原性 相应减 弱
结束
已知:5PbO2+4H++2Mn2+=5Pb2++2MnO4-+2H2O 根据方程式判断氧化性强弱。
氧化性:PbO2 > MnO4 对于任何氧化还原反应,都满足下列规律:
强氧化剂 + 强还原剂 = 弱还原剂 + 弱氧化剂
A
B
b
a
氧化性:A >a 还原性:B > b
22:13:14
结束
判断氧化性强弱: Fe3+与Fe2+ KMnO4与MnO2;
还原性强弱:S2-、S与SO3
氧化性: Fe3+>Fe2+ KMnO4>MnO2 ;
还原成NO共 1 mol。
继续 未被还原的硝酸的物质的量呢?
分析:未被还原的硝酸以Cu(NO3)2形 式存在,共有0.6molCu,故未被还原
的硝酸有0.6×2=1.2mol
22:13:14
结束
氧化性、还原性强弱比较
根据金属性、非金属性强弱来判断
【应用】电解池反应中阴极的放电顺序 如何排列?
K+、 … Al3+(H+) …Zn2+ …H+、Cu2+
22:13:14
结束
氧化还原反应一般规律之三: 反应发生的先后顺序—一般地,氧化剂 总是先氧化还原性强的还原剂;还原剂 总是先还原氧化性强的氧化剂。
能否用浓硫酸干燥H2S气体?理由?
SO2气体呢? 从化合价角度考虑
氧化还原反应一般规律之四: 不同物质中,同一元素的不同价态发生 变化时,该元素的化合价变化规律是: “只靠拢,不交叉”。
