人教版高一化学必修一氧化还原反应ppt课件
合集下载
化学人教版(2019)必修第一册1.3氧化还原反应(共30张ppt)

二 氧化还原反应电子转移的表示方法
►双线桥法•表示意义:表示反应前后同一元素原子间电子转移情况。•基本步骤
如 •注意事项1.箭头、箭尾必须对应化合价变化的同种元素的原子。2.必须注明“得”或“失”。3.氧化剂和还原剂得、失电子总数要相等。
►单线桥法•表示意义:表示反应前后不同元素原子间电子转移情况。•基本步骤
关系图解
第一章 物质及其变化
第2课时 氧化剂和还原剂
人教版化学必修第1册
第三节 氧化还原反应
1.学会判断氧化剂、还原剂、氧化产物、还原产物。2.了解氧化还原反应的应用
学习目标
一、氧化剂和还原剂
1、氧化剂和还原剂
+2 0 0 +1
结论
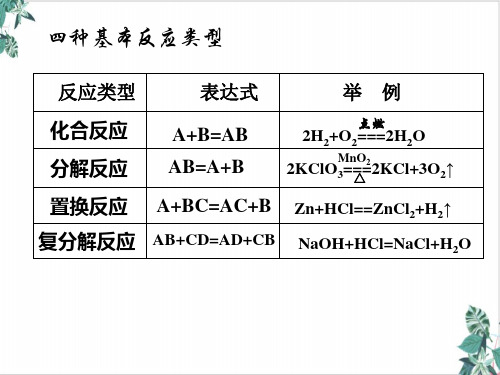
化合反应 A+B═AB
有单质参加的化合反应全部是氧化还原反应
分解反应 AB═A+B
有单质生成的分解反应全部是氧化还原反应
置换反应 A+BC═ AC+B
—
置换反应全部是氧化还原反应
复分解反应 AB+CD═ AD+CB
—
复分解反应都不是氧化还原反应
【说明】 四种基本类型反应不包含所有的化学反应,如+2NaOH═不属于四种基本类型反应中的任何一种,但它有元素化合价的升降,属于氧化还原反应。
CuO → Cu H2 →H2O
氧化反应和还原反应相互依存而统一于同一个氧化还原反应中。
氧化还原反应中元素的化合价为什么会发生变化?其本质原因是什么
?
氧化还原反应的实质:
电子的转移
电子的转移
元素化合价变化
一 氧化还原反应中概念间的关系
概念间的关系图 记忆口诀:氧→得→降→还→还还→失→升→氧→氧即:氧化剂→得到电子→所含元素化合价降低→被还原→发生还原反应。还原剂→失去电子→所含元素化合价升高→被氧化→发生氧化反应。
人教版化学必修1氧化还原反应(51页ppt)

化
氧 化 性
具有
氧 化
表现
剂
合 价 降 低
得 到 电 子
还
还
还
被 还
原 反
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
化
还 原 性
具有
还 原
表现
剂
合 价 升 高
失 去 电 子
被 氧 化
氧 化 生成 反 应
氧 化 产
(六)外界条件对某些物质氧化性或还原性强弱的影响
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
具有
氧 化 大基本反应类型与氧化还原反应间的关系
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
非金属 单质的 氧化性 随非金 属性增 强而增 强,其 离子的 还原性 相应减 弱
(四)根据元素化合价高低来判断氧化性强弱
一般地说,同种变价元素的几种物质,它们的氧化能力是由高 价态到低价态逐渐减弱,还原能力则依次逐渐增强。
判断氧化性强弱: Fe3+与Fe2+; 氧化性: Fe3+>Fe2+
人教版高中化学必修一《氧化还原反应》物质及其变化PPT课件

特征
本质
化合价的升价
电子的转移
宏观
微观
一、氧化还原反应
例、指出下列氧化还原反应中哪种元素被氧化、被还原?
(1) 2KClO3 = 2KCl + 3O2↑ (2) Cl2 + 2NaOH = NaCl + NaClO + H2O (3) 5NH4NO3 = 4N2 + 2HNO3 + 9H2O (4) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (注意:FeS2中硫元素呈−1价) (5) MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O (6) 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
氧化还 原反应
氧化反应
同时
还原反应
失电子或共用电子对偏离
同时
得失电子 总数相等
得电子或共用电子对偏向
一、氧化还原反应
3、从电子转移的角度认识氧化还原反应
化合价降低,得电子,被还原
0 H2
+
+2 CuO
=∆=
+1 H2O
+
0 Cu
化合价升高,失电子,被氧化
一、氧化还原反应
3、从电子转移的角度认识氧化还原反应
得到氧,被氧化
物质 在反 应中
得到氧 被氧化
H2 同 时 CuO 失去氧 被还原
氧化反应
同时
还原反应
一、氧化还原反应
1、从得失氧的角度认识氧化还原反应
H2 + CuO =∆= H2O + Cu 3CO + Fe2O3 =∆= 3CO2 + 2Fe 特点: 元素从化合态转化为游离态 Fe + CuCl2 == FeCl2 + Cu ➢从“得失氧”的角度认识氧化还原反应具有局限性, 是片面的。需要从一个更宽广的视角来认识化学反应。
人教版化学必修一第二章第三节氧化还原反应1优质课件PPT

迹往往是执著者造成的。许多人惊奇地发现,他们之所以达不到自己孜孜以求的目标,是因为他们的主要目标太小、而且太模糊不清,使自己失去动力。如果你的主要 实现就会遥遥无期。因此,真正能激励你奋发向上的是确立一个既宏伟又具体的远大目标。实现目标的道路绝不是坦途。它总是呈现出一条波浪线,有起也有落,但你 你的时间表,框出你放松、调整、恢复元气的时间。即使你现在感觉不错,也要做好调整计划。这才是明智之举。在自己的事业波峰时,要给自己安排休整点。安排出 是离开自己挚爱的工作也要如此。只有这样,在你重新投入工作时才能更富激情。困难对于脑力运动者来说,不过是一场场艰辛的比赛。真正的运动者总是盼望比赛。 很难在生活中找到动力,如果学会了把握困难带来的机遇,你自然会动力陡生。所以,困难不可怕,可怕的是回避困难。大多数人通过别人对自己的印象和看法来看自 尤其正面反馈。但是,仅凭别人的一面之辞,把自己的个人形象建立在别人身上,就会面临严重束缚自己的。因此,只把这些溢美之词当作自己生活中的点缀。人生的 上找寻自己,应该经常自省。有时候我们不做一件事,是因为我们没有把握做好。我们感到自己“状态不佳”或精力不足时,往往会把必须做的事放在一边,或静等灵 些事你知道需要做却又提不起劲,尽管去做,不要怕犯错。给自己一点自嘲式幽默。抱一种打趣的心情来对待自己做不好的事情,一旦做起来了尽管乐在其中。所以, 要尽量放松。在脑电波开始平和你的中枢神经系统时,你可感受到自己的内在动力在不断增加。你很快会知道自己有何收获。自己能做的事,放松可以产生迎接挑战的 社会,面对工作,一切的未来都需要自己去把握。人一定要靠自己。命运如何眷顾,都不会去怜惜一个不努力的人,更不会去同情一个懒惰的人,一切都需要自己去努 一时的享受也只不过是过眼云烟,成功需要自己去努力。当今社会的快速发展,各行各业的疲软,再加上每年几百万毕业生涌向社会,社会生存压力太大,以至于所有 高自己。看着身边一个个同龄人那么优秀,看着朋友圈的老同学个个事业有成、买房买车,我们心急如梵,害怕被这个社会抛弃。所以努力、焦躁、急迫这些名词缠绕 变自己,太想早一日成为自己梦想中的那个自己。收藏各种技能学习资料,塞满了电脑各大硬盘;报名流行的各种付费社群,忙的人仰马翻;于是科比看四点钟的洛杉 早起打卡行动。其实……其实我们不觉得太心急了吗?这是有一次自己疲于奔命,病倒了,在医院打点滴时想到的。我时常恐慌,害怕自己浪费时间,就连在医院打点 浪费。想快点结束,所以乘着护士不在,自己偷偷的拨快了点滴速度。刚开始自己还能勉强受得了,过了差不多十分钟,真心忍不住了,只好叫护士帮我调到合适的速 就在想,平时做事和打点滴何尝不是一样,都是有一个度,你太急躁了、太想赶超,身体是受不了的。身体是革命的本钱,我们还年轻,还有大把的时间够我们改变, 1000前面的那个若是1都不存在了,后面再多的0又有什么用?我是一个急性子,做事风风火火的,所以对于想改变自己,是比任何人都要心急。这次病倒了,个人感觉 通乱忙乎才导致的,病倒换来的努力根本是一钱不值。生病的那几天,我跟自己的大学老师打了一个电话,想让老师帮我解惑一下,自己到底是怎么了。别人也很努力 我了,为啥他们反到身体倍棒而一无所获的自己却病倒了?老师开着电脑,给我分享了两个小故事讲的第一个故事是“保龄球效应”,保龄球投掷对象是10个瓶子,你 是90分,而你如果每次能砸倒10个瓶子,最终得分是240分。故事讲完,老师问我明白啥意思没?我说大概猜到一点,你让我再努力点,对吗?不对!你已经够努力了 你,你现在就是那个每次砸倒9个瓶子的人。你累倒的原因是因为你同时在几个场馆玩,每一个场馆得分都是90分,而有些人,则是只在一个场馆玩,玩多了,他就能 倍,得分却还是远远超过你。老师讲的第二故事是“挖水井”,一个人选择好一处地基,就在那里一直坚持不懈的挖下去,而另一个人则是到处选地基,这边挖几米, 出水来了,而另一个人则是直到累死也没有挖出一滴水。首先,你必须承认努力是必须的,只要你比别人努力了那么一点,你确实能超过一些人。只是人的精力也是有 终得到的结果只会是永远装不满水桶的半桶水。和老师通完电话后,我调整了几天,也对自己手头上的事物做一些大改变。将目前摆在面前的计划一一列出来,挑出最 再以此类推,排完手中所有的计划。对于那些不是很急的,对目前生活和工作不是特别重要的,先果断放弃。我现在最迫切的目标是什么?当然是七月份的转行新媒体 第一位。而新媒体所需学习的技能又有很多,那怎么办呢?先挑自己有点底子的,有点基础的,把巩固持续加强。个人感觉自己写还是有点小基础的
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
高中化学人教版必修一第二章第三节《氧化还原反应》ppt课件 (共50张PPT)

•上述反应中,哪些反应属于氧化 还原反应? •基本反应类型与氧化还原反应有 什么关系?
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
课件《氧化还原反应》优质PPT课件_人教版1

和复分解反应与氧化还原反应的交叉分类
HCl + HClO
是
依据反应物和生成物的类别及反应前后物质种类的多少来分
(10) 2H S + SO 特征:反应前后有元素化合价的升降。
2 2 不涉及氧化还原反应的是( )
氧化还原反应与元素化合价的升降的关系:
3S + 2H2O 是
不涉及氧化还原反应的是( )
CaCO3+2HCl==CaCl2+H2O+CO2↑
化合价降低、还原反应(被还原)
C+u2 O + H02
高温
Cu0+
+1
H2O
化合价升高,氧化反应(被氧化)
从化合价升降的角度
有元素化合价升降的化学反应称为 氧化还原反应。
化合价升高、氧化反应(被氧化)
0
+2
Fe + CuSO4
+2
0
FeSO4 + Cu
化合价降低,还原反应(被还原)
注意:并非只有得氧、失氧的反应才是氧
H2+CuO == Cu+H2O
(8) Na CO + 2HCl 2CuO + C
2Cu + CO2
2 3 氧化反应一定先与还原反应发生
电子的得失
2NaCl +H2O +CO2 ↑
爆竹声中一岁除,春风送暖入屠苏
(9) Cl + H O 氧化还原反应的实质是什么呢?
2 2 本质定义:有电子转移(得失或偏移)的化学反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
1、下列叙述正确的是( )
特征:反应前后有元素化合价的升降。
HCl + HClO
是
依据反应物和生成物的类别及反应前后物质种类的多少来分
(10) 2H S + SO 特征:反应前后有元素化合价的升降。
2 2 不涉及氧化还原反应的是( )
氧化还原反应与元素化合价的升降的关系:
3S + 2H2O 是
不涉及氧化还原反应的是( )
CaCO3+2HCl==CaCl2+H2O+CO2↑
化合价降低、还原反应(被还原)
C+u2 O + H02
高温
Cu0+
+1
H2O
化合价升高,氧化反应(被氧化)
从化合价升降的角度
有元素化合价升降的化学反应称为 氧化还原反应。
化合价升高、氧化反应(被氧化)
0
+2
Fe + CuSO4
+2
0
FeSO4 + Cu
化合价降低,还原反应(被还原)
注意:并非只有得氧、失氧的反应才是氧
H2+CuO == Cu+H2O
(8) Na CO + 2HCl 2CuO + C
2Cu + CO2
2 3 氧化反应一定先与还原反应发生
电子的得失
2NaCl +H2O +CO2 ↑
爆竹声中一岁除,春风送暖入屠苏
(9) Cl + H O 氧化还原反应的实质是什么呢?
2 2 本质定义:有电子转移(得失或偏移)的化学反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
1、下列叙述正确的是( )
特征:反应前后有元素化合价的升降。
【新人教版】高一化学必修第一册 第一章 第三节 氧化还原反应 (共45张PPT)

失去氧,化合价降低,被还原,发生还原反应
+1
0
H2O + C
高温
0
H2
+
+2
CO
得到氧,化合价升高,被氧化,发生氧化反应
失去氧,化合价降低,被还原,发生还原反应
+2
0
CuO + H2
高温
0
Cu
+1
+ H2O
得到氧,化合价升高,被氧化,发生氧化反应
结论:反应前后有元素化合价升降的反应是氧化还原反应。
从元素化合价的升降观点认识(特征) 氧化反应、还原反应和氧化还原反应
反应类型 氧化反应
化合价变化 所含元素化合价升高的反应
还原反应 所含元素化合价降低的反应 氧化还原 凡有元素化合价升降的反应(特征)
反应
氧化还原反应的判断
特征:反应前后有元素化合价的变化(判断依据) 下列反应是氧化还原反应的是
-1
-2 0
(1) 2H2O2 === 2H2O + O2
+4
+5 +2
第三节 氧化还原反应
学习目标: 1、掌握氧化还原反应的概念。 2、能从电子转移角度分析氧化还原反应。 3、掌握氧化还原反应与四种基本反应类型的关系。
从不同角度认识氧化还原反应
1.从得失氧的角度
还原
还原
结论:
氧化
氧化
一种物质被氧化,另一种物质被还原的反应叫氧化还原反应。
2.从元素化合价升降的角度
即氧化还原反应可能是有共用电子对对偏移)的化学反应叫
氧化还原反应。
3.从电子转移(得失或偏移)观点认识(本质) 氧化反应、还原反应和氧化还原反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
18
反应得到氧化产物
反应物所含的元素:化合价降低→得e-→ 发生还原反应 →是氧化剂→表现氧化性→
反应得到还原产物
12
下列反应中,哪些是氧化剂? 哪些是还原剂?
Cu + Cl2 == CuCl2 还原剂 氧化剂
Zn + H2SO4 == ZnSO4 + H2↑ 还原剂 氧化剂
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
普通高中课程标准实验教科书 化学1(必修)
第二章 第三节 氧化还原反应
第一课时 氧化还原反应基本概念
1
旧知回顾
初中阶段,我们知道:
点燃
2Mg + O2 = 2MgO
氧化反应
△ CuO + H2 = Cu + H2O
还原反应
点燃
H2 + Cl2 = 2HCl
得氧、失氧
2
思考与交流
氧化反应和还原反应是独立进行的吗? CuO + H2 =△ Cu + H2O
非氧化还原反应
Cl2 + H2O== HCl + HClO
既是氧化剂又是还原剂 13
〖思考〗
下列几个反应属于基本反应类型中的那一种?
化合价 Cu+Cl2 =△== CuCl2
有变化
化合反应
CaO + H2O === Ca(OH) 2
CaCO3=高=温=CaO+CO2 ↑
△
2KClO3===2KCl+3O2 ↑
2Na + Cl2 == 2NaCl
氧化还原反应:
有元素化合价变化的化学反应 4
〖小结〗
化 氧化还原反应
学
反 应
非氧化还原反应
反应物中元素化合 价升高的反应
氧化反应
还原反应
反应物中元素化合 价降低的反应
化学反应的又一种分类方法
5
氧化还原反应
CuO + H2 =△ Cu + H2O
铜元素的化合价降低,氧化铜发生还原反应 氢元素的化合价升高,氢气发生氧化反应
特征
实质 反应过程
9
〖做一做〗
下列化学反应中,哪些属于氧化还原反应?为什么?
哪些元素的化合价升高了?哪些元素的化合价降低了? 指出含有这些元素的具体物质。
√ Cu + Cl2 点==燃 CuCl2 √ Zn + 2H+ == Zn2+ + H2↑ × CaCO3+ 2H+ == Ca2++H2O+CO2↑ √ Cl2 + H2O== HCl + HClO
+2 +3
↑ ↑↓ ↑↓ ↓
-2 0 +4 +6
硫元素(S):
含有最高价态的元素的物质只具有氧化性;
含有最低价态的元素的物质只具有还原性;
含有中间价态的元素的物质既有氧化性,又有还原性。 16
常见的氧化剂和还原剂: 氧化剂
氧气、氯气、硝酸、浓硫酸、高锰酸钾 ( KMnO4 )、氯化铁( FeCl3 )等
NaOH+HCl==NaCl+H2O
7
氧化还原反应的实质 2Na+Cl2 =点燃= 2Na Cl
失去e-
Na
Cl
失去-后
得到e-后
化合价升降的原因:
Na+ [ Cl ]-
电子的得失
Na+ Cl -
8
氧化还原反应的实质 电子转移 (得失或电子对偏移)
化合价升高 →失e- →发生氧化反应
化合价降低 →得e- →发生 还原反应
CuO失氧变为铜,发生了还原反应; H2得氧变为H2O,发生了氧化反应。
氧化反应和还原反应同时发生的反应 称为氧化还原反应。
3
新知探究
用我们学过的化合价来分析下列各反应:
+2 2CuO
0
+
0 C 0
0 +4
高温
==
2Cu
+
CO2↑
点燃 +2 -2
2Mg + O2 == 2MgO
0
0 点燃 +1 -1
化合价升高 化合价降低
反应
反应
氧化反应
还原反应 6
〖练习〗
指出下列反应哪些属于氧化还原反应?
Cu+Cl2 =△== CuCl2 √
CaO + H2O === Ca(OH) 2
CaCO3=高=温=CaO+CO2 ↑
△
2KClO3===2KCl+3O2 ↑
√
Fe+CuSO4 == Cu+FeSO4 √
还原剂
铁、钠、锌、氢气、碳、CO、亚硫酸钠 (Na2SO3)、SO2 、硫酸亚铁(FeSO4)等
17
〖知识小结〗
⑴氧化还原反应的概念及判断
⑵两条线: 失e- → 化合价升高 → 发生氧化反应 得e- → 化合价降低 → 发生 还原反应
⑶氧化还原反应与四种基本反应类型 的关系
(4)常见氧化剂和还原剂
分解反应
化合价 无变化
Fe+CuSO4 == Cu+FeSO4 置换反应
NaOH+HCl==NaCl+H2O 复分解反应
14
〖小结〗
氧化还原反应与四种基本反应类型的关系
非氧化还原反应
氧化还原反应
化置学换反反应 应
复分解反应
15
交流·探究
元素的化合价与物质的氧化性、还原性的关系
↑ ↑↓ ↓
0
铁元素(Fe):
高温
√ Fe2O3 +3CO= Fe +3CO2
10
二、氧化剂和还原剂
所含元素的 化合价降低 的反应物
具有氧化性
所含元素的 化合价升高
的反应物
具有还原性
一般的,可以用下面的反应式表示一个氧化还原反应。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
11
从电子转移观点说明什么是氧化剂、还原剂? 反应物所含的元素:化合价升高→失e- → 发生氧化反应 →是还原剂→表现还原性→
反应得到氧化产物
反应物所含的元素:化合价降低→得e-→ 发生还原反应 →是氧化剂→表现氧化性→
反应得到还原产物
12
下列反应中,哪些是氧化剂? 哪些是还原剂?
Cu + Cl2 == CuCl2 还原剂 氧化剂
Zn + H2SO4 == ZnSO4 + H2↑ 还原剂 氧化剂
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
普通高中课程标准实验教科书 化学1(必修)
第二章 第三节 氧化还原反应
第一课时 氧化还原反应基本概念
1
旧知回顾
初中阶段,我们知道:
点燃
2Mg + O2 = 2MgO
氧化反应
△ CuO + H2 = Cu + H2O
还原反应
点燃
H2 + Cl2 = 2HCl
得氧、失氧
2
思考与交流
氧化反应和还原反应是独立进行的吗? CuO + H2 =△ Cu + H2O
非氧化还原反应
Cl2 + H2O== HCl + HClO
既是氧化剂又是还原剂 13
〖思考〗
下列几个反应属于基本反应类型中的那一种?
化合价 Cu+Cl2 =△== CuCl2
有变化
化合反应
CaO + H2O === Ca(OH) 2
CaCO3=高=温=CaO+CO2 ↑
△
2KClO3===2KCl+3O2 ↑
2Na + Cl2 == 2NaCl
氧化还原反应:
有元素化合价变化的化学反应 4
〖小结〗
化 氧化还原反应
学
反 应
非氧化还原反应
反应物中元素化合 价升高的反应
氧化反应
还原反应
反应物中元素化合 价降低的反应
化学反应的又一种分类方法
5
氧化还原反应
CuO + H2 =△ Cu + H2O
铜元素的化合价降低,氧化铜发生还原反应 氢元素的化合价升高,氢气发生氧化反应
特征
实质 反应过程
9
〖做一做〗
下列化学反应中,哪些属于氧化还原反应?为什么?
哪些元素的化合价升高了?哪些元素的化合价降低了? 指出含有这些元素的具体物质。
√ Cu + Cl2 点==燃 CuCl2 √ Zn + 2H+ == Zn2+ + H2↑ × CaCO3+ 2H+ == Ca2++H2O+CO2↑ √ Cl2 + H2O== HCl + HClO
+2 +3
↑ ↑↓ ↑↓ ↓
-2 0 +4 +6
硫元素(S):
含有最高价态的元素的物质只具有氧化性;
含有最低价态的元素的物质只具有还原性;
含有中间价态的元素的物质既有氧化性,又有还原性。 16
常见的氧化剂和还原剂: 氧化剂
氧气、氯气、硝酸、浓硫酸、高锰酸钾 ( KMnO4 )、氯化铁( FeCl3 )等
NaOH+HCl==NaCl+H2O
7
氧化还原反应的实质 2Na+Cl2 =点燃= 2Na Cl
失去e-
Na
Cl
失去-后
得到e-后
化合价升降的原因:
Na+ [ Cl ]-
电子的得失
Na+ Cl -
8
氧化还原反应的实质 电子转移 (得失或电子对偏移)
化合价升高 →失e- →发生氧化反应
化合价降低 →得e- →发生 还原反应
CuO失氧变为铜,发生了还原反应; H2得氧变为H2O,发生了氧化反应。
氧化反应和还原反应同时发生的反应 称为氧化还原反应。
3
新知探究
用我们学过的化合价来分析下列各反应:
+2 2CuO
0
+
0 C 0
0 +4
高温
==
2Cu
+
CO2↑
点燃 +2 -2
2Mg + O2 == 2MgO
0
0 点燃 +1 -1
化合价升高 化合价降低
反应
反应
氧化反应
还原反应 6
〖练习〗
指出下列反应哪些属于氧化还原反应?
Cu+Cl2 =△== CuCl2 √
CaO + H2O === Ca(OH) 2
CaCO3=高=温=CaO+CO2 ↑
△
2KClO3===2KCl+3O2 ↑
√
Fe+CuSO4 == Cu+FeSO4 √
还原剂
铁、钠、锌、氢气、碳、CO、亚硫酸钠 (Na2SO3)、SO2 、硫酸亚铁(FeSO4)等
17
〖知识小结〗
⑴氧化还原反应的概念及判断
⑵两条线: 失e- → 化合价升高 → 发生氧化反应 得e- → 化合价降低 → 发生 还原反应
⑶氧化还原反应与四种基本反应类型 的关系
(4)常见氧化剂和还原剂
分解反应
化合价 无变化
Fe+CuSO4 == Cu+FeSO4 置换反应
NaOH+HCl==NaCl+H2O 复分解反应
14
〖小结〗
氧化还原反应与四种基本反应类型的关系
非氧化还原反应
氧化还原反应
化置学换反反应 应
复分解反应
15
交流·探究
元素的化合价与物质的氧化性、还原性的关系
↑ ↑↓ ↓
0
铁元素(Fe):
高温
√ Fe2O3 +3CO= Fe +3CO2
10
二、氧化剂和还原剂
所含元素的 化合价降低 的反应物
具有氧化性
所含元素的 化合价升高
的反应物
具有还原性
一般的,可以用下面的反应式表示一个氧化还原反应。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
11
从电子转移观点说明什么是氧化剂、还原剂? 反应物所含的元素:化合价升高→失e- → 发生氧化反应 →是还原剂→表现还原性→
