(新教材)氧化还原反应PPT优秀课件人教版1
合集下载
人教版化学《氧化还原反应》ppt完美课件【新教材】1(1)

___燃_料__的_燃__烧______等。
易燃物的自燃
食物的腐败
(2)对人类生活和生产不利:_____________、___________、
钢铁的锈蚀
_______________等。
下列关于氧化还原反应的叙述,正确的是( B ) A.失去电子的反应是还原反应 B.失去电子的物质是还原剂 C.发生氧化反应的物质是氧化剂 D.作氧化剂B的物质不能是还原剂
二、氧化剂和还原剂
1.常见的氧化剂、还原剂
物质种类
常见物质
氧 (1)活泼非金属单质
O2 、 Cl2 等
化 (2)含有高价态元素的 浓H2SO4 、___H_N_O_3____、
剂 化合物
___F_e_C_l3_____、__K_M__n_O_4 ____等
(3)活泼金属单质
__A_l___、_Z_n___、__F_e___等
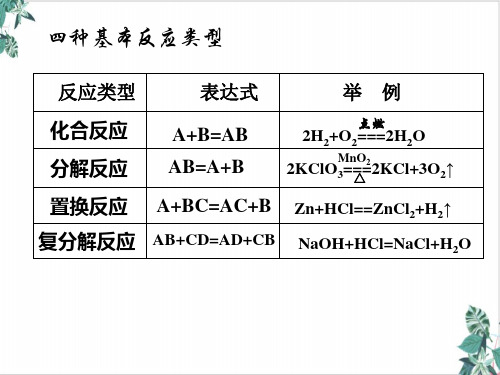
3、以下表示的是碳及其化合物的转化关系,其中涉及的基本 反应类型依次是( D )
C―C高― u温 O→CO2―H―2O→H2CO3C― a― O→ H2CaCO3―高―温→CO2 A.化合、置换、分解、复分解 B.置换、复分解、化合、分解 C.置换、化合、分解、复分解 D.置换、化合、复分解、分解
9、氧化还原反应中电子转移的表示方法
2.从硫元素的化合价态上判断,下列物质中的硫元素不能
表现氧化性的是( B )
A.S C.SO2
B.Na2S D.H2SO4
3.判断正误(正确的打“√”,错误的打“×”) (1)金属单质作反应物时一定是还原剂。( ) (2)在反应C+O2=点==燃==CO2中,CO2作氧化剂。( ) (3)在氢气燃烧生成水的反应中,氢气作还原剂。( ) (4)在反应SO2+Br2+2H2O===H2SO4+2HBr中,水作氧化 剂。( ) (5)氧化剂在反应中得电子,化合价升高。( )
《氧化还原反应》PPT课堂-课件【人教版】1

注:1、通过观察配平不变价元素(一般先配其它元素,最后配H ) 2、检查好后切记划上等号(一般检查O)
《氧化还原反应》PPT课堂-课件【人 教版】1 优秀课 件(实 用教材 )
《氧化还原反应》PPT课堂-课件【人 教版】1 优秀课 件(实 用教材 )
化合价升高4 × 1
0
+5
+4 +4
1C + 4 HNO3(浓)---- 2 H2O + 4 NO2 + 1 CO2
盐 KClO3、KMnO4、 FeSO4 、 Na2SO3
三、氧化还原反应的基本规律
▪ 1、价态决定性质规律 ▪ 2、强者生成弱者规律 ▪ 3、相邻价态转化规律 ▪ 4、强者反应优先规律 ▪ 5、电子得失守恒规律
【重点突破】
▪ 1、价态决定性质规律
当元素具有可变化合价时,一般处于最高 价态时只具有氧化性,处于最低价态时只 具有原性,处于中间价态时既具有氧化性 又具有还原性,但是主要表现为其中一种 性质。 如:浓H2SO4的S处于最高价只具有氧化性, H2S中的S处于最低价只具有还原性,单质 S和SO2中的S处于中间价态既有氧化性又 有还原性。
(又叫“强制弱”规律) 氧化性:氧化剂 > 氧化产物 还原性:还原剂 > 还原产物
(较弱氧化性)
应用一: 可以根据方程式判断物质氧化性、还原性的强弱
【实际应用】
【例题2】根据下列反应,判断有关物质还原性由强到
弱的顺序是( A )
H2SO3+I2+H2O=2HI+ H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
化合价降低1 × 4
《氧化还原反应》PPT课堂-课件【人 教版】1 优秀课 件(实 用教材 )
《氧化还原反应》PPT课堂-课件【人 教版】1 优秀课 件(实 用教材 )
《氧化还原反应》PPT课堂-课件【人 教版】1 优秀课 件(实 用教材 )
化合价升高4 × 1
0
+5
+4 +4
1C + 4 HNO3(浓)---- 2 H2O + 4 NO2 + 1 CO2
盐 KClO3、KMnO4、 FeSO4 、 Na2SO3
三、氧化还原反应的基本规律
▪ 1、价态决定性质规律 ▪ 2、强者生成弱者规律 ▪ 3、相邻价态转化规律 ▪ 4、强者反应优先规律 ▪ 5、电子得失守恒规律
【重点突破】
▪ 1、价态决定性质规律
当元素具有可变化合价时,一般处于最高 价态时只具有氧化性,处于最低价态时只 具有原性,处于中间价态时既具有氧化性 又具有还原性,但是主要表现为其中一种 性质。 如:浓H2SO4的S处于最高价只具有氧化性, H2S中的S处于最低价只具有还原性,单质 S和SO2中的S处于中间价态既有氧化性又 有还原性。
(又叫“强制弱”规律) 氧化性:氧化剂 > 氧化产物 还原性:还原剂 > 还原产物
(较弱氧化性)
应用一: 可以根据方程式判断物质氧化性、还原性的强弱
【实际应用】
【例题2】根据下列反应,判断有关物质还原性由强到
弱的顺序是( A )
H2SO3+I2+H2O=2HI+ H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
化合价降低1 × 4
《氧化还原反应》PPT课堂-课件【人 教版】1 优秀课 件(实 用教材 )
人教版高中化学必修1第三节氧化还原反应.(共9张PPT)ppt

氧化还 原反应
复分解 反应
(7) NaOH + HCl = NaCl + H2O
二、氧化还原反应与四种基本类型 反应的关系:
化 学 非 氧 化 还 原 反 应 氧化 还原 反 应 置反换反应应 复分解反 应
表格
基本反应类 型
反应实例
点燃
化合反应 3Fe+2O2 = Fe3O4 CaO+H2O = Ca(OH)2
分解反应 2H2O 电=解2H2↑+O2↑ CaCO3 =∆ CaO+CO2 ↑
Fe+CuSO4=FeSO4+Cu 置换反应 Zn+H2SO4=ZnSO4+H2 ↑
NaCl+AgNO3=AgCl↓+NaNO3 复分解反应 BaCl2+H2SO4=BaSO4↓+HCl
是否氧 化还原
反应
是
不是
是 不是
关系
20、不要相信普通的东西是有价值的。您必须为生活中的所有事物而奋斗。如果今天和昨天没有什么不同,那就快点改变自己。
化合价升高,失去电子,被氧化
0 0 点燃 +3 -2 (1)4Al + 3O2 == 2Al2O3
化合价降低,得到电子、被还原
O2 是氧化剂 Al是还原剂
Al2O3既是 氧化产物又
升 失 氧 还 降 得 还 氧 是还原产物
化合价升高,失去电子、被氧化
-1
(2)2H2O2
=M=nO=2
-2
2H2O
+
0
部分是 部分不 是
同上
是 都是
是
不是
都 不
不是 是
三、氧化还原反应的一般规律 电子得失(或
化学必修一氧化还原反应新人教版PPT课件

+ 6e-
得2x3e-,化合价降低,被还原
方法:标化合价,找变价数,反应物中变价元素指向产物 ;转移电子总数=m×ne— (m为变价的原子总数,n为单个原子转移电子数;m=1时 才可省略m);得失电子总数要守恒相等
化学必修一氧化还原反应新人教版PPT 课件
化学必修一氧化还原反应新人教版PPT 课件
(3) Na2CO3+2HCl=2NaCl+ H2O + CO2↑ X
(4)
2KClO3
MnO2 === 2KCl+3O2↑
√
(5)
2Na+2HCl=2NaCl+ 高温
H2↑
√
(6) CaCO3 === CaO+CO2↑ X
(7) 2NaOH+2H2SO4=Na2SO4+ 2H2O X
(8) Cl2+2FeCl2=2FeCl3 √
化合价降低,被还原,还原反应,
0
+2
还原产物 0 +2
Fe + CuSO4 + ==== Cu+ FeS氧O化4 产物
化合价升高,被氧化,氧化反应
根据元素
化合价是 否有变化
化学反 应分为
氧化还原反应 非氧化还原反应
1、某元素在化学反应中由化合态(化合物)变为游离
态(单质),则该元素( C)
A.一定被氧化
点燃
例1 2Na + Cl2 ==== 2NaCl
电子的得失→ 化合价的升降
化学必修一氧化还原反应新人教版PPT 课件
Na+ Cl—
化学必修一氧化还原反应新人教版PPT 课件
例2: H2 + Cl2 ==点=燃= 2HCl
人教版化学《氧化还原反应》ppt课件(1)

氧化剂 还原剂
还原产物 氧化产物
【总结】
失去2e-,化合价升高,被氧化
Z0n + +H12SO4==Z+n2SO4 + H02↑
得到2×e-,化合价降低,被还原
Zn: 还原剂 H2SO4:氧化剂 ZnSO4:氧化产物 H2:还原产物
【氧化还原反应概念之间的关系】
反应物 实质 特征 反应 产物
还原剂
(√)
(5)氧化还原反应过程中得电子的物质在反应中被氧化(×)
2.下列反应是氧化还原反应的是
()
高温 A.CaCO3=====CaO+CO2↑
点燃 B.CH4+2O2=====2H2O+CO2 C.Na2CO3+2HCl===2NaCl+H2O+CO2↑ D.2NaOH+H2SO4===Na2SO4+3H2O 解析:B 项中碳元素的化合价由-4 价变为+4 价,氧元
人教版化学《氧化还原反应》ppt课件 (1)
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解
化合
反应
反应
氧化还原反应
置换 反应
非氧化还原反应
复分解 反应
人教版化学《氧化还原反应》ppt课件 (1)
人教版化学《氧化还原反应》ppt课件 (1)
氧化还原反应与四种基本反应类型的关 系可表示为:
①不同的氧化剂与同一还原剂反应时, 反应条件越易,其氧化性越强。
2MOKn2 MO+n2 O4+4HC+4lH1C催l=6化=H△剂=C=lM2H=n2CO2lK2+C+l22+CHl25O2Cl↑+2
↑+ Cl2
8H2O ↑
失电子
人教版化学必修1氧化还原反应(51页ppt)

化
氧 化 性
具有
氧 化
表现
剂
合 价 降 低
得 到 电 子
还
还
还
被 还
原 反
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
化
还 原 性
具有
还 原
表现
剂
合 价 升 高
失 去 电 子
被 氧 化
氧 化 生成 反 应
氧 化 产
(六)外界条件对某些物质氧化性或还原性强弱的影响
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
具有
氧 化 大基本反应类型与氧化还原反应间的关系
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
非金属 单质的 氧化性 随非金 属性增 强而增 强,其 离子的 还原性 相应减 弱
(四)根据元素化合价高低来判断氧化性强弱
一般地说,同种变价元素的几种物质,它们的氧化能力是由高 价态到低价态逐渐减弱,还原能力则依次逐渐增强。
判断氧化性强弱: Fe3+与Fe2+; 氧化性: Fe3+>Fe2+
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
【新教材人教版化学】氧化还原反应PPT完美课件1

【新教材人教版化学】氧化还原反应P PT完美 课件1
【新教材人教版化学】氧化还原反应P PT完美 课件1
【典型例题 1】下列说法正确的是( ) A.氧化还原反应的本质是元素化合价的升降 B.氧化还原反应一定有氧元素参加 C.氧化反应一定先于还原反应 D.发生氧化反应的物质也可能同时发生还原反应
答案:D
检查
检查得、失电子是否相等,如不相等
解析:A 项,氧化还原反应的本质是电子的转移,特征是元素化合价的升降,错误;B 项,
只要有元素化合价升降的反应就是氧化还原反应,与是否有氧元素参加无关,错误;C 项,氧
化反应与还原反应一定同时发生,错误;D 项,若同一物质中的不同种(或同种)元素化合价
有升有降,则该物质同时发生氧化反应和还原反应,如反应
H元素的化合价 降低→H2SO4发生 还原反应→H2SO4被 还原。
2KM +7 nO -24K2M +6nO4M +4nO2O 0 2
Mn元素的化合价 降低→KMnO4发生 还原反应→KMnO4被 还原。 O元素的化合价 升高→KMnO4发生 氧化反应→KMnO4被氧化 。
2.从元素化合价角度的分析:
0
2Na
0
Cl2
+1 -1
2NaCl
Na原子失去1个电子→Na元素化合价升高→Na被氧化→Na发生氧化反应 Cl原子得到1个电子→Cl元素化合价 降低→Cl被还原→Cl发生还原反应
【新教材人教版化学】氧化还原反应P PT完美 课件1
【新教材人教版化学】氧化还原反应P PT完美 课件1
点 燃 0 0
2KClO3
MnO2
2KCl
3O2
、
Cl2 2NaOH NaCl NaClO H2O ,正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
二、氧化还原关系
失电子,化合价升高,发生氧化反应
还原剂+氧化剂=氧化产物+还原产物
得电子,化合价降低,发生还原反应
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
小组合作任务一: 氧化还原反应与四种基本反应类型的关系
氧化还原
分解
置换
化合
复分解
小组合作任务一: 氧化还原反应与离子反应的关系
离子反应
氧化还原反应
反应实例
一、氧化剂、还原剂、氧化产物、还原产物
失2e-电子,化合价升高,发生氧化反应
Fe+H2SO4=FeSO4+H2
得2e-电子,化合价降低,发生还原反应
▪
2.“现代的散文之最大特征,是每一个 作家的 每一篇 散文里 所表现 的个性 ,比从 前的任 何散文 都来得 强”。他 这里所 说的“ 个性”, 还有林 语堂此 前所说 的“性 灵”,指 的也都 是这种“ 自我” 。
▪
3.调查人群中,九成以上的学生为自 己是一 名中国 人而自 豪,九 成以上 的学生 对国家 的未来 充满信 心,这 表明学 生普遍 具有积 极的人 生观。
• 【总结】含有最高价态的元素的物质具有氧化 (填“氧化”或“还原”,下同)性;含有最低 价态的元素的物质具有__还_原___性;含有中间 价态的元素的物质既有__氧_化___性又有__还_原___ 性。
• 【巧记】高价氧化,低价还;中间价态两俱 全。
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
还原剂 氧化剂
氧化产物 还原产物
失2e-
Fe+H2SO4=FeSO4+H2
得2e-
双线桥法
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
2e-
Fe+H2SO4=FeSO4+H2 单线桥法
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
强弱律:
氧化性:氧化剂〉氧化产物 还原性:还原剂〉还原产物
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
练习: 找出下列反应中的氧化剂、还原剂、
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张) 氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
▪
1.散文的写作从此变得面貌一新:不 仅由“白 话”替代 了“文 言”,在 “文字 媒体”的 使用上 完成了 一次全 新的转 换;而 且,由“ 代圣贤 立言” 变为“表 现自己” ,从内 容记写 上实现 了和世 界文学 的同步 对接; 同时, “文章” 上升为 “文学” ,则又 极大地 提升了 散文的“ 审美品 位”。
还原剂:2 氧化剂:2
2. MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2
氧化剂:2 还原剂:2
1. Fe + CuSO4 = FeSO4 + Cu
还原剂:2 氧化剂:2
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化产物、还原产物,比较氧化性、还
原性的强弱。
1. 2Na
还原剂
+ Cl2
氧化剂
=
2NaCl
氧化产物
还原产物
2. MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2
氧化剂 还原剂 还原产物
பைடு நூலகம்
氧化产物
1. Fe + CuSO4 = FeSO4 + Cu
还原剂 氧化剂 氧化产物 还原产物
三、氧化还原规律 还原剂+氧化剂=氧化产物+还原产物
还原性 氧化性
得电子,化合价降低
失电子,化合价升高
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
▪ 【思考】物质中所含元素的化合价高低与物 质的氧化性、还原性有什么关系?
第三节 氧化还原反应
第二课时
每课一题
下列反应那些是氧化还原反应?分析化合价变化 的情况,说明反应中电子得失,分析发生氧 化反应还是还原反应。
1. CuO+2HCl=CuCl2+H2O 2. MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2 • Fe + CuSO4 = FeSO4 + Cu • Ca(OH)2+CO2=CaCO3 + H2O
▪
4.家长对孩子的关注度不够,没有真 正意义 上与孩 子沟通 ;义务 教育阶 段的教 育质量 仍需要 进一步 提高; 增强学 生体质 是一件 长期需 要落实 的事情 ;
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
练习: 找出下列反应中的氧化剂、还原剂, 计算氧化剂得到的电子数和还原剂失去 的电子数,找出两者存在的关系
1. 2Na + Cl2 = 2NaCl
守恒律:
氧化剂得到的电子总数= 化合价降低的总价数= 还原剂失去的电子总数= 化合价升高的总价数
电子守恒是解决氧化还原计算 的基本依据
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
小结
还原剂+氧化剂=氧化产物+还原产物 氧化还原的本质是电子的转移 判断的依据是化合价的变化
学会比较,学会总结
化合价升高 化合价降低
( 特征)
失电子 被氧化(氧化反应) 还原剂
得电子 被还原(还原反应) 氧化剂
(本质) (变化)
(作用)
模型:升失氧作还,降得还作氧
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
