蛋白质组学与分析技术第三讲
合集下载
蛋白质组学全部全套ppt课件

1961 1966
Jacob 和Monod Nirenberg
乳糖操纵子模型 遗传密码
1966
Gellert
DNA连接酶
1970 1970 1972 1977 1981 1983 1984 1986 1989 1994 1997 2001
生命科学回顾(续)
Smith
限制性内切酶
Temin
逆转录酶
Berg
•其目的是阐明人类基因组30亿个碱基对的序 列,发现所有人类基因并阐明其在染色体上的 位置,从而在整体上破译人类遗传信息。
•该计划启动于1990年,原定15年完成,由 于技术的成熟与基因组测序的规模化运作,以 及来自商业竞争方面的压力,2000年6月26 日基因组序列草图测序完成。
基因组计划
遗传图 物理图
功能基因组学
转录组学 蛋白质组学 代谢组学 表型组学 相互作用组学 ……
• 功能基因组学采用一些新的技术,如转录组学应用微 阵列(Microarray)、DNA芯片(DNA chip)及 SAGE(Serial analysis of gene expression)等技术, 可对成千上万的基因表达进行分析比较,并从基因整 体水平上对基因的活动规律进行阐述,力求从细胞水 平上解决基因组问题,以建立对生命现象的整体认识。
序列图
这三条数据将提供此生物所有基因在染色体上的精确定位、 基因内部序列以及基因的间隔序列。
---原核生物或低等真核生物。
1/2 of all genes “identified” have no known function
人类基因组以及多种模式生物、重要生物
基因组全序列的完成,标志着生命科学研 究进入所谓的“后基因组时代 (Postgenome era)”, 即产生了功能基因 组学(Functional Genomics)
课件:第六章 蛋白质组学技术

(尼龙膜: 480µg/cm2 ;硝酸纤维素膜:80µg/cm2 )
特殊要求下的选择 目的蛋白与硝酸纤维膜的结合能力弱
需要更大的机械强度
的免疫学检测
• 封闭 • 靶蛋白与一抗反应 • 与二抗反应 • 显色
2021/11/16
14
二抗与底物反应显色
•辣根过氧化物酶法(HRP) •碱性磷酸酶法(AP) •化学发光显色法
2-DE 分离的可溶性 E. coli 蛋白
2021/11/16
26
双向电泳特点
• 优点:高分辨率 • 缺点:
– 低丰度蛋白质 – 极酸或极碱蛋白质 – 极大或极小的蛋白质 – 难溶蛋白质
2021/11/16
27
生物质谱技术
2021/11/16
28
质谱分析(mass spectrometry,MS)
2021/11/16
9
2021/11/16
10
2021/11/16
11
转膜:负极到正极,依次放海绵,滤纸,凝 胶,硝酸纤维膜, 滤纸,海绵
380mA 30分钟
2021/11/16
12
转膜
硝酸纤 维素膜
价格便宜
简单快速封闭非特异性抗体结合
膜的选择
封闭非特异性抗体结合麻烦
尼龙膜
价格昂贵
需要更高的蛋白结合率
现、同源蛋白质比较、蛋白质加工修饰分析。 2、蛋白质组功能模式(作用)的研究 • 基因产物识别、基因功能鉴定、基因调控机制分析。 • 重要生命活动的分子机制(如细胞周期、分化与发
育、环境反应与调节等)。
• 医药靶分子的寻找和分析(包括新药靶分子、肿瘤 分子标记、人体病理介导分子等)。
2021/11/16
特殊要求下的选择 目的蛋白与硝酸纤维膜的结合能力弱
需要更大的机械强度
的免疫学检测
• 封闭 • 靶蛋白与一抗反应 • 与二抗反应 • 显色
2021/11/16
14
二抗与底物反应显色
•辣根过氧化物酶法(HRP) •碱性磷酸酶法(AP) •化学发光显色法
2-DE 分离的可溶性 E. coli 蛋白
2021/11/16
26
双向电泳特点
• 优点:高分辨率 • 缺点:
– 低丰度蛋白质 – 极酸或极碱蛋白质 – 极大或极小的蛋白质 – 难溶蛋白质
2021/11/16
27
生物质谱技术
2021/11/16
28
质谱分析(mass spectrometry,MS)
2021/11/16
9
2021/11/16
10
2021/11/16
11
转膜:负极到正极,依次放海绵,滤纸,凝 胶,硝酸纤维膜, 滤纸,海绵
380mA 30分钟
2021/11/16
12
转膜
硝酸纤 维素膜
价格便宜
简单快速封闭非特异性抗体结合
膜的选择
封闭非特异性抗体结合麻烦
尼龙膜
价格昂贵
需要更高的蛋白结合率
现、同源蛋白质比较、蛋白质加工修饰分析。 2、蛋白质组功能模式(作用)的研究 • 基因产物识别、基因功能鉴定、基因调控机制分析。 • 重要生命活动的分子机制(如细胞周期、分化与发
育、环境反应与调节等)。
• 医药靶分子的寻找和分析(包括新药靶分子、肿瘤 分子标记、人体病理介导分子等)。
2021/11/16
蛋白质组学及技术介绍PPT通用课件.ppt

拖尾"point streaking") 。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
《蛋白质组研究技术》课件

纯化得到相互作用蛋白。
酵母双杂交技术
利用酵母细胞表达的蛋白与待测蛋白 进行相互作用,筛选出与待测蛋白相 互作用的蛋白。
串联亲和纯化技术
将待测蛋白与其相互作用蛋白一起纯 化下来,再通过分离纯化得到相互作 用蛋白。
03 蛋白质组学在生物医学中 的应用
疾病标志物发现
疾病诊断
通过蛋白质组学技术,发现与疾病相关的特异性蛋白质标志物,有助于疾病的早 期诊断和预后评估。
电泳技术
利用蛋白质在电场中的迁移率不同,将蛋白质分 离成不同的条带。
蛋白质芯片技术
将蛋白质固定在芯片上,通过与待测蛋白质的相 互作用,实现对蛋白质的筛选和检测。
蛋白质鉴定技术
蛋白质鉴定技术
利用各种技术手段对分离得到的蛋白 质进行鉴定,确定其氨基酸序列和分 子量等信息。
氨基酸序列分析
通过测定蛋白质中氨基酸的排列顺序 ,确定蛋白质的种类和来源。
未来发展趋势与展望
技术创新
未来蛋白质组学技术将继续创新 ,如高通量、高灵敏度、高分辨 率的蛋白质检测技术。
跨学科融合
蛋白质组学将与生物信息学、计 算生物学等学科进一步融合,实 现多维度、多层次的数据分析。
临床应用拓展
随着技术的进步和应用研究的深 入,蛋白质组学将在临床诊断、 治疗和药物研发等方面发挥更大 的作用。
分子量测定
利用质谱等技术手段测定蛋白质的分 子量,以验证蛋白质鉴定的准确性。
免疫学检测
利用特异性抗体对蛋白质进行检测和 识别,具有高灵敏度和特异性。
蛋白质功能研究技术
蛋白质功能研究技术
通过各种手段研究蛋白质在生物体内的功能 和作用机制。
细胞生物学技术
通过观察蛋白质在细胞内的定位、分布和动 态变化,研究其功能和作用机制。
酵母双杂交技术
利用酵母细胞表达的蛋白与待测蛋白 进行相互作用,筛选出与待测蛋白相 互作用的蛋白。
串联亲和纯化技术
将待测蛋白与其相互作用蛋白一起纯 化下来,再通过分离纯化得到相互作 用蛋白。
03 蛋白质组学在生物医学中 的应用
疾病标志物发现
疾病诊断
通过蛋白质组学技术,发现与疾病相关的特异性蛋白质标志物,有助于疾病的早 期诊断和预后评估。
电泳技术
利用蛋白质在电场中的迁移率不同,将蛋白质分 离成不同的条带。
蛋白质芯片技术
将蛋白质固定在芯片上,通过与待测蛋白质的相 互作用,实现对蛋白质的筛选和检测。
蛋白质鉴定技术
蛋白质鉴定技术
利用各种技术手段对分离得到的蛋白 质进行鉴定,确定其氨基酸序列和分 子量等信息。
氨基酸序列分析
通过测定蛋白质中氨基酸的排列顺序 ,确定蛋白质的种类和来源。
未来发展趋势与展望
技术创新
未来蛋白质组学技术将继续创新 ,如高通量、高灵敏度、高分辨 率的蛋白质检测技术。
跨学科融合
蛋白质组学将与生物信息学、计 算生物学等学科进一步融合,实 现多维度、多层次的数据分析。
临床应用拓展
随着技术的进步和应用研究的深 入,蛋白质组学将在临床诊断、 治疗和药物研发等方面发挥更大 的作用。
分子量测定
利用质谱等技术手段测定蛋白质的分 子量,以验证蛋白质鉴定的准确性。
免疫学检测
利用特异性抗体对蛋白质进行检测和 识别,具有高灵敏度和特异性。
蛋白质功能研究技术
蛋白质功能研究技术
通过各种手段研究蛋白质在生物体内的功能 和作用机制。
细胞生物学技术
通过观察蛋白质在细胞内的定位、分布和动 态变化,研究其功能和作用机制。
第三讲G蛋白

包括癌基因ras的产物在内,不下于70种蛋 白质属于小G蛋白类
它们有“丰富多彩”的作用
蛋白质合成系统必需的因子,决定蛋白 质分泌路径和分泌方向的因子
G蛋白的分类
Gs Gi Gt Go Gp
Gs
Gs: 细胞表面受体与Gs(stimulating adenylate cyclase G protein, Gs) 偶联激活 腺苷酸环化酶,产生cAMP第二信使,继而 激活cAMP依赖的蛋白激酶。
Rho与细胞骨架
包括Rho、 Rac 和 Cdc42三个亚族;
两人并由此获1994年度诺贝尔生理学 或医学奖
1994年度诺贝尔生理学或医学奖
A.G.Gilman
M.Rodbell
G-proteins and the role of these proteins in signal transduction in cells
G-蛋白又称鸟苷酸调节蛋白(guanine nucleotide regulatory protein),是位于受体 与效应底物分子之间的偶联蛋白。
Ras与细胞增殖分化
最早发现的小G-蛋白 是ras(Rat sarcoma,首先在Harrey和
Kirfen鼠肉瘤病毒上发现,分别被称 为Ha- ras和Ki- ras )基因的产物 肿瘤!!!
激活型Ras激活下游靶蛋白,之一是蛋白激酶Raf, 进一步使下游MEK磷酸化,触发一系列蛋白磷酸 化反应,调节基因 转录和细胞增殖分化
G蛋白还具有激活磷脂酶A2的功能
PLA2: 被水解后产生花生四烯酸,而这个 酸又是前列腺素、血栓恶烷和白三烯的前 体,是神经元突触前的介质
各种转运蛋白: 1. 葡萄糖转运蛋白 2. 镁转运蛋白 3. 钠/质子交换蛋白
它们有“丰富多彩”的作用
蛋白质合成系统必需的因子,决定蛋白 质分泌路径和分泌方向的因子
G蛋白的分类
Gs Gi Gt Go Gp
Gs
Gs: 细胞表面受体与Gs(stimulating adenylate cyclase G protein, Gs) 偶联激活 腺苷酸环化酶,产生cAMP第二信使,继而 激活cAMP依赖的蛋白激酶。
Rho与细胞骨架
包括Rho、 Rac 和 Cdc42三个亚族;
两人并由此获1994年度诺贝尔生理学 或医学奖
1994年度诺贝尔生理学或医学奖
A.G.Gilman
M.Rodbell
G-proteins and the role of these proteins in signal transduction in cells
G-蛋白又称鸟苷酸调节蛋白(guanine nucleotide regulatory protein),是位于受体 与效应底物分子之间的偶联蛋白。
Ras与细胞增殖分化
最早发现的小G-蛋白 是ras(Rat sarcoma,首先在Harrey和
Kirfen鼠肉瘤病毒上发现,分别被称 为Ha- ras和Ki- ras )基因的产物 肿瘤!!!
激活型Ras激活下游靶蛋白,之一是蛋白激酶Raf, 进一步使下游MEK磷酸化,触发一系列蛋白磷酸 化反应,调节基因 转录和细胞增殖分化
G蛋白还具有激活磷脂酶A2的功能
PLA2: 被水解后产生花生四烯酸,而这个 酸又是前列腺素、血栓恶烷和白三烯的前 体,是神经元突触前的介质
各种转运蛋白: 1. 葡萄糖转运蛋白 2. 镁转运蛋白 3. 钠/质子交换蛋白
蛋白质分析和蛋白质组学ppt课件
node
edge node
node
8
所有这些蛋白质能做什么?
“功能”太有局限性。
生物学家想知道:每个蛋白质能做什么, 属于哪条细胞回路或者为什么细胞需要这 个功能,以及在什么地方发生了这样的过 程。
9
Gene Ontology的发起
芽殖酵母基因组数据库(SGD) 果蝇基因组数据库(drosophila genome database,简称 FlyBase) 小鼠基因组信息数据库;(mouse genome information
mitochondrial Single parent membrane
chloroplast One or more parents membrane
14
How does GO work?
What information might we want to capture about a gene product?
4
What’s in a name?
Glucose synthesis Glucose biosynthesis Glucose formation Glucose anabolism Gluconeogenesis
All refer to the process of making glucose from simpler components
[2] Protein families
2
视角3和4的介绍: Gene Ontology (GO)
Consortium
3
Gene Ontology 成立的背景
Year
Number of records
1982
edge node
node
8
所有这些蛋白质能做什么?
“功能”太有局限性。
生物学家想知道:每个蛋白质能做什么, 属于哪条细胞回路或者为什么细胞需要这 个功能,以及在什么地方发生了这样的过 程。
9
Gene Ontology的发起
芽殖酵母基因组数据库(SGD) 果蝇基因组数据库(drosophila genome database,简称 FlyBase) 小鼠基因组信息数据库;(mouse genome information
mitochondrial Single parent membrane
chloroplast One or more parents membrane
14
How does GO work?
What information might we want to capture about a gene product?
4
What’s in a name?
Glucose synthesis Glucose biosynthesis Glucose formation Glucose anabolism Gluconeogenesis
All refer to the process of making glucose from simpler components
[2] Protein families
2
视角3和4的介绍: Gene Ontology (GO)
Consortium
3
Gene Ontology 成立的背景
Year
Number of records
1982
《蛋白质组学》课件
蛋白质组学技术
本节将介绍蛋白质组学常用的实验技术和分析方法,包括质谱、二维电泳、 蛋白质结构预测等。
蛋白质组学应用领域
本节将探讨蛋白质组学在生物医药、农业和环境科学等领域的应用,展示其 广泛的研究价值。
蛋白质组学研究的重要性
本节将详细解释为何蛋白质组学研究对于解决生物学中的关键问题和推动科学进步具有重要意义。
《蛋白质组学》PPT课件
欢迎观看《蛋白质组学》PPT课件,本课程将介绍蛋白质组学的概念、技术、 应用领域和重要性,以及它的发展趋势。
课程介绍
本节将介绍蛋白质组学的基本概念和研究对象,以及在生物学研究中的重要 性。
蛋白质组学概述
本节将对蛋白质组学的研究内容、方法和技术进行概述,帮助您理解蛋白质组学的基本原理。
蛋白质组学的发展趋势
本节将展望析和应用拓展等方面。
结论和要点
本节将总结蛋白质组学课程的要点和结论,帮助您加深对蛋白质组学的理解 和应用。
蛋白质组学及技术介绍通用课件
详细描述
蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
第三讲糖蛋白质鉴定
试剂
碘液
苏丹Ⅲ染液
双缩脲试剂
甲
++++
++
+
乙
++
++++
++
丙
+
++
++++
A.乙种子中含蛋白质最多
B.碘液、苏丹Ⅲ染液和双缩脲试剂与相应的物质发生的颜色反
应分别是蓝色、橘黄色和紫色
C.在观察颜色时有可能用到光学显微镜
D.这三种试剂使用时均不需要水浴加热
谢谢观看
试管中加入等量斐林相相同对试条较剂件高并下,水产淀浴生粉加的酶热麦催芽淀2 糖m粉更i水n多,解。摇成匀麦芽观糖察的试速管率中更的快颜,
色。结果是
()
A.甲呈蓝色,乙呈砖红色,丙呈无色
B.麦甲芽呈糖无属色于还,原乙糖呈,砖与红斐色林试,剂丙反呈应蓝生色成砖红色沉淀, C.麦甲芽、糖乙越皆多显呈色蓝越色明,显丙,呈斐林砖试红剂色本身为蓝色,可得出
D
第40 d
碘液
蓝色
4.(2013·江苏高考)在 1、3、5 号试管中分别加入 2 mL 蒸馏水,2、 4、6 号试管中分别加入 2 mL 发芽的小麦种子匀浆样液,然后 在 1~4 号试管中适量滴加斐林试剂,5、6 号试管中合理滴加 双缩脲试剂,摇匀。预期观察到的实验现象是(多选) ( )
A.5、1、16~号3发 淀4、号试芽 粉5试管的 酶号管中小 能试中加麦使加管入种小入内双子麦斐都缩林匀种呈脲试浆子蓝剂试中中色后剂含的,后有淀因,淀粉1因、粉水3酶解5号号,产试试管管中是蒸馏水, B.加3入中的组的是蓝实生双蒸色麦验缩馏,芽中水2脲号糖甲而试试等无组剂管还还和中中原原乙虽的糖糖含组A,。还的故液原实显和糖示验,B斐结但液林果未可试水相呈剂浴同现本加身蓝色;6 号试管中 C.含4淀热号粉,试酶故管等仍内呈蛋呈蓝白色砖质,红,4色号故试,加管其入进双余行缩试水脲管浴试内加剂热都后后呈出出蓝现色紫色反应。 D.4现号砖试红管色内沉呈淀。砖红色,6 号试管内呈紫色
第3讲 蛋白质的结构体系
螺旋-转折-螺旋(helix-loop/turn-helix)
在多肽链中,两个-螺旋通过一个-转折连接在一 起的超二级结构称为-螺旋--转折--螺旋(HTH)。
螺旋-转折-螺旋(helix-loop/turn-helix)
HTH是具有特定功能的最简单的结构模体,最初发现于噬菌体的 阻遏蛋白中。现已在许多蛋白质中发现两种这类模体,它们各自 具有特征的几何学和氨基酸序列要求。
注意:
不要将 domain 与亚基 (subunit) 混淆: 例如 hemoglobin 由四个亚基所组成,是四 个独立的蛋白质,而每个亚基各含有一个 domain,但有四个亚基不能说是含有四个 domains。
外型结构相似的桶状大分子却有相反的作用
扮黑脸的摧毁恶人 演白脸的劝人向善
Proteasome (20S)是用来
螺旋-转折-螺旋(helix-loop/turn-helix)
例1、HTH DNA结合模体在 DNA结合蛋白 Cro、阻遏蛋 白以及大肠杆菌的 CAP 蛋白
(Catabolite Activator Protein)
中发现。
由Brian Matthews首先在 Cro 的结构分析中提出其专一地结 合 DNA 的模 型 , 即两 个 HTH motif以二聚体形式相连,距离 相当于DNA一个螺距(3.4 nm ),两个-螺旋刚好分别嵌入 DNA的大沟,结合反向重复序 列TGTG/CACA。
在小白蛋白的结构中,HTH模 体被发现3次,其中2个是钙结 合位置,其结合方式与右手三 指握球相似,构成模体的两段 螺旋在整体结构中命名为 E 和 F,故这一模体也称为“ EF手 ” (EF hand)。
α-环/转折-α模体 (helix-loop/turn-helix)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
10
4
10
5
10
6
分离分子量大小 (球状蛋白质)
HR 预装柱 (13 µ m)
用 prep grade (34 µm) 放大
45
精细纯化: 凝胶过滤填料
Superdex™ 30 pg
Mr 100 - 7 000
Superdex 75
Mr 3 000 - 70 000
Superdex 200 pg
Mr 10 000 - 600 000
10
2
10
3
10
4
10
5
10
6
分离分子量大小 (球状蛋白质)
Prep Grade (34 µ m)
有HiLoad™ 预装柱和小包装填料
46
精细纯化:离子交换填料
Mono™ Beads Q & S
10 µ m: Mono Q & S > 25 mg 上样载量
Mini™ Beads Q & S
3µ m: Mini Q & S < 2 mg上样载量
47
精细纯化:离子交换和疏水层析填料
RESOURCE™ 15 µ m
Q, S, Phenyl, Ether, Isopropyl
RESOURCE HIC Test Kit
1 ml 预装柱流速高达 10 ml/min
48
精细纯化:反相层析填料
Sephasil™
RPC
57
合理衔接不同层析技术
样品非常澄清或很稀
粗提
AC IEX IEX
沉淀 (e.g. 在高离子强度下)
中度纯化
HIC
重新溶解
精细纯化
GF
GF
GF
或
RPC
或
RPC
作含高盐样品处理
58
一个可溶性,非融合蛋白质的 多维纯化
去乙酰氧化头孢菌素 C 合成酶 Deacetoxycephalosporin C synthase (DAOCS)
33
三步纯化策略
纯度
精细纯化
达到最高纯度
中度纯化
去除大部分杂质
粗提 样品准备, 萃取, 净化
分离, 浓缩 和稳定样品
Step
34
三步纯化策略
层析填料的 颗粒大小
精细纯化 中度纯化
粗提
步骤
35
三步纯化策略
流速
精细纯化 中度纯化
粗提
步骤
36
三步纯化策略
分辩率
精细纯化 中度纯化
粗提
步骤
37
粗提
目的
24
柱层析分离
常说的过柱子应该叫柱层析分离,也叫柱色谱。我 们常用的是以硅胶或氧化铝作固定相的吸附柱。柱子可 以分为:加压,常压,减压。 压力可以增加淋洗剂的流动速度,减少产品收集的 时间,但是会减低柱子的塔板数。所 以其他条件相同的 时候,常压柱是效率最高的,但是时间也最长. 减压柱能够减少硅胶的使用量,但是由于大量的空 气通过 硅胶会使溶剂挥发,以前曾经大量的过 减压柱, 但是自从尝试了加压后,就很少使用减压柱色谱了。
27
HiTrap™ Chelating
准备柱子 用 H2O 洗 加 NiSO4 再用 H2O 洗
用平衡缓冲液平衡柱子
加样 用平衡缓冲液冲洗 柱子
用洗脱缓冲液 洗脱融合蛋白
3 min
3 min
5-15 min
2 min
废液
废液
收集
收集组份
28
高效纯化策略
分辩率
精细纯化 纯化
速度 载量
粗提
回收率
29
51
适用於三步纯化策略的层析技术
层析技术
IEX
主要特色 高分辨率 高载量 快速 分辨率好 载量一般 快速 高分辨率 高载量 快速 高分辨率 高分辨率
粗提
中度纯化
精细纯化
HIC
AC
GF RPC
52
适用於三步纯化策略的层析技术
层析技术
IEX
样品起始状态
样品结束状态
低离子强度 样品体积不受限制
高离子强度 样品体积不受限制 特异性结合 样品体积不受限制 样品体积受限制 (<5% 总柱体积) 流速受限制 需要有机溶剂
减少不同层析技术间的样品处理(e.g. 浓缩, 交换 缓冲液) 尽量简单
54
衔接层析技术时注意事项
起始条件
小量样品 低离子强度
层析技术
GF IEX
结束情况
样品稀释 交换缓冲液 (如果需要)
高离子强度或 pH 改变 低离子强度
特异性洗脱条件
高离子强度
特异性结合条件
HIC
AC
55
合理衔接不同层析技术
纯化粗样 快速浓缩 (减少体积) 和稳定样品 (去除蛋白 酶) 最适用层析技术: 离子交换 / 疏水层析
分辩率
快速
38
载量
回收率
粗提: 离子交换填料
预装柱 20ml 颗粒大小 流速
HiPrep™ 16/10 Q XL & SP XL
HiPrep 16/10 DEAE & CM
90 µ m
90 µ m
25
蛋白质分析制备仪
26
选择纯化设备
纯化需要 + 快速,高处理量筛选 (GST or (His)6 融合蛋白) 非常快速,一步纯化 (适合大部分融合蛋白) 一步纯化 (适合大部分融合蛋白) 优化以提高纯度 常规实验,重复性好 纯化后蛋白复性 MicroSpin™ Syringe + ÄKTA™ 系统 Purification HiTrap™ HiTrap Modules columns columns
凝胶过滤层析法又称排阻层析或分子筛方法,主要是根 据蛋白质的大小和形状,即蛋白质的质量进行分离和纯 化。
三种不同的蛋白质根据它们大小的不同在层析柱中被分离。
22
亲和层析(affinity chromatography)
在生物分子中有些分子的特定结构部位能够同其他分子相互识别并 结合,如酶与底物的识别结合、受体与配体的识别结合、抗体与抗 原的识别结合,这种结合既是特异的,又是可逆的, 改变条件可以 使这种结合解除。生物分子间的这种结合能力称为亲和力。
高离子强度或 pH 改变 样品被浓缩
低离子强度 样品被浓缩 特异性洗脱条件 样品被浓缩 交换缓冲液 样品被稀释 在有机溶剂中,或会损失 生物活性
HIC AC
GF
RPC
53
纯化工艺中不同层析技术的衔接
一般准则:
结合互补选择性的技术,纯化工艺应尽量采用不 同层析技术(e.g. IEX, HIC and GF)
5µ m
离子交换/疏水层析/反相层析 离子交换/反相层析
50
适用於三步纯化策略的层析技术
蛋白质性质
净电荷
大小 疏水性 生物辩识 (配基特异性) 配基特异性,净电荷, 疏水性
层析技术
离子交换(IEX)
凝胶过滤(GF) 疏水层析(HIC), 反相层析(RPC) 亲和层析(AC) 扩张柱床吸附技术 (EBA) 有AC, IEX or HIC
3.有机溶剂分级分离法
降低介电常数 争夺水化膜
3
蛋白沉淀步骤
硫酸铵沉淀(盐析):高盐溶液中蛋白质聚合而沉淀 TCA沉淀(三氯醋酸沉淀):TCA 10%-20%,蛋白质可冰上沉淀, 用丙酮和乙酸清洗沉淀。去除TCA 丙酮沉淀:3倍体积的冰丙酮,蛋白在-20度沉淀,离心沉淀蛋白,丙 酮通过空气或冻干去除 在丙酮中用TCA三氯醋酸沉淀:两者联合使用更有效,10%的TCA在 丙酮中重悬裂解样品溶液 用苯酚提取,随后在甲醇中醋酸铵沉淀:蛋白质被提取到饱和酚中, 在甲醇中用醋酸铵从酚相中沉淀蛋白,丙酮清洗
蛋白质组学与分析技术
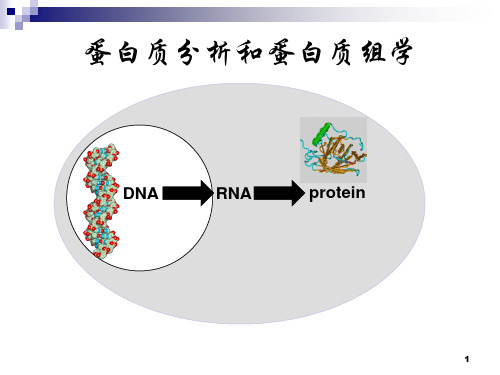
邱德文 中国农科院植物保护研究所 2010。3。24
1
蛋白质的分离纯化方法
(一)根据分子大小不同的纯化方法
1、透析和超过滤
利用蛋白质分子不能透过半透膜将其
与小分子物质分开
半透膜为玻璃纸或纤维素材料
2
利用溶解度差别的纯化方法
1.等电点沉淀
调整溶液pH
不同蛋白在各自 pI处依次沉淀 2.盐溶和盐析
14
15
16
17
18
19
20
层析分离技术(chromatography)
层析是广泛使用的分离蛋白质的方 法,它是根据蛋白质的形态、大小和电 荷的不同而设计的物理分离方法。
凝胶过滤层析、离子交换层析、亲 和层析等是目前最常用的层析方法。
21
凝胶过滤层析(gel filtration chromatography)
低溶解度的蛋白质
SDS SDS
萃取
萃取
溶解试剂 (尿素, 乙二醇 非离子性清洁剂)
GF (在非离子性清洁剂中)
HIC
HIC
GF
GF
56
合理衔接不同层析技术
粗样或样品含高盐
样品澄清
GF GF GF
脱盐
脱盐
脱盐
粗提
AC
IEX
HIC
IEX
或者需要稀释
中度纯化
IEX
HIC
精细纯化
GF
或
GF
或
GF
GF
RPC
一种不稳定,氧气敏感酶的纯化,结晶和三维结构测定 Purification of a labile, oxygen-sensitive enzyme for crystallization and 3D structure determination
