乙烯物理性质
乙烯

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。
乙烯的结构与性质

燃料添加剂:乙烯 也可用作燃料添加 剂,以提高燃料的 燃烧性能和减少污
染排放
其他用途:除了上 述用途外,乙烯还 可用于合成树脂、 纤维、涂料等材料, 以及作为工业气体 用于金属加工等领
域
PART 5
总结
乙烯是一种重要的有机化合 物,具有独特的结构和性质, 因此在多个领域具有广泛的 应用价值
x
以下是一些乙烯的主要用途
化工原料:乙烯是 一种重要的化工原 料,可用于合成各 种有机化合物,如 聚乙烯、乙丙橡胶、
环氧乙烷等
农业化学品:乙烯在 农业上可用于促进果 实成熟和开花,以及 作为植物生长调节剂。 此外,乙烯还可用于 制造农药和除草剂等
农业化学品
医药原料:乙烯及 其衍生物在医药领 域也有广泛应用, 如用于合成抗生素、 避孕药、镇痛药等
02
在生产过程中,乙烯需要通过一系列的分离和提纯步骤,以
去除杂质并获得高纯度的产品。常用的分离和提纯方法包括
压缩、冷凝、精馏和吸附等
PART 7
乙烯的储存和运输
1
由于乙烯易燃、易爆、有 毒,因此需要采取特殊的
储存和运输措施
2
在储存方面,乙烯通常储 存在金属罐或球罐中,并 需要保持低温、干燥、通
风良好
例如,采用先进的清洁生产技术和设备,减少废气和废水的排放;对固体废弃物进行回收 再利用,提高资源利用率;加强企业的环保管理和监管,确保废弃物得到妥善处理
此外,为了满足消费者对环保产品的需求,乙烯的下游产品也需要向环保、低碳、节能等方向 发展。例如,开发高强度、高韧性的聚乙烯材料,减少对环境的污染;开发环保型涂料、粘合 剂等化工产品,减少对人体的危害
3
在运输方面,乙烯需要使 用专用的管道或车辆进行 运输,并需要严格控制温
21 乙烯
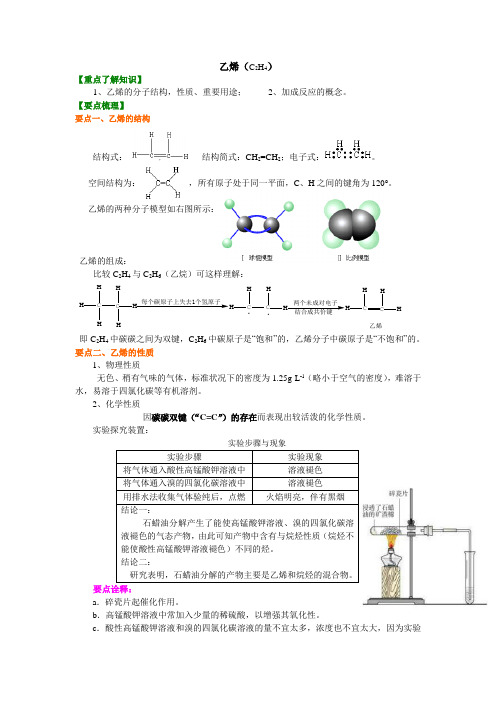
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。
乙烯的性质和用途

3% 1% 5% 7% 13%
57% 14%
返回
1、乙烯的原料来源
10多年前世界有25%~35%的乙烯是以乙烷为原料。 目 前,世界约有55%以上的乙烯是以石脑油为原料裂解装 置生产的(见表) 原料和 国家
乙烷 46.3 4.7
柴油 18.7 11.0 53.1
丙烷 17.8 5.9 7.2
石脑油 15.1 70 94.1 24.0
(3)甲醇制低碳烯烃生产技术 )
本技术是以合成气为原料的甲醇制低碳烯烃 生产技术作为 C1化工的开发热点之一,有望 乙烯或者丙烯的新来源我国拥有丰富的煤炭 资源,加强对煤炭经甲醇制烯烃的技术的研 究,不仅可提高我国甲醇生产装置的经济效 益,还可缓解丙烯供应紧张的矛盾。
返回
1、国外乙烯生产状况
世界各地区乙烯工业的发展仍保持不均匀的态势, 发达国家的和地区的乙烯生产能力增加较少,而 欧洲的态势分别依托市场优势和廉价原料优势, 成为乙烯投资的热点地区,因此世界乙烯工艺的 重心正在加速向亚洲和中东地区转移。早在2008 年国际金融危机爆发之际,中东就不断新建实话 产能。预计2015年,中东乙烯产能将占全球乙烯 产能的15%,,届时全球90%的乙烯衍生物和 70%的丙烯衍生物净出口来自中东。
Pt , Pb或 Ni
@
乙烯能被氧气直接氧化, 乙烯能被氧气直接氧化,也能被其它氧化剂氧 化。
2H2C = CH2 + O2 2H2C →
Al2O3 503~523K
CH2 O
@
乙烯水合法生产乙醇,反应式如下
553~ 573 K
H 2 C − CH 2 + H 2 O C 2 H 5 OH →
我国乙烯主要生产厂家的生产能力
乙烯的结构和性质课件

乙烯的物理性质
乙烯的物理状态
无色气体
乙烯在常温常压下为无色气体,具有特殊的甜味。
易燃
乙烯是一种易燃气体,遇到明火或高温容易发生燃烧。
乙烯的熔点、沸点和密度
熔点低
乙烯的熔点非常低,容易在低温 下由气态转变为液态。
沸点低
乙烯的沸点也相对较低,因此在常 温下容易挥发成气态。
密度小
乙烯的密度比空气稍小,所以在空 气中容易上升扩散。
与其他化合物的结构比较
与乙烷比较:乙烯比乙烷少两个 氢原子,多一个碳-碳双键,因 此乙烯的化学反应活性更高。
与乙炔比较:乙烯和乙炔都含有 碳-碳不饱和键,但乙烯是双键, 乙炔是三键,因此乙炔的化学反
应活性更高。
这些结构特点使得乙烯具有独特 的物理和化学性质,在生活和工
业生产中具有广泛的应用。
03
与氢的加成
在适当条件下,乙烯能够与氢发 生加成反应,生成乙烷。
与水的加成
乙烯能够与水在酸催化下发生加 成反应,生成乙醇。
乙烯的氧化反应
燃烧反应
乙烯能够完全燃烧生成二氧化碳和水。
环氧乙烷的形成
在特定条件下,乙烯可以与氧气发生环氧化反应, 生成环氧乙烷。
醇和醛的形成
乙烯可以通过氧化剂(如高锰酸钾、硝酸)氧化 成乙醛,进一步氧化成乙酸。
结构特点
乙烯分子中的两个碳原子 通过双键连接,每个碳原 子再与两个氢原子通过单 键连接。
空间构型
平面构型,由于双键的存 在,乙烯分子呈现出平面 形态。
乙烯的电子云分布和化学键
电子云分布
在乙烯分子中,电子云主要分布在双 键和单键周围,形成离域π键。
化学 键
双键由一个σ键和一个π键组成,σ键 是由两个碳原子的原子轨道头碰头重 叠形成,π键则是由两个碳原子的p轨 道肩并肩重叠形成。
乙烯的性质和用途

结构与组成
乙烯分子式为C2H4,结构式为CH2=CH2。 乙烯分子中还有两个氢原子,这两个氢原子是等价的。
乙烯分子中有一个碳碳双键,这个双键是乙烯分子中唯 一的双键。
乙烯分子中没有孤电子对,因此它是非极性分子。
02
乙烯的制备与生产
天然气裂解制乙烯
01
02
03
04
原料
主要使用天然气,包括甲烷、 乙烷和丙烷等。
04
乙烯的危害与防护
健康危害
急性毒性
刺激性
乙烯是一种无色易燃气体,低浓度时无毒 性,但在高浓度时会对呼吸中枢产生麻醉 作用。
乙烯对眼和呼吸道有刺激作用,可引起流 泪、咽痛、咳嗽等症状。
致敏性
致突变性
部分人群可对乙烯产生过敏反应,如哮喘 发作、皮肤瘙痒等。
乙烯在一定浓度下可引起基因突变,对生 殖系统存在潜在影响。
乙烯的新用途开发
要点一
Байду номын сангаас总结词
随着技术的不断发展,乙烯的新用途将会不断被发现和开 发。
要点二
详细描述
乙烯是一种重要的有机化工原料,其用途非常广泛。然而 ,随着技术的不断发展,乙烯的新用途也将会不断被发现 和开发。例如,乙烯可以用于生产功能性的高分子材料、 特种化学品、液晶材料等;还可以用于生物医学领域,如 制备药物载体、生物可降解材料等。这些新用途的开发将 为乙烯的应用领域带来更加广泛的发展空间。
农业化学制品
乙烯利
一种植物生长调节剂,可促进果实成 熟和植物生长发育,广泛应用于农业 生产。
环氧乙烷
一种杀菌剂,可用于防治水稻纹枯病 等农作物病害。
工业气体
作为反应物参与化工反应
乙烯在许多化工反应中作为反应物参与反应,如制备乙醇、 丙酮等。
乙烯物理化学性质归纳

甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质可作为电视、雷达等的高频绝缘材料。
2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质中文名称聚丙烯英文名称polypropylene ,简称PPCAS号9003-07-0俗称百折胶分子式[C3H6]n 结构简式溶解性不溶于常见的酸、碱有机溶剂外观和性状无毒、无臭、无味的乳白色高结晶的聚合物2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。
区分乙烯和乙烷的方法

区分乙烯和乙烷的方法乙烯(C2H4)和乙烷(C2H6)是两种常见的碳氢化合物,它们在化学性质和物理性质上有着显著的差异。
本文将介绍几种常用的方法来区分乙烯和乙烷。
1. 物理性质1.1 沸点乙烯和乙烷的沸点有较大的差异。
乙烷的沸点为-88.6°C,而乙烯的沸点为-103.7°C。
因此,通过测量样品的沸点,可以初步判断乙烷和乙烯的区别。
1.2 密度乙烯和乙烷的密度也有所不同。
乙烷的密度为0.57 g/cm³,而乙烯的密度为0.88 g/cm³。
因此,通过测量样品的密度,可以进一步区分乙烷和乙烯。
2. 化学性质2.1 燃烧性质乙烯和乙烷的燃烧性质也不同。
乙烯在空气中燃烧时会产生明亮的火焰,并且火焰是蓝色的。
而乙烷在空气中燃烧时也会产生火焰,但火焰是黄色的。
通过观察样品燃烧时的火焰颜色,可以初步判断乙烷和乙烯的区别。
2.2 反应性乙烯和乙烷的反应性也不同。
乙烯是一种较为活泼的烯烃,可以参与许多加成反应、聚合反应和氧化反应。
而乙烷由于其分子结构的饱和性,反应性较低。
通过对样品进行一系列的化学反应,可以进一步区分乙烷和乙烯。
3. 实验方法3.1 沸点测定法通过使用沸点测定仪器,可以测定样品的沸点。
首先,将待测样品装入沸点测定仪器中,加热样品并观察其沸腾点。
如果样品的沸点为-88.6°C,则可以初步判断为乙烷;如果样品的沸点为-103.7°C,则可以初步判断为乙烯。
3.2 密度测定法通过使用密度计或比重计,可以测定样品的密度。
首先,将待测样品放入密度计中,读取密度计的示数。
如果样品的密度为0.57 g/cm³,则可以初步判断为乙烷;如果样品的密度为0.88 g/cm³,则可以初步判断为乙烯。
3.3 燃烧实验通过将待测样品点燃,并观察其燃烧时的火焰颜色,可以初步判断样品的化学性质。
如果样品燃烧时火焰为蓝色,则可以初步判断为乙烯;如果样品燃烧时火焰为黄色,则可以初步判断为乙烷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生产工艺路线选择
乙烯物理性质:通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
外观与性状:无色气体,略具烃类特有的臭味。
少量乙烯具有淡淡的甜味。
吸收峰:吸收带在远紫外区pH:水溶液是中性熔点(℃):-169.4 沸点(℃):-103.9 相对密度(水=1):0.61 相对蒸气密度(空气=1):0.98 饱和蒸气压(kPa):4083.40(0℃) 燃烧热(kJ/mol):1411.0 临界温度(℃):9.2 临界压力(MPa):5.04 闪点(fp):无意义引燃温度(℃):425 爆炸上限%(V/V):36.0 爆炸下限%(V/V):2.7 溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚。
溶于四氯化碳等有机溶剂。
乙醛:外观与性状:无色液体,有强烈的刺激臭味,易挥发。
熔点(℃):-121沸点(℃):20.8相对密度(水=1):0.78相对蒸气密度(空气=1):1.52饱和蒸气压(kPa):98.64(20℃)燃烧热(kJ/mol):279.0 kcal/mol临界温度(℃):188闪点(℃):-39 原料来源:石油裂化
催化剂性能:钯盐催化剂溶液有毒,具有酸性,并含有高浓度的氯离子,有强烈的腐蚀性.
安全:产品都是易燃易爆有毒物质,与空气能形成爆炸混合物。
环保分析:如是用碳钢制造,要求内衬耐酸耐温橡胶和瓷砖,各法兰连接处和同氧气的罐子腐蚀更严重,一般需采用特种材料。
先进性:通过可得区与理想反应器超级结构法两步系统预分析确定基本单元数量与连接类型,提供求解初值与变量边界,大大降低了模型求解复杂度。
经济性分析:1.反应条件缓和,有较高的选择性2.反应热的除去比较方便,有氧化可用反应物或溶剂的蒸发以移走反应热3.反应温度易控,温度分布均匀4.反应设备结构简单,生产能力高,
工艺条件
乙醛生产方法
1.乙醇氧化法2CH3CH2OH+O2→2CH3CHO+2H2O
2.乙炔水合法C2H2+H2O→CH3CHO
3.乙烯直接氧化法CH2CH2+O2→CH3CHO
1、反应温度
一席液相痒化生产乙醛在热力学上是很有利的,温度因素主要影响反应速率和选择性。
从动力学方程可知,升高温度,反应速率常数k值增大,有利于加快反应速率,但乙烯在催化剂溶液中的溶解度随温度升高而减小,又对反应速率产生不利益影响。
对于金属钯的氧化而言,温度高,可以提高Pd2+的平衡浓度,是催化剂溶液中[PdCl4]浓度增加,有利于加速碳化反应速率。
就氧化亚铜的氧化而言,温度升高可增大反应速率常数,但氧气的溶解度却随之降低。
综合以上分析可知,温度对反应速率产生的影响,需视两个相反效应何者占优势而言。
在温度不太高时,反应速率随温度升高而加快,但随着温度的升高,有利于因素的优势逐渐减小,而不利因素的影响逐渐显著。
且反应温度高,副反应速率也相应加快,反应选择性会下降,故存在一适宜的反应温度。
工业生产上一般控制在393~403K。
2、反应压力
乙烯络合催化氧化生产乙醛是一个气液想反应,增加压力有利于乙烯和氧气在催化剂溶液中的溶解度,加快氧化反应速率,提高生产能力。
但是,由于乙烯氧化生产乙醛是一个热效应较大的反应,反应热的移除是利用产物乙醛和催化剂溶液中水的蒸发来实现的,所以催化剂溶液是处于沸腾状态操作的,反应压力也就根据所选定的温度而自然确定的。
当反应温度为939~403K时,表压为0.3~0.38MPa。
3、原料气的配比和纯度
在一段法中,人们从采用乙烯大大过量的方式,为减少原料的损失,要求乙烯和氧气的纯度
在99%以上。
工业生产中要求严格控制循环气中氧含量和乙烯含量分别在8%和65%左右。
一步法的工艺流程示于图3-1-45。
以纯氧为氧化剂,反应器操作温度约为130℃,压力约为0.3MPa。
为安全计,气体混合物组成必需处在爆炸范围以外,因此氧约为Ψ(氧)=7%,而使用过量乙烯。
乙烯的单程转化率为30%~40%,以保持O2转化掉,w(乙烯)≈0.5。
以PdCl2-CuCl2水溶液为催化剂。
采用鼓泡床塔式反应器,反应后物料不论气体、液体和催化剂全部上升进入分离器,经分离器分离,将气体和反应液分开。
气体经冷却塔冷却、水洗涤塔洗涤,回收绝大部分乙醛(尾气中乙醛含量小于100ul〃l),大部分返回反应系统继续参与反应,少量排放至火炬烧掉。
洗涤塔下部流出的粗乙醛进入粗乙醛贮槽。
粗乙醛在轻组分蒸馏塔中分出低沸点物氯甲烷、氯乙烷及溶解的乙烯和CO2等,最终蒸馏塔塔顶出纯度为99.7%以上的精乙醛,侧线出丁烯醛等副产物。
在反应中,有不溶性树脂和固体草酸铜留在反应液中,数量一多不仅污染催化液,而且使铜离子浓度下降,结果会影响催化剂活性。
为此,操作中抽出少量在再生塔中再生,再生塔先通入氧和加入一定量盐酸,使一价铜氧化成二价2+铜,然后升温至170℃,借助催化液中的Cu的氧化作用将草酸铜分解,放出CO2并生成Cu。
再生后的催化液送回反应器。
该流程选择
性为95%左右,催化剂生产能力约为1503kg乙醛/(m催化剂·h)。
二步法工艺流程见图3-1-46。
采用两台反应器,第一个反应器只通乙烯,不通空气,在100~105℃,0.81~0.91MPa下操作,此时乙烯几乎全部参与反应,不需循环。
经闪蒸塔进行气液分离后,气相进后续工序,进行精制,获得乙醛产品。
液体进入第二个反应器(图上的氧化器),用+2+空气氧化催化液,使Cu成为Cu。
与一步法一样,催化剂也需再生,故流程中设有再生塔。
氧化器反应温度100~110℃,压力1.0~1.2MPa。
该法乙烯单程收率95%~99%,产品乙醛收率94.5%。
二法各有优缺点,例如一步法对原料要求甚高,又要空分装置,但少一个反应器,系统中没有氮气,设备可做得小一些,流程短,操作压力也比二步法低。
一般认为,选择何种生产方法与当地资源和工业条件有关。
当地有纯乙烯和氧气可供利用,则采用一步法为好,若无此条件则采用二步法为宜,但需解决好副产氮气的利用问题,以便降低生产成本。
因为系统中有HCl、O2和CuCl2存在,两种方法的防腐问题要引起高度重视,设备大多需用钛钢制造,输送催化液的泵也要选用钛泵。
核心设备
乙烯氧化制乙醛气使用液鼓泡反应器,它由反应器和除沫器组成,反应器上部有接管与除沫
器连通,除沫器底部有回液管与反应器下部相通,反应器底部有循环气管伸入至反应器内部,反应器和除沫器内壁分别衬贴有耐酸的筒壁砖,在伸入反应器内的循环气管的外壁包裹一层聚四氟乙烯板。
采用具有外循环管的鼓泡塔式反应器,以达到良好的传质,气液间有充分的?接触表面,催化剂溶液有充分的轴向混合以达到整个反应器内浓度均一,并除去?反应热的要求。
除热方式为籍产物乙醛和水的蒸发以带走反应热,反应液是处于沸腾状态?
的,反应温度是根据设定的压力而自然确定的,即溶液的泡点。
如增大压力,要?保持反应液沸腾,
反应温度必须提高,因此反应压力要控制。
像这种反应液处于沸腾状态,产物以气相形态出料的在鼓泡式反应器的反应?温度是根据反应压力来控制的。
生产工艺流程
相催化氧化一般是指气一液相氧化反应,反应物与催化剂共处同一相,习惯上称为液相氧化反应。
单纯的气相氧化因缺乏适宜的催化剂及操作困难而几乎没有。
近年来,均相催化氧化技术不断地成功应用在高级烃类制仲醇、乙醛自催化氧化制醋酸、环烷烃氧化制醇和酮混合物(如环已烷氧化制环己酮、环己醇)、瓦克法制醛或酮(如乙烯络合氧化制乙醛)、烃类过氧化氢制备(如过氧化氢异丙苯)、烯烃环氧化(如丙烯环氧化制环氧丙烷)等方面,并以其高活性和高选择性而日益受到人们的关注。
以PdCl2 -CLlC12为催化剂在水溶液中对烯烃进行氧化,生成相应的醛或酮的方法称为瓦克(Wacker)法。
这是一种液相氧化法,由于反应在液相中进行,使用的又是络合催化剂,故又称作均相络合催化氧化法。
乙醛是重要的有机合成中间体,大量用来制造醋酸、醋酐和过醋酸,还用来制造乳酸、季戊四醇、1,3-丁二醇、丁烯醛、正丁醇、2-乙基己醇、三氯乙醛、三羧甲基丙烷等。
1960年以前,乙醛生产以乙炔水合法为主。
1959年成功开发了乙烯络合催化氧化制乙醛新工艺瓦克(Wacker)法,70年代末该法成为主要的工业生产方法。
生产安全与环保
原料产品都是易燃易爆有毒物质,在常温常压下是无色气体,易燃易爆。
反应温度高,放出大连反映热,反映温度高,放热量大是该工艺的一大特点为了保证反应温度,及时一走反应热对安全生产,极为重要。
操作中若不能及时一走反应热
反应温度急剧升高,有燃烧和爆炸的危险。
能形成爆炸混合物反应体系中含量过高能形成爆炸混合物,尤其是循环气中氧含量过高。
工业生产上从安全和经济两方面考虑。
比如控制点在楼梯处,此时若盲目加宽门宽或外门宽度,智慧增加造价,造成浪费,而疏散时间却没有减少,若要解决问题,必须加宽楼梯才行。
