构型构象异构优秀课件
合集下载
10立体异构-PPT课件
(一)环己烷的构象 保持正常键角,无角张力的构象有船式和椅式。
船式
椅式
E
半椅式
船式
椅式
椅式构象为最稳定构象
(二)环己烷中的平键和直键 直键——与分子对称轴平行的键。简称a键。 平键——与对称轴成109.5O夹角的键。简称e键。
a e e a e a a e
a e e a
在环己烷中,每个碳原子都有一个a键和一个e 键,当环己烷椅式构象相互翻转时,a键和e键 同时转变。
e e
反 -十 氢 萘
• 十氢萘反式构象比较稳定,顺反两种构 象能量相差 8.7kJ ·mol-1 • 为书写方便,十氢萘也常用平面式表示
H
H
H
H
第二节
顺反异构
一、产生顺反异构的条件
分子中存在限制旋转的因素,如双键或脂 环。
每个不能自由旋转的碳原子必须连有2个 不同的原子或原子团。
a a
HOOC H
COOH
* *
OH OH
COOH
酒石酸
判断一个分子是否有手性要看它有没有对称因 素,而手性碳只是构成分子具有手性的一个最 通常的因素。
判断下列分子有无旋光性
Cl Cl CH3
CH3 Cl H H
Cl H Cl CH3
H
Cl
Cl
C H 3 C H HC H O O H 3C 2C
CH3 CH3
(二)旋光异构体构型的标记方法
旋光性物质使偏振光振动平面旋转的角度 即旋光度,用“”表示。
旋光度与什么有关呢?
ρ (质量浓度)增大, 也增大 L(测定管的长度)增大, 也增大 ∴ 正比于ρ 和L
=K× ρ L(K是比例常数)
我们定义K为比旋光度[]T , D [] T = /(ρ L) , D为钠光波长,T为
船式
椅式
E
半椅式
船式
椅式
椅式构象为最稳定构象
(二)环己烷中的平键和直键 直键——与分子对称轴平行的键。简称a键。 平键——与对称轴成109.5O夹角的键。简称e键。
a e e a e a a e
a e e a
在环己烷中,每个碳原子都有一个a键和一个e 键,当环己烷椅式构象相互翻转时,a键和e键 同时转变。
e e
反 -十 氢 萘
• 十氢萘反式构象比较稳定,顺反两种构 象能量相差 8.7kJ ·mol-1 • 为书写方便,十氢萘也常用平面式表示
H
H
H
H
第二节
顺反异构
一、产生顺反异构的条件
分子中存在限制旋转的因素,如双键或脂 环。
每个不能自由旋转的碳原子必须连有2个 不同的原子或原子团。
a a
HOOC H
COOH
* *
OH OH
COOH
酒石酸
判断一个分子是否有手性要看它有没有对称因 素,而手性碳只是构成分子具有手性的一个最 通常的因素。
判断下列分子有无旋光性
Cl Cl CH3
CH3 Cl H H
Cl H Cl CH3
H
Cl
Cl
C H 3 C H HC H O O H 3C 2C
CH3 CH3
(二)旋光异构体构型的标记方法
旋光性物质使偏振光振动平面旋转的角度 即旋光度,用“”表示。
旋光度与什么有关呢?
ρ (质量浓度)增大, 也增大 L(测定管的长度)增大, 也增大 ∴ 正比于ρ 和L
=K× ρ L(K是比例常数)
我们定义K为比旋光度[]T , D [] T = /(ρ L) , D为钠光波长,T为
最新2019-3有机化合物的同分异构现象-PPT课件

H C 2C H C H C 2 H 3 C H C 3 H C H C H 3
1-丁烯
2-丁烯
C H3 CH3C CH2
2-甲基丙烯
Ch2a02p0/t1e0/1r 3
17
例3. 碳环化合物也能形成官能团位置异构体。 如甲酚有三个异构体:
CH3 OH
邻甲苯酚
CH3
OH
OH
间甲苯酚
CH3
对甲苯酚
Ch2a02p0/t1e0/1r 3
2. 乙烷的构象
乙烷分子绕C—C σ 键旋转
,产生无
数个构象异构体,其中有两个典型构象异构体,称为
极限构象异构体——重叠式(顺叠式)构象、交叉式
(反叠式)构象。
重叠式构象
Ch2a02p0/t1e0/1r 3
交叉式构象 26
构象的表示方法:锯架式、立体透视式和纽曼(Newman)投 影式,其中扭曼投影式最重要。 扭曼投影式:把乙烷分子模型的C—C键的一端对着观察者,另 一端远离观察者,进行投影操作,两碳原子重合。前一个碳用
Ch2a02p0/t1e0/1r 3
6
仲氢 伯 HH H 氢H C C C H
HH H
多一个C
取代伯氢 取代仲氢
正丁烷 沸点-0.5℃
异丁烷 沸点-11.7℃
同样用-CH3取代丁烷碳架异构体中的不同类 型氢原子,可以得到戊烷的3个碳架异构体:
Ch2a02p0/t1e0/1r 3
7
H HH HHHH
分子的构象:分子中原子或基团绕单键旋转,在空间排列 方式称为分子的构象,表示分子构象的化学式称为构象 式.
同分异构现象:化合物的分子式相同,分子的结构和性质 不同的现象称为同分异构现象。
化学课件 10 立体异构 ppt

第十章 立体异构
【教学目标】
1. 掌握: 顺反异构和对映异构的概念、产生条件; 能判断有机物是否存在顺反异构和对映异构;手性碳 原子和手性分子概念。
2. 熟悉:旋光性、旋光度;费歇尔投影式书写方法; D/L构型标记法。
3. 了解:顺反异构和对映异构的生物学性质,能从 立体异构知识理解手性药物生理活性差异。
的原子(或基团)没有相同的,就要采用 Z-E构型命名法。
a
d
a
e
CC
b Z型 e
C C (a>b、d>e)
b E型 d
常见基团优先次序(sequence rule)如下:
—I >—Br > —Cl > —SO3H > —SH > —F >—O—C—R > —OR O
> —OH > —NO2 > —NR2 > —NHR > —NH2 > —CCl3 > —CO2H
盛液体或 溶液的管子
丙酸
亮
α
暗亮
乳酸
上页 下页 首页11
二、旋光度和比旋光度
1、旋光度
通常用旋光仪测定物质的旋光性
偏振面被旋光性化合物所旋转的角度称为旋光度, 用 表示
(+)-2-丁醇 表示它 向右旋转偏振面。
()-2-丁醇 表示它 向左旋转偏振面。
2、比旋光度 (specific rotation)
=-96°
答:胆固醇的比旋光度为-96°(氯仿)。
[α]D20 = -96o (c 0.05, CHCl3)
三、旋光性和分子结构的关系
1、手性分子和手性碳原子
观察自己的双手, 左手与右手有什么联系和区别?
【教学目标】
1. 掌握: 顺反异构和对映异构的概念、产生条件; 能判断有机物是否存在顺反异构和对映异构;手性碳 原子和手性分子概念。
2. 熟悉:旋光性、旋光度;费歇尔投影式书写方法; D/L构型标记法。
3. 了解:顺反异构和对映异构的生物学性质,能从 立体异构知识理解手性药物生理活性差异。
的原子(或基团)没有相同的,就要采用 Z-E构型命名法。
a
d
a
e
CC
b Z型 e
C C (a>b、d>e)
b E型 d
常见基团优先次序(sequence rule)如下:
—I >—Br > —Cl > —SO3H > —SH > —F >—O—C—R > —OR O
> —OH > —NO2 > —NR2 > —NHR > —NH2 > —CCl3 > —CO2H
盛液体或 溶液的管子
丙酸
亮
α
暗亮
乳酸
上页 下页 首页11
二、旋光度和比旋光度
1、旋光度
通常用旋光仪测定物质的旋光性
偏振面被旋光性化合物所旋转的角度称为旋光度, 用 表示
(+)-2-丁醇 表示它 向右旋转偏振面。
()-2-丁醇 表示它 向左旋转偏振面。
2、比旋光度 (specific rotation)
=-96°
答:胆固醇的比旋光度为-96°(氯仿)。
[α]D20 = -96o (c 0.05, CHCl3)
三、旋光性和分子结构的关系
1、手性分子和手性碳原子
观察自己的双手, 左手与右手有什么联系和区别?
第十五章--立体异构PPT课件

H2N H
L-多巴 (DOPA) 用于治疗帕金森氏症
COOH D-多巴
无效,在体内会导致危险的积累
O
O
(R) – 香芹酮,留兰香味 (S) – 香芹酮,芫荽香味
一、偏振光和旋光性
光源
光束先进方向
光波振动方向与光束前进方向关系示意图
普通光
Nicol prism
普通光
平面偏振光
平面偏振光: 通过Nicol棱镜,仅在 一个平面上振动的光。
有机化合物分子具有手性的最常见情况是存在 手性碳原子。手性碳原子是指与4个不相同的原子或
* 原子团相连的碳原子,常用“ ”号标出。如:
C3HC * HCOOH C3HC * HCOOH
OH
N2H
必须指出的是: 1. 有手性碳原子的分子并不一定是手性分子。 2. 没有手性碳原子的分子并不一定不是手性分子。 3. 一个分子中只有一个手性碳原子时,则它一定是 手性分子。 4. 手性碳原子是判断分子是否手性的重要依据。
2. R/S 构型标记法 —— 绝对构型
根据基团的顺序规则,确定与手性碳原子相连的4个基团优 先顺序的大小,假设顺序为a>b>c>d。将优先顺序最小的基 团d处于眼睛对面最远的位置上,然后再看a→b→c的排列顺序, 如 顺 时 针 方 向 的 定 为 R 构 型 ( 拉 丁 文 Rectus 的 缩 写 ) , 假 若 a→b→c是逆时针方向的则定为S构型(拉丁文Sinister的缩写).
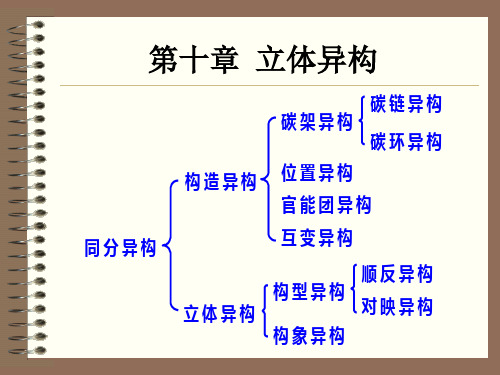
结构异构
碳链异构 位置异构官能团异构
互变异构 价键异构
同分异构
顺反异构 构型异构
立体异构
Stereoisomer
构象异构
旋光异构 ( 对映异构,光学异构)
第一节 顺反异构
《构象异构》幻灯片

球棍模型
透视式
纽曼投影
式
乙烷的穿插式构象
球棍模个甲基互相穿插,不 同碳原子上的氢原子彼此相距最远, 相互间的排斥力最小,分子内能最低, 因而稳定性最大。故穿插式是乙烷的 优势构象。重叠式中的2个甲基互相重 叠,2个碳原子上的氢原子彼此相距最 近,相互间的排斥作用最大,,分子 内能最高,因而是最不稳定的构象。
二、环已烷的构象
环己烷分子由于C—C键的旋转 或扭曲可形成各种构象,其中椅式构 象和船式构象是环己烷的两种典型构 象(如图10-10),二者可以互相转 变。
转 变
椅式构象 象
船式构
在环己烷的椅式构象中,相邻碳 原子的键均处于穿插式,碳原子上的 氢相距较远,内能较低。在船式构象 中,船底的键相互处于重叠式,且船 首船尾所结合的氢原子彼此相距很近, 相互间产生的斥力较大,内能较高。 故环己烷最稳定的构象为椅式构象, 最不稳定的构象为船式构象。
构象和构型都是表示分子中原子 或原子团在空间的排列。所不同的是, 构象异构体之间可以通过单键的旋转 或扭曲而相互转变,而构型异构体之 间在化学键不发生断裂的情况下是不 能互相转变的;一般情况下,不能把 构象异构体别离开来,而可通过适当 方法对构型异构体进展别离〔顺式与 反式〕或拆分〔R-型与S-型〕。
习题
l. 解释以下概念 〔1〕构造、构型与构象 〔2〕手性碳原子与手性分子 〔3〕对映体与非对映体 〔4〕内消旋体与外消旋体
2.指出以下化合物有无顺反异构体, 假设有,那么写出它们的异构体,
并用 顺、反法和Z、E法表示其构型。
(l)2-丁烯酸 (2)2-甲基-3-溴-2-己烯. (3)l,3-二溴环丁烷 (4)l,2-二氯乙烷 (5)2-苯基-3-甲基-2-戊烯 (6)1-氯-1,2-二溴乙烯
有机化学02立体化学PPT课件

a
Ph
C10H7-
CCC
-H7C10
Ph
36
第36页/共133页
a
b
a
b
a
b
HO2C
H
H
CH3
first resolved in 1909
H HO2C
第37页/共133页
b a
H CO2H
37
联苯型 Biphenyls
NO2 O2N
HO2C CO2H
ab
ba
OH OH
38
第38页/共133页
NH2
HO2CC* H C* HCO2H OH OH
29
第29页/共133页
问题:有无手性碳原子?
OH OH
CH2CHCHCHCHCHO
OH OH OH
OH
CH3
H Br
CO2H
30
第30页/共133页
Other chiral atoms:
:NR1R2R3
非手性氮
R1
R1
R3
N . flipping . N
3、手性面
CO2H
CO2H
(S)-(-)-[10]paracyclophane2-carboxylic acid
O
O
CO2H
可拆分,200 ºC 仍稳定
39
第39页/共133页
4、螺旋性 Helicity Helices (cylindrical, conical) are chiral objects.
21
第21页/共133页
手性分子的判据: 一般,若分子既没有对称面 m 也无对称中心 i, 就是手性分子, 不能 与其镜像重叠。
配合物的结构和异构现象PPT课件

1.三角双锥 2.四方锥 3.多面体之间的转化
三角双锥 (trigonal bipyramid, TBP) D3h
四方锥 (square pyramid, SP)
C4v
[Fe(CO)5] D3h
BiF5
C4v
1.三角双锥
d8、d9、d10 和 d0构型金属离子较常见。
如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 [Co(H)(N2)(PPh3)3]
S
Ag C
Ag
N
N
Ag C
S
AgSCN晶体
二、配位数3
配位数为3的配合物,其空间结构一般 为平面三角形.
原因:当三个配体配位于没有非键电子 的中心原了,只有在配体占等边三角形的三 个角即键角为120°,配体之间的斥力最小。
中心原子是以 sp2、dp2、或ds2杂化轨 道与配体的合适轨道成键。单核的平面3配 位的配合物不多。
(a), (b), D4h
沿四重轴拉长或压扁
(2).沿2个四重轴(C4)改变长度的称正交变形 (Oh→D2h).如图(c).
(3). 沿 着 一 个 三 重 轴 ( C3 ) 的 变 形 称 三 角 变 形 (Oh→D3d).如图(d).
2、三角棱柱(D3h )
1965年出现了第一个三角棱柱配合物 [Re(S2C2Ph2)3]属于这一结构。
一、平面正方形配合物的几何异构现象
1、[MA2B2] 最典型的代表是二氯·二氨合铂 (Ⅱ)[PtCl2(NH3)2],其有两种几何异构体分别为 顺式和反式。
图2.5 [PtCl2(NH3)2]的两种几何异构体
2、[MABCD] 这一类配合物应有三种几何异构体。最早得
到的这一型式的配合物是 [Pt(NH3)(NH2OH)(Py)(NO2)]+ 阳 离 子 , 它 的 三 种 异构体如下图。
三角双锥 (trigonal bipyramid, TBP) D3h
四方锥 (square pyramid, SP)
C4v
[Fe(CO)5] D3h
BiF5
C4v
1.三角双锥
d8、d9、d10 和 d0构型金属离子较常见。
如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 [Co(H)(N2)(PPh3)3]
S
Ag C
Ag
N
N
Ag C
S
AgSCN晶体
二、配位数3
配位数为3的配合物,其空间结构一般 为平面三角形.
原因:当三个配体配位于没有非键电子 的中心原了,只有在配体占等边三角形的三 个角即键角为120°,配体之间的斥力最小。
中心原子是以 sp2、dp2、或ds2杂化轨 道与配体的合适轨道成键。单核的平面3配 位的配合物不多。
(a), (b), D4h
沿四重轴拉长或压扁
(2).沿2个四重轴(C4)改变长度的称正交变形 (Oh→D2h).如图(c).
(3). 沿 着 一 个 三 重 轴 ( C3 ) 的 变 形 称 三 角 变 形 (Oh→D3d).如图(d).
2、三角棱柱(D3h )
1965年出现了第一个三角棱柱配合物 [Re(S2C2Ph2)3]属于这一结构。
一、平面正方形配合物的几何异构现象
1、[MA2B2] 最典型的代表是二氯·二氨合铂 (Ⅱ)[PtCl2(NH3)2],其有两种几何异构体分别为 顺式和反式。
图2.5 [PtCl2(NH3)2]的两种几何异构体
2、[MABCD] 这一类配合物应有三种几何异构体。最早得
到的这一型式的配合物是 [Pt(NH3)(NH2OH)(Py)(NO2)]+ 阳 离 子 , 它 的 三 种 异构体如下图。
立体化学总结PPT课件
CH2OH
D-(+)-甘油醛
COOH
H
H OH
CH2OH
COOH H OH
CH3
D-(-)-乳酸
左右旋(+、-)已改变!
第21页/共39页
2) R/S命名法(绝对构型):
R/S法是1970年采用的系统命名法。它是通过化合物 的真实构型。该法需要用到“次序规则”。
将与手性碳相连的四个基团按次序规则排列: a>b>c>d
COOH
实物图(球棍模型或透视图)是可任意转动的!
第17页/共39页
费歇尔(Fischer)投影式不能离开纸面翻转!
COOH H OH
CH3
翻转
COOH HO H
CH3
离开纸面翻转180o, 得到对映体
COOH
互为镜像
H
OH
COOH
CH3
OH
H
COOH
OH
H
CH3
CH3
实物图(球棍模型或透视图)可任意翻转!
R
CH2NH2
Br
H
CH2NHCH3
S COOH
NH2 CH3
R
S
R
第30页/共39页
Newman式与Fischer式间的转化
H H*
* HO
OH
600
HO 重叠式构象 H
CHO
CH2OH
OH H
CH2OH CHO
步骤: a. 写出重叠式构象, 竖线向下
第31页/共39页
Newman式与Fischer式间的转化 (续)
第19页/共39页
3、对映体的命名
1) D/L命名法(相对构型):
在1951年前, 由于缺乏实验方法测得对映体的真正构 型, 人们采取人为规定的方法, 选用含有手性碳原子的甘 油醛作为标准, 规定: 羟基在手性碳原子的右边, 用D表示, 羟基在手性碳原子的左边, L表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H3C H
HH
H CH3
顺-2-丁烯
cis-2-丁烯
反-2-丁烯
trans-2-丁烯
3、顺反异构体命名 (1)顺反构型标记
环状化合物 烯烃: 相同或相似原子或基团处 于同侧为顺,异侧为反。
H 3C
CH3
H 3C
H
H3C
H
H
H
CH 3
H
CH3 H3C
H
H
H CH 3
顺-1,2-二甲基环丙烷
顺-2-丁烯
1
246
3
5
4H
5
H1
6
3
2
①C2-C3及C5-C6间的碳氢键处于重叠式位置;
② 船头和船尾上的两个碳氢键向内伸展,相距较近, 比较拥挤,存在非键张力。
∴重点掌握椅型构象
环己烷椅式(Chair Form)构象的画法
H
1
H
H
H
6H5
H
2H
H 4 H
H 3 H
H
锯架式
纽曼式
环己烷椅式构象的特点:
1. 有6个a (axial) 键,有6个e (equatorial)键。
•碳链异构 例如: 正丁烷与异丁烷
•官能团位置异构 例如:苯取代基的邻、间 和对位异构
•互变异构 例如:烯醇式与醛、酮
OH CH 2 CH
O CH 3CH
2、烷烃的构象
σ键可自由旋转(成键原子绕键轴的相对旋转不 改变电子云的形状)
构象 一个已知构型的分子,仅由 于单键的旋转而引起分子中 的原子或基团在空间的特定 排列形式称为构象。
环上有取代基时,e键取代比a键取代更稳定。
H
H
R R
e键取代,R与 CH2处于对位交叉 能量较低,含量较高 优势构象
H H
R
R
a键取代,R与 CH2处于顺位交叉 能量较高,含量较低 非优势构象
只能取船型的环己烷衍生物
甲基环己烷:
优势构象(95%)
两个规则
Hassel规则:
带有相同基团的多取代环己烷,如果没有其它因素 的参与,那末在两个构象异构体之间,总是有较多取代基 取e键向位的构象为优势构象。
构型构象异构
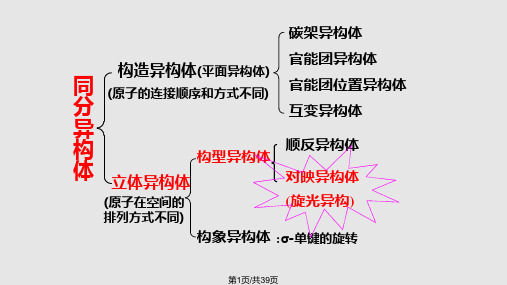
16.3.4 有机化合物异构
1、有机化合物的异构现象
构造异构
异构
立体异构
(空间排列 方式不同)
碳链异构 (碳链排列不同)
官能团位置异构
官能团异构(例:醚与醇)
互变异构
顺反异构
构型异构
旋光异构
构象
(同一化合物不同的空 间取向,一般不能分离)
构造: 分子中原子的排列次序不同
构型: 分子中原子的排列次序相同,空间取向不同 构象: 分子中由于单键可旋转,引起的原子或基团 空间取向不同,同一分子有无数构象式
键旋转能垒很低(~12.6KJ/mol)
以能量为纵坐标,以单键的旋转角度为横坐标作图, 乙烷的能量变换曲线如下:
HH HH H H
-1
kJ.mol
位能
1 2 .6
H
H
H
H HH
0°
60°
旋转角度
H
H
H
H HH
120°
•丁烷的构象
CH3
H
H
H
H
CH3
I 对位交叉式 0。
HCH3
H H
HCH3
II 部分重叠式 60。
Barton规则:
带有不同基团的多取代环己烷,如果没有其它因素的 参与,那末其优势构象总是趋向于使作用最强的和较强的 基团尽可能多地取e键的向位。
其它环的构象
四
平面式
元
环
折叠式
转换能量 E = 6.3 KJmol-1
五 元 环
信封式
半椅式
练习:
下列异构体中哪一个最稳定?并指出其中的构 象异构体和顺反异构体。
环己烷有两种构象:
椅型 稳定
船型 不稳定
两种构象通过C-C单键的旋转,可相互转变; 室温下,环己烷主要在椅型构象存在(99.9%以上)。 为什么椅型构象稳定?
椅型构象:
3 45
2
6
1
6
4
5
1 32
①所有两个相邻的碳原子的碳氢键都处于交叉式位置;
②所有环上氢原子间距离都相距较远,无非键张力。
船型构象:
反- 1,2-二甲基环丙烷
反-2-丁烯
3、 顺反异构体的命名
C
H
锯架式
H H
H
H
H H
纽曼式
HH
H
H
H HH
楔形式
锯架式
纽曼式
• 介于重叠式与交叉式之间的无数构象称为扭曲式构象。
乙烷的构象
HH
重叠式:
H H
H H
能量高,不稳定(因 非键张力大),一般 含0.5%
交叉式: 注意:
H
H
H
H
H
H
非键张力小,能量 低,稳定。一般含 99.5%
室温下不能将乙烷的两种构象分离,因单
C3H
C3H C3H
C3 C H 3H
C3H
顺(a、e取代) 反(e、e取代) 反(a、a取代)
(最稳定)
3、顺反异构体命名
顺反异构的形成条件: 必要条件:有限制碳碳键自由旋转的因素 充分条件:每个双键碳须连接两个不同的原子或基团。
例如,1-丁烯: CH 2=C
H CH 2CH 3
没有顺反异构
H3C CH3
由于分子主要以交叉式构象的形式存在, 所以高级烷烃的碳链呈锯齿形。
•环己烷的构象
1890年,H. Sachse 对拜尔张力学说提出异议。 1918年,E. Mohr 提出非平面、无张力环学说。 指出用碳的四面体模型可以组成两种环己烷模型。
椅式构象
船式构象
环己烷分子中的六个碳不共平面,且六元环是无 张力环,键角为109.5°。
Newman投影式的写法:
(1). 从C-C单键的延线上观察:
前碳
后碳
(2). 固定“前”碳,将“后”碳沿键轴旋转,得到乙烷
的各种构象。
最典型的有两种:重叠式和交叉式。
•构象的表示 极限构象式:能量最低和最高
重
H
H
叠 式
HC HH
C HH
H HH H H
H
HH H
HH
H H
楔形式
交
H
HH
叉 式
HC HH
构象异构体 单键旋转时会产生无 数个构象,这些构象 互为构象异构体(或 称旋转异构体)。
烷烃分子立体形状表示方法:
实线-键在纸平面上; 楔线-键在纸平面前;
虚线-键在纸平面后。
H
HC
•乙烷的构象
H
H H
C H
重叠式(由H-C-C-H组成的两面角为0o) 交叉式(由H-C-C-H组成的两面角为60o)
CH3
H
CH3
H
H
H
III 邻位 12交 0。叉式
H3CCH3
H3C
CH3 H
HCH3
H H
H H
IV 全重 18叠 0。式
H
H
H
V 邻位 24交 0。叉式
H H3C
H H
VI 部分 30重 0。叠式
注意:常温下,丁烷主要是以对位交叉式存在,全
重叠式实际上不存在。
丁烷的能量图如下:
高级烷烃的碳链呈锯齿形
2. 有C3对称轴。(过中心,垂直于1,3,5平面和2,4,6平 面,两平面间距50pm)
3. 有构象转换异构体 。(K=104-105/秒) 4. 环中相邻两个碳原子均为邻交叉。
H
5
H
H 4H
H
251pm
H
H
6
H H
3
2
250pm
H
1
H
249pm
H
a键转变成e键,e键转变成a键; 环上原子或基团的空间关系保持。
