PG酶
苏州格锐思生物科技有限公司多聚半乳糖醛酸酶(PG)试剂盒说明书
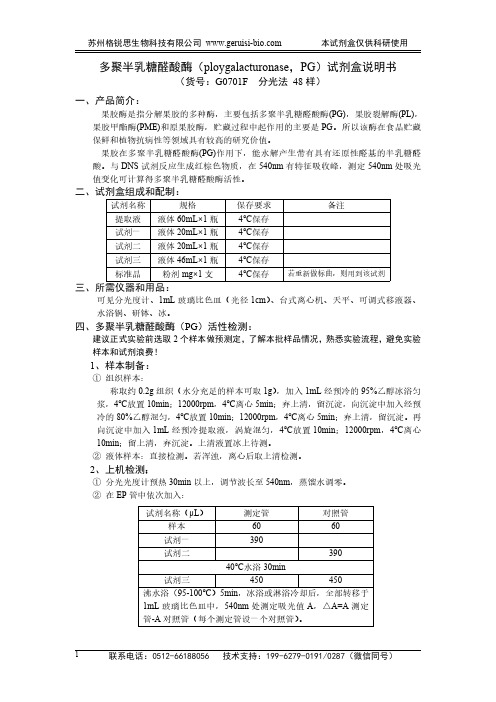
多聚半乳糖醛酸酶(ploygalacturonase,PG)试剂盒说明书(货号:G0701F分光法48样)一、产品简介:果胶酶是指分解果胶的多种酶,主要包括多聚半乳糖醛酸酶(PG),果胶裂解酶(PL),果胶甲酯酶(PME)和原果胶酶,贮藏过程中起作用的主要是PG。
所以该酶在食品贮藏保鲜和植物抗病性等领域具有较高的研究价值。
果胶在多聚半乳糖醛酸酶(PG)作用下,能水解产生带有具有还原性醛基的半乳糖醛酸。
与DNS试剂反应生成红棕色物质,在540nm有特征吸收峰,测定540nm处吸光值变化可计算得多聚半乳糖醛酸酶活性。
二、试剂盒组成和配制:试剂名称规格保存要求备注提取液液体60mL×1瓶4℃保存试剂一液体20mL×1瓶4℃保存试剂二液体20mL×1瓶4℃保存试剂三液体46mL×1瓶4℃保存标准品粉剂mg×1支4℃保存若重新做标曲,则用到该试剂三、所需仪器和用品:可见分光度计、1mL玻璃比色皿(光径1cm)、台式离心机、天平、可调式移液器、水浴锅、研钵、冰。
四、多聚半乳糖醛酸酶(PG)活性检测:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①组织样本:称取约0.2g组织(水分充足的样本可取1g),加入1mL经预冷的95%乙醇冰浴匀浆,4℃放置10min;12000rpm,4℃离心5min;弃上清,留沉淀,向沉淀中加入经预冷的80%乙醇混匀,4℃放置10min;12000rpm,4℃离心5min;弃上清,留沉淀。
再向沉淀中加入1mL经预冷提取液,涡旋混匀,4℃放置10min;12000rpm,4℃离心10min;留上清,弃沉淀。
上清液置冰上待测。
②液体样本:直接检测。
若浑浊,离心后取上清检测。
2、上机检测:①分光光度计预热30min以上,调节波长至540nm,蒸馏水调零。
②在EP管中依次加入:试剂名称(μL)测定管对照管样本6060试剂一390试剂二39040℃水浴30min试剂三450450沸水浴(95-100℃)5min,冰浴或淋浴冷却后,全部转移于1mL玻璃比色皿中,540nm处测定吸光值A,△A=A测定管-A对照管(每个测定管设一个对照管)。
上海市闵行区2023-2024学年高三上学期学业质量调研试题(一模)生物含答案

图12023学年第一学期高三年级学业质量调研生物学学科注意:1.本考试设试卷和答题纸。
作答必须涂或写在答题纸上,在试卷上作答一律不得分。
2.“单选”指每题只有一个选项为正确答案;“多选”指每题有两个或两个以上选项为正确答案;“编号选填”指每空有一个或多个选项为正确答案。
一、高原鼠兔(15分)青藏高原东部牧区属于高山草甸生态系统(图1), 主要植被是多年生草本植物。
广泛分布于此的植食性 小型哺乳动物高原鼠兔,主要利用植被高度较低、视 野开阔的草地生境。
野外收集该区域的香鼬和艾虎粪 便进行分析,发现高原鼠兔在这两种动物的食物中出 现频次非常高。
1.(1分)高原鼠兔取食、挖掘、排泄、刈割等活动会使草甸表面形成土丘和裸露斑块,经过一段时间恢复,裸斑上逐渐有植物生长,但植物盖度较低,称之为秃斑。
形成秃斑的过程属于______(初生/次生)演替。
2.(2分)以下关于高山草甸生态系统的描述,正确的是______。
(多选)A .信息双向传递B .能量双向流动C .受全球变暖影响D .存在能量倒金字塔研究人员采用堵洞盗洞法估测高原鼠兔的种群数量,计算公式为:种群数量=有效洞口数/洞口系数。
将待测区域内高原鼠兔的洞口全部填埋,连续3天每天记录被盗开的洞口数并计算平均值,即有效洞口数;在附近另一片较小的区域内测定有效洞口数后,用夹捕法捕尽区域内的高原鼠兔,计算有效洞口数与种群数量的比值,即洞口系数。
3.(2分)关于堵洞盗洞法的叙述,下列错误..的是______。
(单选) A .该方法依据的是数学中的抽样原理B .测有效洞口数时,连续3天均应于同一时间段记录C .每天记录好被盗开的洞口数后,均需要重新填埋D .幼年高原鼠兔尚不能掘土打洞,会导致估测数量偏大图24.(2分)如图2,较小区域B 内的有效洞口数为4个,共有高原鼠兔35只。
则待测区域A 内的高原鼠兔的种群数量大约是______只。
研究人员选取了处于同等放牧条件下的研究区域,以扰动最强处为中心向扰动弱的方向,根据有效洞口数将高原鼠兔扰动由强到弱划分为4组,探究了高原鼠兔不同强度扰动对高山草甸生态系统和放牧质量的影响,结果如下表1所示。
聚半乳糖醛酸酶的作用

聚半乳糖醛酸酶的作用
聚半乳糖醛酸酶(Polygalacturonase,PG)是一种酶类,能够分解多聚半乳糖醛酸(Polygalacturonic acid,PGA),从而引起水果和蔬菜的软化和腐烂。
PG在食品加工和果蔬保鲜等方面具有重要的作用。
1. 软化作用
PG能够水解水果和蔬菜中的多聚半乳糖醛酸,导致细胞壁结构的松弛和膨胀,使得水果和蔬菜变得柔软易嚼,口感更佳。
在加工酿造某些果汁和酒类时,使用PG可加速食材软化,提高绵密感和口感。
2. 改变颜色
在水果和蔬菜的某些部位,如苹果和西红柿的皮下,含有较高浓度的PG酶。
当水果和蔬菜成熟后,PG酶会分解细胞壁上的多聚半乳糖醛酸,使得水果和蔬菜表面颜色变深。
在加工食品、饮料、化妆品等过程中,通过调节PG酶的加入量,可以改变产品的颜色。
3. 提高食品品质
PG酶能够降低果蔬的硬度和黏度,提高食品的口感和质感。
在生产某些食品中,添加PG酶可以使食品更加细滑顺口、口感更加丰富。
4. 保鲜作用
成熟的水果和蔬菜常常易受微生物侵染而变质。
在果蔬储存和运输的过程中,加入PG酶能用于处理水果和蔬菜的过程中,
降低漏水、延长货架期、减少腐烂,从而达到果蔬保鲜的效果。
总之,聚半乳糖醛酸酶在食品处理和果蔬保鲜方面有着重要的作用,通过控制其活性和添加量可以调节产品的口感、颜色和质感等特点,使得产品更接近消费者的味觉和视觉体验。
在番茄果实成熟过程中多聚半乳糖醛酸酶(PG)的作用

在番茄果实成熟过程中多聚半乳糖醛酸酶(PG)的作用番茄果实成熟过程中,多聚半乳糖醛酸酶(PG)起着重要的作用。
本文将重点讨论PG在番茄果实成熟中的作用以及其机制。
多聚半乳糖醛酸酶是一种亲水性酶,主要作用是催化果实中多聚半乳糖醛酸(PGAs)的水解反应,将PGAs分解为低聚半乳糖醛酸(LPGAs)、半乳糖醛酸(PGA)和半乳糖醛酸(GAs)。
这个过程被称为果实软化,是果实成熟的一个标志。
果实软化是一个复杂的过程,涉及多个生物化学反应和细胞生理变化。
PG的水解作用是其中一个关键步骤。
在果实成熟早期,PG在细胞间隙和细胞壁区域表达并分泌,促进果实细胞间隙的泡松和细胞壁的降解。
随着果实成熟的进行,PG的表达逐渐下降,细胞间隙的泡松减少,细胞壁的降解减缓,果实变得更加坚硬。
果实成熟的过程受多种因素的调控,其中包括内源激素乙烯。
PG的表达与乙烯合成紧密相关。
在果实初期,PG的表达受植物内源激素乙烯的正调控,乙烯能够促进PG基因的转录和PG酶活性的增强。
随着果实成熟的进行,PG的表达逐渐下降,研究表明这可能与果实中乙烯的含量减少有关。
乙烯通过调控PG的表达和活性,参与了果实成熟过程中果实软化的调控。
PG在果实成熟过程中的作用不仅局限于果实的软化。
研究发现,PG在果实色素合成中也起着重要的作用。
果实成熟过程中,番茄果实由绿色逐渐变为红色,这是由于类胡萝卜素的合成和叶绿素的分解。
PG被发现与类胡萝卜素的合成有关,其表达与类胡萝卜素合成途径关键基因的表达呈正相关。
此外,PG的表达还与果实中多种次生代谢产物的积累有关。
因此,PG在果实成熟过程中起着重要的调控作用。
除了果实成熟过程中的作用,PG在番茄生理生化过程中也具有重要意义。
例如,研究表明PG在植物对胁迫应答中起着关键作用,参与了植物对病原微生物的抵抗和逆境胁迫的应答。
此外,PG在植物的生长和发育中也起着重要作用。
多聚半乳糖醛酸酶(PG)活性检测试剂盒说明书 可见分光光度法

多聚半乳糖醛酸酶(PG)活性检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC2660规格:50T/24S产品简介:多聚半乳糖醛酸酶(Ploygalacturonase,PG)属果胶酶的一种,广泛存在于植物、细菌及真菌中。
其催化多聚半乳糖醛酸分解,在果实软化、花粉授粉、种子发育成熟及器官脱落等方面具有重要作用,并且病原菌在侵染宿主植物时,可分泌多聚半乳糖醛酸酶来降解宿主细胞壁,进而导致病程发展。
PG水解多聚半乳糖醛酸生成半乳糖醛酸,半乳糖醛酸与DNS试剂反应生成在540nm有特征吸收峰的棕红色物质,测定540nm处吸光值变化可计算得果胶酶活性。
试验中所需的仪器和试剂:可见分光光度计、低温台式离心机、水浴锅、1mL玻璃比色皿、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
产品内容:提取液:液体30mL×1瓶,4℃保存。
试剂一:液体8mL×1瓶,4℃保存。
若溶液中有晶体析出,37℃水浴溶解。
试剂二:粉剂×1瓶,4℃避光保存。
临用前加入8mL蒸馏水,60℃水浴助溶。
试剂三:液体20mL×1瓶,4℃避光保存。
标准品:粉剂×1支,10mg半乳糖醛酸,4℃保存。
临用前加入0.943mL蒸馏水,配成50μmol/mL 的标准液。
操作步骤:一、粗酶液提取:组织:按照质量(g):蒸馏水体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提取液,冰浴匀浆后于4℃,16000g,离心10min,取上清置于冰上待测。
细菌:先收集细菌到离心管内,离心后弃上清;按照细菌数量(104个):提取液体积(mL)为500~1000︰1的比例(建议500万个细菌加入1mL提取液),冰浴超声波破碎细菌(功率20%或200W,超声3s,间隔7s,总时间5min);然后4℃,16000g,离心10min取上清置于冰上待测。
液体:直接检测或用提取液稀释后检测。
多聚半乳糖醛酸酶(PG)反义基因转化加工番茄

摘 要 :通过农杆菌 g0 r c
tme c n )B 4 0 介导将 多聚半乳糖醛酸酶(G) u f i sL A 4 ae 4 P 反义基 因导入新疆加工番茄
( 代号:9 —6 9 1 2混) 。卡那霉素抗性筛选 ,获得移栽成活 的 1 0株再 生植株 ,P R和 S uh r l t检测 表明,其 中 C o ten bo
文献标识码:A
文章编号:10 —6020 )30 8 —4 0 26 3 (0 70 —170
收稿 日期:2 0 —22 0 60 —8
基金项 目:天津 大学青年 教师基金 资助项 目( 1 0 1 ) 5 1 1 1 ;国家 自然科学基金资助项 目(0 7 9 4 3 20 3 ) 作者简 介 :寇晓虹 ( 9 0 ) 1 7 一 ,女 ,副 教授 ,博 士 ,主 要从 事果实 采后 生理和 生物 技术方面 的研 究 。
维普资讯
※生物工程
食 品科学
20,o 2, o0 17 07V1 8N .3 8 .
多聚半乳糖醛酸酶( G' P ) 反义基 因转化加工番茄
寇 晓 虹 , 罗 云 波 z 田慧 琴 ,石 英 ,
(. 1天津大学农业与生物 工程 学院,天津 30 7  ̄ 0 0 2 108 ) 0 0 3 2中国农业大学食品科学与营养工程学院,北京 .
Ke o d :p l g l tr n s ( G) o t e :g n t a so a o ;f i f n s y w r s oy aa u o a eP :tmao s e e ct n f r t n r t r e s c i r m i u m i
中图分类号 :T 2 S
(_ol e f r ut ead ie gneig Taj nv ̄i , inn 1 l g i l r o nier , in nU ie t Taj C e o Ag c u n B n i y i
甜瓜多聚半乳糖醛酸酶(PG)基因克隆及其反义序列植物表达载体构建

甜瓜多聚半乳糖醛酸酶(PG)基因克隆及其反义序列植物表达载体构建甜瓜多聚半乳糖醛酸酶(PG)基因克隆及其反义序列植物表达载体构建1.引言甜瓜(Cucumis melo L.)是一种重要的蔬果作物,在全球范围内广泛种植。
甜瓜的品质特征之一是其独特的口感和香甜的味道,这些特性主要源于果实中的多糖类物质。
多聚半乳糖醛酸(polygalacturonase,PG)酶是负责降解果实细胞壁多聚半乳糖醛酸的关键酶类。
了解甜瓜中PG酶的基因和途径,对于改善甜瓜品质和果实保鲜具有重要意义。
2.材料与方法2.1.材料本研究选择了甜瓜果实中高表达PG基因的组织作为材料,对该基因进行克隆和表达载体构建。
2.2.方法2.2.1. RNA提取和cDNA合成从甜瓜果实材料中提取总RNA,并利用逆转录酶反应合成cDNA。
2.2.2. PG基因克隆设计特异引物,利用PCR方法扩增PG基因序列,并通过聚合酶链式反应(PCR)纯化产物。
2.2.3. 反义序列构建利用分子生物学技术,设计和构建包含PG基因反义序列的表达载体。
2.2.4. 植物转化和表达将构建的表达载体引入适宜的植物体细胞,通过遗传转化技术使其表达PG基因反义序列。
3.结果与讨论3.1. PG基因克隆通过PCR扩增,成功克隆了甜瓜中PG基因的目标片段。
3.2. 构建反义序列表达载体通过插入PG基因反义序列,成功构建了植物表达载体pPG-RNAi。
3.3. 植物转化和表达利用农杆菌介导的遗传转化技术,成功将pPG-RNAi载体导入拟南芥(Arabidopsis thaliana)体细胞。
通过PCR和RT-PCR技术验证了PG基因反义序列在转基因株中的表达。
4.结论本研究成功克隆了甜瓜中PG基因的目标片段,并构建了包含该基因反义序列的植物表达载体。
通过植物转化技术,成功实现了该反义序列在拟南芥中的表达。
这一研究为深入了解甜瓜果实PG酶的功能和调控机制提供了重要工具和平台。
5.展望基于相关研究成果,今后可以进一步探究甜瓜中PG基因的调控机制,通过基因编辑等技术手段实现PG基因的精确调控和功能分析。
二磷酸甘油酸变位酶

二磷酸甘油酸变位酶二磷酸甘油酸变位酶(phosphoglycerate mutase,简称PGM)是一种重要的酶,在糖代谢途径中起着关键作用。
它能够催化2-磷酸甘油酸(2-phosphoglycerate)与3-磷酸甘油酸(3-phosphoglycerate)之间的互相转化反应,这个反应对于糖酵解和糖异生途径中的糖分解和合成过程至关重要。
PGM主要参与糖酵解途径中糖分解的过程。
糖酵解是生物体内分解葡萄糖产生能量的过程,它主要分为糖原酵解和糖类代谢两个途径。
在糖原酵解途径中,葡萄糖经过一系列酶的催化作用得到磷酸甘油酸(glyceraldehyde-3-phosphate),然后通过PGM的作用将磷酸甘油酸转化为3-磷酸甘油酸。
而在糖类代谢途径中,糖类被合成为磷酸甘油酸,然后通过PGM的作用转化为2-磷酸甘油酸。
这两个反应相互转化,通过PGM的调节使得糖酵解途径中能够高效地产生能量。
PGM的催化过程是通过底物的磷酸基在酶的作用下发生迁移,从而实现底物的转化。
其催化机制分为两个步骤,首先是底物的磷酸基迁移,然后是底物的羟基迁移。
具体来说,PGM通过催化底物2-磷酸甘油酸的磷酸基迁移到一个活性位点上,形成一个磷酸酯中间体。
然后底物的羟基与磷酸酯中间体发生羟基迁移反应,最终得到3-磷酸甘油酸。
这个反应过程中,PGM的活性位点中含有一个重要的组氨酸残基,它在催化过程中起到了关键作用。
PGM的功能不仅仅限于糖酵解途径,它还参与了其他代谢途径的调节。
例如,在脂肪酸合成途径中,PGM通过调节底物的转化反应,参与了乙酰辅酶A的合成过程。
此外,PGM还与一些疾病的发生发展密切相关。
研究发现,PGM的突变可能导致糖酵解途径的紊乱,进而引起一些代谢性疾病,如糖尿病等。
二磷酸甘油酸变位酶是一种在糖代谢途径中起关键作用的酶。
它通过催化底物的转化反应,参与了糖酵解和糖异生途径中的糖分解和合成过程。
PGM的功能不仅仅限于糖酵解途径,它还参与了其他代谢途径的调节。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
提要概述了植物多聚半乳糖醛酸酶(PG)的作用方式、组织定位、序列结构及其功能等。
对PG同工酶、序列差异性及功能多样性进行了讨论。
关键词植物;多聚半乳糖醛酸酶;功能;综述Structure and Function of Plant Polygalacturonases-A ReviewLu Shengmin,Xi Yufang,Jin Yongfeng,and Zhang Yaozhou(Biochemistry Institute,Food Science and Technology Departme nt,Zhejiang University,Hangzhou 310029)Abstract The action mode,localization,sequence structure and function of plant polygalac-turonases were summarized,and their iso-enzymes,sequence difference and function multiformity were also discussed.Key words Plant;Polygalacturonase;Function;Review果胶是植物细胞壁的主要成分之一,与半纤维素一起组成共同伸展的网络状结构,纤维素微纤丝镶嵌在其中,这是Carpita等提出的植物初生壁模型〔1〕。
果胶类分子的主要特征是由α-(1→4) 连接的D-半乳糖醛酸线状链,其中有些半乳糖醛酸的羧基发生了甲基酯化,有的在线状主链上插入了一些鼠李糖单位,这些鼠李糖残基上常带有富含阿拉伯聚糖和半乳糖的侧链。
果胶结构通过二价阳离子交联及与其它细胞壁聚体共价结合而加强。
植物细胞分化和形状巨变时,果胶网络结构发生系统性的分解,因此,果胶代谢在植物发育过程中具有重要的作用。
许多酶与催化果胶降解有关。
外切和内切多聚半乳糖醛酸酶(PG)、果胶裂解酶、果胶甲基酯酶和β-半乳糖苷酶通过作用于中性支链残基而使果胶聚合体的分子量降低〔2〕。
此外,还有可能存在至今未发现的酶在裂解果胶与细胞壁其它结构网络间的共价键上起作用。
人们对PG调节果胶降解已有广泛研究,本文综述植物PG的结构与功能研究进展。
1 PG的作用方式和组织定位早在1965年,Hobson〔3〕用细胞壁蛋白粗提液体外降解纯化果胶的方法发现了果实软化与PG活性的相关性,并将PG按作用方式分为内切多聚半乳糖醛酸酶(endo-PG)、外切多聚半乳糖醛酸酶(exo-PG)和寡聚半乳糖醛酸酶(oligo-PG)。
前者以内切方式水解断裂多聚半乳糖醛酸链,后二者以外切方式依次从半乳糖醛酸多聚链或寡聚链的非还原端释放出一个单体或一个二聚体。
endo-PG对底物的特异性较强,exo-PG则较弱。
Tieman〔4〕应用免疫定位法检测整个番茄果实中的PG蛋白,发现PG的积累首先出现于心皮到果实中柱的这部分组织中,其次出现于果皮组织和其辐射状细胞的细胞壁中,在时间上PG的积累和茄红素的积累同步,PG蛋白大多存在于细胞壁间层或初生壁,少量定位于细胞质膜上。
Pear用趋于成熟的番茄果皮为材料,应用PG-cDNA探针进行分子杂交,发现PGmRNA在果皮外层细胞和维管区细胞内含量较高〔5〕。
另外,PG也在果实、叶和花脱落区,豆荚、花药、花粉粒、花粉管及快速生长组织中被检出,表明PG参与植物发育的许多过程。
2 PG同工酶Tucker等〔6〕研究番茄PG时发现共有2种同工酶,分别是PG1和PG2。
PG1分子量较大,等电点为8.6,热稳定性较好,出现于果实成熟的早期阶段。
Brady等〔7〕又发现,随着果实的成熟出现2种分子量较小的同工酶,即PG2A和PG2B,分子量分别为42kD和46kD,其等电点均为 9.4。
以后的研究证实PG2A 和PG2B是同一基因的产物,其差异只在于糖苷化的程度不同〔8〕。
这3种同工酶均为糖蛋白。
PG蛋白的SDS变性及蛋白酶消化反应〔6〕,免疫交叉反应〔9〕表明了PG1是PG2A或PG2B与其它亚单位的非共价复合体。
Giovannoni等证明了这2种同工酶在DNA 水平上源自于同一PG基因组〔10〕。
Pressey纯化出了这种能将纯化的PG2A和PG2B转换成PG1的因子,将其命名为PG转化子〔11〕,这是一个约为100kD 的糖蛋白,对蛋白酶敏感,但具有很高的热稳定性。
由于PG转化子能在未成熟组织中被检出和某些抽提条件下只能得到PG2同工酶,所以Pressey〔12〕认为PG1只是抽提过程中所得的假象,并不一定存在于果实中。
Knegt等〔13〕发现纯化的PG转化子与PG2形成相似于PG1的产物,将其命名为PGx,同时将纯化的PG1加热产生了类似于与PG2形成PGx的转化活性,且发现未反应的PG转化子定位于植物细胞壁。
因此他们提出PG转化子的功能是负责PG或其它蛋白结合于植物细胞壁,PG1可能是成熟过程中具生理活性的PG形式。
3 PG结构及序列的差异性目前已被克隆的果实PG基因大约有8kb的转录单位,编码区序列一般为4kb 左右,被8个大小不一的内含子打断,每个基因组中可能只含一个PG基因拷贝。
花粉专一的PG基因内含子数量较少,只有3~4个〔14〕。
根据cDNA序列推导出的初生肽与成熟PG 蛋白进行的比较,发现PG蛋白在翻译时或翻译后进行了一系列的加工。
PG-cDNA初生肽N-末端部位有一典型的疏水信号序列,引导PG蛋白进入内质网腔和定位于细胞壁。
PG-cDNA初生肽有4个潜在的糖苷化位置,至今还不清楚这些位点的功能,但可以解释按cDNA推算的PG分子量和SDS-PAGE电泳之后的蛋白分子量之间的差异。
在PG加工过程中,前导肽和羧基端13 个氨基酸被剪切,最终形成一个成熟的PG蛋白〔25〕。
将所有真核和原核PG蛋白序列排列分析表明有4个保守结构域存在,其中结构域Ⅲ中的H残基被认为与催化反应有关〔15〕。
在所有真菌和植物PG中,半胱氨酸残基的位置均有较好的保守性。
果实成熟和花粉专一的PG排列有以下不同:①果实成熟的PG有一相当长的氨基端结构域。
②在这一结构域内,大约在105位的保守的天冬氨酸残基处有一保守的小区F-G -A-〔KR〕-G-D-G,而在花粉PG中则无;这个Asp (D)残基及相应的118位的Cys残基在大多数PG中是保守的。
③335位的Cys残基只局限在花粉专一的PG中。
除了这些差异之外,花粉与果实成熟有关的PG显示了较高的序列同源性。
植物发育不同阶段的PG活性是由多基因家族编码的,并受到时空的差异表达。
不同PG基因家族成员编码的氨基酸序列差异较大。
例如,番茄果实成熟有关的PG序列与1个番茄脱落区的 PG只有41%的同源性,而却与1个瓜果PG基因(MPG3)有60%的同源性,这表明PG基因家族成员序列的差异先于主要的被子植物家族的差异的出现。
尽管许多PG序列在总长上显示了相对高的差异,但仍有一些高度保守的区域存在,尤其是在酶的羧基端,该部分的一些高度保守的残基与催化功能有关〔16,17〕。
这些保守序列区已用于设计简并寡核苷酸引物通过RT-PCR方法克隆基因家族成员,其中包括至今克隆的所有PG的高度保守的区域GHGISIGS,该区域可用来鉴定序列是否编码PG蛋白〔18~20 〕。
Hadfield等对众多的已克隆植物PG的氨基酸序列进行分析,将PG分成三大分化单位〔20 〕,即分化单位A(果实和脱落区,无预期的前序列),分化单位B(果实和脱落区,具预期的前序列),分化单位C(花粉区,无前序列的外切PG)。
分化单位A由非花粉组织中表达的基因组成,编码缺乏一段预期的前序列的蛋白;分化单位B由所有的克隆编码具前序列的PG基因组成(包括番茄成熟PG);分化单位C完全由花粉表达的基因组成,编码外切PG,反映了PG的一种功能上的差异。
然而多数的已克隆PG的生化作用方式仍不清楚,有可能在分化单位A和B中的成员也含exo-PG。
N端的一段前序列只在PG的某一分化单位存在,这种前序列的功能至今不明,但可能以一种非活性状态在蛋白向最终定位运送过程中起作用,也有可能将蛋白定位在细胞壁的某一专门的位置上〔8〕。
由于将删除前序列部分长度的序列重新排列可产生1个具同样3种分化单位的种系发生树,这表明前序列并不是序列分类的依据。
至今将PG分成三大分化单位的功能意义仍不清楚。
4 PG功能的多样性PG蛋白于35年前被首次分离并被认为参与植物发育许多阶段的果胶降解,尤其是那些需要细胞分化的阶段。
例如,PG活性与器官脱落〔21〕,豆荚和花药裂开〔22〕,花粉粒成熟和花粉管生长有关〔23〕。
在快速生长组织中已检出PG活性,表明它可能与细胞伸长有关〔24〕。
虽然PG参与植物发育的许多过程,但多数研究集中在果实成熟、离层区和花粉上。
4.1 PG与果胶的降解果实的软化是细胞分离的结果。
细胞分离是由胞间层结构改变、细胞壁总体结构破坏以及胞壁物质降解引起的。
在果实的软化期间,果胶和半纤维素都发生了溶解和去聚化,被认为与细胞壁的松懈及降解有关〔25,26〕。
番茄果实成熟的研究表明,果实软化伴随着可溶性果胶和果胶酸增加,并与PG活性呈明显的相关性〔27,28〕。
这种相关性也存在于其它果实中〔29〕。
番茄果实中PG是主要的细胞壁水解酶之一,这至少有4个方面的证据:①果实软化进程与PG活性增高一致。
②体外实验中PG能直接水解未成熟果实中分离得到的细胞壁材料。
③未成熟果实的果皮组织用PG酶液处理时,其超微结构的变化与成熟时一样。
④果实不能正常成熟和软化的突变体(rin,nor)都缺乏PG〔30〕。
果胶降解尤其集中在成熟后期并与过熟阶段的果实变质有关〔31,35〕。
最近对成熟很快的网纹甜瓜细胞壁降解的研究表明,果实软化的启动和早期阶段伴随着半纤维素多糖分子的降解,尤其是木葡聚糖部分(在细胞壁的“经纬模型”假设中,木葡聚糖可能作为“闩锁”控制微纤丝的滑动〔32〕)。
果实的成熟后期(变质过熟期),果胶发生了集中的降解〔33〕。
果胶的降解增大了细胞壁网络的孔径,导致细胞壁的膨胀,这在很多果实软化后期被观察到〔34〕,也增加了酶对底物的接触。
PG活性在仁果类鳄梨果实、核果类桃中也很高。
在桃果实中,已发现3种PG同工酶活性,2 种外切酶活性,1种内切酶活性〔35〕。
番茄的内切PG活性在早期果实发育期间就存在,成熟过程中维持稳定,而桃的外切PG活性受成熟调节〔35〕。
桃的内切PG活性与离核(溶质)特性有关〔36〕。
鳄梨具有高水平的PG活性,并与成熟时多聚糖醛酸的溶解和降解在时间上相关〔31〕。
以往报告缺乏内切PG活性的果实,包括草莓、苹果、柿和瓜类,在严格的条件下,内切PG活性和PGmRNA的积累已被检测出〔37〕。
