喜树碱
喜树碱的研究进展

喜树碱的研究进展摘要现代临床试验表明喜树碱(Camptothecin,CPT)是一种具有抗癌活性的生物碱,它对膀胱癌、脑癌、肝癌等30余种恶性肿瘤都有不同的程度的疗效。
本文从喜树碱的研究历史、喜树碱的抗癌活性、喜树(Camptotheca acuminate. Decne) 中喜树碱的资源、化学合成喜树碱以及采用生物技术获得喜树碱等方面综述了喜树碱的研究进展,旨在为今后喜树碱进一步开发利用提供依据。
关键词喜树碱;抗癌活性;喜树碱来源Abstract Modern clinical experiment shows that Camptothecin is a kind of alkaloid possessing antitumor ctivities in different cancers,such as bladder cancer 、cerebrum cancer、liver cancer and so on.. In this paper, In order to offer foundation for further researching Camptothecin hereafter,an overview is given on advances in the research of Camptothecin from the following aspects: the history of Camptothecin development、antitumor activity of Camptothecin、sources of Camptothecin in Camptotheca acuminate. Decne、composing Camptothecin in chemical method and obtaining Camptothecin in biological technology, etc.Key words Camptothecin;antitumor activity;sources喜树(Camptotheca acuminate.Decne.)为珙桐科(Nyssaceae)喜树属(Camptotheca Decne.)植物[1],是我国的南方特有的落叶乔木树种,分布于我国长江流域及西南各省和印度部分地区,台湾、广西、河南等地也有栽培。
10羟基喜树碱结构式_解释说明以及概述

10羟基喜树碱结构式解释说明以及概述1. 引言1.1 概述在现代医药领域中,天然产物及其衍生物一直是研究的热点。
其中,10羟基喜树碱因其独特的结构和广泛的生理活性而备受关注。
它是一种具有杂环骨架的化合物,拥有多个羟基官能团,并且在生物体内具有重要的药理作用。
本文将详细解释10羟基喜树碱的结构式,并概述其相关概念和物理性质。
1.2 文章结构本文共分为五个部分。
首先,在引言中,我们将介绍10羟基喜树碱的背景和意义,并展示文章结构。
其次,在“10羟基喜树碱结构式解释”部分,我们将深入探讨这种化合物的基本概念、结构解析以及物理性质。
然后,在“10羟基喜树碱的作用及应用”章节中,我们将详细描述其在药理学、医学以及其他领域中的诸多应用。
接着,在“合成方法与制备工艺”部分,我们将介绍此化合物的合成路径、反应机理以及制备工艺的优化与改进。
最后,在“结论与展望”章节中,我们将总结主要研究发现,并讨论存在的问题以及未来的研究方向。
1.3 目的本文旨在对读者介绍10羟基喜树碱这一有机化合物的重要性和特点。
通过对其结构式、作用机制和应用领域的探讨,使读者能够全面了解10羟基喜树碱,并为进一步的研究和开发提供参考。
此外,本文还将着重讨论该化合物的合成方法和制备工艺,以期在工业生产中的应用得到进一步推广和提升。
最后,我们也将指出当前研究存在的问题,并对未来可能的发展方向进行展望。
通过本文内容的阐述,旨在促进科学界对10羟基喜树碱研究领域的关注和更深入地探索。
2. 10羟基喜树碱结构式解释2.1 基本概念10羟基喜树碱是一种天然产物,属于吲哚类生物碱。
它的化学式为C19H22N2O3,分子量为322.39g/mol。
其命名来源于结构中含有的十个羟基(hydroxy)和一个吲哚环(indole ring)。
该化合物在医学、生物科学、药理学以及其他领域具有重要的研究和应用价值。
2.2 结构解析10羟基喜树碱的结构由三个主要部分组成:吲哚环、非连续的两个苯环和十个羟基官能团。
喜树碱衍生物的合成及其抗肿瘤活性的研究共3篇

喜树碱衍生物的合成及其抗肿瘤活性的研究共3篇喜树碱衍生物的合成及其抗肿瘤活性的研究1喜树碱衍生物的合成及其抗肿瘤活性的研究随着近年来对天然产物的深入研究,许多草本植物中的化合物被证明具有抗肿瘤活性。
在其中,喜树碱被认为是一种具有潜在抗肿瘤活性的天然产物,它由喜树属植物中提取,具有强烈的生物活性和丰富的药理活性成分。
而喜树碱衍生物则是一系列新的合成化合物,具有解决天然产物使用难的问题和进一步拓展喜树碱的生物活性领域的潜力。
元素分析、1H NMR、13C NMR、MS等现代分析方法的应用已成功合成了一系列的喜树碱衍生物。
其中一种化合物,永立康喜树碱(YLLL),是一种新的喜树碱类化合物,具有较高的抗肿瘤活性。
它的临床前药效研究表明,YLLL具有抗肿瘤的多种药理学特征,如细胞增殖的抑制、细胞周期的阻滞和凋亡的诱导等。
实验结果表明,在体外实验中,YLLL可迅速抑制肿瘤细胞的生长和扩张;而在动物实验中,YLLL可降低肿瘤负荷并延长小鼠的生存时间。
这为以后开发抗肿瘤药物提供了极大的帮助。
深入研究表明,YLLL的抗肿瘤机制主要是通过抑制多种蛋白酶而产生作用,如蛋白酶PFKFB3。
通过对亚甲蓝染色的实验发现,YLLL对肿瘤细胞的DNA含量和核形态也产生了改变。
这种机制使其在肿瘤治疗中具有更广阔的应用前景。
总体而言,喜树碱衍生物的合成研究和抗肿瘤活性研究为抗肿瘤药物发展提供了新的方向和活力,同时也充分验证了天然产物的生物活性与药理活性的潜力。
未来,我们将进一步挖掘喜树碱衍生物的潜力,进一步发掘新的药物治疗方式,为人类健康事业作出更大贡献综上所述,喜树碱及其衍生物在抗肿瘤活性领域具有广泛应用前景。
通过现代化学合成与分析方法,以及深入的生物学研究,我们可以不断探索喜树碱在肿瘤治疗方面的潜力。
未来,我们有理由相信,在喜树碱衍生物的基础上,继续研究和创新,将会有更多的突破和发现,为人类健康事业作出更大的贡献喜树碱衍生物的合成及其抗肿瘤活性的研究2喜树碱是一种在自然界中广泛存在的植物生物碱,具有很多的生物活性,其中包括抗肿瘤作用。
喜树碱构效关系-概述说明以及解释

喜树碱构效关系-概述说明以及解释1.引言1.1 概述概述部分的内容可以介绍喜树碱的背景和相关研究的重要性。
可以参考以下内容:喜树碱是一种具有丰富植物化学活性的天然产物,广泛存在于喜树科植物中。
它们以其独特的化学结构和广泛的生物活性受到了科学家们的广泛关注。
喜树碱被发现具有多方面的药理活性,包括抗炎、抗菌、抗氧化、抗肿瘤、抗HIV等。
这些活性使得喜树碱成为了药物研发领域的重要研究对象。
随着现代科学技术的发展,人们对喜树碱的研究也取得了显著的进展。
通过对喜树碱进行结构活性关系研究,可以揭示其生物活性的结构基础,并为药物设计和优化提供理论指导。
喜树碱构效关系的研究对于挖掘更多有潜力的药物候选物、改进现有药物的性能以及阐明喜树科植物的药用价值具有重要意义。
本篇文章将综述喜树碱的构效关系研究,旨在全面地总结和分析已有的研究成果,并对未来的研究方向和可能的应用进行展望。
通过深入研究喜树碱的定义、特性、生物活性以及结构与活性的关系,我们可以更好地理解这一类天然产物的潜力和应用前景,为药物研发和临床治疗提供有力支持。
1.2 文章结构本文将围绕喜树碱的构效关系展开讨论。
文章分为引言、正文和结论三个主要部分。
引言部分将对本文的内容进行概述,首先介绍喜树碱的定义和特性,然后阐述文章结构和目的。
正文部分将详细讨论喜树碱的构效关系。
其中,2.1小节将介绍喜树碱的定义和特性,包括其化学结构、分子量、理化性质等。
2.2小节将探讨喜树碱的生物活性,包括其抗肿瘤、抗炎症等生物活性表现。
2.3小节将重点研究喜树碱的结构与活性关系,探讨不同结构因素对喜树碱生物活性的影响。
结论部分将总结喜树碱构效关系的重要性,并展望未来研究的方向。
3.1小节将对本文中探讨的喜树碱构效关系进行总结,并分析其在药物研发领域中的应用前景。
3.2小节将给出未来研究的展望,指出需要进一步深入研究喜树碱的构效关系,并提出值得关注的研究方向。
最后,3.3小节将进行总结,重申文章的主要观点和结论。
喜树碱合成

1975年,Cory等人以呋喃衍生物为原料,经过17步以0.03%的总产率得到了(S)—Camptothecin。
该步骤产率低,但创新之处在于二元环结构的化合物4是经过光学拆分得到的,并且内酯呋喃化合物4具有光活性,可以在氧气、光照的作用下发生氧化,接着在氯化亚砜、DMF的作用下形成氯代化合物5,进而合成了喜树碱7。
Corey E J, Crouse D N, Anderson J E. A total synthesis of natural 20 (S)-camptothecin [J]. J. Org. Chem, 1975, 40:2140~2141.2001年,Comins小组[3]以吡啶衍生物8为原料,经过6步完成了喜树碱的不对称全合成。
该路线比较短,但其中的某些关键步骤产率不高。
[3]Comins D L, Nolan J M. A Practical Six-Step Synthesis of (S)-Camptothecin [J]. Org. Lett,2001, 3: 4255~4257.Comins等人以2-氯-6-乙氧甲氧基吡啶为原料合成7位或9位CPT衍生物[8]研究表明, 喜树碱7 位、9 位取代基团对其活性、水溶性和脂溶性有重要影响。
在7 - 位引入小分子烷基可以提高它的活性,其中以乙基最好。
在9 - 氨基喜树碱葡萄糖酸苷( 9 -ACG) 是新合成的一种水溶性衍生物。
它与CPT 相比,9-ACG 水溶性更好,通常多数CPT 药物包括9 -AC 都能被人体内的人血清白蛋白作用而导致内酯环活性降低, 药效持续时间变短。
但是, 9 -ACG 可以改变与体内的血清白蛋白的作用方式而达到稳定内酯环, 提高抗癌活性的效果。
Comins DL,Nol an JM. A pr ac t i ca lsix-step synthesis of (S)-camptothecin [J].Org Lett,2001,3(26):4255~4257.Bennasar等人用对吡啶季铵盐的对位进行芳香亲核,引入所需的手性中心后,再经过脱氢,还原酯基,氧化等步骤得到CPT[9]将其制成前药, 以期降低母体化合物毒副作用, 改善其药物动力学特征, 提高溶解性、肿瘤作用靶向性和E 内酯环的稳定性, 可扩大临床应用范围。
喜树碱自总结

喜树碱是一种植物抗癌药物,从中国中南、西南分布的喜树中提取得到。1976年中国化学家高怡生等合成消旋喜树碱成功。喜树碱对肠胃道和头颈部癌等有较好的疗效,但对少数病人有尿血的副作用。10-羟基喜树碱的抗癌活性超过喜树碱,对肝癌和头颈部癌也有明显疗效,而且副作用较少。喜树碱是继紫杉醇之后的第二个木本植物来源的抗癌药物。1985年美国学者发现喜树碱是迄今为止唯一的通过抑制拓扑异构酶Ⅰ(topoisomeraseⅠ,TopoⅠ)发挥细胞毒性的天然植物活性成分。TopoⅠ是一种与细胞分裂相关的酶,阻断该酶的产生即可阻止癌细胞的生长。
理化性质:浅黄色针状结晶(甲醇-乙腈),分解点:264℃~267℃,[α]25D +31.3。(氯仿-甲醇)。在紫外光下表现强烈的蓝色荧光,和酸不能生成稳定的盐。
喜树碱难溶于水及一般有机溶剂,微溶于氯仿、乙醇、乙酸、乙酸乙酯,可溶于碱、吡啶、二甲基亚砜、醋酸和三氯甲烷和甲醇的混合液等少数溶剂,在浓硫酸中酸解呈黄绿色溶液。
作用机理: DNA拓扑异构酶I
•Topo I与DNA结合形成可裂解复合物,在DNA磷酸二酯上形成一个单链缺口,让未受损的单链从缺口中回转,使DNA松弛,以利于复制核转录,随后将缺口连接。
•CPT-Topo I-DNA三元复合物的形成,使其可裂解复合物稳定化,导致DNA单链断裂,不能再度连接。
•不同种癌细胞拓扑酶过度表达
构效关系
•内酯环是其抗癌活性的关键部位。其环上的羰基氧与20-OH共同影响其活性。
•ABCD四个环的平面结构有利于其嵌入。
•20-C的S构型对其活性有一定贡献。
•衍生物脂溶性的大小。
•分子内氢键。活化内酯,削弱羟基与酶的相互作用。
图1
衍生物合成思路
临床应用:用于抗病毒,抗早孕,恶性肿瘤,银屑病,治疣,急慢性白血病以及血吸虫病引起的肝脾肿大等。
常用抗肿瘤用药——喜树碱
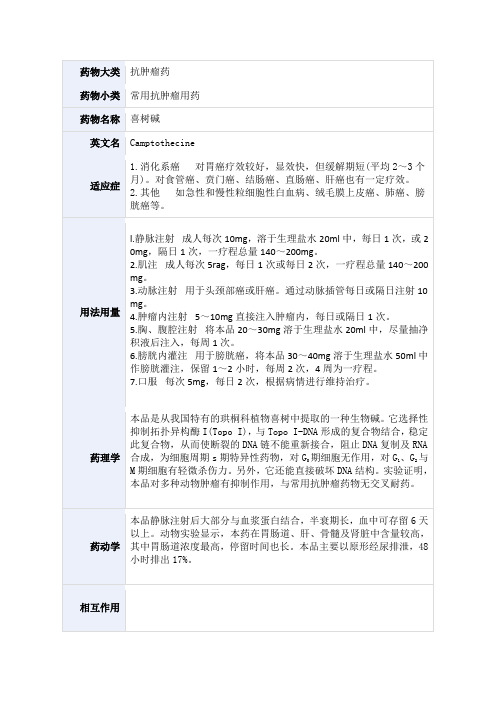
药物大类抗肿瘤药药物小类常用抗肿瘤用药药物名称喜树碱英文名Camptothecine适应症1.消化系癌对胃癌疗效较好,显效快,但缓解期短(平均2~3个月)。
对食管癌、贲门癌、结肠癌、直肠癌、肝癌也有一定疗效。
2.其他如急性和慢性粒细胞性白血病、绒毛膜上皮癌、肺癌、膀胱癌等。
用法用量l.静脉注射成人每次10mg,溶于生理盐水20ml中,每日1次,或2 0mg,隔日1次,一疗程总量140~200mg。
2.肌注成人每次5rag,每日1次或每日2次,一疗程总量140~200 mg。
3.动脉注射用于头颈部癌或肝癌。
通过动脉插管每日或隔日注射10 mg。
4.肿瘤内注射5~10mg直接注入肿瘤内,每日或隔日1次。
5.胸、腹腔注射将本品20~30mg溶于生理盐水20ml中,尽量抽净积液后注入,每周1次。
6.膀胱内灌注用于膀胱癌,将本品30~40mg溶于生理盐水50ml中作膀胱灌注,保留1~2小时,每周2次,4周为一疗程。
7.口服每次5mg,每日2次,根据病情进行维持治疗。
药理学本品是从我国特有的珙桐科植物喜树中提取的一种生物碱。
它选择性抑制拓扑异构酶I(Topo I),与Topo I-DNA形成的复合物结合,稳定此复合物,从而使断裂的DNA链不能重新接合,阻止DNA复制及RNA 合成,为细胞周期s期特异性药物,对G期细胞无作用,对G1、G2与M期细胞有轻微杀伤力。
另外,它还能直接破坏DNA结构。
实验证明,本品对多种动物肿瘤有抑制作用,与常用抗肿瘤药物无交叉耐药。
药动学本品静脉注射后大部分与血浆蛋白结合,半衰期长,血中可存留6天以上。
动物实验显示,本药在胃肠道、肝、骨髓及肾脏中含量较高,其中胃肠道浓度最高,停留时间也长。
本品主要以原形经尿排泄,48小时排出17%。
相互作用。
不同种源喜树幼枝中喜树碱的含量

植物学通报 2005, 22 (5): 584 ̄589①陕西省教育厅产业化培育项目(03JC39)和西北大学科研基金项目(02NW10)资助。
②通讯作者。
Author for correspondence. E-mail: lwenzhe@ 收稿日期: 2004-12-19 接受日期: 2005-02-28 责任编辑: 于昕不同种源喜树幼枝中喜树碱的含量①王玲丽 刘文哲②(西北大学生命科学学院 西安 710069)摘要 通过HPLC 测定了喜树(Camptotheca acuminata )不同器官及不同种源幼枝中喜树碱的含量。
结果表明, 喜树碱含量在叶、种子和幼枝(幼叶和幼茎)中较高, 木质部中较少, 髓中最低。
不同种源的幼枝中, 来自成都种源喜树的喜树碱含量最高。
通过比较, 两年生喜树各器官中喜树碱含量普遍比一年生高, 幼枝中顶枝的喜树碱含量比侧枝高。
关键词 喜树, 喜树碱, 幼枝, 种源Contents of Camptothecin in Camptotheca acuminatafrom Different ProvenancesWANG Ling-Li LIU Wen-Zhe ②(College of Life Science, Northwest University, Xi’an 710069 )Abstract Camptothecin (CPT) content in organs of Camptotheca acuminata and young shoots from different areas of China was determined by HPLC. CPT content in leaves, seeds and young shoots was higher than that in xylem, lowest in piths and highest in young shoots from Sichuan province. CPT content in young biennial shoots was higher than that in annual shoots and that in caulody was higher than that in subbranches.Key words Camptotheca acuminata , Camptothecin, Young shoot , Provenance喜树(Camptotheca acuminata ), 为珙桐科(Nyssaceae)喜树属多年生亚热带落叶阔叶乔木, 是我国特有树种, 主要分布在长江流域及西南各省(中国科学院中国植物志编辑委员会,1983)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. CPT衍生物的设计:永无 止境
• 根据在A-B、C-D、E环上取代基位置的不同, 可以将CPT衍生物分成三类。 • 第一类:A-B环的修饰。早期发现,A-B环被 取代后不丧失活性。这个二元环上可以被许多 官能团取代,特别是在7位、9位和10位上, 尽管会保留甚至在某些情况下会提高天然产物 的细胞毒性。当前已经研发了两种主要的抗癌 药——拓扑替康和伊立替康,并且已经用于临 床。
• 它是一种口服的拓朴异构酶Ⅰ抑制剂,在临床 Ⅱ期开发阶段,在体内的稳定性较topotecan 好,副作用特别是胃肠道毒性似更少。另外, 发现该类化合物中的BN280927兼有抑制 TopoⅠ和TopoⅡ两种酶的作用,但不形成 TopoⅡ可切割复合物。该化合物对G0期的肿 瘤细胞也有明显的抑制作用,细胞水平的 IC50低于SN38,并且对SN38的耐药株也有 很强的细胞毒作用。
第二种策略的图解
6.喜树碱类化合物的构效关系
• A、B、C环:1)在C-7、9、10位及11位引入 不同的取代基,特别是7位和10位引入双取代 基,可干扰喜树碱开环形式及喜树碱与人血清 白蛋白的结合,从而提高内酯在体内的稳定性。 2)在C-7、9;C-9、10;C-10、11间增加一 个环,虽然不能增加内酯环的稳定性,但能增 加体内和体外的肿瘤活性。
• 伊立替康(CPT-11):又名开普拓,结构如图。 1998年,被批准与5-FU(5-氟尿嘧啶)和叶酸 联用,作为治疗转移性结肠癌的一线药物,现 在也是治疗非小细胞肺癌的一线药物。CPT-11 是一个水溶性前药,在体内被羧酸酯酶代谢成 活性形式SN-38,结构如图。SN-38是主要活 性代谢产物,其活性比CPT-11强100~1000倍。 SN-38经肝脏尿苷二磷酸葡萄糖醛酸转移酶 (UDP-GT)生成葡萄糖醛酸化SN-38(SN38G)。当SN-38G分泌进入肠道,肠道中细菌 的β-葡萄糖醛酸酶又能使之变回SN-38。存在 药物的肝肠循环。
胸苷酸合成酶作为抗癌药 物的靶点
• 胸苷酸合成酶(TS)系有相同亚基构成的同源 二聚体胞浆酶,它参与体内DNA生物合成所需 的胸腺嘧啶核苷酸的起始合成过程,是该过程 的限速酶。TS催化脱氧尿苷一磷酸(dUMP) 的甲基化反应,生成脱氧胸苷一磷酸(dTMP), 在此过程中,5,10-亚甲基四氢叶酸提供甲基。 此后dTMP发生磷酸化形成脱氧胸苷三磷酸 (dTTP),后者是DNA生物合成的必需物质。 这是Байду номын сангаас胞内从头合成dTTP的唯一途径,因此TS 是肿瘤化疗的一个关键靶点,抑制TS将导致细 胞“无嘧啶死亡”。
• 拓扑替康(TPT),又名拓泊替康、和美新, 结构如图。本品为CPT半合成衍生物,作用靶 点为TopoⅠ,为S期抗肿瘤药。临床前研究表 明,TPT抗肿瘤谱较广,对L1210和P338白血 病小鼠的活性及在体内抗Lewis肺癌和B-16黑 色素瘤的作用均优于CPT。在人结肠癌异体移 植物,TPT可以诱导肿瘤消退及延缓其生长。 1996年,美国FDA批准其为治疗卵巢癌的二 线药物。2000年,被批准为治疗小细胞肺癌 的二线药。
5.拓扑异构酶Ⅰ介导DNA 断裂的序列特异性靶点
• Topo毒剂可以作为抗生素直接作用于细菌的Tope,也 可以作为抗肿瘤制剂直接作用于真核生物的酶类。但是, 一些局限性阻碍了它们的广泛应用。毒性是重要的不需 要的次生效应。比如,TopoII毒剂,会因为化疗引起 白血病。这些副作用与Tope有非常弱的序列特异性有 关——在裂解位点周围只有一个或两个碱基。比如,对 于CPT来说,只在T和G之间断裂。因此,化学家们正 致力于增加这些药物的特异性。一种策略是,通过使用 前体药使药物只在肿瘤细胞处释放。另一种策略是,将 药物共价结合到DNA配体上,然后再将这个特异性序 列结合到DNA上,从而增加DNA的特异性。
第八章 喜树碱的药物设计,靶向癌 细胞死亡与基因
王伟宁
1.引言
• 喜树碱是四十多年前发现一种植物抗癌药物。 拓扑异构酶Ⅰ是一种非常重要的DNA操作酶, 是唯一知道的喜树碱的靶点,它结合在共价蛋 白核酸复合物的界面。这主要与喜树碱的化学 与生物学的三个方面有关:一是以拓扑异构酶 Ⅰ为靶点合成的喜树碱抗肿瘤衍生物,二是由 拓扑异构酶Ⅰ抑制剂诱导的细胞死亡机制,三 是拓扑异构酶Ⅰ抑制剂靶点所对应的特定的 DNA序列。作为设计抗癌药物的首选天然产 物,或是作为研究拓扑异构酶Ⅰ对DNA新陈 代谢的实验工具。
• 20-(S)-Camptothecin (CPT)最早是在1966年,由 美国的Wall等从中国特有的珙桐科植物喜树中提 取到的,由美国国立肿瘤研究所(NCI)动物模型 上证实其抗肿瘤作用,并将其水溶性钠盐用于临床 试验。在过去的四十年,从大量的植物科中发现了 这种单萜吲哚类生物碱,包括茜草科、夹竹桃科、 钩吻科、茶茱萸科等。 • 尽管有抗肿瘤的活性,但是后来发现碱处理开环后 药物活性明显下降,同时还伴随着严重的毒性反 应——包括严重的腹泻、出血性膀胱炎,使得CPT 类化合物的临床研究就此中断。1985年发现CPT 特异作用于核内蛋白拓扑异构酶Ⅰ。二十年后,拓 扑异构酶Ⅰ仍是已知的CPT的唯一靶点,这使得这 种生物碱成为真正的靶点抗癌制剂。
除了拓扑替康和伊立替康,还有很多A环和B 环上被取代的CPT衍生物,如图:
• 第二类:C-D环的修饰。对于C环和D环 的衍生物,他们一般没有活性或比CPT 的活性低很多。在这一类中,唯一用于 临床开发的是C环修饰的衍生物DRF1042,在5位有一个取代基,现在已经 进行到临床Ⅱ期开发阶段。
• 第三类:E环的修饰。A-B环或C-D环的修饰往 往是增加CPT的水溶性,并且减少内酯环E环 开环形成无活性的羧化物形式。在以往的研究 中,对CPT内酯环E环的改造都会造成化合物 失活,因此一直以来认为,E环是CPT的活性 必须基团,在结构修饰中一般都避免对E环的 改造,而新一代的高喜树碱,用七元环替代了 六元内酯环,能消除E环的分子内氢键,降低 羰基活性。其中,二氟取代物Diflomotecan (BN280915)结构如图。
• Caspases(半胱天冬酶,胱门蛋白酶)是一 类蛋白裂解酶,在细胞内以无活性的酶原形式 存在。半胱天冬酶具有半胱氨酸激活位点和底 物裂解位点,当作用于胞内特异性底物后将引 起细胞凋亡。但当它们被激活后并不会降解胞 内的所有蛋白,相反,它们只会选择性的作用 于自身的靶蛋白,在靶蛋白一级结构中Asp (天冬氨酸)残基的位置之后将靶蛋白裂解, 介导细胞发生凋亡。
• 5)E环α羟基可以酯化,以增大羰基的 位阻并破坏分子内氢键。其引入脂肪族 氨基酸、大分子或糖均能增加药物的稳 定性和水溶性。6)去除E环的A~D四 元环衍生物活性降低或丧失,说明喜树 碱的内酯环是其抗肿瘤的关键部位。
第九章 靶向胸苷酸合成酶的抗叶 酸药物的癌症治疗
1.引言
• 四氢叶酸衍生物是细胞一碳代谢中的重要辅 酶。在某些氨基酸、嘌呤和嘧啶的生物合成 反应中,四氢叶酸衍生物作为各种酶的特殊 底物,提供羟甲基、甲酰基和甲基等一碳单 位,发挥着重要作用。抗叶酸药物是以叶酸 依赖性酶为靶点,设计合成的与这些酶的特 殊底物(即叶酸辅酶)结构相似的一类化合 物,它们和酶结合后可阻止正常底物与酶的 结合,从而干扰细胞的叶酸代谢和一碳代谢
• CPT类化合物的作用机制是参与TopoⅠ作用过程 中与DNA形成的“可切割复合物”,阻碍DNA 链的闭合,导致细胞DNA单链断裂(SSB), 这种单链断裂对细胞来说并不是致死性的,当可 切割复合物与正在进行复制的DNA复制又相遇 时,会继发性的造成不可逆的DNA双链断裂 (DSB),最终引起细胞死亡。 • 因此,S期细胞对CPT类化合物特别敏感。另外, CPT稳定的可切割复合物也作用于RNA聚合酶的 转录过程,抑制RNA的合成,在DNA模板链形 成不可逆的单链断裂,并在启动子区域引起少量 双链断裂。
• 例如,抗叶酸药物甲氨蝶呤(MTX), 它作为一种叶酸还原酶抑制剂,主要抑制 二氢叶酸还原酶而使二氢叶酸不能还原成 有生理活性的四氢叶酸,从而使嘌呤核苷 酸和嘧啶核苷酸的生物合成过程中一碳基 团的转移作用受阻,导致DNA的生物合 成受到抑制。主要用于儿童急性白血病和 绒毛膜上皮癌,可作为免疫抑制剂应用。
• 不良反应:1.骨髓抑制:中性粒细胞下降、血 小板减少、贫血等,为主要限制性毒性。2.胃 肠道反应:恶心、呕吐、腹泻、便秘、肠梗阻、 腹痛、口腔炎、厌食等。3.皮肤反应:脱发, 偶见严重的皮炎及瘙痒。4.神经肌肉反应:头 痛、关节痛、肌肉痛、全身痛、感觉异常。5. 呼吸系统反应:可致呼吸困难。 6.肝脏:有时 出现肝功能异常,转氨酶升高。7.全身反应: 乏力、不适、发热等。8.局部刺激:静脉注射 时,若漏出血管外可产生局部刺激、红肿。
• 一些抗叶酸药物通过阻断DNA生物合成中 所需的嘌呤和嘧啶核苷酸的生物合成,导 致肿瘤细胞的死亡,在临床上用作抗肿瘤 药物。 • 最早用作抗肿瘤药物靶点的叶酸依赖性酶 是二氢叶酸还原酶(DHFR)。DHFR催化 二氢叶酸还原成四氢叶酸,然后在其他酶 的作用下生成四氢叶酸的各种活性衍生物。 因此,它在叶酸代谢循环中处于中心地位。
• 不良反应:1.胃肠道:迟发性腹泻(给药24h 后发生的腹泻)、恶心与呕吐、厌食、腹痛及 黏膜炎。2.血液学:中性粒细胞减少。3.急性 胆碱能综合症:主要症状为:早发性腹泻及其 他症状,如用药后第一个24小时内发生:腹 痛、结膜炎、鼻炎、低血压、血管舒张、出汗、 寒战、全身不适、头晕、视力障碍、瞳孔缩小、 流泪、流涎增多,以上症状于阿托品治疗后消 失。4.其它作用:早期的反应如呼吸困难、肌 肉收缩、痉挛及感觉异常等均有报道。
• 3)在C-5、12、14位取代则活性降低或丧失。 4)B环饱和,几乎无活性。 • D、E环:1)20位的氧为活性必需,内酯环氧 被氮或硫取代,活性丧失。2)D环吡啶酮为抗 肿瘤活性必需。3)20(S)异构体较20(R) 异构体活性强10~100倍。4)E环扩环成七元 内酯环,形成高喜树碱能消除E环的分子内氢 键,降低羰基活性。
2.喜树碱:拓扑异构酶ⅠDNA复合体的分子钳
