实验-常见阴离子未知液的定性研究分析
阴离子的鉴定实验报告

阴离子的鉴定实验报告阴离子的鉴定实验报告引言:阴离子是化学中重要的一类物质,其鉴定对于分析化学和环境科学等领域具有重要意义。
本实验旨在通过一系列实验方法,鉴定不同阴离子的存在与浓度。
实验一:氯离子的鉴定实验材料:氯化钡溶液、盐酸、硝酸银溶液、稀硝酸步骤:1. 取一定量的待测溶液,加入少量盐酸,若产生白色沉淀,则存在氯离子。
2. 取一定量的待测溶液,加入硝酸银溶液,若产生白色沉淀,则存在氯离子。
3. 若以上两步均出现白色沉淀,则通过稀硝酸滴定法测定氯离子的浓度。
实验结果及分析:通过实验一的步骤,我们可以确定待测溶液中是否存在氯离子。
若出现白色沉淀,即可确认存在氯离子。
通过稀硝酸滴定法,我们可以进一步测定氯离子的浓度。
实验二:硫酸根离子的鉴定实验材料:硝酸铅溶液、硫酸钠溶液步骤:1. 取一定量的待测溶液,加入硝酸铅溶液,若产生黄色沉淀,则存在硫酸根离子。
2. 取一定量的待测溶液,加入硫酸钠溶液,若产生白色沉淀,则存在硫酸根离子。
实验结果及分析:通过实验二的步骤,我们可以确定待测溶液中是否存在硫酸根离子。
若出现黄色或白色沉淀,即可确认存在硫酸根离子。
实验三:碳酸根离子的鉴定实验材料:盐酸、钡氯化物溶液步骤:1. 取一定量的待测溶液,加入盐酸,若产生气泡,则存在碳酸根离子。
2. 取一定量的待测溶液,加入钡氯化物溶液,若产生白色沉淀,则存在碳酸根离子。
实验结果及分析:通过实验三的步骤,我们可以确定待测溶液中是否存在碳酸根离子。
若出现气泡或白色沉淀,即可确认存在碳酸根离子。
结论:通过以上实验,我们可以鉴定出待测溶液中是否存在氯离子、硫酸根离子和碳酸根离子。
通过滴定法和产物的观察,我们还可以进一步测定阴离子的浓度。
这些实验方法在分析化学和环境科学等领域具有重要的应用价值,对于了解物质的组成和性质具有重要意义。
常见阴离子的鉴定报告

常见阴离子的鉴定报告报告编号:2021-CL-001样品信息:样品名称:未知液体样品编号:2021-SN-001取样时间:2021年1月1日样品来源:实验室实验室处理后的液体样品,取自实验室原料库中的混合液体。
样品保存在常温下,避免光照和氧化。
鉴定方法:样品的阴离子类型鉴定采用离子色谱仪进行分析。
实验过程中采用离子交换柱,采用高压梯度洗选法和电导检测法,对样品中的阴离子进行了全面鉴定。
鉴定结果:样品中共检测出7种常见阴离子,具体鉴定结果如下:1. 氢氧根离子(OH-):未检测到。
2. 碳酸根离子(CO32-):未检测到。
3. 氯离子(Cl-):1.0 mg/L。
4. 硝酸根离子(NO3-):3.5 mg/L。
5. 硫酸根离子(SO42-):未检测到。
6. 磷酸根离子(PO43-):未检测到。
7. 氟离子(F-):0.5 mg/L。
结论:样品中检测出氯离子、硝酸根离子和氟离子等3种阴离子,其中氯离子、硝酸根离子浓度较高。
据分析,该样品可能是一种水溶液用于清洗装备的清洁剂。
备注:1. 该鉴定报告是根据实验室分析结果编写而成,并且仅适用于此样品。
对于其他样品,请重新进行分析。
2. 本报告仅对实验室所提供的样品进行阴离子鉴定,不代表该样品中不含有其他化学物质。
3. 实验室在样品提取、保存以及测试过程中都尽可能地保证样品不受污染,但是我们无法保证样品的绝对纯度,并且我们不对损失或任何直接或间接损害承担任何责任。
报告人:XXX 实验室资深分析师2021年6月1日。
常见阴离子的分离、鉴定
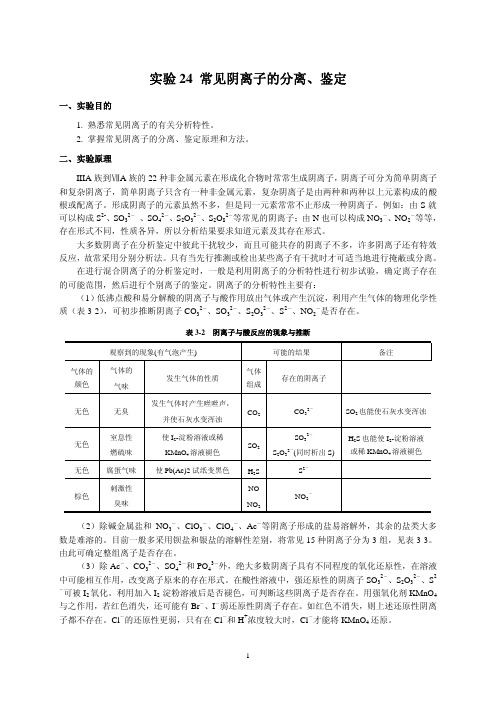
1. 阴离子的初步试验 (1)酸碱性试验
对于混合阴离子试液,首先用 pH 试纸测定其酸碱性,若试液呈强酸性,则低沸点酸或易分解 酸的阴离子如 CO32-、SO32-、S2O32-、S2-、NO2-等不存在。若为中性或弱碱性,则继续以下试验。
(2)挥发性试验 待检阴离子:SO32-、 CO32-、 S2O32-、S2-、NO2-。 在 5 支试管中分别滴加 SO32-、 CO32-、 S2O32-、S2-、NO2-的试液 3~4 滴,再加入 3.0 mol· L-1 H2SO4 溶液 2 滴,用手指轻敲试管的下端,必要时在水浴中微热,观察微小气泡的产生,颜色及 溶液是否变浑。如何检验产生的 SO2、CO2、H2S 和 NO2 气体?写出反应方程式。由此可判断这些阴 离子是否存在。 (3)沉淀试验 ① 与 BaCl2 的反应 待检阴离子:SO42-、PO43-、SO32-、CO32-、S2O32-。 在 5 支离心试管中分别滴加 SO42-、PO43-、SO32-、CO32-、S2O32-的试液 3~4 滴,然后滴加 0.1 mol·L-1 的 BaCl2 溶液 3~4 滴,观察沉淀的生成。离心分离,试验沉淀在 6.0 mol·L-1 HCl 溶液中 的溶解性。解释现象并写出反应方程式。 ② 与 AgNO3 的反应 待检阴离子:Cl-、Br-、I-、SO42-、PO43-、SO32-、CO32-、S2-、S2O32-。 在 9 支试管中分别滴加 Cl-、Br-、I-、SO42-、PO43-、SO32-、CO32-、S2-、S2O32-的试液 3~4 滴,再滴加 0.1 mol·L-1 的 AgNO3 溶液 3~4 滴,观察沉淀的生成与颜色的变化(Ag2S2O3 刚生成时 为白色,迅速变黄→棕→黑)。然后用 6.0 mol·L-1 HNO3 溶液酸化,观察哪些沉淀不溶于 HNO3(若 S2-和 S2O32-生成的沉淀不溶解,可加热后再观察)。写出反应方程式。 (4)氧化还原性的试验 ① 氧化性试验 待检阴离子:NO2-、NO3-。 在 2 支试管中分别滴加 NO2-、NO3-试液 10 滴,用 3.0 mol·L-1 H2SO4 溶液酸化后,加 CCl4 10 滴和 0.1 mol·L-1 KI 溶液 5 滴,振荡试管,观察现象,写出反应方程式。
阴离子鉴定实验报告

一、实验目的通过本实验,掌握常见阴离子的鉴定方法,学会利用化学试剂和仪器对溶液中的阴离子进行鉴定,提高实验操作技能和化学分析能力。
二、实验原理阴离子鉴定实验主要是利用各种阴离子与特定试剂反应产生的颜色变化、沉淀生成、气体产生等现象来识别和鉴定阴离子。
常见的鉴定方法有沉淀反应、颜色反应、气体生成等。
三、实验用品1. 试管:若干2. 试管夹:若干3. 胶头滴管:若干4. 烧杯:若干5. 玻璃棒:若干6. 酚酞试液:1%7. 氢氧化钠溶液:1%8. 氯化钡溶液:1%9. 硫酸钡溶液:1%10. 碳酸钠溶液:1%11. 稀硝酸:1mol/L12. 稀盐酸:1mol/L13. 酒精灯:1个14. 滤纸:若干15. 漏斗(含铁圈):1个四、实验步骤1. 取少量待测溶液于试管中,滴加酚酞试液,观察溶液颜色变化。
2. 若溶液变红,继续滴加稀硝酸,观察红色是否消失。
若红色消失,则可能含有OH-离子。
3. 另取少量待测溶液于试管中,滴加氯化钡溶液,观察是否有白色沉淀生成。
若有,继续滴加稀硝酸,观察沉淀是否溶解。
若沉淀溶解,则可能含有CO32-离子。
4. 另取少量待测溶液于试管中,滴加硫酸钡溶液,观察是否有白色沉淀生成。
若有,继续滴加稀硝酸,观察沉淀是否溶解。
若沉淀溶解,则可能含有SO42-离子。
5. 另取少量待测溶液于试管中,滴加稀盐酸,观察是否有气体产生。
若有,继续滴加氯化钡溶液,观察是否有白色沉淀生成。
若生成白色沉淀,则可能含有Cl-离子。
6. 另取少量待测溶液于试管中,滴加碳酸钠溶液,观察是否有白色沉淀生成。
若有,继续滴加稀硝酸,观察沉淀是否溶解。
若沉淀溶解,则可能含有Ag+离子。
五、实验现象1. 加入酚酞试液后,溶液变红,继续滴加稀硝酸后红色消失,可能含有OH-离子。
2. 加入氯化钡溶液后,生成白色沉淀,继续滴加稀硝酸后沉淀溶解,可能含有CO32-离子。
3. 加入硫酸钡溶液后,生成白色沉淀,继续滴加稀硝酸后沉淀溶解,可能含有SO42-离子。
阴离子鉴定实验报告

阴离子鉴定实验报告阴离子鉴定实验报告引言:阴离子是化学中一类带负电荷的离子,其在化学反应和实验中起着重要的作用。
为了准确鉴定不同的阴离子,我们进行了一系列实验。
本报告将详细介绍实验的目的、原理、实验步骤、结果和结论。
实验目的:本实验的目的是通过一系列实验方法,准确鉴定给定溶液中的阴离子种类。
实验原理:阴离子鉴定主要依靠其与特定试剂反应所产生的沉淀、颜色变化或气体释放等特征。
根据这些特征,我们可以确定阴离子的存在与否。
实验步骤:1. 首先,准备一系列已知阴离子的溶液,如氯离子、硫酸根离子、碳酸根离子等。
2. 取一小部分待测溶液,加入氯化银试剂。
若产生白色沉淀,则表明溶液中存在氯离子。
3. 取另一小部分待测溶液,加入硝酸银试剂。
若产生黄色沉淀,则表明溶液中存在硫酸根离子。
4. 取第三个待测溶液,加入盐酸试剂。
若产生气泡,则表明溶液中存在碳酸根离子。
5. 根据以上实验结果,结合颜色变化、沉淀形成等特征,可以准确鉴定待测溶液中的阴离子种类。
实验结果:通过以上实验步骤,我们得到了以下结果:1. 待测溶液A加入氯化银试剂后,产生白色沉淀,表明溶液A中存在氯离子。
2. 待测溶液B加入硝酸银试剂后,产生黄色沉淀,表明溶液B中存在硫酸根离子。
3. 待测溶液C加入盐酸试剂后,产生气泡,表明溶液C中存在碳酸根离子。
结论:根据实验结果,我们可以得出以下结论:1. 待测溶液A中存在氯离子。
2. 待测溶液B中存在硫酸根离子。
3. 待测溶液C中存在碳酸根离子。
实验的目的是通过一系列实验方法,准确鉴定给定溶液中的阴离子种类。
通过实验步骤,我们成功地鉴定了待测溶液中的氯离子、硫酸根离子和碳酸根离子。
这些实验结果对于进一步的化学分析和研究具有重要意义。
结语:阴离子鉴定实验是化学实验中常见的一种实验方法。
通过实验,我们可以准确鉴定给定溶液中的阴离子种类。
本实验报告详细介绍了实验的目的、原理、步骤、结果和结论。
通过这样的实验,我们可以更好地理解阴离子的特性和鉴定方法,并将其应用于实际化学分析中。
常见非金属阴离子的分离与鉴定实验报告

常见非金属阴离子的分离与鉴定实验报告常见非金属阴离子的分离与鉴定实验报告实验目的:通过实验,了解常见非金属阴离子的分离与鉴定方法,掌握实验操作技巧,并能正确判断不同阴离子的存在与否。
实验原理:常见非金属阴离子包括氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子、碳酸根离子等。
本实验通过一系列化学反应,利用各个阴离子的特性进行分离与鉴定。
实验器材与试剂:实验器材:试管、滴管、烧杯、玻璃棒等。
试剂:氯化银溶液、溴化银溶液、碘化银溶液、硫酸银溶液、硝酸银溶液、盐酸、硫酸、硝酸、碳酸钠溶液等。
实验步骤:1. 氯离子的鉴定取一小部分待测溶液,加入少量氯化银溶液。
若产生白色沉淀,则表示存在氯离子。
2. 溴离子的鉴定取一小部分待测溶液,加入少量溴化银溶液。
若产生黄色沉淀,则表示存在溴离子。
3. 碘离子的鉴定取一小部分待测溶液,加入少量碘化银溶液。
若产生红褐色沉淀,则表示存在碘离子。
4. 硫酸根离子的鉴定取一小部分待测溶液,加入少量硫酸银溶液。
若产生白色沉淀,则表示存在硫酸根离子。
5. 硝酸根离子的鉴定取一小部分待测溶液,加入少量硝酸银溶液。
若产生白色沉淀,则表示存在硝酸根离子。
6. 碳酸根离子的鉴定取一小部分待测溶液,加入少量盐酸。
若产生气泡,且气泡通入饱和石灰水中产生白色沉淀,则表示存在碳酸根离子。
实验结果与分析:根据实验步骤所述,通过观察产生的沉淀或气泡,可以判断待测溶液中是否存在氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子和碳酸根离子。
实验注意事项:1. 实验操作时要小心,避免溶液溅出或溅入眼睛。
2. 实验过程中要保持实验器材的干净,避免交叉污染。
3. 实验结束后,要彻底清洗实验器材,保持实验室的整洁。
实验总结:通过本次实验,我了解了常见非金属阴离子的分离与鉴定方法,并掌握了实验操作技巧。
实验结果表明,通过一系列化学反应,我们可以准确判断不同阴离子的存在与否。
这对于化学分析和实际应用具有重要意义。
在今后的学习和实验中,我将继续加强对化学实验操作的掌握,提高自己的实验技能。
关于常见阴离子未知液半微量定性分析的讨论

© 1995-2005 Tsinghua Tongfang Optical Disc Co., Ltd. All rights reserved.
3 阴离子未知混合液中阴离子分析的次序
综上所述,
再考虑到
S2-
、S2O
23
、SO
23
对 C l- 、B r- 、I-
鉴定的影响,
以及
SO
23
、S2O
23
对
CO
23
鉴定
的影响, 结合文献[ 2 ]上已有的内容, 笔者认为按以下次序进行分析较好:
实验次序
1
2
3
4
5
6
7
8
9
10
分组 试验
实验内容
初步 实验
c= 4 ppm
c= 4 ppm
c= 4 ppm
c= 2 ppm
c= 4 ppm
文献[ 2 ]上无 干扰时的灵敏度
m = 0. 1 Λg (SiO 2) , c= 2 ppm
表
2 排除干扰后所测得的
PO
34
鉴定反应的灵敏度
干扰离子
S2-
S2O 32-
SO 32-
C l- (多)
四种离子混合
测得的灵敏度
Abstract: Som e p rob lem s abou t the sem im icroqualitative analysis of the unknow n so lu tion con tain ing comm on an2 ion s are d iscu ssed, and som e im p rovem en ts are p rom o ted on the step of an ion s qualitative analysis.
常见非金属阴离子的分离与鉴定

试液中加AgNO3溶液,然后加稀HNO3 ,生成黑色Ag2S 、白色 AgCl、淡黄色AgBr、黄色AgI沉淀,表示S2-、Cl-、Br-、I-可能 存在。如果生成白色沉淀,很快变为黄色、棕色、褐色,最后变 为黑色,表示S2O32-存在。
示 例
某阴离子未知液经初步实验结果如下: ⑴试液呈酸性时无气体产生; ⑵酸性溶液中加 BaCl2 溶液无沉淀产生; ⑶加入稀硝酸溶液和 AgNO3 溶液产生黄色沉淀; ⑷酸性溶液中加入 KMnO4 ,紫色褪去,加I2 —淀 粉溶液,蓝色不褪去; ⑸与 KI无反应。 由以上初步实验结果,推测哪些阴离子可能存在。说 明理由,拟出进一步验证的步骤简表。
三、还原性阴离子检验
1、试液用H2SO4酸化,加入KMnO4溶液,如有SO32-、 S2O32-、 S2-、
Cl-、Br-、I-、NO2-存在,KMnO4的紫红色褪去。
2、试液用H2SO4酸化,加入碘-淀粉溶液,SO32-、 S2O32-、 S2-能 使碘-淀粉溶液的紫色褪去。
四、难溶盐阴离子试验
未知阴离子混合溶液的分离与鉴定
1、确定范围,将未知转化为已知。(初步检验) 2、已知离子混合液的分析 ⑴在混合离子溶液中,如果某个离子在鉴定时不受 其他离子的干扰,则可直接取试液进行该离子的分 别分析,而不需要进行系统分析。若干扰离子可通 过简单方法消除时,也应尽量创造条件进行分别分 析。 ⑵如果溶液中离子间的干扰无法用简单方法排除, 则需要根据具体情况确定合理的分离方案进行系统 分析。
常见阴离子的初步性质检验
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验-常见阴离子未知液的定性分析————————————————————————————————作者:————————————————————————————————日期:23常见无机阴离子的分离与鉴别 一、实验目的1、熟悉常见阴离子的有关性质并掌握它们的鉴别反应2、进一步培养观察实验和分析现象中所遇到的问题的能力 二、实验原理1、常见阴离子有以下13种:SO 42-、、PO 43-、CO 32-、SO 32-、S 2O 32-、S 2-、Cl -、Br -、I -、Ac -、NO 3-、NO 2-在阴离子中,有的遇酸易分解,有的彼此氧化还原而不能共存。
故阴离子的分析有以下两个特点:(1) 阴离子在分析过程中容易起变化,不易于进行手续繁多的系统分析。
(2) 阴离子彼此共存的机会很少,且可利用的特效反应较多,有可能进行分别分析。
在阴离子的分析中,主要采用分别分析方法,只有在鉴定时,在某些阴离子发生相互干扰的情况下,才适当采取分离手段。
但采用分别分析方法,并不是要针对所研究的全部离子逐一进行检验,而是先通过初步实验,用消去法排除肯定不存在的阴离子,然后对可能存在的阴离子逐个加以确定。
由于阴离子间的相互干扰较少,实际上许多离子共存的机会也较少,因此大多数阴离子分析一般都采用分别分析的方法,只有少数相互有干扰的离子才采用系统分析法,如S 2-、SO 32-、S 2O 32-;Cl -、Br -、I -等。
混合阴离子分离与鉴定举例:[例] SO 42-、NO 3-、Cl -、CO 32-混合液的定性分析(分析:由于这四个离子在鉴定时互相无干扰,均可采用分别分析法)方案:SO 42-、NO 3-、Cl -、CO 32-稀HCl 酸化、BaCl 2 稀HCl FeSO 4、H 2SO 4 稀HNO 3、AgNO 3BaSO 4↓(白色) CO 2 [Fe(NO 3)]2+ AgCl ↓(白)初步试验包括挥发性实验、沉淀实验、氧化还原实验等,具体为:4A 沉淀实验(1) 与 BaCl 2的反应在13支离心试管中分别滴加SO 42、SiO 32、 PO 43-、SO 32-、 CO 32-、 S 2O 32、S 2-、Cl -、Br -、I -、NO 3-、NO 2-、Ac -,各2滴,然后滴加一滴0.5M BaCl 2。
反应方程式:1) Ba 2++ SO 42-=BaSO 4↓(白) BaSO 4↓+HCl= 不反应 2) Ba 2++ SiO 32-=BaSiO 3↓(白)BaSiO 3+2HCl=H 2SiO 3↓(胶状)+BaCl 2 3) 3 Ba 2++2 PO 43-=Ba 3(PO 4)2↓(白)Ba 3(PO 4)2+3 HCl= BaCl 2+H 3PO 4 4) Ba 2++ CO 32-=BaCO 3↓(白)BaCO 3+2 HCl= BaCl 2+H 2O+CO 2↑ 5) Ba 2++ SO 32-=BaSO 3↓(白)BaSO 3+2HCl= BaCl 2+H 2O+SO 2↑ 6) Ba 2++ S 2O 32-=BaS 2O 3 ↓(白) BaS 2O 3+2 HCl= BaCl 2+H 2O+SO 2↑+S↓而S 2-、、Br -、I -、NO 3-、NO 2-、Ac -中加入BaCl 2后无现象。
(2) 与AgNO 3的反应反应方程式:7) 2Ag ++ SO 42-=Ag 2SO 4 ↓(白)Ag 2SO 4+HNO 3= 不反应58) 2Ag ++ SiO 32-=Ag 2SiO 3 ↓(白)Ag 2SiO 3+2HNO 3=H 2SiO 3+2AgNO 39) 3 Ag ++ PO 43-=Ag 3PO 4 ↓(黄)Ag 3PO 4+3 HNO 3= AgNO 3+ H 3PO 410)2Ag ++ CO 32-=AgCO 3 ↓(白)AgCO 3+2HNO 3=2AgNO 3+H 2O+CO 2↑ 11) 2Ag ++ SO 32-=Ag 2SO 3 ↓(黄)Ag 2SO 3+2HNO 3=2AgNO 3+H 2O+ SO 2↑ 12) 2Ag ++ 2S 2-=Ag 2S↓(黑) 13)Ag ++ Cl -=AgCl↓(白)AgCl+ HNO 3= 不反应 14) Ag ++ Br -=AgBr↓(黄) AgBr+ HNO 3= 不反应 15) Ag ++ I -=AgI ↓(黄) AgI+ HNO 3= 不反应其它离子如NO 3-、NO 2-、Ac -无明显现象。
B 挥发性实验待检离子:SO 32-、 CO 32-、 S 2O 32、S 2-、NO 2-反应方程式:16)2H ++ CO 32-= H 2O+CO 2↑ 17) 2H ++ SO 32-= H 2O+SO 2↑618) 2H ++ S 2O 32-= H 2O+SO 2↑+S↓(黄) 19) 2H ++ S 2-= H 2S↑ 20) 2H ++ NO 2-=NO↑+ H 2O C 氧化还原性试验 (1) 氧化性试验21) 2I -+ 4H ++ 2NO 2-= 2NO↑+ 2H 2O+I 2 其余离子无明显现象。
(2) 还原性试验KMnO 4试验22)2MnO 4-+ 5SO 32-+ 6H +=2Mn 2++ 5SO 42-+3H 2O 23) 4MnO 4-+ 5S 2O 32-+ 9H += 10SO 42-+4Mn 2++18H 2O 24) 2MnO 4-+ 10Br -+ 16H +=2Br 2+2Mn 2++8H 2O25) 2MnO 4-+ 10 I -+ 16H + =2I 2+2Mn 2++8H 2O 26) 2MnO 4-+ 5NO 2-+ 16H += 5NO 3-+2Mn 2++8H 2O 27) 2MnO 4-+ 10Cl -+ 16H +=5Cl 2+2Mn 2++8H 2O 28) 2 MnO 4-+ 5S 2-+ 16H += 5S↓(黄)+2Mn 2++8H 2O 其余离子无明显现象 I 2-淀粉试验I 2 + S 2-= 2I -+ S↓ I 2 + 2S 2O 32-= 2I -+ S 4O 62H 2O + I 2 + 2SO 32-= 2H ++ 2I -+ SO 427三、实验方法1、已知阴离子混合液的分离与鉴定2、未知阴离子混合液的分析某混合离子试液可能含有CO 32-、NO 2-、NO 3-、PO 43-、S 2-、SO 32-、S 2O 32-、SO 42-、Cl -、Br -、I -,按下列步骤进行分析,确定试液中含有哪些离子。
(1) 初步检验A 用pH 试纸测试未知试液的酸碱性如果溶液呈酸性,哪些离子不可能存在?如果试液呈碱性或中性,可取试液数滴,用3mol·L -1H 2SO 4酸化并水浴加热。
若无气体产生,表示CO 32-、NO 2-、S 2-、SO 32-、S 2O 32-等离子不存在;如果有气体产生,则可根据气体的颜色、臭味和性质初步判断哪些阴离子可能存在。
B 钡组阴离子的检验在离心试管中加入几滴未知液,加入1~2滴1mol·L -1BaCl 2溶液,观察有无沉淀产生。
如果有白色沉淀产生,可能有SO 42-、SO 32-、PO 43-、CO 32-等离子(S 2O 32-的浓度大时才会产生BaS 2O 3沉淀)。
离心分离,在沉淀中加入数滴6mol·L -1HCl ,根据沉淀是否溶解,进一步判断哪些离子可能存在。
C 银盐组阴离子的检验取几滴未知液,滴加0.1mol·L -1AgNO 3溶液。
如果立即生成黑色沉淀,表示有S 2-存在;如果生成白色沉淀,迅速变黄变棕变黑,则有S 2O 32-。
但S 2O 32-浓度大时,也可能生成Ag(S 2O 3)23-不析出沉淀。
Cl -、Br -、I -、CO 32-、PO 43-都与Ag +形成浅色沉淀,如有黑色沉淀,则它们有可能被掩盖。
离心分离,在沉淀中加入6mol·L -1HNO 3,必要时加热。
若沉淀不溶或只发生部分溶解,则表示有可能Cl -、Br -、I -存在。
D 氧化性阴离子检验取几滴未知液,用稀H 2SO 4酸化,加CCl 4 5~6滴,再加入几滴0.1mol·L -1KI 溶液。
振荡后,CCl 4层呈紫色,说明有NO 2-存在(若溶液中有SO 32-等,酸化后NO 2-先与它们反应而不一定氧化I -,CCl 4层无紫色不能说明无NO 2-)。
E 还原性阴离子检验取几滴未知液,用稀H 2SO 4酸化,然后加入1~2滴0.01mol·L -1 KMnO 4溶液。
8若KMnO 4的紫红色褪去,表示可能存在SO 32-、S 2O 32-等离子。
根据(1)~(5)实验结果,判断有哪些离子可能存在。
(2) 确证性试验根据初步试验结果,对可能存在的阴离子进行确证性试验。
四、注意事项1、在观察BaS 2O 3沉淀时,如果没有沉淀, 应用玻璃棒摩擦试管壁, 加速沉淀生成。
2、注意观察Ag 2S 2O 3在空气中氧化分解的颜色变化。
3、在还原性试验时一定要注意, 加的氧化剂KMnO 4和I 2-淀粉的量一定要少, 因为阴离子的浓度很低。
如果氧化剂的用量较大时,氧化剂的颜色变化是不容易看到的。
9。
